Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Biotecnología en el Sector Agropecuario y Agroindustrial
versión impresa ISSN 1692-3561
Rev.Bio.Agro vol.15 no.1 Popayán ene./jun. 2017
https://doi.org/10.18684/BSAA(15)95-104
DOI: http://dx.doi.org/10.18684/BSAA(15)95-104
ISOTERMAS E CALOR ISOSTÉRICO DE ADSORÇÃO DA ÁGUA DO AMIDO DE QUINOA
ISOTERMAS Y CALOR ISOSTÉRICO DE ADSORCIÓN DE AGUA DE ALMIDÓN DE QUINUA
WATER ADSORPTION ISOTHERMS AND ISOSTERIC HEAT OF QUINOA STARCH
AUGUSTO PUMACAHUA-RAMOS1, KATHERINE MILUSCA LIMAYLLA-GUERRERO2, JAVIER TELIS-ROMERO3, JOSÉ FRANSCISO LOPES-FILHO3
1 Universidad Peruana Unión. EP. Ingeniería en Industrias Alimentarias. Dr. Ingeniería de Alimentos. Juliaca, Perú.
2 Programa Nacional de Alimentación Escolar Qali Warma. Ing. de Alimentos. Puno, Perú.
3 Universidade Estadual Paulista (UNESP).Instituto de Biociencias, Letras y Ciencias Exatas (IBILCE). Dpto. Engenharia de Alimentos. Dr. Engenharia de Alimentos. São José do Rio Preto, SP. Brasil.
Correspondencia: augusto.pumacahua@upeu.pe
Recibido para evaluación: 17 de Julio de 2015. Aprobado para publicación: 25 de Julio de 2016.
RESUMO
A quinoa possui mais de 60% de amido, sendo uma alternativa de extração e comercialização. Para isto é necessário conhecer o comportamento do amido frente à temperatura e umidade relativa do ar. O objetivo desta pesquisa foi avaliar as isotermas de adsorção do amido de quinoa em cinco temperaturas (20, 30, 40, 50 e 60°C) e dez atividades de água (0,036 a 0,907). Os pontos experimentais foram ajustados aos modelos matemáticos GAB, Oswin, Henderson, Peleg e Ferro-Foltan. Foram determinadas as energias de ativação da adsorção da água pelas constantes do modelo GAB e o calor isostérico pelo modelo de Peleg. As isotermas mostraram ser do tipo II na classificação de Brunauer. Os teores de água da monocamada (Xm) determinados pelo modelo de GAB variaram de 7,90% a 10,38% base seca (b.s.) para temperaturas de 60 e 20°C e as energias de ativação obtidas pelas constantes Xm, C e K do modelo de GAB foram de 300; 160 e 6 kJ/kg, respectivamente. O calor isostérico de adsorção foi de 3732 kJ/kg para umidade de equilíbrio de 0,5% b.s. e diminuiu com o aumento da umidade até valor próximo ao calor latente de vaporização da água pura a 36% b.s. As propriedades determinadas são características de amidos com elevado teor de amilopectina.
PALAVRAS-CHAVE: Chenopodium quinoa Willd, Amido de quinoa, Isotermas de adsorção, Calor isostérico de adsorção.
ABSTRACT
The objective of this study was to evaluate adsorption isotherms and isosteric heats of quinoa's starch at five temperatures (20, 30, 40, 50 and 60°C) and ten water activities (0,036 to 0,907). The experimental values were fitted to mathematical models of GAB, Oswin, Henderson, Peleg and Ferro-Foltan. Activation energies for water adsorption were determined by the constants of GAB model and the isosteric heat by Peleg model. The isotherms exhibited type II in the classification of Brunauer. Monolayer moisture contents (Xm) obtained by GAB model ranged from 10,38 to 7,90% in dry basis (d.b.) at temperatures of 20 to 60°C, respectively. Activation energies determined using constants Xm, C and K of GAB model were 300, 160 and 6 kJ/kg, respectively. The isosteric heat of adsorption was 3732 kJ/kg at moisture equilibrium of 0,5% d.b. The value decreased next to latent heat of vaporization of pure water as moisture increased up to 36% d.b. The results obtained are characteristic of starches with high amylopectin content.
KEY WORDS: Chenopodium quinoa Willd, Quinoa starch, Isoterms sorption, Sorption isosteric heat.
RESUMEN
La quinua posee más de 60% de almidón, siendo una alternativa de extracción y comercialización. Para esto es necesario conocer el comportamiento del almidón frente a la temperatura y la humedad relativa del aire. El objetivo de esta investigación fue evaluar las isotermas de adsorción del almidón de quinua en cinco temperaturas (20, 30, 40, 50 y 60°C) y diez actividades de agua (0,036 a 0,907). Los puntos experimentales fueron ajustados a los modelos matemáticos GAB, Oswin, Henderson, Peleg y Ferro-Foltan. Fueron determinados las energías de activación da la adsorción del agua por las constantes del modelo GAB y el calor isostérico por el modelo Peleg. Las isotermas mostraron ser del tipo II según la clasificación de Brunauer. Los contenidos de agua de la monocapa (Xm) determinados por el modelo GAB variaron de 7,90% a 10,38% base seca (b.s.) para temperaturas de 60 y 20°C y las energías de activación obtenidas por las constantes Xm, C y K del modelo GAB fueron de 300, 160 y 6 kJ/kg, respectivamente. El calor isostérico de adsorción fue de 3732 kJ/kg para la humidad de equilibrio de 0,5% b.s. y disminuyó con el aumento de la humedad hasta un valor próximo al calor latente de vaporización del agua pura a 36% b.s. Las propiedades determinadas son característicos de almidones con elevado contenido de amilopectina.
PALABRAS-CLAVE: Chenopodium quinoa Willd, Almidón de quinua, Isotermas de adsorción, Calor isostérico de adsorción.
INTRODUÇÃO
A quinoa (Chenopodium quinoa Willd.) é um grão andino com características de grãos de cereais que possui elevado teor de amido (em média 60%). O Peru é um dos principais produtores e exportadores do grão cujos valores somaram US 142 milhões no ano de 2015, com exportações para os Estados Unidos, Holanda, Alemanha e Austrália [1]. Não existem dados sobre a exportação de derivados deste grão na forma de amido, pois a principal forma de comercialização é como grãos inteiros. Para agregar valor ao produto e disponibilizar matérias primas mais elaboradas, há necessidade de separar os componentes do grão de maior interesse como o amido e o germe.
O amido é o principal componente do grão de quinoa e pode ser extraído por processos de moagem semelhante à moagem úmida do milho. Segundo Pumacahua- Ramos [2], a extração do amido via moagem úmida, mostrou rendimento médio de extração em torno de 60% referente ao grão inteiro. O diâmetro médio do grânulo está em torno de 1 µm, que é 20 vezes menor que do amido de mandioca e 10 vezes menor que do amido de milho. Também possui baixo teor de amilose (< 12%) e elevado teor de amilopectina que apresenta característica cristalina de interesse para indústrias papeleira, alimentícia, têxtil, e outras [2].
A determinação das atividades de água em função do teor de umidade de equilíbrio (Xe) expressas em porcentagem base seca (% b.s.) do amido é de grande importância para sua conservação. Estas propriedades podem ser estudadas determinando experimentalmente as isotermas de adsorção ou de desorção. Na conservação de alimentos secos quatro fatores são importantes: a atividade de água (aw), o teor de umidade de equilíbrio (Xe), a umidade relativa e a temperatura do ambiente. A aw é uma característica principal, pois dependendo deste valor no alimento pode-se determinar a sua vida de prateleira. Sabe-se que em alimentos com aw acima de 0,67 os fungos se desenvolvem levando o alimento à deterioração. Curvas isotermas de sorção determinam a dependência da aw com a Xe que podem ser representadas mediante diversos modelos matemáticos. Estudos desta dependência foram realizados para diversos alimentos secos [3-13]30 and 37\u00a0\u00b0C using standard static gravimetric method. The sorption isotherms exhibited a type III behaviour according to Brunauer-Emmett-Teller (BET). Pelo estudo da termodinâmica dos alimentos, existem três tipos de água nos alimentos com seus respectivos calores de sorção que estão relacionados às aw. A água absorvida, a água da monocamada e a água da multicamada. Se esta água se relaciona com a temperatura pode ser determinada a energia de ativação (Ea) correspondente, sendo que a Ea da absorção deve ser considerado um parâmetro independente ao processo de difusão-sorção. Todos estes calores podem ser determinados pelas constantes do modelo de GAB [10].
O fenômeno de sorção pode ser explicado por uma equação de estado denominada calor isostérico de sorção. Esta propriedade termodinâmica pode ser determinada em função das atividades de água dos alimentos em pelo menos três temperaturas. O calor isostérico (Qs) representa a energia necessária para romper a ligação da água com o substrato do alimento. Atualmente duas equações termodinâmicas são utilizadas para determinar seu valor [14]. Dada à importância do amido de quinoa na industrialização dos grãos e sua conservação, os objetivos desta pesquisa foram: obter e avaliar as isotermas de adsorção da água no amido de quinoa extraído mediante moagem úmida, determinar os modelos que melhor representem os dados experimentais e determinar o calor isostérico de adsorção do processo.
MÉTODO
Grãos de quinoa da variedade Blanca de Juli foram hidratadas em solução de 0,55% de ácido láctico e 0,2% de SO2 durante 4 h. Após, os grãos passaram por processos de trituração, retirada do germe, moagem fina, peneiramento, decantação e secagem do amido. O amido recuperado foi moído, peneirado em peneira de 80 mesh e colocado em saco plástico sob refrigeração.
As proteínas foram determinadas pelo método de Kjeldahl com fator de correção de 6,25, as gorduras pelo método Bligh-Dyer e a porcentagem de amilose segundo o método descrito por Mahmood et al. [15].
Na construção das isotermas utilizou-se o método estático gravimétrico [10]. Foram preparadas soluções saturadas de 10 sais diferentes e colocadas em recipientes com tampa de rosca com suporte interno para colocação das amostras. As soluções saturadas (Tabela 1) proporcionaram aw entre 0,036 a 0,907 para as cinco temperaturas (20, 30, 40, 50 e 60°C).
As temperaturas foram equilibradas mediante câmara incubadora tipo BOD (Modelo TE-391, TECNAL, Brasil). Aproximadamente 1 g de amido foi colocado no interior do recipiente. A umidade de equilíbrio (Xe) foi determinada pelo método padrão de estufa (105°C por 24 h) quando a amostra não apresentou variação da massa. Os teores de umidade foram expressos em porcentagem de base seca (%b.s.).
Para o ajuste aos dados experimentais os seguintes modelos matemáticos foram utilizados: O modelo de Guggenheim-Anderson-de Boer (GAB) [16] (Eq. 1) e suas constantes dependentes da temperatura (Eqs. 2, 3 e 4) [10, 11].
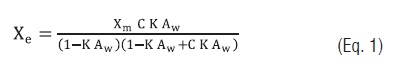 Eq. 1
Eq. 1
 Eq. 2
Eq. 2
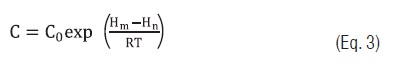 Eq. 3
Eq. 3
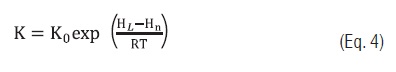 Eq. 4
Eq. 4Oswin [17] (Eq. 5) Henderson [18] (Eq. 6) Peleg [19] (Eq. 7) Ferro-Foltan [20] (Eq. 8)
 Eq. 5
Eq. 5
 Eq. 6
Eq. 6
 Eq. 7
Eq. 7
 Eq. 8
Eq. 8Onde, Xe: teor de umidade de equilíbrio (%); Xm, C e K: constantes do modelo GAB; A, B, C, K1, K2, n1 e n2 constantes dos modelos (Eqs 5, 6, 7 e 8); R é a constante geral dos gases (0,462 kJ/kg K) e T é a temperatura absoluta.
No modelo de GAB, Xm representa o teor de água na monocamada, C a constante de Guggenheim referente à diferença da entalpia de sorção da monocamada e multicamada, K é o fator de correção referente à entalpia de sorção da multicamada com relação ao da água pura. As constantes ?Xm, Hm, Hn e HL (kJ/kg) são as energias de ativação para atingir a umidade de equilíbrio Xe, os calores de sorção da água da monocamada, multicamada e a entalpia de vaporização da água pura, respectivamente [10, 11].
O calor isostérico de sorção, QS, (Eq. 9) é a soma do calor isostérico líquido de sorção (qS) e a entalpia de vaporização da água pura (HL) na temperatura média aritmética:
 Eq. 9
Eq. 9O calor isostérico líquido de sorção, qS, foi calculado pela Eq. 10 [14, 21]:
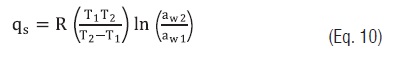 Eq. 10
Eq. 10O modelo de Peleg foi utilizado para determinar as atividades de água da Eq. 10.
Adicionalmente foram determinadas a variação da energia livre de Gibbs e a variação da entropia mediante as equações:
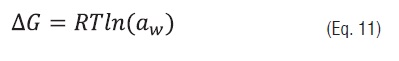 Eq. 11
Eq. 11
 Eq. 12
Eq. 12em que ΔG, é a energia livre de Gibbs (kJ/kg) e ΔS, a entropia de adsorção (kJ/kg K).
A fim de obter um modelo que expresse o calor isostérico de adsorção em função da Xe, as seguintes equações foram testadas [21 - 23]:
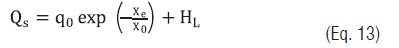 Eq. 13
Eq. 13
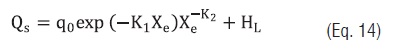 Eq. 14
Eq. 14
 Eq. 15
Eq. 15em que qo é o calor isostérico de adsorção da monocamada, X0 o teor de umidade inicial do amido (%), K1 e K2 são constantes.
Em relação aos dados experimentais, os valores das umidades de equilíbrio Xe e os calores isostéricos determinados pelos modelos matemáticos foram avaliados pelo coeficiente de determinação (R2) e pela Média Absoluta percentual do Erro (MA%E) definido como:
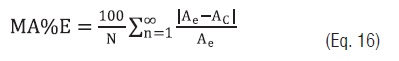 Eq. 16
Eq. 16em que N; número de determinações, A; o parâmetro Xe ou Qs, os sub índices, e, C; significam experimental e calculado.
RESULTADOS
As análises químicas mostraram que o amido de quinoa contém 3,41 % (±0,40%) de proteína, 0,80% (±0,14%) de gordura e 10,93% (±1,23%) de amilose. A Figura 1 apresenta as umidades de equilíbrio Xe em função da aw nas 5 temperaturas, como resultado da parte experimental do estudo de adsorção pelo método estático gravimétrico.
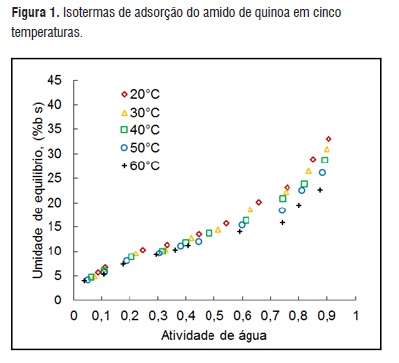 Figura 1
Figura 1Verifica-se que na faixa de aw entre 0,59 a 0,66 que a Xe variou de 20,13 a 14,10% nas quatro temperaturas.
Esses valores representam teores de umidade de segurança para inibir o desenvolvimento microbiano. Umidades de equilíbrio abaixo de 0,65 de aw são seguros contra o crescimento de fungos por longos períodos de tempo. A 20°C e 0,6 de aw, a farinha de Eragrostis tef apresentou 11% de umidade de equilíbrio [13], o amido de mandioca 10,5% [12], farinha de casca de laranja de 18% [10] e bagaço de mandioca de 13% [11]. Se considerarmos uma temperatura ambiente de 30°C e 0,6 de aw o amido de quinoa não deverá ter mais que 17% de umidade para se manter seguro, porem Xe abaixo deste valor são recomendáveis. Conclui-se que o amido de quinoa apresenta-se com maior capacidade de absorção de água e maior estabilidade que os demais produtos em pó mencionados.
Na Tabela 2 são apresentados os valores das constantes de ajuste dos modelos matemáticos, o coeficiente de determinação (R2) e a média relativa do erro (MA%E) nas atividades de água de 0,03 até 0,91.
Observa-se que o modelo de Peleg descreve melhor os dados experimentais de adsorção do amido de quinoa na maioria das atividades de água testadas. A média do MA%E do modelo de Peleg nas 5 temperaturas foi de 4,07%, respectivamente. Os modelos de GAB, Oswin, Henderson e Ferro-Foltan ajustaram-se com médias entre 5,10 a 7,10%, respectivamente. Observou- se que as MA%E dos modelos diminuem quando comparados a partir de 0,18 de aw. Verificou-se que todos os modelos testados podem ser utilizados satisfatoriamente para determinar Xe ou aw do amido de quinoa em baixas aw. Os valores da MA%E desta pesquisa foram próximos ou melhores que de outros amidos, como o de ahipa e pinhão [21, 24].
O modelo de GAB fornece dados de calores de adsorção dos alimentos quando suas constantes mostram dependência com a temperatura. As constantes do modelo de GAB (Xm, C e K) mostraram essa dependência.
A Xm variou entre 10,380% para 20°C até 7,900% para 60°C. A constante C diminuiu de 16,17 para 14,00 e a constante K aumentou de 0,770 até 0,781. Com esses valores das constantes, as curvas apresentaram formas sigmóides, típicas de isotermas tipo II de Brunauer, pois 0 < K =1 e C = 2 [25].
Doporto et al. [24] fizeram estudos de isotermas de amido de casava nas temperaturas de 10, 20 e 30°C, determinando as constantes Xm (11,6 a 7,2%), C (26,2 a 10,3) e K (0,71 a 0,8).
Como as constantes do modelo de GAB mostraram dependência com a temperatura, os calores envolvidos no processo de adsorção foram determinados (Eqs. 2, 3 e 4) e apresentados na Tabela 3.
Pelos dados da Tabela 3 a energia de ativação para o teor de água da monocamada (ΔXm) é ligeiramente maior que o valor para o amido com elevado teor de amilopectina e menor que nos amidos de mandioca e pinhão. O calor da monocamada, HC, de 160 kJ/kg é ligeiramente superior ao do amido de mandioca e inferior aos demais amidos. O calor da multicamada, HK, de 6 kJ/kg é ligeiramente superior ao amido com alto teor de amilopectina e inferior aos demais amidos.
Como era de se esperar, o calor de adsorção da monocamada é maior que o da multicamada, confirmando que a ligação das moléculas de água são mais fortes na monocamada.
Os dados experimentais das umidades de equilíbrio Xe foram ajustados pelo modelo de Peleg e apresentados na Figura 2. Este modelo apresenta um bom ajuste na média das atividades de água a 20, 30, 40, 50 e 60 °C.
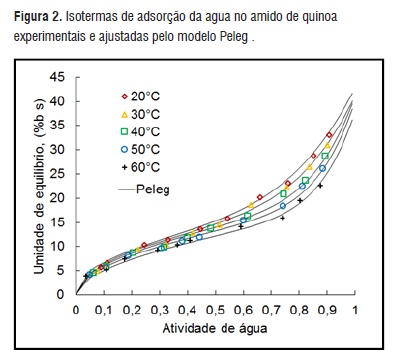 Figura 2
Figura 2Para a determinação das propriedades termodinâmicas da água utilizou-se os resultados obtidos das aw e das umidades de equilíbrio Xe em pelo menos três temperaturas. Utilizou-se o modelo de Peleg (Eq. 7), devido à melhor média de ajuste dos dados experimentais (R2 = 0,995 e MA%E = 4,067), para determinar os valores de Xe entre 0,5 a 37%, isso, mediante iteração por meio da ferramenta Solver© do programa Excel© do Windows 7©, com um valor inicial arbitrário. Com as aw determinadas nas temperaturas de 20 e 60°C determinou-se o calor isostérico de adsorção (Eqs. 13, 14 e 15).
Todos os modelos empíricos que relacionam o calor isostérico com Xe ajustaram satisfatoriamente com R2 > 0,952 e MS%E < 1%, sendo os modelos da Eqs. 12 e 13 os que apresentaram melhores resultados. Com as constantes dos modelos das Eqs. 13 a 15 as seguintes equações permitem determinar o calor isostérico de adsorção em função das Xe do amido:
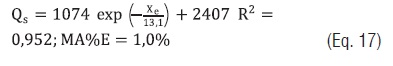 Eq. 17
Eq. 17
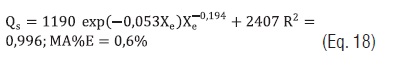 Eq. 18
Eq. 18
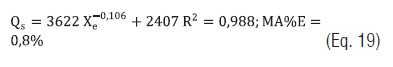 Eq. 19
Eq. 19A Eq. 16 foi a que melhor se ajustou aos dados, como mostrado na Figura 2.
Pela Eq. 18, nas Xe de 0,5; 5; 10; 20 e 30% o calor isostérico de adsorção foi de 3731,7; 3050; 2867,1; 2646,6 e 2515,3 kJ/kg, respectivamente. Este calor diminui até próximo ao valor do calor latente de vaporização da água pura conforme a umidade de equilíbrio aumenta. Observa-se um incremento notável quando o Xe é próximo de 0%. Segundo Tsami [22] a água nos alimentos com Xe entre 2 a 8% se encontra fortemente ligada nos sítios ativos da camada monomolecular.
Para Xe maiores que 10% consideram-se ligações na multicamada com menor força e para Xe maiores que 25% considera-se como água livre. Observa-se na Figura 3 que para Xe menores que 10% o calor isostérico aumenta exponencialmente e para altas Xe os calores descem a níveis do calor latente de vaporização, HL.
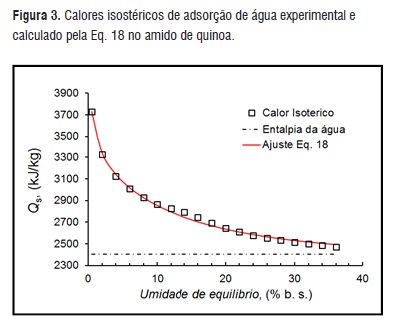 Figura 3
Figura 3Resultados semelhantes foram reportados para alimentos, como arroz com casca, farinha de babaçu, bagaço de mandioca e D-limoneno, sementes de pimenta [5, 9, 11, 28, 29].
Quanto ao valor do calor isostérico, pesquisas apresentaram resultados distintos ao do amido de quinoa. Amido de pinhão a 10% teve 3222 kJ/kg de QS [21]. O QS da farinha de mandioca a 5% e Xe foi de 6611 kJ/kg e a 35% de 2500 kJ/kg [30]. O QS da farinha de Ahipa a 10% foi de 5000 kJ/kg [24]. Portanto verifica-se que o amido de quinoa da variedade Blanca de Juli apresentou menor valor de calor isostérico de adsorção que os outros amidos mencionados. Segundo Pumacahua-Ramos [2], os grânulos do amido de quinoa da variedade Blanca de Juli possuem diâmetros de aproximadamente 1,3 µm, muito menores que os amidos comerciais. A adsorção de água pelos grânulos pequenos é mais fácil comparada ao de maior tamanho. Isto pode explicar o menor valor do calor isostérico de adsorção.
Na Figura 3 e 4, estão representados o comportamento da energia livre de Gibbs e da entropia, em função da umidade de equilíbrio. Como o calor isostérico de sorção diminui quando aumenta a temperatura, e a entropia aumenta, quando aumenta a temperatura, a energia livre de Gibbs é negativa (ΔG<0) (Figura 4). Da mesma forma, a ΔG tende ao equilíbrio (ΔG = 0) ao aumentar a umidade de equilíbrio. Sabe-se que a maior agua livre, menores os sítios ativos de adsorção da água. Estes resultados indicam que o processo de adsorção de água pelo amido de quinoa é espontâneo. A influência da temperatura nos fenômenos de adsorção também pode ser observada nas Figuras 4 e 5. Ao aumentar a temperatura ΔG e ΔS diminuem, pois as moléculas de água em altas temperaturas possuem maiores energias na adsorção. Resultados semelhantes foram reportados para o ΔG do D-limoneno em pó [29], para o ΔS do bagaço de mandioca e sementes de nopal [7, 11].
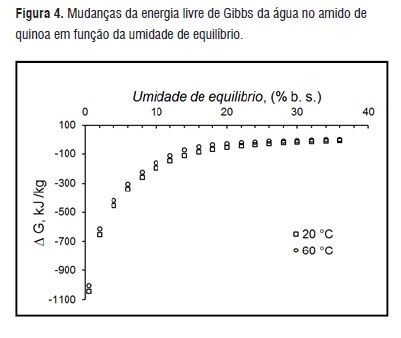 Figura 4
Figura 4
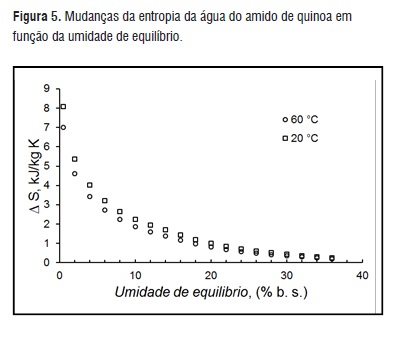 Figura 5
Figura 5CONCLUSÕES
O amido de quinoa pode ser conservado em segurança com relação ao desenvolvimento de fungos desde que possua umidade de equilíbrio entre 13,7 a 17,9% nas temperaturas de 60 a 20°C, respectivamente. Entretanto estudos específicos de microbiologia devem ser conduzidos.
Os modelos matemáticos para as isotermas ajustaram- se satisfatoriamente aos dados experimentais, porém o modelo de Peleg teve o melhor ajuste médio. Os ajustes mostraram-se melhores nas temperaturas de 20, 30 e 40°C do que para as temperaturas de 50 e 60°C.
Pelas constantes do modelo de GAB determinaramse os calores envolvidos no processo de adsorção.
Estes calores foram menores comparados a outros amidos e farinhas.
O calor isostérico, a energia livre de Gibbs e a entropia diferencial diminuiram à medida que a Xe e a temperatura aumentaram. Da mesma forma os três modelos matemáticos ajustaram muito bem os valores dos calores isostéricos de sorção experimentais.
Novas pesquisas devem ser feitas com amidos de outras variedades de quinoa, pois nos países produtores existem muitas outras variedades.
AGRADECIMENTOS
Os autores agradecem ao Departamento de Engenharia de Alimentos da Universidade Peruana Unión - Juliaca - Peru e ao Instituto de Biociências, Letras e Ciências Exatas da Universidade Estadual Paulista - SP, Brasil pelo apoio financeiro.
REFERENCIAS
[1] AGRODATA. Exportaciones de quinua peruana [online]. 2014. Disponible: http://www.agrodataperu.com/category/quinua-exportacion. [Citado 28 de abril del 2014] [ Links ].
[2] PUMACAHUA-RAMOS, A. Extração e caracterização de amido de quinoa, cañihua e Mirabilis jalapa [Tesis doctoral]. São Paulo (Brasil): Universidade Estadual Paulista Júlio de Mesquita Filho, Instituto de Biociências, Letras e Ciências Exatas, Programa de Pós-Graduação em Engenharia e Ciência de Alimentos, 2014, 126 p. [ Links ]
[3] SORMOLI, M. and LANGRISH, T. Moisture sorption isotherms and net isosteric heat of sorption for spray dried pure orange juice powder. Food Science Technology, 62, 2015, p. 875-882. [ Links ]
[4] LI, Y., WANG, X., JIANG, P. and LI, X. Sorption equilibrium moisture and isosteric heat of adsorption of Chinese dried wheat noodles. Journal of Stored Products Research, 67, 2016, p. 19-27. [ Links ]
[5] YOGENDRARAJAH, P. SAMAPUNDO, S. DEVLIEGHERE, F., DE SAEGER, S. and DE MEULENAER, B. Moisture sorption isotherms and thermodynamic properties of whole black pepercorns (Piper nigrum L.). LWT - Food Science and Technology, 64(1), 2015, p. 177-188. [ Links ]
[6] POHNDORF, R.S., CADAVAL, T.R.S. and PINTO, L.A. A. Kinetics and thermodynamics adsorption of carotenoids and chlorophylls in rice bran oil bleaching. Journal of Food Engineering, 185, 2016, p. 9-16. [ Links ]
[7] HASSINI, L., BETTAIEB, E., DESMORIEUX, H., TORRES, S.S. and TOUIL, A. Desorption isotherms and thermodynamic properties of prickly pear seeds. Industrial Crops and Products, 67, 2015, p. 457-465. [ Links ]
[8] MARTÍNEZ-LAS HERAS, R., HEREDIA, A., CASTELLÓ, M.L. and ANDRÉS, A. Moisture sorption isotherms and isosteric heat of sorption of dry persimmon leaves. Food Bioscience, 7, 2014, p. 88-94. [ Links ]
[9] OLIVEIRA, G.S., COSTA, J.M.C. and AFONSO, M.R.A. Caracterização e comportamento higroscópico do pó da polpa de cajá liofilizada. Revista Brasileira de Engenharia Agrícola e Ambiental, 18(10), 2014, p. 1059-1064. [ Links ]
[10] VILLA-VÉLEZ, H.A., DE SOUZA, S.J.F., PUMACAUA- RAMOS, A., POLACHINI, T. and TELISROMERO, J. Thermodynamic properties of water adsorption from orange peels. Journal Bioenergy Food Science, 2(2), 2015, p. 72-81. [ Links ]
[11] POLACHINI, T.C., BETIOL, L.F.L., LOPES-FILHO, J.F. and TELIS-ROMERO, J. Water adsorption isotherms and thermodynamic properties of cassava bagasse. Thermochimica Acta, 632, 2016, p. 79-85. [ Links ]
[12] CHISTÉ, R.C., CARDOSO, J.M., DA SILVA, D.A. and PENA, S. Hygroscopic behaviour of cassava flour from dry and water groups. Ciência Rural, 45(8), 2015, p. 1515-1521. [ Links ]
[13] ABEBE, W. and RONDA, F. Flowability, moisture sorption and thermal properties of tef [Eragrostis tef (Zucc.) Trotter] grain flours. Journal Cereal Science, 63, 2015, p. 14-20. [ Links ]
[14] CHEN, C. Obtaining the isosteric sorption heat directly by sorption isotherm equations. Journal of Food Engineering, 74(2), 2006, p. 178-185. [ Links ]
[15] MAHMOOD, T. TURNERA, M.A. and STODDARDB, F.L. Comparison of Methods for Colorimetric Amylose Determination in Cereal Grains. Starch/ Stärke, 59, 2007, p. 357-365. [ Links ]
[16] VAN DEN BERG, C. and BRUIN, S. Water activity and its estimation in food systems: theoretical aspects, in Water Activity: Influences on Food Quality. New York (USA): Academic Press, 1981, p. 1- 61. [ Links ]
[17] OSWIN, C.R. The kinetics of package life III. The isotherm. Journal of Chemical Industry, 65, 1945, p. 419-421. [ Links ]
[18] HENDERSON, S.M. A basic concept of equilibrium moisture. Agricultural Engineering, 33, 1952, p. 29-32. [ Links ]
[19] PELEG, M. Assessment of a semi-empirical four parameter general model for sigmoid moisture sorption isotherms. Journal of Food Process Engineering, 16, 1993, p. 21-37. [ Links ]
[20] FERRO-FONTAN, C., CHIRIFE, J., SANCHO, E. and IGLESIAS, H.A. Analysis of a model for water sorption phenomena in foods. Journal of Food Science, 47, 1982, p. 1590-1594. [ Links ]
[21] THYS, R.C.S., NOREÑA, C.P.Z., MARCZAK, L.D.F., AIRES, A.G. and CLADERA-OLIVERA, F. Adsorption isotherms of pinhão (Araucaria angustifolia seeds) starch and thermodynamic analysis. Journal of Food Engineering, 100(3), 2010, p. 468-473. [ Links ]
[22] TSAMI, E. Heat of sorption of water in dried fruits. International Journal of Food Science and Technology, 25(3), 1991, p. 350-359. [ Links ]
[23] MULET, A., SANJUÁN, R. and BON, J. Sorption Isosteric Heat Determination by Thermal Analysis and Sorption Isotherms. Journal of Food Science, 64(1), 1999, p. 64-68. [ Links ]
[24] DOPORTO, M.C., DINI, C., MUGRIDGE, A., VIÑA, S.Z. and GARCÍA, M.A. Physicochemical, thermal and sorption properties of nutritionally differentiated flours and starches. Journal of Food Engineering, 113(4), 2012, p. 569-576. [ Links ]
[25] BLAHOVEC, J. Sorption isotherms in materials of biological origin mathematical and physical aproach. Journal of Food Engineering, 65(4), 2004, p. 489-495. [ Links ]
[26] AL-MUHTASEB, A.H., MCMINN, W.A.M. and MAGEE, T.R.A. Water sorption isotherms of starch powders. Journal of Food Engineering, 61(3), 2004, p. 297-307. [ Links ]
[27] SANDOVAL, A.J. and BARREIRO, J.A. Moisture adsorption isotherms of amorphous cassava starch at different temperatures determined by a dynamic vapor sorption technique. Revista de la Facultad de Agronomia (LUZ), 29, 2012, p. 475- 493. [ Links ]
[28] MATOS, E.N.V., SAMPAIO, R.M. and DO L. DE PAULA, M. Determinação das isotermas de adsorção e do calor de sorção de farinha de babaçu comercial. Cadernos de Pesquisa, 21, 2014, p. 1-9. [ Links ]
[29] RUBIANO, K. y ASOCIADO, P. Evaluación de las propiedades termodinámicas y térmicas del d-limoneno encapsulado. Revista U.D.C.A Actualidad and Divulgación Científica, 18(2), 2015, p. 425-434. [ Links ]
[30] AYALA-PONTE, A. Estimación de las isotermas de adsorción y del calor isostérico en harina de yuca, Biotecnología en el Sector agropecuario y agroindustrial, 9(1), 2011, p. 88-96. [ Links ]














