Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.15 no.2 Popayán July/Dec. 2017
https://doi.org/10.18684/BSAA(15)112-120
DOI: http://dx.doi.org/10.18684/BSAA(15)112-120
BIOSILO DE RESIDUOS DE MERLUZA Y HARINA DE CEBADA FERMENTADOS CON BACTERIAS ÁCIDO LÁCTICAS SELECCIONADAS
BIO-SILAGE OF HAKE WORK-PROCESSING WASTE AND WHEAT MEAL FERMENTED WITH SELECTED LACTIC ACID BACTERIA
BIOSILAGEM DE DESPERDÍCIO DE MERLUZA E FARINHA DE CEVADA FERMENTADOS COM BACTÉRIAS ÁCIDO LÁCTICAS SELECIONADAS
EMILIO MARGUET1, MARISOL VALLEJO2, GUSTAVO SCHULMAN3, CECILIA IBAÑEZ4, PABLO LEDESMA5, ROMINA PARADA6
1 Universidad Nacional de la Patagonia, Facultad de Ciencias Naturales, Sede Trelew, Grupo de investigación de Biotecnología Bacteriana. Doctor en Bioquímica. Trelew, Argentina.
2 Universidad Nacional de la Patagonia, Facultad de Ciencias Naturales, Sede Trelew, Grupo de investigación de Biotecnología Bacteriana. Doctora en Biología. Trelew, Argentina.
3 Universidad Nacional de la Patagonia, Facultad de Ciencias Naturales, Sede Trelew, Grupo de investigación de Biotecnología Bacteriana. Licenciado en Biotecnología. Trelew, Argentina.
4 Universidad Nacional de la Patagonia, Facultad de Ciencias Naturales, Sede Trelew, Grupo de investigación de Biotecnología Bacteriana. Licenciada en Biotecnología y Biología Molecular. Trelew, Argentina.
5 Universidad Nacional de la Patagonia, Facultad de Ciencias Naturales, Sede Trelew, Grupo de investigación de Biotecnología Bacteriana. Licenciado en Biología. Trelew, Argentina.
6Universidad Nacional de la Patagonia, Facultad de Ciencias Naturales, Sede Trelew, Grupo de investigación de Biotecnología Bacteriana. Licenciada en Biología. Trelew, Argentina.
Correspondencia: emarguet@yahoo.com.ar
Recibido para evaluación: 24 de Noviembre de 2016. Aprobado para publicación: 29 de Marzo de 2017.
RESUMEN
Se estudió la capacidad como inoculantes de biosilo de Lactococcus lactis Tw34 y Lactobacillus plantarum Lb7. Los experimentos se llevaron a cabo con una mezcla de subproductos de merluza (Merluccius hubbsi) y harina de cebada, fermentada durante 7 días. Como control se utilizó una muestra acidificada con ácido láctico. En las mezclas biológicas, el pH disminuyó por debajo de 5,0 después de 2 días de fermentación y permaneció estable hasta el final de la experiencia. La población máxima (>109 UFC/g) se alcanzó después de 5 días de incubación a 18°C. La concentración de péptidos solubles en agua aumentó durante los 7 días de incubación y no hubo diferencias significativas (p < 0,05) entre el control y ambos biosilos. Las concentraciones de péptidos solubles en ácido tricloroacético de los biosilos fueron superiores al control (p > 0,05). Después de 7 días, las concentraciones de fósforo alcanzadas fueron 2,26 y 2,42 g /100 g en los biosilos fermentados con Lc. lactis Tw34 y Lb. plantarum Lb7 respectivamente, mientras que en el control los valores permanecieron casi estables (1,61 g/100 g). Al final de la experiencia, la actividad inhibitoria de tripsina fue suprimida en ambos biosilos mientras que, en el control los factores antinutricionales seguían siendo activos. Los resultados indican la factibilidad del uso de la mezcla seleccionada como sustrato para la producción de biosilo y la eficacia de Lc. lactis Tw34 y Lb. plantarum Lb7 como inoculantes.
PALABRAS CLAVE: Biosilo, Merluza, Cebada, Fermentación.
ABSTRACT
Suitability of Lactococcus lactis Tw34 and Lactobacillus plantarum Lb7 as bio-silage inoculants was studied. Experiments were carried out with a mixture of hake (Merluccius hubbsi) by-products and barley meal fermented during 7 days. A sample acidified with lactic acid was used as control. In biological mixtures, the pH dropped below 5,0 after 2 days of fermentation and remained stable until the end of the experience. Maximum populations (> 109 CFU/g) were reached after 5 days of incubation at 18°C. Water soluble peptides concentration increased during the 7 days of incubation and no significant differences (p < 0,05) were found between the control and both bio-silage. Trichloroacetic acid soluble peptides concentrations of bio-silages were higher than the control (p > 0,05). After 7 days, phosphorous concentrations reached 2.26 and 2,42 g/100 g in bio-silages fermented with Lc. lactis Tw34 and Lb. plantarum Lb7, respectively, while control values remains almost stable (1,61 g/100 g). At the end of the experience, inhibitory activity of trypsin was abolished in both bio-silage while in control sample antinutritional factors remained active. The results indicated the feasibility of the use of the selected mixture as substrate for bio-silage production and the effectiveness Lc. lactis Tw34 and Lb. plantarum Lb7 as inoculants.
KEYWORDS:Bio-silage, Hake, Barley, Fermentation.
RESUMO
Foi estudada a capacidade de inoculantes em biosilagem de Lactococcus lactis Tw34 y Lactobacillus plantarum Lb7. Os experimentos foram realizados com uma mistura de produtos de merluza (Merluccius hubbsi) e farinha de cevada, fermentada durante 7 dias. Como controle se utilizou uma amostra acidificada com ácido láctico. Nas misturas biológicas, o pH ficou abaixo 5,0 depois de 2 dias de fermentaç ão e permaneceu estável até o final do experimento. A contagem máxima de viáveis (>109 UFC/g) foi alcançada depois de 5 dias de incubaç ão a 18°C. A concentração de peptídeos solúveis em água aumentou durante os 7 dias de incubação e não houve diferença significativa (p < 0,05) entre o controle e a silagem. As concentrações de peptídeos solúveis em ácido tricloroacético da silagem foram superiores ao controle (p >0,05). Depois de 7 dias, as concentrações de fósforo alcançadas foram de 2,26 e 2,42 g/100 g nas silagens fermentadas com Lc. lactis Tw34 e Lb. plantarum Lb7 respectivamente, en quanto que no controle os valores permaneceram quase estáveis (1,61 g/100 g). No final do experimento, a atividade inibitória de tripsina foi suprimida em ambas silagens enquanto que no controle os fatores antinutricionais continuavam ativos. Os resultados indicam a possibilidade do uso de uma mistura selecionada como substrato para a produç ão de silagem e a capacidade de Lc. lactis Tw34 e Lb. plantarum Lb7 como inoculantes.
PALAVRAS CHAVE:Biosilagem, Merluza, Cevada, Fermentação.
INTRODUCCIÓN
La acuicultura es, a escala mundial, el sector de producción de alimentos que más ha crecido, registrando un aumento de casi el 10% entre los años 1984 y 2004. Estos registros son significativamente superiores si se los compara, en el mismo período, con la producción ganadera (3%) y la pesca extractiva (1,6%). Desde el año 1984 hasta 2014 el aumento interanual exhibió una media del 3%, sensiblemente menor que las 2 décadas pasadas pero aún superiores a la pesca extractiva que se mantuvo en un promedio de 1,3 de aumento interanual [1].
El costo de los alimentos es uno de los factores que más influye en esta actividad económica por lo que existe una constante evolución en la producción de nuevos y mejores productos. Se ha prestado especial atención a la búsqueda de fuentes alternativas con el objeto de reducir la dependencia de la harina de pescado como principal fuente de proteínas [2]. Los altos costos de este producto influyen en forma directa en la sustentabilidad de la acuicultura [1, 2].
Las harinas de origen vegetal han sido la mejor opción para reemplazar las proteínas animales debido a su bajo costo y accesibilidad [3, 4]. Sin embargo, estos productos presentan algunos inconvenientes como la presencia de factores antinutricionales, digestibilidad reducida, baja palatabilidad y alto contenido en ácido fítico [4, 5, 6, 7]. Esta situación induce a tomar ciertas previsiones, siendo recomendables tratamientos físicos, químicos o biológicos antes de la inclusión de aditivos vegetales en alimentos destinados a la alimentación de peces [6, 8, 9].
En forma paralela durante los últimos años la idea de alimentos funcionales, inicialmente desarrollada para consumo humano, ha sido trasladada al uso veterinario. El objetivo de estos alimentos está dirigido, no sólo a satisfacer los requerimientos nutricionales y metabólicos, sino a brindar beneficios a la salud de quien los consuma. La inclusión de probióticos o microorganismos potencialmente benéficos en las dietas para peces ha demostrado eficacia para mejorar la salud del huésped y el medio ambiente [10, 11].
La definición más aceptada de probióticos es la sugerida por Fuller quien los describe como 'organismos vivos usados como suplemento alimenticio que ejercen un efecto benéfico en el huésped animal, al mejorar el balance intestinal' [12]. Sin embargo los medios acuáticos necesitan una readecuación de esta definición por lo que Verschuere sugiere definir a los probióticos como 'microorganismos vivos que tienen un efecto beneficioso sobre el hospedador modificando la comunidad microbiana relacionada o con el ambiente en el que éste se desarrolla, a través de una mejora del uso del alimento o de su valor nutricional, y/o de la respuesta del hospedador a las enfermedades, y/o la calidad del ambiente' [11]. Ha sido ampliamente demostrado que la adición de probióticos a la dieta de los peces promueve la colonización y adhesión intestinal, aumenta la respuesta inmunológica y capacidad de resistir a enfermedades infecciosas [10]. Sin embargo, también hay que tener en consideración que la adición de probióticos, no sólo puede traer los beneficios enumerados, sino que se puede recurrir a la fermentación previa con estos microorganismos para mejorar la calidad del alimento, aumentar la aceptación y disminuir los efectos negativos de los nutrientes no digeridos [8, 13, 14].
En este trabajo se evaluaron parámetros vinculados con el aumento de la calidad en alimentos experimentales elaborados con desechos de merluza y harina de cebada sometidos a una fermentación previa utilizando 2 cepas de bacterias ácido lácticas (BAL). Las cepas forman parte de la colección de cultivos del Laboratorio de Biotecnología Bacteriana (Facultad de Ciencias Naturales, Sede Trelew, Universidad Nacional de la Patagonia 'San Juan Bosco') y fueron seleccionadas de acuerdo a sus características probióticas. La cepa Lactococcus lactis subsp lactis Tw34 es productora de nisina Z y presenta actividad inhibitoria contra patógenos frecuentes en acuicultura [15], mientras que la cepa Lactobacillus plantarum Lb7 tiene alta resistencia a pH bajos y sales biliares, y exhibe altos índices de autoagregación [16].
MÉTODO
Microorganismos
Las cepas Lc. lactis subsp lactis Tw34 y Lb. plantarum Lb7 se obtuvieron de la colección perteneciente al Laboratorio de Biotecnología Bacteriana (Facultad de Ciencias Naturales, Universidad Nacional de la Patagonia). Las cepas se reactivaron con sucesivos cultivos en caldo y agar de Man, Rogosa y Sharp (MRS, Biokar, Francia) y se conservaron en leche descremada suplementada con glicerol al 10% a 30°C.
Elaboración del alimento experimental
Se realizó a partir de residuos de merluza (Merluccius hubbsi) tratados con molinillo a 12.000 revoluciones por minuto hasta obtener una masa uniforme. Se utilizaron granos de cebada deshidratados tratados del mismo modo que el procedimiento descrito para los residuos de merluza, hasta obtener una harina de aspecto uniforme. La composición final del alimento experimental contenía: homogenato de merluza 68%, harina de cereal 25%, aceite de girasol 5%, mezcla de vitaminas 1% (Vitamin Premix, EEUU) y sorbato de sodio 1% (Saporiti, Argentina).
Proceso de fermentación
El alimento experimental se sometió a un proceso de fermentación durante 7 días a una temperatura constante de 18°C. La inoculación se realizó con 1 ml de un cultivo en caldo MRS de las cepas mencionadas cada 100 g de alimento. Como control se realizó una incubación del alimento experimental, previamente tratado con ácido láctico (Sigma, EEUU) hasta alcanzar un pH de 4,5 y bajo las condiciones descritas. La toma de muestras se realizó cada 24 h hasta completar la experiencia de 7 días. Todos los ensayos se realizaron por triplicado y las muestras se conservaron a -30°C hasta el momento de su procesamiento.
Para los ensayos posteriores se obtuvieron sobrenadantes por centrifugación a 13000 g (Heraeus Biofuge Pico, Reino Unido) de la mezcla resultante de 1 g de muestra en 1 ml de agua destilada, previamente tratada con vortex durante 1 min.
Determinación del pH
El pH de las muestras se determinó con un pHmetro Orion modelo 410A con electrodo Orion para sólidos 8135BN
Determinación de fosfato libre
El fosfato liberado se determinó en el sobrenadante de las muestras según la técnica descrita por Fiske y Subarow [17]. La reacción se llevó a cabo utilizando 100 µL de muestra y 900 µL de una solución que contenía 0,6 M de H2SO4, 2% de ácido ascórbico y 0,5% de molibdato de amonio (Cicarelli, Argentina). Luego de una incubación a 50°C durante 30 min se realizó la lectura de la densidad óptica a 820 nm. Para la curva de calibración se utilizó una solución patrón de K2HPO4 (Cicarelli, Argentina).
Determinación de fracciones proteicas
La fracción soluble en agua (FSA) se determinó en los sobrenadantes de las muestras, previa dilución en agua destilada hasta alcanzar una concentración de 0,1 g/mL. Las muestras se conservaron durante 24 h a 4°C y se llevó a cabo una nueva homogenización en la forma indicada anteriormente. Las suspensiones se centrifugaron a 13000 g durante 2 min y la concentración del sobrenadante se determinó mediante la técnica del o-ftaldialdhehído [18].
La fracción soluble en ácido tricloroacético al 12% (FSTCA) se determinó tratando un volumen de los sobrenadantes obtenidos según el procedimiento descrito para la FSA, con igual volumen de una solución de TCA al 24% (Cicarelli, Argentina), sometiendo la mezcla a agitación vigorosa durante 1 min [19]. Luego de un período de reposo de 10 min la suspensión se centrifugó durante 2 min a 13000 g y la concentración del sobrenadante se determinó mediante la técnica del o-ftaldialdhehído.
La reacción se llevó a cabo con 2 mL de reactivo de o-ftaldialdhehído (Sigma, EEUU) y 50 µL de FSA o 100 µL de FSTCA. La lectura se realizó en espectrofotómetro (Jenway, Reino Unido) a 590 nm y los cálculos se realizaron utilizando una curva patrón de leucina. Los resultados de FSA y FSTCA se expresaron en mg de leucina/100 g de alimento experimental.
Determinación de la actividad inhibitoria de tripsina
Se utilizó como sustrato 1 mL de una solución de azocaseína (Sigma, EEUU) (10 mg/mL en buffer Tris, 0,1 M y pH 8,5) tratada con tripsina (Sigma, EEUU) a una concentración final de 0,1 mg/mL. Se agregaron 100 µL de cada muestra y como control se utilizó agua destilada. Luego de una incubación a 37°C durante 30 min se detuvo la reacción con 100 µL de TCA al 25% y se centrifugó a 13000 g durante 2 min. El sobrenadante se trató con 600 µL de NaOH 0,5 M y se realizó la lectura de la densidad óptica en espectrofotómetro a 450 nm [20]. Los resultados se expresaron en unidades de inhibición de tripsina por mg utilizando la fórmula sugerida por Liu y Markanis [21].
Recuento bacteriano
Los recuentos bacterianos de las respectivas muestras se realizaron por diluciones seriadas en medio líquido y posterior siembra en agar MRS para las cepas en estudio. Los resultados se expresaron en unidades formadoras de colonia por gramo de alimento experimental (UFC/g).
Análisis estadístico
Todos los ensayos se realizaron por triplicado; los promedios, desvíos estándar y análisis de la varianza (ANOVA) se calcularon mediante el uso del programa estadístico HyperStat. El ANOVA se aplicó para establecer diferencias significativas (p ≤0,05).
RESULTADOS
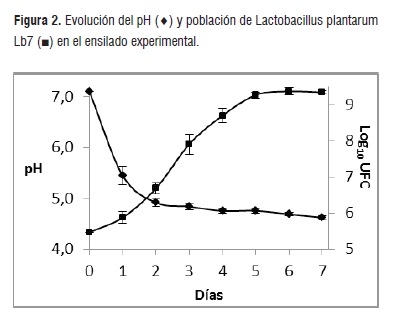
La harina de cebada constituye una fuente rica en almidón que, degradado por las amilasas propias del cereal, eleva la concentración de azúcares que comienzan a ser fermentados por las BAL. Este fenómeno permite el rápido descenso del pH y el aumento de la población de BAL, como se puede observar en las figuras 1 y 2.
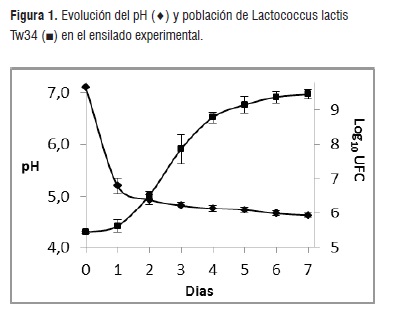
En el caso de Lc. lactis Tw34 el pH descendió a 5,45 durante las primeras 24 h y a 4,94 a las 48 h. Luego y hasta el séptimo día los valores descendieron levemente hasta alcanzar un valor de 4,58. La población aumentó levemente durante las primeras 24 h, luego y hasta el cuarto día se desarrolló la fase logarítmica que alcanzó una población de 4,2*108 UFC. La población a los 7 días de experiencia llegó a 2,1*109 UFC.
El comportamiento en la evolución del pH y el aumento de la población de la cepa Lb. plantarum Lb7 fue comparable al observado en el caso anterior. El pH al final de la experiencia fue 4,58 y se alcanzó una población de 1,8*109 UFC.
Como se ha demostrado en trabajos anteriores, los cereales resultan fuentes suficientes de hidratos de carbono para mantener un sostenido descenso del pH [22]. Los valores de pH alcanzados en ambos casos al final de la experiencia crean un ambiente donde las BAL componen casi con exclusividad la microbiota del ensilado, inhibiendo las bacterias que potencialmente puedan actuar como patógenos o deteriorantes.
Las poblaciones alcanzadas en ambos casos resultan lo suficientemente elevadas como para adherirse y colonizar el intestino de los peces y lograr competir con otros grupos bacterianos potencialmente indeseables. La nisina Z, producida por la cepa Lc. lactis Tw 34 es efectiva contra la mayoría de los bacterias patógenas Gram+ habituales en acuicultura [15] y, como se ha demostrado, la producción de esta bacteriocina es factible utilizando como sustratos proteínas originadas en el descarte de la industria pesquera [13].
La cepa Lb. plantarum Lb 7 exhibe una gran resistencia a bajos pH y contenido de sales biliares que en forma conjunta con sus propiedades de autoagregación, coagregación e hidrofobicidad hace posible desarrollar mecanismos de protección contra patógenos a través de la competición de sitios de adhesión y nutrientes [16].
Como se puede observar en la figura 3 la evolución de la concentración de la fracción de péptidos solubles en agua (FSA) fue comparable en los tres casos (p = 0,05). La concentración final en el control fue de un equivalente a 1081 mg de leucina por 100 g mientras que en los ensilados de Lb. plantarum Lb7 y Lc. Lactis Tw34 se obtuvieron valores de 1189 y 1244 mg de leucina por 100 g, respectivamente.
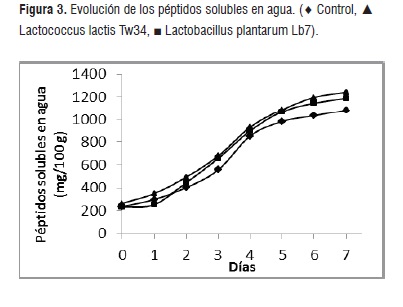
Esto se debe en forma casi excluyente a la actividad de las proteasas musculares, especialmente la catepsina D, que exhibe su máxima actividad a pH ácido [23], condición lograda en el ensilado control por el agregado de ácido láctico y por la síntesis del mismo en los casos de los alimentos experimentales fermentados con bacterias. Esta actividad hidrolítica produce péptidos de mediano a gran tamaño que exhiben dificultad para ser transportados dentro de la célula bacteriana y en consecuencia no influyen en la duplicación celular.
En la figura 4, podemos observar que el aumento de las concentraciones de péptidos solubles en ácido tricloroacético (PSTCA) varía muy poco en el control a través de los 7 días de experiencia mientras que, en los alimentos fermentados por los microorganismos seleccionados hay un aumento constante. Los valores finales del ensilado control y los fermentados por Lb. plantarum Lb7 y Lc. lactis Tw34 fueron 368; 771 y 840 mg de leucina por 100 g, respectivamente. En este parámetro encontramos diferencias significativas entre los valores determinados en los ensilados biológicos y el control (p ≤ 0,05).
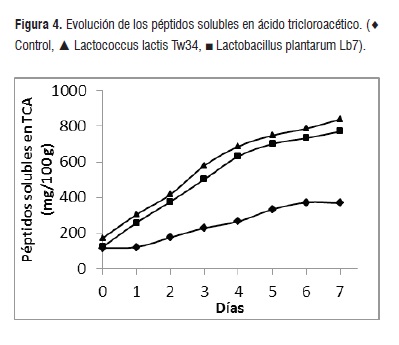
En estos casos las proteasas de las BAL utilizan como sustratos los péptidos originados por las enzimas musculares, dando como resultado una elevada concentración de PSTCA, constituido por péptidos de 2 a 20 aminoácidos que pueden ser transportados al interior de la célula [24]. El mecanismo de transporte es llevado a cabo por un sistema muy especializado denominado Opp que logra llevar al citosol péptidos que contienen los aminoácidos necesarios para mantener un constante crecimiento de la población celular [25].
El descenso del pH, el aumento de la densidad poblacional y el aumento de la fracción de PSTCA son eventos relacionados y que dependen de la calidad de los sustratos utilizables como fuentes de aminoácidos y azúcares fermentables. Ya ha sido demostrado en trabajos anteriores la buena calidad de las proteínas de pescado, inclusive aquellas que componen el descarte, que permiten satisfacer las demandas metabólicas de las BAL, aún en aquellas especies de desarrollo fastidioso [26].
Otro aspecto que se debe considerar es que la hidrólisis de las proteínas durante la fermentación produce cambios en la palatabilidad con el consecuente aumento del apetito, mejora la digestibilidad y el grado de conversión del alimento. En los últimos años también se ha demostrado que los péptidos de bajo peso molecular tienen propiedades adicionales, además de las descritas, vinculadas con la capacidad antioxidante [27, 28].
Uno de los problemas de suplementar dietas destinadas a peces con derivados de cereales es la inclusión de factores antinutricionales. El ácido fítico y sus derivados contienen más del 80% del fósforo presente en las células vegetales y resulta, en esa forma química, inaccesible, tanto para peces monogástricos como agástricos. En consecuencia se ve impedida su biodisponibilidad, liberándose e impactando en forma negativa en el medio ambiente. Esta molécula tiene además la propiedad de formar quelatos con cationes divalentes y complejos con proteínas, disminuyendo en forma sensible su accesibilidad en la dieta [6, 9].
Las metodologías para disminuir la concentración de fitatos se basan en el pretratamiento con fitasas comerciales o la fermentación con microorganismos que posean actividad enzimática específica [6,7, 9,22]. En nuestro caso el proceso de fermentación permitió un aumento constante de la concentración de fósforo libre alcanzando valores de 2,42 y 2,26 g por 100 g de ensilado en los casos de Lb. plantarum Lb7 y Lc. lactis Tw34 (figura 5).
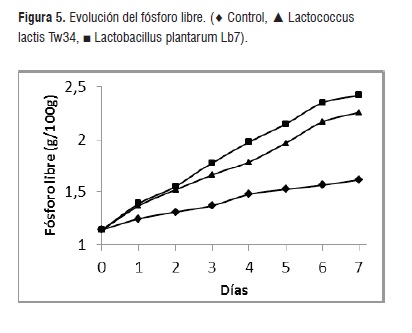
En cambio la concentración se mantuvo relativamente constante en el ensilado control, logrando al final de la experiencia una concentración de 1,61 g por 100 g, valor que muestra diferencia significativa con respecto a los ensilados biológicos (p ≤ 0,05).
El fenómeno del aumento de la concentración de fósforo libre se debe a la acción enzimática de las BAL sobre los fitatos de la cebada de modo tal que, un compuesto orgánico inaccesible y con impacto negativo en el medio ambiente se transforma en una forma química aceptable para el metabolismo de los peces. La técnica del tratamiento con bacterias lácticas de alimentos que contienen componentes derivados de cereales ha comenzado a utilizarse con mayor frecuencia fundamentado en las ventajas de eliminar el ácido fítico que interfiere en la biodisponibilidad de minerales y en la degradación de proteínas [9, 22].
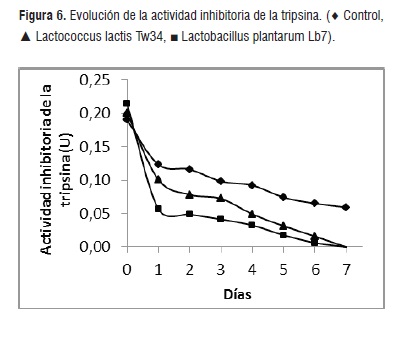
El ácido fítico y sus derivados no son los únicos factores antinutricionales presentes en los alimentos para peces que utilizan ingredientes alternativos derivados de plantas. Los taninos, oligosacáridos, polisacáridos, lectinas y otras especies químicas disminuyen la digestibilidad de nutrientes y la absorción de minerales y vitaminas [4, 5, 7]. El ensayo de la actividad antitripsina es una técnica que nos permite determinar la capacidad de un derivado vegetal para interferir la hidrólisis enzimática de proteínas. La cebada no contiene elevadas concentraciones de factores antinutricionales sin embargo, como se puede observar en la figura 6, luego de 7 días, el proceso fermentativo logra eliminar por completo la actividad antitripsina, mientras que en el control se mantiene una actividad de 0,6 U.
Sin embargo, en este caso no podemos concluir si la desaparición de la actividad antitripsina se debe a la hidrólisis del ácido fítico o a la metabolización de otros factores.
CONCLUSIONES
Los azúcares contenidos en la cebada contribuyen a la duplicación bacteriana que permite la disminución del pH a valores tales que, impiden el desarrollo de flora indeseable. El metabolismo de las cepas elegidas también aumenta la concentración de oligopéptidos que favorecen la digestibilidad y la palatabilidad, y además contribuye a la disminución de los niveles de factores antinutricionales en general, o como el ácido fítico, en particular. En consecuencia, los resultados de este trabajo sugieren la conveniencia de realizar fermentaciones previas con BAL en alimentos destinados a peces que contienen derivados vegetales.
AGRADECIMIENTOS
Los autores agradecen el apoyo financiero provisto por la Secretaría de Políticas Universitarias (Ministerio de Educación, Argentina), Proyectos de Vinculación Tecnológica: 'Capacidades Universitarias para el Desarrollo Productivo' y a la Secretaría de Ciencia y Técnica de la Universidad Nacional de la Patagonia San Juan Bosco.
REFERENCIAS
[1] ORGANIZACIÓN DE LAS NACIONES UNIDAS PARA LA AGRICULTURA Y LA ALIMENTACIÓN (FAO). El estado mundial de la pesca y la acuicultura. Oportunidades y desafíos. Roma (Italia): 2014. [ Links ]
[2] CARUSO, G. Use of plant products as candidate fish meal substitutes: an emerging issue in aquaculture productions. Fisheries and Aquaculture Journal, 6, 2015, p. 1-3. [ Links ]
[3] MOHAMED, S., HASSAAN, M.S., SOLTANB, M.A. and ABDEL MOEZC, A.M. Nutritive value of soybean meal after solid state fermentation with Saccharomyces cerevisiae for Nile tilapia, Oreochromis niloticus. Animal Feed Science and Technology, 201, 2015, p. 89–98. [ Links ]
[4] COUTO, A., PERES, H., OLIVA-TELES, A. and ENES, P. Screening f nutrient digestibility, glycaemic response and gut morphology alterations in gilthead seabream (Sparus aurata) fed whole cereal meals. Aquaculture 450, 2016, p. 31–37. [ Links ]
[5] RIBEIRO, L., MOURA, J., SANTOS, M., COLEN, R., RODRIGUES, V., BANDARRA, N., SOARES, F., RAMALHO, P., BARATA, M., MOURA, P., PEDRO POUSÃO-FERREIRA, P. and DIAS, J. Effect of vegetable based diets on growth, intestinal morphology, activity of intestinal enzymes and haematological stress indicators in meagre (Argyrosomus regius). Aquaculture, 447, 2015, p. 116-128. [ Links ]
[6] TORRECILLAS, S., MOMPEL, M.J., CABALLERO, M.J., MONTERO, D., MERRIFIELD, A., RODILES, A., ROBAINA, L., ZAMORANO, M.J., KARALAZOS, V., KAUSHIK, S. and IZQUIERDO, M. Effect of fishmeal and fish oil replacement by vegetable meals and oils on gut health of European sea bass (Dicentrarchus labrax). Aquaculture, 468, 2017, p. 386-398. [ Links ]
[7] DANWITZ, A., VAN BUSSEL, G.J., SIMON, F., KLATT, S.F. and SCHULZ, C. Dietary phytase supplementation in rapeseed protein based diets influences growth performance, digestibility and nutrient utilisation in turbot (Psetta maxima L.). Aquaculture, 450, 2016, p. 405–411. [ Links ]
[8] HAIDAR, M., PETIE, M., HEINSBROEK, L., VERRETH, J. and SCHRAM J. The effect of type of carbohydrate (starch vs. nonstarch polysaccharides) on nutrients digestibility, energy retention and maintenance requirements in Nile tilapia. Aquaculture, 463, 2016, P. 241-247. [ Links ]
[9] MAREN, M., FISCHER, M., EGLI, I., AEBERLI, I., HURRELL, R. and MEILE, L. Phytic acid degrading lactic acid bacteria in tef-injera fermentation. International Journal of Food Microbiology, 190, 2014, p. 54–60. [ Links ]
[10] AKHTER, N., WU, B., MEMON, A.M. and MOHSIN, M. Probiotics and prebiotics associated with aquaculture: A review. Fish & Shellfish Immunology, 45, 2015, p. 733-741. [ Links ]
[11] VERSHUERE, L., ROMBAUT, G., SORGELOOS, P. and VERSTRAETE, W. Probiotic bacteria as biological control agents in aquaculture. Microbiology and Molecular Biology Reviews, 64, 2000, p. 655– 671. [ Links ]
[12] DAWOOD, M. and KOSHIO, S. Recent advances in the role of probiotics and prebiotics in carp aquaculture. Aquaculture, 454, 2016, p. 243-251. [ Links ]
[13] VÁZQUEZ, J.A., GONZÁLEZ, M.P. and MURADO, M.A. Preliminary tests on nisin and pediocin production using waste protein sources factorial and kinetic studies. Bioresource Technology, 97, 2006, p. 605–613. [ Links ]
[14] VÁZQUEZ, J.A., DOCASAL, S.F., PRIETO, M.A., GONZÁLEZ, M.P. and MURADO, M.A. Growth and metabolic features of lactic acid bacteria in media with hydrolysed fish viscera. An approach to bio-silage of fishing by-products. Bioresource Technology, 99, 2008, p.6246-6257. [ Links ]
[15] SEQUEIROS, C., GARCÉS, M., VALLEJO, M., MARGUET, E. and OLIVERA, N. Potential aquaculture probiont Lactococcus lactis TW34 produces nisin Z and inhibits the fish pathogen Lactococcus garvieae. Archives of Microbiology, 197, 2015, p. 449-458. [ Links ]
[16] VALLEJO, M., MARGUET, E. y ETCHECHOURY, V.E. Potencial probiótico de cepas de Lactobacillus aisladas de quesos ovinos patagónicos. Revista Salud Pública y Nutrición, 9, 2008, p. 1-10. [ Links ]
[17] FISKE, C.H. and SUBARROW, Y. The colorimetric determination of phosphorus. Journal of. Biological Chemistry, 66, 1925, p. 375–400. [ Links ]
[18] URSHEV, Z., NINOVA-NIKOLOVA, N., ISHLIMOVA, D., PASHOVA-BALTOVA, K., MICHAYLOVA, M. and SAVOVA T. Selection and characterization of naturally occurring high acidification rate Streptococcus thermophilus strains. Biotechnology and Biotechnological Equipment, 28, 2014, p. 899-903. [ Links ]
[19] NGO, A., EZOULIN, M., YOUM, I. and YOUAN, B. Optimal concentration of 2,2,2-trichloroacetic acid for protein precipitation based on response surface methodology. Analytical and Bioanalytical Techniques, 5, 2014, p. 1-11. [ Links ]
[20] SPELBRINK, R.E., GERRITS, P.J., MOOIJ, C. and GIUSEPPIN, M.L. Quantitative determination of trypsin inhibitory activity in complex matrices. The Open Food Science Journal, 5, 2011, p. 42-46. [ Links ]
[21] LIU, K. and MARKAKIS, P. An improved colorimetric method for determining antitryptic activity in soybean products. Cereal Chemistry, 66, 1989, p. 415-422. [ Links ]
[22] MAGALA, M., KOHAJDOVA, Z. and KAROVICOVA, J. Degradation of phytic acid during fermentation of cereal substrates. Journal of Cereal Science, 61, 2015, p. 94-96. [ Links ]
[23] SRIKET, C. Proteases in fish and shellfish: Role on muscle softening and prevention. International Food Research Journal, 21, 2014, p. 433-445. [ Links ]
[24] ATANASOVA, J., MONCHEVA, P. and IVANOV,A I. Proteolytic and antimicrobial activity of lactic acid bacteria grown in goat milk. Biotechnology & Biotechnological Equipment, 28, 2014, p. 1073-1078. [ Links ]
[25] NOENS, E. and LOLKEMA, J. Physiology and substrate specificity of two closely related amino acid transporters, SerP1 and SerP2, of Lactococcus lactis. Journal of Bacteriology, 197, 2015, p. 951-958. [ Links ]
[26] HORNA, S.J., ASPMO, S.I. and EIJSINK, V.G. Evaluation of different cod viscera fractions and their seasonal variation used in a growth medium for lactic acid bacteria. Enzyme and Microbial Technology, 40, 2007, p. 1328–1334. [ Links ]
[27] HALIM, N.R., YUSOF, H.M. and SARBON, N.M. Functional and bioactive properties of fish protein hydrolysates and peptides: A comprehensive review. Trends in Food Science and Technology, 51, 2016, p. 24-33. [ Links ]
[28] SILA, A. and BOUGATEF, A. Antioxidant peptides from marine by-products: Isolation, identification and application in food systems. A review. Journal of Functional Foods, 21, 2016, p.10–26. [ Links ]














