INTRODUCCIÓN
La deforestación, a nivel mundial es uno de los procesos de degradación ambiental de alto impacto negativo en la sostenibilidad y competitividad de los ecosistemas, que genera pérdidas de biodiversidad, degradación de suelos, aguas y cambios en los microclimas de las regiones afectadas y del clima a nivel global. A pesar de que en los últimos 25 años la deforestación ha venido disminuyendo en más del 50% aún se siguen deforestando los bosques a nivel mundial [1].
En Colombia la región Caribe ocupa el cuarto puesto en zonas de alta deforestación presentando un 13% de la superficie deforestada [2], asociado a fuertes problemas de degradación de suelos, aguas y pérdidas de biodiversidad, lo cual requiere programas de recuperación basados en establecimiento de plantaciones forestales y agroforestales. Frente a esta problemática la Corporación Nacional de Investigación y Fomento Forestal (CONIF) han priorizado la necesidad de establecer plantaciones forestales en los planes de desarrollo del sector, con líneas de investigación en evaluación de recursos genéticos, nutrición forestal mediante sistemas de fertilización orgánica y biológica y manejo de suelos, para optimizar la producción, lograr rendimientos competitivos y lograr una sostenibilidad ambiental, económica y social en este sector productivo [3,4].
En especies arbóreas, se presentan limitantes en la producción tanto a nivel de vivero, trasplante y plantación establecida, relacionados con los procesos de multiplicación, aclimatación y adaptación de los cultivos a diversas condiciones agroecológicas. El uso de biofertilizantes con base en Hongos Formadores de Micorrizas Arbusculares (HFMA) se han convertido en una interesante alternativa para reducir pérdidas en estos procesos, ya que se han demostrado en un alto número de cultivos (semestrales y perennes) el efecto benéfico relacionado con mayor supervivencia de plantas a nivel de vivero debido al incremento en el crecimiento de raíces y mejor nutrición en estados tempranos de desarrollo; reducción de tiempos en vivero por las mayores tasas de crecimiento y acumulación de biomasa y mejor adaptación a condiciones de estrés hídrico y nutricional bajo condiciones de campo [5,6,7]. Estos efectos se ven reflejados en incrementos en supervivencia a nivel de vivero y trasplante, capacidad de producción de biomasa y en la calidad del producto final, que para el productor forestal se convierten en mayor competitividad y sostenibilidad, con reducciones de costos de producción y mejora en los ingresos [8-10 ].
La simbiosis entre HFMA y el 80% de las especies vegetales, es una de las asociaciones más antiguas, con evidencias de su existencia desde hace más 400 millones de años, jugando un papel predominante en la adaptación de plantas a los ecosistemas terrestres, empleando mecanismos de co-evolución HFMA-plantas [11,12 ]. Uno de los beneficios de esta simbiosis más estudiados, a nivel mundial, está relacionado con la nutrición vegetal en ambientes con restricción de nutrientes, en donde, mediante mecanismos de intercambio bidireccional de nutrientes la planta suministra al hongo carbohidratos para su metabolismo y el hongo favorece la toma y transporte de nutrientes que la planta requiere [13 ]. La simbiosis favorece la tolerancia de la planta a estrés biótico o abiótico, mejora las características físicas del suelo y favorece la diversificación de especies vegetales en ecosistemas [14-18 ].
Estudios realizados sobre diversidad de HFMA asociados a diferentes especies de árboles maderables y no maderables han demostrado que existe una amplia gama de morfoespecies de HFMA asociados a la rizosfera de estos árboles [7,19-24 ] lo que sugiere que los HFMA pueden ser utilizados en especies arbóreas o arbustivas en forma de biofertilizantes, en plantas con cualquier tipo de reproducción por semilla, vegetativa o por producción in vitro, constituyéndose en una alternativa valiosa para solucionar problemas de propagación, aclimatación y nutrición de las especies , permitiendo establecer sistemas de producción más eficientes, precoces y productivos, que contribuyen con la sostenibilidad por que requieren una menor aplicación de insumos fertilizantes, riego y pesticidas, con sus respectivas reducciones en costos de insumos y mejoras en la eficiencia en el establecimiento y producción en sistemas forestales. Adicionalmente, esta tecnología puede ser fácilmente transferible a técnicos y agricultores [25 ].
El objetivo de este estudio fue evaluar 4 inóculos de HFMA que fueron aislados de plantaciones forestales del Caribe Colombiano, sobre el crecimiento y absorción de nutrientes de Pachira quinata, Gmelina arbórea, Eucalyptus sp. y Acacia mangium bajo condiciones de vivero.
MÉTODOS
Ubicación del experimento y material vegetal
La investigación se realizó en la estación experimental Monterrey Forestal, ubicada en el Municipio de Zambrano, Departamento de Bolívar, Colombia, localizado a 9°44′41″N y 74°49′02″O a una altitud de 20 m.s.n.m con una temperatura media de 28°C, donde se establecieron ensayos a nivel de vivero para cada una de las cuatro especies forestales de mayor difusión en la zona: P. quinata, G. arbórea, Eucalyptus sp.. y A. mangium . La obtención de las plántulas fue a partir de semilla sexual. La germinación de las semillas se realizó bajo invernadero utilizando como sustrato Cisco y empleándose 300 semillas por especie.
Microorganismos
Estudios previos realizados por la alianza Corpoica-Pizano [25 ], permitieron seleccionar y consolidar cuatro inóculos con HFMA nativos aislados de suelos asociados a especies forestales. Estos inóculos estuvieron conformados por esporas nativas, de la siguiente forma: El Inóculo 1 con esporas de Glomus sp. + Acaulospora sp.; el inóculo 2 de Glomus sp. + Acaulospora sp. + Scutellospora sp.; el inóculo 3 de Glomus sp. + Gigaspora sp. y el inóculo 4 de Glomus sp. + Acaulospora sp. + Entrophospora sp. La multiplicación de todos los inóculos se realizó en los invernaderos de la Corporación Colombiana de Investigación Agropecuaria - Corpoica en el centro de investigación Tibaitatá, utilizando como hospedero Brachiaria decumbens Stapf (1919), sembradas en materos de 500 g, usando como sustrato suelo y arena estéril en proporción 3:1 e inoculando aproximadamente 70 esporas por matera. Después de cinco meses los inóculos se recogieron y llevaron al laboratorio para su posterior lectura de esporas de HFMA mediante la metodología propuesta por Gendermann and Nicholson (1963) con algunas modificaciones [26 ].
Diseño experimental
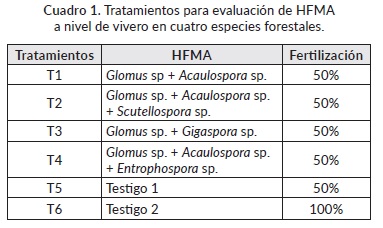
El diseño experimental empleado fue bloques completos al azar con 3 repeticiones, 30 plántulas como unidad experimental y seis tratamientos: 4 inóculos de HFMA y dos testigos con el 50% y 100% de fertilización química (Cuadro 1). Estos ensayos se establecieron utilizando como sustrato, suelo + arena en proporción 3:1 v/v. Las plántulas se sembraron en bandejas de 50 cubetes. En cada sitio de siembra, se inocularon aproximadamente 70 esporas de HFMA plántula-1. La fertilización de los tratamientos se realizó al inicio del experimento aplicando un fertilizante químico de lenta liberación (16-8-12 + (2 MgO) + micro elemento con una dosis de 1 g planta-1 para el testigo 100% y la mitad de la dosis para el testigo 50% y los tratamientos con HFMA.
Sistema de muestreo y variables analizadas
Se realizaron con frecuencia quincenal muestreos no destructivos en las especies bajo estudio: P. quinata, G. arborea, Eucalyptus sp. y A. mangium, se midieron variables de desarrollo de las plantas como: altura (cm) y diámetro de tallo (mm). Adicionalmente, se realizó análisis químico de tejido vegetal de los nutrientes esenciales: Nitrógeno (Kjeldahl EPA 351,3 modificado), Fósforo (Digestión abierta nítrico:perclórico (5:2)/Espectrofotometría), Potasio, Calcio y Magnesio (Digestión abierta nítrico:perclórico (5:2)/espectrometría de absorción atómica).
Análisis estadístico
Para las variables de altura y diámetro del tallo se realizó un ANAVA previa confirmación de los supuestos de normalidad y homocedasticidad con los estadísticos de Shapiro-Wilk y la prueba de comparación de medias de Tukey para los análisis paramétricos que resultaron significativos. Los análisis fueron realizados con el programa STATISTIX 9.0 software (Analytical Software, Tallahassee, FL,USA). Los resultados de absorción de nutrientes son tendencias, ya que corresponden al promedio de los tres bloques; sin embargo, como el tamaño de la muestra de planta es tan pequeño para los análisis químicos, no se realizó estadística.
RESULTADOS
Efecto de la inoculación con HFMA sobre el crecimiento en las especies forestales G. arborea, P. quinata, Eucalyptus sp. y A. mangium
Los resultados obtenidos en este estudio muestran que para G. arborea en la variable de altura, solo se obtuvieron diferencias estadísticamente significativas (p< 0,05) de acuerdo a la prueba de comparación de medias Tukey a la sexta semana de evaluación, en donde el tratamiento T2 (Glomus sp. + Acaulospora sp. + Scutellospora sp.) y T3 (Glomus sp. + Gigaspora sp.) alcanzaron los mayores valores (27,6 y 25,8 cm, respectivamente) en comparación con el tratamiento fertilizado químicamente al 50% (T5) (19,4 cm) (Cuadro 2). Para el caso del diámetro del tallo solo se encontraron diferencias a la 12 semana después de la siembra (sds) en donde el T6 (fertilizado químicamente con el 100%) obtuvo el mayor valor (5,55 mm), sin embargo, en esta misma semana tanto el T6 como el T2 alcanzaron los valores óptimos en diámetro (≥ 5 mm) al cuello de tallo para su trasplante (Cuadro 2); para la 14 sds todos los tratamientos excepto el testigo 1 (T5), alcanzaron los 5 mm de diámetro. Aunque no se encontraron diferencias estadísticamente significativas para la altura y el diámetro en la mayoría de las semanas evaluadas, se puede observar que los tratamientos inoculados con HFMA obtuvieron valores similares o superiores al tratamiento fertilizado al 50%, siendo el T2 el que mayor valor obtuvo durante todo el tiempo de evaluación (Cuadro 2). Este resultado, refleja la ventaja del uso de HFMA, en estados iniciales de las plantas en vivero. De acuerdo a los resultados obtenidos para esta especie, la inoculación con HFMA favoreció el rápido crecimiento de las plantas permitiendo menor tiempo de permanencia en vivero lo cual es ideal para los productores.
Cuadro 2 Efecto de la inoculación con HFMA sobre parámetros de crecimiento en G. arborea.
Nota: Letras diferentes corresponden a diferencias significativas (P ≤ 0,05) de acuerdo a la prueba de comparación de medias de Tukey. Sds: semana después de la siembra. T1: Glomus sp. + Acaulospora sp., T2: Glomus sp. + Acaulospora sp. + Scutellospora sp., T3: Glomus sp. + Gigasp.ora sp., T4: Glomus sp. + Acaulosp.ora sp. + Entrophospora sp., T5: Fertilización química al 50% y T6: Fertilización química al 100%.
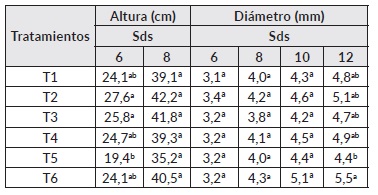
En el caso de Pachira quinata no se encontraron diferencias estadísticamente significativas (P<0,05) en la altura de las plantas de acuerdo a la prueba de comparación de medias Tukey. Aunque no se presentaron diferencias entre tratamientos se puede observar que todos los tratamientos inoculados con HFMA presentaron mayores valores en altura en comparación a los dos testigos (fertilizados químicamente al 50 y 100%) (Cuadro 3). En cuanto al diámetro solo se encontraron diferencias a la semana 10 en donde el tratamiento T3 fue el que obtuvo el mayor valor (4,15 mm) en esta variable en comparación a los dos testigos (T5 y T6) presentando los menores valores (2,92 y 3,47 mm respectivamente). Las plantas de P. quinata alcanzaron el diámetro adecuado (≥ 5 mm) para su trasplante a campo en la semana 14, en donde el T3 fue el único que alcanzó este valor (5,06 mm) (Cuadro 3). De los tratamientos inoculados se destaca el comportamiento de T3 (Glomus sp. + Gigaspora sp.), que representan potencial para el productor, ya que con estos tratamientos se reduce la fertilización en vivero y se obtienen plantas óptimas en altura en un menor tiempo que con la fertilización completa (T6).
Cuadro 3 Efecto de la inoculación con HFMA sobre parámetros de crecimiento en P. quinata.
Nota: Letras diferentes corresponden a diferencias significativas (P ≤ 0.05) de acuerdo a la prueba de comparación de medias de Tukey. Sds: semana después de la siembra. T1: Glomus sp. + Acaulospora sp., T2: Glomus sp. + Acaulospora sp. + Scutellospora sp., T3: Glomus sp. + Gigaspora sp., T4: Glomus sp. + Acaulospora sp. + Entrophospora sp., T5: Fertilización química al 50% y T6: Fertilización química al 100%.
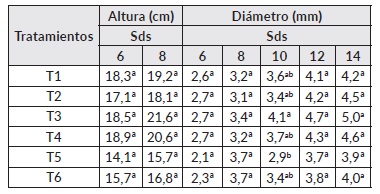
Los resultados obtenidos en la especie Eucalyptus sp. muestran diferencias estadísticamente significativas (P<0,05) de acuerdo a la prueba de comparación de medias Tukey en la altura y diámetro de las plantas, la altura es una de las variables importantes a tener en cuenta para el trasplante a campo, en donde la óptima está entre 15 a 20 cm (27). Lo anterior se confirma con los resultados obtenidos en este estudio, donde la altura ideal para el trasplante a campo se alcanzó a partir de la 4 sds con el tratamiento 3 (Glomus sp. + Gigaspora sp.) (Cuadro 4), demostrando los beneficios del uso de HFMA en la reducción de hasta 8 semanas en vivero para plántulas de Eucalyptus sp.
El eucalipto tiene la capacidad de asociarse con dos tipos de micorrizas, con HFMA y ectomicorrizas, los HFMA juegan un papel importante sobre plantas jóvenes y las ectomicorrizas sobre plantas de mayor edad. Estudios realizados por Holste et al [28 ], en Eucalyptus grandis con HFMA y ectomicorrizas sobre el crecimiento y contenido de nutrientes con combinaciones bajas y altas de nitrógeno (N) y fósforo (P) con diferentes relaciones bajo condiciones de invernadero, encontraron que la co-inoculación de HFMA y ectomicorrizas en E. grandis afecto positivamente el peso seco radical, mientras que la inoculación en forma individual con HFMA aumento el contenido de nutrientes en el tejido vegetal de esta especie. Todos estos resultados demuestran la importancia del uso de HFMA durante etapas tempranas de crecimiento de esta especie vegetal
Cuadro 4 Efecto de la inoculación con HFMA sobre la altura en Eucalyptus sp.
Nota: Letras diferentes corresponden a diferencias significativas (P ≤ 0,05) de acuerdo a la prueba de comparación de medias de Tukey. Sds: semana después de la siembra. T1: Glomus sp. + Acaulospora sp., T2: Glomus sp. + Acaulospora sp. + Scutellospora sp., T3: Glomus sp. + Gigaspora sp., T4: Glomus sp. + Acaulospora sp. + Entrophospora sp., T5: Fertilización química al 50% y T6: Fertilización química al 100%.
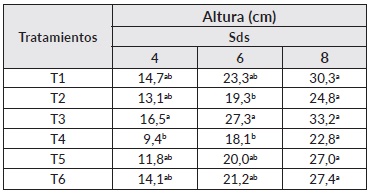
Para el caso de A. mangium, en promedio, las plantas llegaron a 13 cm de altura a las 12 sds. En el cuadro 5 se presentan los resultados obtenidos en esta especie en donde se encontraron diferencias estadísticamente significativas a lo largo de todo el período de monitoreo. En este tiempo se evidencia el efecto positivo del tratamiento de inoculación 3, el cual superó en altura al testigo con el 50% de la fertilización (T5 y T6). Para el diámetro se encontraron diferencias en la 2, 6, 8, 10 y 12 sds en donde el tratamiento T3 presentó valores promedios más altos que los testigos fertilizados al 50 y 100% en las semanas evaluadas (Cuadro 5).
Cuadro 5 Efecto de la inoculación con HFMA sobre parámetros de crecimiento en A. mangium
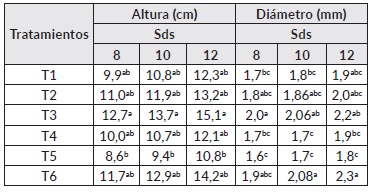
Nota: Letras diferentes corresponden a diferencias significativas (P ≤ 0,05) de acuerdo a la prueba de comparación de medias de Tukey. Sds: semana después de la siembra. T1: Glomus sp. + Acaulospora sp., T2: Glomus sp. + Acaulospora sp. + Scutellospora sp., T3: Glomus sp. + Gigaspora sp., T4: Glomus sp. + Acaulospora sp. + Entrophospora sp., T5: Fertilización química al 50% y T6: Fertilización química al 100%.
Co-inoculaciones realizadas con los HFMA Acaulospora scrobiculata, Scutellospora calospopra y la bacteria solubilizadora de fosfato Paenibacillus polimyxa demostraron que pueden mejorar el crecimiento, la absorción de nutrientes y la calidad en las plantas de Acacia auriculiformis, las plantas inoculadas tanto de forma simples como combinadas con estos microrganismos fueron un 83% más altas que los controles, así mismo se presentaron mayores incrementos en la longitud de la raíz, diámetro del tallo, peso seco de la parte aérea y de la raíz en todas las plantas inoculadas con HFMA y P. polimyxa de forma individual y combinada [29 ]
En los ecosistemas naturales los HFMA no se encuentran asociados a una sola especie vegetal, sino por el contrario existe una alta diversidad de estos hongos que pueden estar colonizando diferentes sistemas de raíces, sin embargo, la eficiencia de la simbiosis podría diferir según el genotipo tanto de la planta hospedera como la del HFMA [30-33 ]. En ese sentido los resultados obtenidos en este estudio demuestran el efecto benéfico que tiene la biofertilización de HFMA en especies forestales en las cuales, dependiendo del género y la especie presentes en cada inóculo, difieren los beneficios observados, aunque, en términos generales, todos los inóculos de HFMA evaluados presentaron efectos positivos sobre el crecimiento de estas especies, alcanzando valores similares e incluso superior, en algunos casos a los tratamientos en donde se aplicó fertilización de síntesis química al 50 y 100%.
Las especies forestales bajo estudio sugieren que el inóculo de HFMA más eficiente para efectos de evaluación del desarrollo de las plantas y estado óptimo para trasplante a campo es el inóculo 3, que es un inóculo mixto de HFMA con predominio de los géneros Glomus sp. y Gigaspora sp. Este inóculo, de acuerdo con los resultados obtenidos permite alcanzar en un menor tiempo la robustez necesaria para pasar de vivero a campo, lo cual se ve reflejado en una disminución de costos de producción por la reducción de fertilizantes de síntesis química y en labores de campo asociadas a la etapa de vivero. Resultados encontrados por Ramírez et al [25 ], concuerdan con los obtenidos en este estudio en donde plantas de G. arborea inoculadas con HFMA alcanzaron mayor crecimiento y grosor del tallo aproximadamente 3 meses después de la siembra a nivel de vivero que los testigos con fertilización química. En consecuencia, es posible determinar que una de las ventajas que ofrece la inoculación con HFMA, es la optimización en la absorción de nutrientes, por lo que se obtienen plantas mejor nutridas con una menor dosis de fertilización y el desarrollo agronómico de las plantas se ve favorecido por la inoculación con estos microorganismos.
En un estudio realizado en plantas de Tectona grandis inoculadas con HFMA nativos bajo condiciones in vitro y ex vitro, encontraron que las plantas de T. grandis responden a la inoculación con HFMA en donde para los ensayos ex vitro las plantas inoculadas con Claroideoglomus etunicatum PBT03 fue el que presento la mayor altura y diámetro del tallo comparado con los demás tratamientos inoculados con HFMA y el control no inoculado, mientras que para los ensayos in vitro las plantas que estaban inoculadas con Funneliformis mosseae RYA08 fue el que presento los mayores valores en altura y peso seco de la planta en comparación a los demás tratamiento [7 ].
Retama-Ortiz et al [34 ], evaluaron el efecto que tienen 10 consorcios de HFMA nativos aislados de la rizosfera de Liquidambar styraciflua e inoculados en 4 especies de árboles (L. styraciflua, Terminalia amazonia, Cordia alliodora y Cojoba arborea) encontrando que las especies L. styraciflua, Terminalia amazonia, Cojoba arborea tuvieron una mayor respuesta a la inoculación con los HFMA evaluados, mostrando una mayor altura, número de hojas y peso seco total en comparación al control.
Aunque en la literatura se encuentran muy pocos estudios realizados con HFMA en las especies forestales evaluadas en esta investigación, el efecto benéfico que tienen los HFMA sobre especies forestales en vivero y campo ha sido muy bien reportado en donde se han encontrado resultados similares a los obtenidos en este trabajo, como una mayor altura y diámetro de las plantas, mayor acumulación de materia seca en hojas y raíz y un mayor porcentaje de supervivencia en el trasplante a campo cuando estas están inoculadas con HFMA, bien sea en forma simple o co-inoculadas con otros HFMA y bacterias promotoras de crecimiento vegetal [29,35-39 ].
Efecto de la inoculación con HFMA sobre la absorción de nutrientes en las especies forestales G. arborea, P. quinata, Eucalyptus sp. y A. mangium
Para la especie G. arbórea, se puede observar que el tratamiento T1 inoculado con Glomus sp. + Acaulospora sp. fue superior al testigo 50% (T5) en la absorción de nutrientes como el nitrógeno (N) y magnesio (Mg). Mientras que, este mismo tratamiento (T1) obtuvo valores similares al testigo 100% (T6) en la absorción de nutrientes como fósforo (P), potasio (K), calcio (Ca) y Magnesio (Mg) (Cuadro 6).
En P. quinata las mayores absorciónes de N, P, K, Ca y Mg se presentaron en los tratamientos inoculados con HFMA (T3 y T4) en comparación con el tratamiento fertilizado químicamente al 50% (Cuadro 5). En la absorción de nitrógeno se encontró que el T6 obtuvo los mayores valores (0.172 g de N planta-1), sin embargo, en los tratamientos T3 y T4 (0,145 y 0,146 g de N planta-1 respectivamente) se encontraron valores superiores al tratamiento fertilizado al 50% (0,104 g de N planta-1), en este mismo sentido.
ocurrio con la absorción de K y Mg en donde el T6 fue el que obtuvo los mayores valores pero los tratamientos T3 y T4 presentaron valores superiores al T5. La absorción de P por parte de la planta fue mayor en el tratamiento inoculado con Glomus sp. + Gigaspora sp. (T3) en donde éste al estar fertilizado con el 50% presentó mayor absorción de este elemento en comparación a los testigos fertilizados con el 50 y 100% (T5 y T6), esta misma tendencia se presentó con la absorción de Ca en donde los tratamietos T3 y T4 fertilizados químicamente con el 50% superaron a los testigos (T5 y T6) (Cuadro 6).
Cuadro 6 Tendencias sobre la absorción de nutrientes en tres especies forestales (G.melina, P. quinata, Eucalyptus sp. y A.mangium)
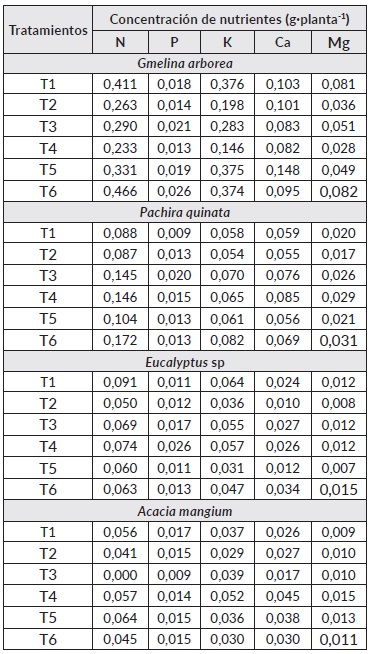
Nota: T1: Glomus sp. + Acaulospora sp., T2: Glomus sp. + Acaulospora sp. + Scutellospora sp., T3: Glomus sp. + Gigaspora sp., T4: Glomus sp. + Acaulospora sp. + Entrophospora sp., T5: Fertilización química al 50% y T6: Fertilización química al 100%.
La respuesta a la inoculación con HFMA en la concentración de nutrientes en Eucalyptus sp. se observa en cuadro 5. De acuerdo a los resultados obtenidos en la concentración de nitrógeno y K, el tratamiento T1 fue el que presentó los mayores valores (0,091 g de N y 0,064 g de K planta-1) de absorción de estos elementos, seguido de los tratamientos T4 (0,074 g de N y 0,057 g de K planta-1) y T3 (0,069 g de N y 0,055 g de K planta-1) en comparación con los tratamientos fertilizados químicamente al 50% (0,060 g de N y 0,031 g de K planta-1) y al 100% (0,063 g de N y 0,047 g de K planta-1) (Cuadro 6). Se observó que en la absorción de P los mayores valores promedios (0,026 g de P planta-1) se obtuvieron en el tratamiento inoculado con Glomus sp. + Acaulospora sp. + Entrophospora sp. (T4) comparado con los testigos T5 (0,011 g de P planta-1) y T6 (0,013 g de N planta-1) (Cuadro 6). La tendencia en la absorción de Ca y Mg fue similar en donde el tratamiento T6 fue el que obtuvo los mayores valores (0,034 g de Ca y 0,015 g de Mg planta-1), sin embargo, los tratamientos T3 (0,027 g de Ca y 0,012 g de Mg planta-1) y T4 (0,026 g de Ca y 0,012 g de Mg planta-1) obtuvieron valores superiores al T5 (0,012 g de Ca y 0,07 g de Mg planta-1) que se encontraba fertilizado con el 50% sin inoculación.
Con relación a la respuesta a la inoculación con HFMA en la concentración de nutrientes para la especie A. mangium se encontró que el tratamiento T5 fue el que obtuvo los mayores promedios en absorción de N, sin embargo, los tratamientos T1, T3 y T4 fueron superiores al testigo 100% (T6) en la absorción de este mismo elemento (Cuadro 5). La absorción de K, Ca y Mg en la planta por parte del T4 (Glomus sp. + Acaulospora sp. + Entrophospora sp.) presentó los mayores valores de estos elementos en comparación a los testigos fertilizados con el 50 y 100% sin inocular (Cuadro 6). La absorción de P en plantas de A. mangium fue mayor en el tratamiento T1 (0,017 g de P planta-1) en comparación a los testigos con el 50% (0,015 g de P planta-1) y 100% (0,015 g de P planta-1).
La asociación simbiótica mutualista micorriza - planta está basada en el intercambio bidireccional de nutrientes particularmente el P [5,13,40 ]. Las plantas pueden tomar los nutrientes a partir de dos vías: la primera es a través de las células epidérmicas cerca del ápice de la raíz y de los pelos radicales y la otra a través del micelio extrarradical de los HFMA. La captación de P a través de la raíz es rápida y como resultado hay un agotamiento progresivo de este nutriente y es ahí en donde juega un papel muy importante el micelio extraradical de los HFMA en donde éste tiene una alta afinidad por transportadores de fósforo inorgánico (Pi) para ser trasferido a la corteza de la raíz [5,41]. En ese contexto los resultados obtenidos en la absorción de Pi en este estudio demuestran que los HFMA jugaron un papel muy importante en la translocación de este nutriente a las diferentes especies forestales evaluadas, ya que la absorción de este elemento por parte de los HFMA dependiendo del tipo de inóculo y de la especie forestal, se incrementó en comparación al testigo fertilizado con el 50% y en algunas ocasiones se obtuvieron valores iguales o mayor al testigo fertilizado al 100% sin inocular ( Tabla 1 ), (Tabla 2 ), (Tabla 3 ) y (Tabla 4 ). En estudios realizados por Sharma and Adholeya [42 ]en donde evaluaron la absorción de P en 3 especies arbóreas forestales (Acacia nilotica var. cupressiformis, Albizzia lebbeck y Eucalyptus tereticornis), encontraron que de diez especies de HFMA evaluadas, Glomus intraradices (HFMA 1004) y una mezcla de HFMA (HFMA-1209) obtuvieron la mayor absorción de fósforo (P) en los brotes de estas especies, adicionalmente, la inoculación con estos dos tipo de HFMA dio el mayor peso seco y esto se correlaciono altamente con la absorción de P.
Adicional a los resultados encontrados en la absorción de P por parte de los HFMA inoculados en las diferentes especies forestales evaluadas en este estudio, se presentaron resultados similares con los obtenidos en la absorción de los demás nutrientes (N, K, Ca y Mg), en donde en general las plantas que estaban inoculadas con HFMA presentaron valores superiores o iguales a los testigos (T5 y T6).
Otros estudios realizados en A. auriculiformis, Schizolobium parahyba y Schizolobium parahyba var amazonicum [29,43,44 ] han demostrado que la absorción de nutrientes por parte de los HFMA evaluados fue mayor a los controles. Cely et al [43 ], evaluaron los HFMA (Claroideoglomus etunicatum y Acaulospora sp.) y las bacterias promotoras de crecimiento vegetal (dos cepas de Rhizobium sp. y Burkholderia sp.) nativos de la rizósfera de Schizolobium parahyba en diferentes combinaciones, encontraron que los tratamientos con C. etunicatum + Rhizobium sp. (Rh1) y Acaulospora sp., ambos tratamientos fertilizados con 150 g de N-P-K incrementaron el rendimiento en madera y las combinaciones de Acaulospora sp. + Rhizobium sp. (Rh2) y Acaulospora sp. + Rhizobium sp. (Rh1) ambos fertilizados con 75 g de N-P-K aumentaron el crecimiento de las plantas en vivero.
Tanto los resultados de los experimentos del presente trabajo como los reportados en la literatura, permiten afirmar que los biofertilizantes de tipo HFMA representan un buen potencial para disminuir los limitantes que se presentan en la producción de especies forestales a nivel de vivero, reflejado en mayor desarrollo radical, mayor tasa de crecimiento, mejor adaptación a condiciones de estrés hídrico y nutricional en campo [10,45 ]. Por otra parte, el uso de biofertilizantes con base en HFMA podría reducir los tiempos de vivero, y para el productor forestal se convierten en mayor competitividad y sostenibilidad, con reducciones de costos de producción y mejora en los ingresos.
CONCLUSIONES
El uso de HFMA nativos como inoculante para las diferentes especies forestales evaluadas en esta investigación fue muy eficaz cuando estos son combinados con el 50% de fertilización de síntesis química en donde las asociaciones Glomus. sp. + Gigaspora. sp. - Gmelina arbórea, P. quinata, Eucalytus sp. y A. mangium a nivel de vivero representan un potencial para el productor forestal. El uso de esta tecnología para las especies forestales permitió obtener las condiciones óptimas de altura y diámetro de cuello de la raíz para su trasplante a campo, así como una mayor absorción de nutrientes por parte de las plantas cuando estas se encontraban asociadas a los HFMA mencionados anteriormente.