INTRODUÇAO
As microalgas são um conjunto heterogêneo de micro-organismos fotossintéticos unicelulares procariontes (cianobactérias) e eucariontes que habitam diversos ambientes como águas marinhas, doces, residuais, e o solo. Crescem em ampla faixa de temperatura, pH e disponibilidade de nutrientes. Estima-se que sejam responsáveis pela produção de 50% do oxigênio e pela fixação de 50% de dióxido de carbono no planeta. Possuem grande diversidade de espécies, sendo identificadas mais de 40.000, embora se estime que existam mais de 100.000 espécies. A maioria das espécies é desconhecida quanto à composição bioquímica e metabólica. As microalgas classificam-se de acordo com o tipo de pigmentação, ciclo de vida, morfologia e estrutura celular. As espécies mais estudadas para aplicações biotecnológicas referem-se às algas verdes e diatomáceas [1,2].
As microalgas são consideradas uma fonte de alimentação na indústria aquícola, com elevado teor de lipídios (12 a 51%), de proteínas (35 a 60%), pigmentos (8 a 12%), hidratos de carbono (17 a 25%) e outros constituintes bioativos utilizados na indústria de alimentos e farmacêutica [3,4]. As microalgas verdes são de fácil cultivo e produzem biomassa com rendimentos de cerca de 10 a 45 g de biomassa (seca·dia·m2) com produção anual de 1340 toneladas em peso seco e sem cinzas [5-7].
Os lipídios constituem um importante grupo de moléculas orgânicas, desempenhando funções vitais na organização e estrutura celular como; fonte de energia, sinalizador no controle celular e como receptor de outras macromoléculas em locais alvos específicos. As microalgas são capazes de sintetizar uma variedade de lipídios, incluindo dois grandes grupos; que são os estruturais e de armazenamento energético. Para o primer grupo são compostos principalmente de lipídios conjugados (fosfolipídios e glicolípidios) de membrana. Em quanto para o segundo grupo está representado pela forma de triacilgliceróis (TAGs) que podem ser convertidos em biodiesel como ésteres metílicos de ácidos graxos (FAMEs sigla em inglês) pela transesterificação. As microalgas podem sintetizar e acumular lipídios até 20-50% do peso em matéria seca [1,8]. Os rendimentos de recuperação podem depender de diversos fatores como a espécie utilizada, condições de cultura (intensidade de luz temperatura e meio de crescimento) e metodologias de extração [9]. A possibilidade de conversão de lipídios de microalgas em biodiesel levou ao aumento do número de pesquisas com a produção das microalgas. Isto induziu a busca por técnicas economicamente viáveis para processos industriais para obtenção de biocombustíveis [10,11]
A resistência das microalgas deve-se a uma espessa parede celular ultra rígida, que pode impedir a extração eficiente pelos solventes orgânicos dos componentes intracelulares e afetar a purificação [9]. Por isso, é importante se desenvolver técnicas preliminares e assistidas para se destruir a parede celular, romper a estrutura da microalga e liberar os componentes sem mudar suas estruturas químicas [7,12,13].
Os lipídios das microalgas são obtidos por técnicas preparativas e analíticas, entre as mais utilizadas são as extrações em frio com solventes orgânicos (apróticos e próticos), como as metodologias Bligh & Dyer 1959 (B&D) e Folch (1957) as mais citadas em trabalhos nesta área que como método alternativo apresenta as seguintes vantagens: menor utilização de volumem de solvente, de fácil operação e menor toxicidade [14]. A metodologia inclui uma mistura binaria entre um solvente polar (próticos) e apolar (apróticos), gerando duas fases: uma orgânica com os lipídios totais e a outra aquosa com proteínas, carboidratos, etc. [15,16] Esta técnica é baseada na utilização de um solvente apolar para extrair os lipídios neutros e esterificáveis e num álcool relativamente polar para os lipídios polares. No tanto, os valores da metodologia de Bligh & Dyer (1959) foram subestimados comparados aos de Folch (1957), em amostras de tecido marinho com mais 10% de lipídios [13]. Esta metodologia é muito testada em microalgas dulciaquícola e marinhas em diversas pesquisas [17], mas o solvente utilizado o clorofórmio apresentam algumas desvantagens como: é um solvente com efeitos adversos para a saúde humana e meio ambiente [9], além disso, sua estrutura química tem uma maior constante dielétrica (CD) e momento dipolar em comparação com outros solventes orgânicos de baixa polaridade com maior afinidade a lipídios não polares ou neutros (acilgliceróis).
O objetivo deste trabalho foi comparar o desempenho de extração de diferentes solventes alternativos em associo com HCl 3 mol.L-1, para substituir a mistura por parte do clorofórmio como solvente orgânico apolar (acetato de etilo, éter de petróleo e éter etílico) ou o metanol como solvente prótico polar (etílico, isopropílico e terc-butanol) pela metodologia B&D, determinando os rendimentos de recuperação de lipídios totais e identificar a composição de ácidos graxos dos óleos obtidos na microalga Scenedesmus sp.
METODOS
Coleta do material biológico
A cepa de Scenedesmus sp BR003. foram obtidos na coleção da cianobactérias e microalga, da UCP/UFV do Departamento de Biologia Vegetal da Universidade Federal de Viçosa (UFV) em Viçosa, Minas Gerais. As amostras foram inoculadas em Erlenmeyers de 50 mL utilizando meio de cultura BG11 com pH 6,5 ± 0,1, em condições fotoautotróficas de crescimento a 25°C; foto-período 16 (luz): 8 (escuro) h; irradiação 60 µmols fotóns·m2s-1. Quando os inóculos alcançavam concentrações entre 106-107células/mL-1, estes eram transferidos para Erlenmeyers de volume maior, e o volume completado com meio de cultura fresco (BG11) até a obtenção de 300 mL de inoculo.
Preparação da amostra
As amostras líquidas, inicialmente como biomassa líquida (cultivo), foram concentradas por centrifugação (Eppendorf 5430R) a 7000 xg, 10 minutos, a 5ºC. O concentrado de células foi lavado com água deionizada (Millipore Direct-Q 3 UV), resuspendido em água e centrifugado a 2800 xg por três vezes. As amostras concentradas foram liofilizadas por 24 horas a -48°C (Liofilizador, terroni LS 3000, Brasil).
Extração de lipídios por screening de reagentes
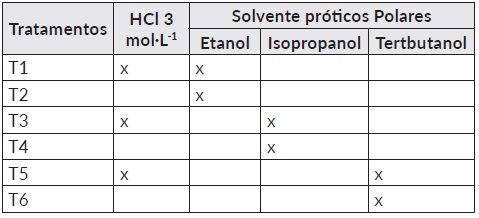
Os tratamentos foram solventes orgânicos apolares (Tabela 1) e próticos polares (Tabela 2) com a metodologia de B&D modificado (clorofórmio-metanol-Agua 1:2:0,8), com ou sem adição de HCl 3 mol·L-1 (Vetec, 37%, Química Fina, Brasil). A quantidade de amostra para todos os tratamentos foi de 0,5 g de microalga liofilizada.
Tabela 1 Solventes orgânicos apolares (acetato de etila, éter de petróleo e éter etílico) que substituíram o clorofórmio na metodologia B&D modificado.
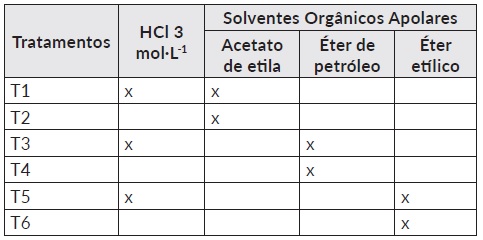
Tabela 2 Solventes próticos polares (etílico, isopropílico e tert-butanol) que substituíram o metanol na metodologia B&D modificado.
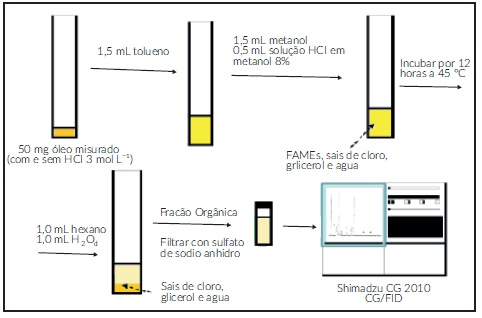
A biomassa liofilizada foi misturada e homogeneizada com 12,5 mL de solvente orgânico apolar, 25 mL do solvente prótico polar e 8 mL de água destilada. A mistura foi submetida a banho de ultrassom por 15 min, 50°C, 40 kHz (Ultracleaner, Brasil). E a fração orgânica extraída com um funil. A fase aquosa foi extraída três vezes com a mesma mistura inicial, com agitação manual sem a etapa centrifugação. As fases orgânicas recolhidas foram passadas por papel filtro (Whatman®, número 1) com sulfato de sódio anidro (Vetec Química Fina). O solvente foi evaporado e os lipídios foram determinados por gravimetria.
Derivatização (HCl/metanol)
O perfil de ácidos graxos foi determinado [18] com 50 mg de óleo (misturados com e sem HCl 3 mol·L-1) obtidos nos tratamentos com solventes orgânicos apolares e próticos polares, como o demonstra a figura 1.
Cromatografia em fase gasosa (CFG)
Os ácidos graxos foram determinados por cromatografia em fase gasosa (CFG) em cromatógrafo com as seguintes especificações e condições: cromatógrafo SHIMADZU 2010, coluna: Supelco (SGE HT-5 25 m x 0,32 mm x 0,25 µm), gás de arraste: hélio, direção de injeção: 270°C, 3,0 mL·min fluxo de injeção, fluxo da coluna: 6,57 mL/min ou 85,7 cm·seg. com pressão constante, programa de temperatura, inicia de 80°C por três minutos, e aumento até 330°C, com intervalos de 12°C por minuto e temperatura de 330°C por dois minutos, detector: FID, gás He (30 mL·min), H2 fluxo 40 mL·min, fluxo de ar 400 mL·min, temperatura de 330°C. Os FAMEs foram comparados com os tempos de retenção e as áreas dos picos dos padrões autênticos fragmentados e identificados cada ácido graxo recuperado, identificado e sua quantidade determinada por amostra [19]. Seis ácidos graxos (C16:0, C18:0, C18:1n9t, C18:1n9c, C18:2n6c, C18:3n6 e C20:0) foram usados como padrões externos.
Analise estatística
Os ésteres metílicos de ácidos graxos (FAMEs) das amostras da microalga Scenedesmus sp., foram obtidos em triplicata. O teor de lipídios totais extraídos pelo rompimento acida das células da microalga com os diferentes solventes (apolares e próticos polares) pela metodologia B&D que foram comparados por ANOVA de uma via e teste de Tukey, em nível de significância de p<0,05.
RESULTADOS
As médias dos níveis independentes entre os solventes orgânicos e álcoois testados frente aos adicionados e não de HCl 3 mol·L-1 diferiram de zero (P<0,05) mostrando, pelo menos, um constaste. As interações desses níveis evidenciam uma dependência no comportamento nos teores de lipídios totais da microalga Scenedesmus sp. (Tabela 3).
Tabela 3 Analise de variância dos parâmetros de solventes orgânicos apolares e próticos polares frente à influência do HCl 3 mol·L-1, na extração de lipídios totais na microalga Scenedesmus sp.

(*) Significativo al nivel del 5% por el test F.
Extração de lipídios por diferentes solventes orgânicos apolares e próticos polares.
HCl 3 mol·L-1 como agente químico associado com a metodologia de B&D que utilizo clorofórmio, acetato de etilo, éter de petróleo e etílico como solventes orgânicos apolares, apresentaram os maiores rendimentos de extração de lipídios totais da microalga Scenedesmus sp., comparados aos não adicionados. Os tratamentos com HCl 3 mol·L-1 com solventes testados que foram com o éter de petróleo (22,7%) e etanol (21,4%), não apresentaram diferença significativa pelo teste de Tukey (p<0,05) na extração de lipídios comparada à metodologia de B&D (24,5%) como o descreve a figura 2.
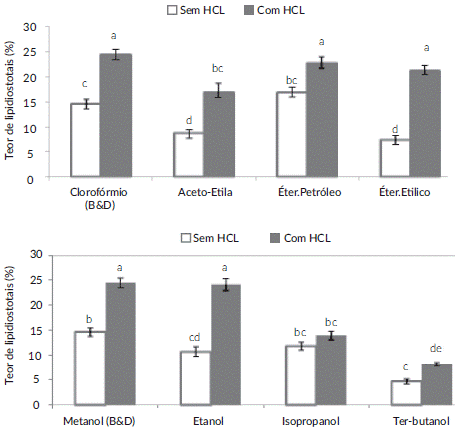
* Valores com mesmas letras sobrescritas não diferem em nível de 5% de significância pelo teste de Tukey.
Figura 2 Teor de lipídeos totais extraídos da microalga Scenedesmus sp. com solventes orgânicos apolares (Clorofórmio, Acetato de etila, Éter de Petróleo e etílico) e próticos polares (Metanol, Etanol, Isopropanol, Terc-butanol), com e sem HCl 3 mol·L-1.
A extração de lipídeos de Scenedesmus sp. com os solventes próticos polares (Etanol, Propanol e Terc-butanol) foi semelhante com os resultados dos solventes apolares com HCl 3 mol·L-1 ou não, mas com maior recuperação lipídica na amostra liofilizada da microalga com etanol (24,14%) e sem diferenças comparados ao método de B&D com metanol (24,5%). Os tratamentos com isopropanol e terc-butanol apresentaram níveis baixos de extração de lipídios da microalga independentemente à adição ou não de HCl 3 mol·L-1 (Figura 2).
Composição de Ácidos Graxos (AG)
O teor de ácidos graxos totais na microalga determinadas por cromatografia em fase gasosa (CFG) nos óleos obtidos com solventes orgânicos (apolares e próticos) pela metodologia B&D, ao ser utilizado clorofórmio (7,14 mg·g-1) apresento maior quantidade extraída em comparação com o éter etílico (6,2 mg·g-1) sem diferença significativa (P<0,05). Em quanto, para o éter de petróleo (11,95 mg·g-1) evidencio o maior valor de extração e diferença significativa (P<0,05) frente clorofórmio e éter etílico como o evidencia a Tabela 4.
Tabela 4 Quantidade de ácidos graxos extraídos com a metodologia Bligh & Dyer (B&D), solventes orgânicos (acetato de etila, éter de petróleo e etílico) e álcoois (etanol, isopropanol e terc-butanol) na microalga Scenedesmus sp.
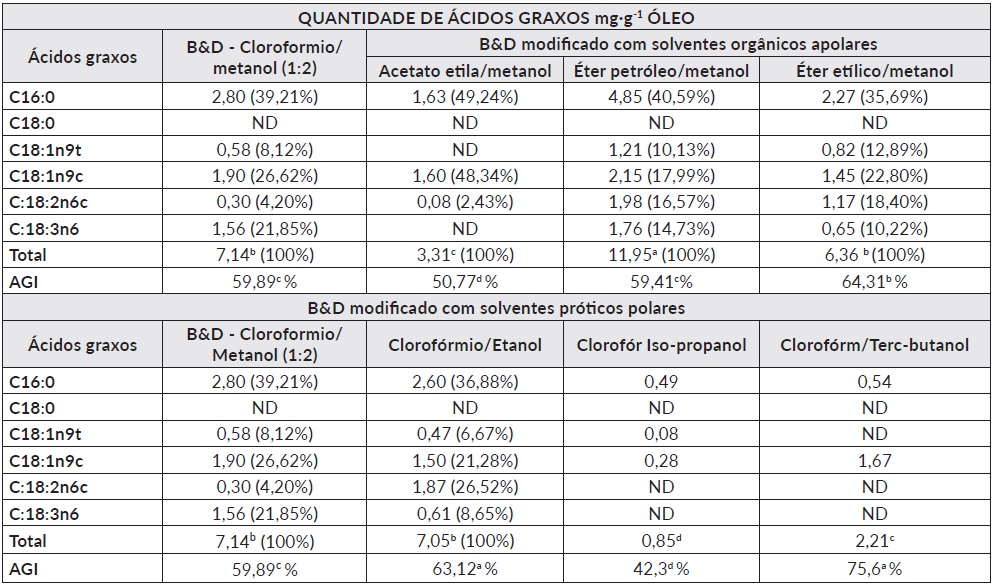
AGI = Ácidos graxos Insaturados. B&D : Bligh & Dyer. Médias seguidas por mesma letra no total não diferencem pelo teste de Tukey (p < 0,05).
A utilização de solventes próticos polares mostrou maior eficiência na extração de ácidos graxos com a técnica B&D (7,14 mg·g-1) semelhante ao uso do etanol (7,05 mg·g-1) sem diferença significativa (P<0,05). O isopropanol (0,85 mg·g-1) e terc-butanol (2,21 mg·g-1) não apresentaram boa eficácia na extração de lipídios esterificáveis detectadas por CFG (Tabela 4).
DISCUSSÃO
A maior quantidade de lipídios totais de Scenedesmus sp. extraídos com solventes apolares e próticos polares com adição ou não de HCl 3 mol·L-1 indica a eficácia do método químico para o rompimento celular da microalga (Figura 4). A primeira limitação para a extração dos lipídios de sítios intracelulares da microalga é o rompimento celular com baixo custo energético, econômico, redução de gasto de reagentes e extração de contaminantes (clorofilas e/ou DNA) nos óleos [20]. Isto torna necessário decompor a parede celular por métodos físico como homogeneização (alta pressão), banho ultrassom, sonicação, micro-ondas, contato com elementos abrasivos e pressurização ou métodos enzimáticos com lípases e proteases [8]. Os mecanismos dessas técnicas são diferentes, mas todas visam liberar os lipídios no citoplasma da célula, mas os solventes orgânicos (apróticos e próticos) não têm capacidade adequada para penetrar ou dissolver as paredes celulares das células vegetais [7,21].
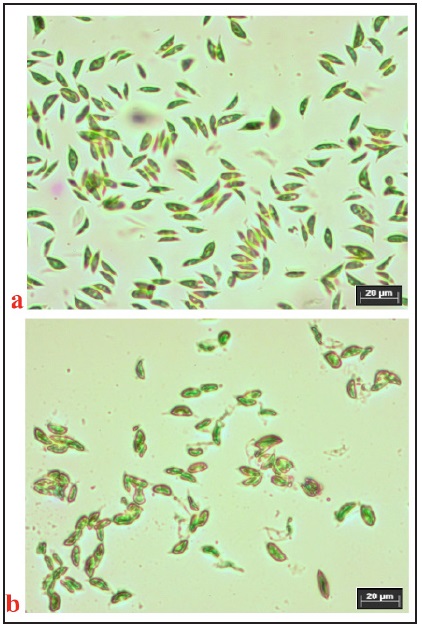
Figura 4 Células da microalga Scenedesmus sp. a: células testemunhas. b: células após da aplicação de HCl 3 mol·L-1. (microscopia ótica; Carl Zeiss IX51; 100x).
A metodologia B&D o clorofórmio como solvente apolar extrator, mais com a presença de metanol que formara em primeira etapa um sistema monofásico e logo com adição de agua, o sistema será bifásico com a separação dos compostos polares e não polares nas fases superior e inferior respectivamente [14,22]. Para o sistema B&D apresentou a maior porcentagem de extração de lipídios, inclusive com os tratamentos com éter de petróleo e éter etílico. O aumento na extração é atribuído ao clorofórmio pela maior polaridade maior como sua constante dielétrica (CD. 4,81) comparado ao éter de petróleo (CD 1,44 a 1,88) e éter etílico (CD. 4,3), de baixa polaridade e CD menor que o do clorofórmio. Isto permite extrações com os éteres (petróleo e etílico) em especial de petróleo por recuperar os lipídios neutros esterificáveis (mono, di, trigliceróis) e ácidos graxos livres de baixa polaridade. Extrações de lipídios com clorofórmio (B&D) pode superestimar os teores de lipídios quando acima de 2% no tecido animal [23], pois este solvente pode extrair lipídios de media e alta polaridade como fosfolipídios, lipoproteínas, glicolípidios e esfingolipídios [24].
A cor de fração orgânica (extrato lipídico), reage com a biomassa liofilizada da microalga Scenedesmus sp. pela metodologia Bligh & Dyer 1959 (B&D), mostrou cor verde escura com e sem HCl 3 mol·L-1. (Figura 5) e, possivelmente corantes como as clorofilas podem estar presentes como contaminante no lipídio, pois uma mistura de clorofórmio·metanol foi utilizada para a extração de clorofilas [25]. A extração simultânea de clorofilas e lipídios de interesse para se obtiver ácidos graxos (insaturados) puros para a produção de biocombustíveis e suplementos alimentares (ômega ω-3, 6, 9) mostrou teores de clorofilas entre 1 a 25% da massa lipídica [26].

Figura 5 Distribuição da coloração das fases (orgânica e aquosa) e biomassa da microalga scenedesmus sp. na extração de lipídios pela metodologia Bligh & Dyer 1959 (clorofórmio/metanol).
A utilização de etanol em substituição do metanol nos ensaios para a extração de lipídios da microalga Scenedesmus sp. com a metodologia B&D com adição de HCl 3 mol·L-1 não mostrou diferenças comparado ao método padrão com metanol. Os Isopropanol e terc-butanol apresentaram baixa capacidade extratora com diferenças com metanol e etanol (p<0,05). O álcool, em qualquer metodologia de extração, tem a função de romper as ligações covalentes que retém os lipídios com proteínas e carboidratos em forma de lipoproteínas e glicolípidios, respectivamente [27]. Os resultados com o etanol foram melhores que com metanol, mesmo com semelhança em algumas propriedades químicas (solubilidade, constante dielétrica e momentos dipolares) e formulas estruturais entre esses compostos, que diferem, apenas, na presença de um carboneto. As propriedades desses dois álcoois incluem a extração de compostos de alta e mediana polaridade em sistemas bifásicos, como na extração de lipídios com a separação de contaminantes (corantes, proteínas e carboidratos) que ficam na fase aquosa no sistema e não interferindo na quantificação da fração orgânica [24,25].
Na tabela 4 evidencia-se a presença de acido palmítico C16:0, que corresponde à maior quantidade de ácidos graxos saturados (AGS) identificado (padrão externo) na microalga estudada, nas amostras submetidas nos solventes orgânicos e álcoois. Para a indústria dos biocombustíveis quantidades apreciáveis de AGS são desejadas. O ácido palmítico confere ao óleo resistência à degradação oxidativa em condições de altas temperaturas e, portanto, aumenta seu tempo de armazenamento [28]. Ao contrário, AGS não são desejados em aditivos destinados à indústria de alimentos funcionais porque, em estudos prévios, estes AGS foram relacionados ao aumento dos níveis de LDL no organismo, aumentando os riscos de desenvolvimento de doenças coronarianas [29].
Ácidos graxos (AG) de origem vegetal de natureza insaturada como oleico (C18:1n6c), linoleico, (C18:2n6c) e α e (-linolênico (C18:3n6) são importantes para as indústria dos alimentos visando a obtenção de compostos tipo ômega (ω-3, 6 e 9) para suplementos alimentares funcionais e nutracêuticos [30,31] e para o setor da bioenergia como matéria prima para a produção de biocombustíveis especialmente o biodiesel [32]. Ácidos graxos (AG) da microalga Scenedesmus sp. analisados por CFG e extraídos com solventes apolares e próticos polares (álcoois) relatou a presença de ácidos graxos de tipo insaturado como majoritários nos óleos extraídos. A maior quantidade de ácidos graxos extraídos nos primeiros ensaios com éter de petróleo apresenta resultados diferentes (P<0,05) aos do outros solventes apolares testados, incluindo o clorofórmio que é utilizado na técnica padrão (B&D) indicando que o éter de petróleo tem uma maior capacidade de extração de lipídios de baixa polaridade, especialmente neutros (mono, di, tri acilgliceróis) trans-esterificáveis associados com ácidos graxos de cadeia saturada e insaturada. Na tabela 4 reporta os teores totais de ácidos graxos de natureza insaturada (AGI) recuperados com o éter de etílico que mostrou maior porcentagem em composição (64,31%) seguida pelo clorofórmio (59,89%) e éter de petróleo (59,41%), e por ultimo o acetato de etila (59,41%) evidenciando também a quantidade mais baixa extraída no total (3,31 mg·g-1 m.s).
A quantidade total AG totais extraídos entre o metanol (B&D) e etanol apresenta diferença (P<0,05), que para o segundo teve um maior porcentagem de extração de ácidos graxos de natureza insaturada (63,12%) que a comparação com metanol apresenta o valor de 59,89% AGI, mas estes não apresentaram diferença (P<0,05) nos valores de extração total de AG (mg·g1). O isopropanol e o terc-butanol contiveram o 42,3 e 75,6% de ácidos insaturados respectivamente, mas sua extração total foi baixa de 0,85 e 2,21 mg·g-1 m.s. respectivamente. Os ácidos oleico (C18:1n6c), linoleico (C18:2n6c) e linolênico (C18:3n6c) foram mais predominantes em todos os tratamentos com a microalga Scenedesmus sp. utilizando-se os solventes como com solventes próticos polares (etanol e metanol). A presença dos ácidos graxos de tipo ômega-3 (linolênico), ômega 6 (linoleico) e ômega 9 (oleico) apresentam uma serie de propriedades anti-inflamatórias, antitrombóticas, antiarrítmicos, vasodilatadores e precursor de ácidos graxos de cadeia longa. Esses efeitos benéficos foram demonstrados na prevenção de doenças cardíacas, da hipertensão, do diabete tipo 2, da artrite reumatoide entre outras quando são utilizados em alimentos funcionais e nutracêuticos [33]. Na indústria energética a utilização de óleos com altas quantidades de acido oleico apresentam boas propriedades de equilíbrio para a fabricação de biocombustíveis [34]. Essas propriedades incluem qualidade de ignição, combustão em calor, redução do ponto de obstrução de filtro frio em regiões frias (CFPP sigla em inglês), estabilidade oxidativa, viscosidade, lubrificação e numero de cetano determinadas pelas estruturas dos componentes de ésteres graxos [32,35 ]. O ótimo equilíbrio no teor de ácidos graxos insaturados/saturados nos óleos da microalga com solventes orgânicos apróticos (éter de petróleo ou etílico) e próticos (etanol) representa uma alternativa adequada para a produção de biodiesel com padrão de boa qualidade.
CONCLUSÃO
A otimização dos rendimentos de extração de lipídios totais da microalga Scenedesmus sp., com HCl 3 mol·L-1 variou com os reagentes testados, especialmente com éter (petróleo e etílico) como solvente orgânico apolar e o prótico polar (etanol) para álcoois. Os teores aumentaram com a disponibilização de lipídios intracelulares pelo rompimento da parede celular. Isto possivelmente disponibilizo a produção de ácidos graxos metil-esterificáveis de tipo saturados (palmítico) e insaturados (ácido oleico, linoleico e linolênico) pela derivatização (HCl/metanol) dos óleos obtidos como lipídios neutros (acilgliceróis) como constituintes majoritários presentes no interior da célula. O perfil de ácidos graxos determinada na microalga scenedesmus sp. a potencializa a produção desta espécie como fonte promissória de terceira geração de compostos bioativos (ácidos graxos essenciais tipo ômega) utilizáveis no desenvolvimento industrial na indústria da nutrição humana, animal e dos biocombustíveis. Além disso, em apresentar novas opções em metodologias que utilize reagentes com atividade química melhor ou semelhantes para a extração de metabolitos primários ou secundários em amostras biológicas, que contribuía na segurança em laboratório com utilização de solventes (apróticos e/ou próticos) de baixa toxicidade para o operador e/ou meio ambiente.