INTRODUCCIÓN
El estrés ambiental tal como la sequía, temperatura, salinidad, contaminación por metales pesados y pesticidas, unidos al cambio climático, serán los factores limitante que afecten la productividad agrícola en las siguiente década [1,2]. A nivel global la salinidad es uno de los estrés que causa una sustancial pérdida en la productividad y calidad de los cultivos [2]. La acumulación de diferentes tipos de sales en cantidades excesivas causan toxicidad y desbalances en las plantas [3]. De todos los iones el Na+ muestra la máxima toxicidad, la mayoría de los suelos que son afectados por salinidad contienen altas concentraciones de sales de sodio [4]. La salinización y alcalinización del suelo es el proceso por el cual hay una acumulación de sales libres en el subsuelo y el agua superficial, habiendo una marcada degradación del suelo, materia orgánica y micoorganismos rizosféricos, lo que limita el crecimiento de las plantas [5,6,7].
La halófitas son plantas que han desarrollado mecanismos adaptativos a suelos salinos. Para el caso de especies arbóreas, se han reportado estudios de tolerancia a salinidad en Eucalyptus, Populus, Casuarina y Acacia [8]. La casuarina (Casuarina equisetifolia), también conocida como roble costero o pino australiano es una importante especie utilizada para el control de la erosión y restaura suelos salinos y pobre por su habilidad de fijar nitrógeno [9, 10]. Las raíces secundarias de la casuarina están asociadas con el hongo micorrízico Glomus moseae, el cual facilita la absorción de agua y nutrientes disponibles en el suelo, y a Frankia sp., bacteria fijadora de nitrógeno que favorece tolerancia a suelos pobres [10]. Algunas rizobacterias promotoras del crecimiento vegetal (PGPR) son tolerantes a la salinidad y podrían ayudar a las plantas a sobrevivir en suelos salinos [11].
Dentro de las rhizobacterias se encuentra Pseudomonas spp. La bacteria Pseudomonas fluorescens cepa PF17, promueve resistencia al estrés salino en plantas de Helianthus annuus lo que a su vez ha favorecido su cultivo [12]. Algunas cepas de P. fluorescens UM16, UM270, UM256 y UM240 fueron aisladas de la rizósfera de un suelo seleccionado por registrar actividades contra diversos patógenos, con una eficiencia particular contra Botritys cinerea; estas cepas promueven el crecimiento de la planta a través de mecanismos directos e indirectos [13,14].
En casuarina no se ha reportado el uso de Pseudomonas spp en términos de bioaumento para suelos con altos contenidos de sodio y cloro. En muchas ocasiones ésta característica del suelo es la limitante para utilizar estos árboles con fines forestales, porque, aunque la planta presente una tolerancia natural al estrés salino, simbiosis con microoganismos específicos, o se le hayan dado cuidados protocolarios en invernadero, ello no es suficiente al momento de trasplante en campo. Con este marco el objetivo principal de esta investigación fue la de evaluar la eficiencia de Casuarina equisetifolia como especie tolerante a la salinidad y determinar si Pseudomonas fluorescens aumenta ésta capacidad en condiciones de invernadero.
MÉTODO
Material biológico
Para esta investigación se utilizó semilla de casuarina (Casuarina equisitifolia L.), provenientes de árboles de 30 años de edad establecidos en el área urbana de la ciudad de Uruapan Michoacán (19° 24( 28.7( Latitud Norte y 102° 04( 21.8( Longitud Oeste). La recolección se hizo manualmente durante los últimos días de abril del 2014. Para ello, se cortaron frutos color marrón de las ramas bajas del árbol por presentar éstos un buen poder germinativo [15]. Los frutos se colocaron en bolsas de papel estraza a temperatura ambiente por un periodo de 3 días, tiempo en que las bractéolas abrieron para liberar la semilla; éstas fueron conservadas a temperatura ambiente en una bolsa de papel limpia hasta el momento de su uso.
Fases del trabajo experimental
El experimento se desarrolló en tres etapas: 1) Prueba de germinación de casuarina en laboratorio, 2) Prueba de tolerancia de casuarina a NaCl bajo condiciones de invernadero y 3) Prueba de tolerancia de casuarina a NaCl mediado por Pseudomonas fluorescens, cepas: UM16, UM240, UM256 y UM270. Cada uno de los experimentos se llevó a cabo de manera independiente.
Efecto del NaCl sobre la germinación. Para esta prueba se utilizaron semillas de casuarina, las cuales se colocaron en solución de NaCl a diferentes concentraciones (0 a 2 % p/v), por un periodo de 24 horas. Después, las semillas fueron distribuidas en cajas Petrí, cubiertas en su base de papel absorbente humedecido con 1 mL de las disoluciones correspondientes. Para este experimento se utilizó un diseño completamente al azar con 11 tratamientos y cinco repeticiones; cada unidad experimental estuvo compuesta por 15 semillas y se evaluó el número de semillas y días a germinación.
Prueba de tolerancia a NaCl bajo condiciones de invernadero. Para este experimento se utilizaron charolas de poliestireno expandido (Copper block ®), cada charola con 60 orificios y capacidad para 220 mL Las charolas se llenaron con suelo arcilloso colectado en las instalaciones de la Facultad de Agrobiología “Presidente Juárez”, ubicada en la ciudad de Uruapan Michoacán, a 19° 23( 41.2( Latitud Norte y a 102° 03( 33.3( Longitud Oeste. Posterior a su llenado se realizó la siembra de semillas de casuarina para lo cual se sumergió en agua corriente por 24 horas antes de la siembra; ello con el fin de uniformizar la germinación; después se colocaron 4 semillas por orificio a una profundidad de 5 mm y 2 cm de separación. Los sustratos se humedecieron con agua antes de la siembra para facilitar el procedimiento. Una vez germinadas las semillas, se realizó un aclareo dejando sólo dos plantas por cavidad en cada charola. La humedad de los sustratos fue revisada diariamente de manera inicial, y después del primer mes se revisó cada tercer día. Cuando las plantas alcanzaron una longitud de 5 cm se iniciaron a regar con 35 mL de las soluciones de NaCl al 0, 0,25, 0,50, 1,00,1,50 y 2,00% en disolución con agua cada 8 días durante dos meses. La cantidad de solución aplicada se determinó a manera tal que el NaCl quedara concentrado en el suelo, sin propiciar el escurrimiento de la disolución por efecto de la gravedad. Se agrega 100 mL de agua a un volumen de suelo determinado, colectar el agua filtrada en un recipiente y aplicar el modelo: Agua en el suelo= volumen inicial-volumen filtrado. En este experimento se utilizó un diseño de completamente al azar, donde cada tratamiento correspondió a las 6 disoluciones de NaCl, con 3 repeticiones y 16 plantas por unidad experimental. Las variables que se midieron fueron: altura de la planta, número de ramillas por planta, longitud de l raíz principal y materia seca de la raíz y parte aérea.
Tolerancia al NaCl mediado por Pseudomonas fluorescens. Para este experimento se utilizaron plantas de casuarina provenientes de semillas que se germinaron en un sustrato de perlita (Agrolita ®). Una vez que las plantas alcanzaron una altura de 5 cm se trasplantaron 2 pantas en vasos de unicel del número ocho, cada vaso contenía 210 g de suelo arcilloso previamente esterilizado en autoclave, después de una semana del trasplante se etiquetaron, En este experimento se utilizaron 4 cepas de Pseudomonas fluorescens (UM16, UM240, UM256 y UM270) que se aplicaron a un suelo esterilizado y 2% de NaCl. Se incluyeron dos testigos: uno en el que sólo se aplicó agua corriente, y otro en el que se regó con disolución de NaCl al 2%, hasta que las plantas alcanzaron dos meses y medio de desarrollo. El suelo se colectó de áreas con poca maleza en el rancho de la Facultad de Agrobiología “Presidente Juárez”. Con ayuda de una pala fueron extraídas, en cubetas de 19 L muestras de los primeros 15 cm del suelo, para posteriormente estas ser tamizadas y mezcladas en tinas de plástico. Para eliminar el exceso de humedad, el suelo se dejó secar a temperatura ambiente por espacio de 15 días, con una remoción de la muestra cada tercer día para mantener aireación de las capas basales. Después del tiempo de secado, el suelo se colocó en bolsas de plástico para ser esterilizado en autoclave a una temperatura de 121oC por espacio de 45 min, antes de ser almacenado hasta el momento de su uso. En este experimento se empleó un diseño completamente al azar, con seis tratamientos, 15 repeticiones y dos plantas por unidad experimental y las variables evaluadas fueron las mismas del experimento 2.
Cultivo y crecimiento de las bacterias
Las cepas UM16, UM256, UM240 y UM270 de la bacteria Pseudomonas fluorescens [20], fueron cultivadas en medio nutritivo ( Bioxon®). Para 1 L de medio de cultivo se agregaron 30 g L-1, se ajustó el pH a 7 con HCl o bien KOH y se esterilizó en autoclave a 121oC por espacio de 15 minutos. Las bacterias fueron sembradas en el medio colocando, con una aza bacteriológica, cada cepa bacteriana en un matraz independiente conteniendo el medio de cultivo líquido. Posteriormente, se llevaron a agitación por 24 horas a 30°C y 150 rpm en un agitador orbital por 24 horas previas a su aplicación en las plantas desarrolladas en invernadero, o bien hasta que alcanzaron una fase de crecimiento de logaritmo de 1x10-6 UFC.
Inoculación de las cepas bacterianas
La aplicación de las bacterias se realizó 15 días después del trasplante de las plantas a los contenedores individuales. En esta fase se comparó el efecto de las 4 cepas de Pseudomonas fluorescens (UM16, UM240, UM256 y UM270) sobre la tolerancia de Casuarina equisetifolia a NaCl. Se incluyeron dos testigos: uno en el que sólo se aplicó agua corriente, y otro en el que se regó con disolución de NaCl al 2%. Al resto de las plantas se les agregaron directamente sobre el suelo 10 mL de la bacteria (1x10-6 UFC) en suspensión preparada. Ocho días después de la aplicación de las bacterias, se regó con 70 mL contenedor-1 de NaCl al 2% (p/v) (excepto testigo absoluto). Esta práctica se repitió cada 8 días por mes y medio, tiempo en el que las plantas se extrajeron de los contenedores para hacer las evaluaciones correspondientes.
RESULTADOS
Prueba de germinación
Número de semillas germinadas y días a germinación. De acuerdo a los resultados obtenidos, las semillas de C. equisetifolia germinaron en todas las concentraciones de cloruro de sodio evaluadas, sin diferencias estadísticas para esta variable; sin embargo, el tiempo de germinación se retrasó en proporción directa a la concentración de NaCl en la solución (Figura 1). El tratamiento a 2% de NaCl exhibió germinación 9 días después que el testigo.
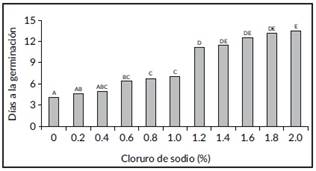
Figura 1 Tiempo de germinación de semillas de Casuarina equisetifolia embibidas en diferentes concentraciones de NaCl bajo condiciones de laboratorio. Valores con la misma letra son estadísticamente iguales (Tukey, P< 0,05).
La falta de inhibición de germinación de la semilla a las diferentes concentraciones de NaCl, pudo deberse a la condición misma de las semillas que presentan tolerancia a éste elemento. En semillas de arroz, de los genotipos CSR10 y M148, tolerantes al cloruro de sodio (NaCl) o sal, se observó que mantienen una baja relación de Na/K en los brotes y restringen la toma y translocación del Na de la raíz hacia los brotes. En la raíz, el genotipo CSR10 suprime el estrés aumentando la unión de electrolitos, promueve la acumulación de solutos compatibles y mantienen la homeostasis iónica celular más aficientemete que el genotipo M148 [16].
Efecto del NaCl sobre el crecimiento de C. equisetifolia bajo condiciones de invernadero
Materia seca de raíz y parte aérea. Se observaron diferencias significativas entre tratamientos para materia seca de raíz y parte aérea. El testigo predominó con el porcentaje más alto de materia seca, mientrs que a la concentración de 1% de NaCl las plantas presentaron menor respuesta con 23,48% inferior al testigo absoluto (Figura 2). En materia sec de la parte aérea las plantas crecidas en 2,00, 0,50, 0,25 y 1,50%, presentaron un 1,18, 11,53, 11,92 y 23% respectivamente, por debajo del testigo. Las concentraciones estadísticamente iguales se manifestaron entre 3,5 y 14,3% por debajo del testigo absoluto.
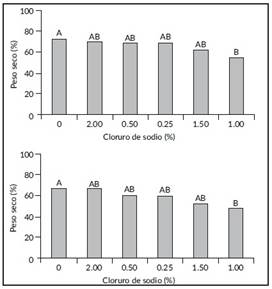
Figura 2 Porcentaje de materia seca de raíz (superior) y parte aérea (inferior) de Casuarina equisetifolia, crecidas a diferentes concentraciones de NaCl en invernadero. Valores con la misma letra son estadísticamente iguales (Tukey, P>0,05).
La raíz de las platas es el órgano que estará en contacto directamente son las salinidad. El estrés salino daña las funciones de la raíz y otros organelos celulares provocando una disminución en el metabolismo y desarrollo fisiológico de las plantas debido al decremento de los pigmentos fotosintéticos, al desbalance en la toma de nutrientes, acumulación de iones tóxicos y al estrés osmótico y oxidativo en diversos tipos de plantas [17,18,19]. El hecho de que estadísticamente no haya habido diferencias en profundidad, aunado a la cantidad de materia seca en el tratamiento con 2% de NaCl, hace pensar en el mismo principio fisiológico para C. equisetifolia. Así mismo, se confirmó que esta especie arbórea se desarrolla en concentraciones de hasta 2 % de salinidad y su combinación con otros factores de estrés o bioaumentación explica una tolerancia simultánea a varias condiciones adversas, tal como lo comentan [10] para NaCl e hidrocarburos. En este escenario, la salinidad del suelo podría jugar un papel importante en la estimulación y mantenimiento de la planta al activar los mecanismos adaptativos preestablecidos de ésta.
Al comparar estos datos con los resultados de materia seca de raíz, se infiere que el desarrollo radical se relaciona directamente con el exhibido en la parte aérea de la planta. En una investigación similar se pudo observar un aumento en la producción de materia seca y fresca de raíz y brotes de plantas de frijol que fueron inoculadas con una o varias especies de bacterias promotoras del crecimiento [20]. Es destacable el hecho que a partir del 1,5% de NaCl se notó un aumento perceptible en la materia seca, evidencia de que los mecanismos de tolerancia no sólo se reflejan en raíz, sino también en parte aérea, al tener condiciones adversas en el suelo [20].
Pseudomonas fluorescens y su efecto sobre la tolerancias de C. equisetifolia a NaCl
Altura y número de ramillas. Se tuvieron diferencias altamente significativas entre tratamientos para la altura y número de ramillas de las plantas. Las plantas con mayor altura y producción de ramillas fueron las correspondientes al testigo absoluto (Figura 3). Para esta condición las cepas de Pseudomonas empleadas no tuvieron efecto, estadísticamente fueron iguales al tratamiento con NaCl al 2%. Pseudomonas fluorescens se caracteriza por la producción de ácido indolacético (AIA), el cual es un regulador de crecimiento implicado en la producción de raíces, no teniendo un efecto significativo en la parte aérea de las plantas [21].
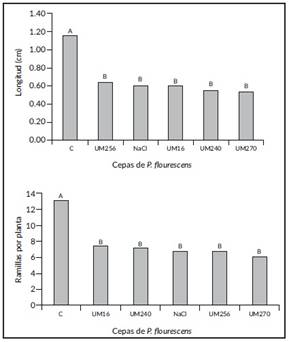
Figura 3 Altura promedio (superior) y número de ramillas (inferior) por planta de Casuarina equisetifolia inoculadas con Pseudomonas fluorescens cepas: UM16, UM240, UM256 y Um270, bajo invernadero. Valores con la misma letra son estadisticamente iguales (Tukey, P>0,05).
Materia seca parte aérea y radicular. Hubo diferencias estadísticas significativas entre tratamientos en el contenido de materia seca de la parte aérea y radicular. Las plantas que no recibieron tratamiento alguno mostraron materia seca superior a las plantas inoculadas con las diferentes cepas de P. fluorescens, aunque estadísticamente tuvieron el mismo efecto que las plantas inoculadas con la cepa UM256 de Pseudomonas fluorescens (Figura 4), con rendimientos inferiores al testigo absoluto (12,06%), pero superior al testigo con cloruro de sodio (18,70%). Al igual que en los resultados de la materia seca aérea el porcentaje más alto de materia seca radicular se observó en el testigo absoluto; sin embargo, llama la atención el hecho de que las plantas tratadas con las cepas de Pseudomonas fluorescens presentaron cierto porcentaje entre los testigos con y sin NaCl; de ellas, las plantas inoculadas con la cepa UM256 mostraron una cantidad de materia seca 1,26% por debajo del testigo absoluto, y 10,06% superior a las plantas que sólo se les aplicó NaCl. Para el caso de las plantas inoculadas con las cepas UM270, UM16 y UM240, se observó un contenido de materia seca de raíz 5,37, 6,16 y 7,85% por debajo del testigo absoluto, así como un 2,73, 4,59 y 5,49% por encima del testigo con NaCl al 2%, respectivamente (Figura 4 y 5).
Los resultados anteriores son similares a los estudiados por [20], donde la cepa de Pseudomonas fluorescens PF17 incrementó el crecimiento y tolerancia de girasol (Helianthus annuus) a salinidad. Diferente a lo que se pudiera haber esperado, se observó que la cepa UM256 promovió un mejor desarrollo de la raíz que las cepas UM16 y UM270, las cuales han mostrado en diferentes experimentos una mayor producción de masa radicular y efectos de antibiosis a patógenos como Botrytis cinerea [21]. Este efecto de resistencia a la salinidad es característico de varias especies de rizobacterias [22]. Los resultados concuerdan con los reportados por [23], donde plantas de pepino (Cucumis sativus) con Pseudomona fluorescens. presentaron un incremento en la longitud de brotes y la biomasa total. Así mismo, [21] comentan que las bacterias UM270, UM240, UM16 y UM256 incrementaron el peso de raíz en plantas de Medicago truncatula en condiciones in vitro. Hasta el momento, no hay reportes de estudios similares con esta bacteria para C. equisetifolia.
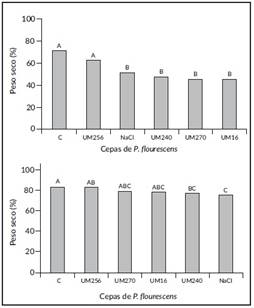
Figura 4 Porcentaje de materia seca en parte aérea (izquierdo) y radicular (derecho) de plantas de Casuarina equisetifolia sin tratar (testigo) o tratadas con NaCl e inoculadas con Pseudomonas fluorescens bajo invernadero. Valores con la misma letra son estadísticamente iguales (Tukey, P>0,05).
CONCLUSIONES
La semilla de Casuarina equisetifolia tienen la capacidad de germinar en concentraciones de hasta 2% de NaCl y su tiempo de germinación es retrasado en forma directamente proporcional a la cantidad de cloruro de sodio en la solución.
Las cepas probadas de Pseudomonas fluorescens no tuvieron efecto sobre el crecimiento y aumento de ramillas en plantas de Casuarina equisetifolia bajo condiciones de invernadero en suelo estéril regado con NaCl al 2%. Esto se manifestó visualmente en la tolerancia de las planta al estrés salino. Hasta el momento, los reportes sobre la respuesta a salinidad de la semilla de C. equisetifolia son escasos y poco se han estudiado los efectos de Peudomonas sp en el aumento de la tolerancia de casuarina al estrés salino.















