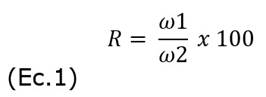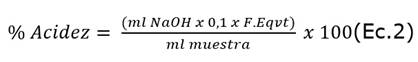INTRODUCCIÓN
En la actualidad, el alto desarrollo de la industria alimenticia ha conllevado a la generación de gran cantidad de residuos, tanto biodegradables como no biodegradables, lo cual ha obligado al perfeccionamiento e implementación de nuevas técnicas o métodos para el aprovechamiento de los mismos [1,2,3,4]. En particular, los residuos resultantes de la agroindustria hortofrutícola, generalmente han sido utilizados para la fabricación de productos de valor agregado destinados básicamente a la alimentación animal o a la elaboración de insumos para la producción agrícola, lo que ha permitido minimizar la carga de estos sobre el medio ambiente y, por ende, aliviar los resultados negativos ambientales tales como propagación de plagas, malos olores, contaminación de suelos y cuerpos de agua, entre otros [5]. Sin embargo, una gran cantidad de estos subproductos terminan desechados, lo que implica, además de lo anotado referente al medio ambiente, pérdidas económicas considerables para los productores y comercializadores.
La guayaba rosada (Psidium guajava L) es conocida como la “manzana de los trópicos” debido a sus atractivas características de color, aroma, sabor y propiedades funcionales. Cultivada por primera vez en América Central, la guayaba rosada se ha convertido en un importante cultivo comercial en muchos países del mundo, incluidos Pakistán, Brasil, México, Egipto, India, Indonesia y Colombia entre otros [6]. Durante el año 2016 se cosecharon en Colombia 11.131 ha de guayaba, con una producción total de 119.161 ton, distribuida en 12 departamentos dentro de los cuales se destacan Santander, Meta, Valle del Cauca, Boyacá, Antioquia y Caldas [7].
Perteneciente al grupo de las frutas denominadas tropicales, de pulpa jugosa color rosado, ha sido considerada una fuente importante de carotenoides, pectina, fibra dietética, y otros fitoquímicos como el ácido ascórbico, el ácido elágico y las antocianinas [6,8,9,10].
Con fines comerciales, la guayaba se procesa en forma de pulpa, jugos, néctares, mermeladas y concentrados, pero estos productos involucran aproximadamente la utilización del 70-75% de la fruta [9]. La agroindustrialización de la guayaba presupone el descarte de sus subproductos (25-30% de la fruta), lo cual conduce a los problemas ambientales anteriormente anotados. Estos residuos (epicarpio y semillas) han sido aprovechados para la elaboración de compuestos antimicrobianos, producción de etanol, biomasa ácido-láctica y ácido láctico [11,12]. Sin embargo, el epicarpio de algunas frutas presenta gran importancia a nivel agroindustrial ya que contiene pigmentos carotenoides que pueden ser utilizados como fuente importante de colorantes naturales o de provitamina A [13,14].
Los carotenoides son pigmentos naturales ampliamente distribuidos en múltiples productos de origen vegetal y animal y son los responsables de la coloración amarilla, naranja o roja de diversas frutas, raíces, flores, invertebrados, peces y pájaros entre otros [15,16,17]. Diversos estudios han demostrado que la ingesta de carotenoides se relaciona con una disminución del riesgo de padecer diferentes tipos de cáncer, enfermedades cardiovasculares, cataratas, degeneración macular, enfermedades neurológicas, inflamatorias y desórdenes inmunológicos [6,9].
En múltiples investigaciones se han estudiado, separado e identificado como carotenoides mayoritarios de la guayaba el fitoflueno, el β-caroteno y en mayor proporción el licopeno, haciendo de la guayaba una excelente fuente de estos componentes [6,9,10,18,19,20,21].
En este orden de ideas, los pigmentos carotenoides se constituyen como una fuente importante de color para ser aplicados a diferentes matrices alimenticias en sustitución de colorantes artificiales o sintéticos. En particular, la industria cárnica en la formulación de múltiples productos adiciona nitratos y nitritos, que además de cumplir la función de actuar como conservantes y antioxidantes, juegan un papel preponderante en el desarrollo de la coloración de los mismos. Sin embargo, en las últimas décadas se ha discutido el uso de ellos, ya que su consumo en cantidades altas conlleva a problemas de intoxicación y desarrollo de enfermedades catastróficas [22,23,24,25 ]. El objetivo del presente estudio fue caracterizar la harina de epicarpio de guayaba y determinar sus componentes carotenoides, fenólicos y su actividad antioxidante, con fines de ser aprovechada como aditivo en productos alimenticios procesados.
MÉTODO
El estudio se llevó a cabo en el Laboratorio de Tecnología de Frutas y Hortalizas de la Universidad Nacional de Colombia - Sede Palmira, ubicado en el municipio de Palmira, Valle del Cauca, Colombia, ubicado a 1001 msnm y con una temperatura promedio de 24°C. Su cabecera está situada a 3° 31’ 48’’ de latitud norte y 76° 81’ 13’’de longitud oeste. Las guayabas se adquirieron en un mercado local especializado en venta de frutas en grado de madurez para consumo en fresco. Con la ayuda de un cuchillo en acero inoxidable, se retiró el epicarpio, procurando eliminar los residuos de pulpa adheridos. Éste se pesó y se empacó en bolsas de polietileno selladas al vacío, para lo cual se utilizó una máquina selladora manual EGARVAC S.C.P. Basic B (Vacarisses, Barcelona, España). Las bolsas selladas se sometieron a conservación bajo congelación (-30 ± 1°C) durante 24 horas. Posteriormente fueron sometidas a secado por liofilización utilizando un aparato liofilizador LABCONCO, de 18 L de capacidad, a presión de vacío a 0,120 mbar y temperatura del condensador -80°C durante 24 horas. Finalmente, el epicarpio seco se molió en un molino IKA M-20s3, USA hasta obtener una harina con diámetro de gránulo promedio de 0,25 mm, la cual se empacó en bolsas al vacío y se mantuvo a temperatura de refrigeración (5 ± 1°C) hasta el momento de realizar los respectivos análisis.
Parámetros fisicoquímicos
La harina de epicarpio de guayaba (HEG) se sometió a los siguientes análisis: rendimiento en peso (%), pH, sólidos solubles (°Brix), acidez titulable (%), parámetros de color (L*, a*, b*, C, h), contenido de humedad (%) y actividad de agua (Aw). De la misma forma, se determinó el contenido de carotenoides, la actividad antioxidante y el contenido de compuestos fenólicos. Todas las pruebas se realizaron por triplicado.
Rendimiento en peso (%). Se midió el peso del epicarpio tanto en fresco como después del proceso de liofilización y se calculó el rendimiento mediante la siguiente ecuación 1:
Donde:
R: Rendimiento (%)
ω1: Peso del epicarpio después de la liofilización (g)
ω2: Peso del epicarpio antes de la liofilización (g)
Determinación del pH. Con la ayuda de un pH-metro (MP 230, Metter Toledo, Suiza) calibrado con soluciones tampón de pH 7 y pH 4 se midió el pH de la salchicha, para lo cual a 1 g de la muestra se le adicionaron 10 mL de agua destilada hasta obtener una solución homogénea. (Norma Técnica Colombiana NTC - 4592) [26].
Determinación de sólidos solubles (°Brix). A 10 g de la muestra se le adicionó agua destilada en relación 1:10. Se mezcló con agitación permanente en un beaker de 250 mL hasta obtener una mezcla homogénea. Sobre el prisma inferior del refractómetro (POCKET ATAGO PAL - 1, Japón) se colocó una alícuota de la mezcla y se hizo la respectiva medición. El resultado se expresó en °Brix de acuerdo a la Norma Técnica Colombiana NTC - 4624 [26].
Determinación de la acidez titulable (% Acidez). En un beaker se colocó 1 g de la muestra y se mezcló con 10 mL de agua destilada, hasta obtener una mezcla homogénea. Se agregaron tres gotas de fenolftaleína como indicador, y se tituló con una solución 0,1 N de NaOH hasta obtener un pH 8,1-8,2 según la Norma Técnica Colombiana NTC - 4623 [26]. El porcentaje de acidez se calculó mediante la siguiente ecuación 2:
Determinación de los parámetros de color. Las mediciones se realizaron en un colorímetro MICOLTA CHROMA METER CR-400, Japón), a través del cual se evaluaron los parámetros CIELab de la Comisión Internacional de Iluminación. Se utilizó un iluminante D65 y un observador a 2° (equipo calibrado con una placa de cerámica blanca con valores de referencia Y = 89,5, x = 0,3176 y y = 0,3340). Con base en estos parámetros se calcularon la tonalidad (h) y la cromaticidad (C) utilizando las siguientes ecuaciones 3 y Ecuación 4:
Determinación del contenido de humedad (%). Se pesaron 0,5 g de la muestra y se colocaron en un crisol a 105°C en un analizador halógeno de humedad HB43-S Metter Toledo, Suiza de acuerdo al método AOAC 925.09 [27[. El contenido de humedad se expresó en porcentaje de peso húmedo.
Determinación de la actividad de agua (Aw). Con la ayuda de un equipo para medir actividad de agua (AquaLab, 4te, USA) y de acuerdo a la norma AOAC 978.19 [28 ] se determinó la actividad de agua de las muestras analizadas.
Determinación del contenido de carotenoides. El contenido de carotenoides totales en la HEG se realizó de acuerdo a lo propuesto por Ordoñez et al. [15]. 0,1 g de la muestra se colocaron en un tubo de ensayo recubierto con papel aluminio y se le adicionaron 7 mL de una mezcla de etanol/hexano (4:3 v/v). El tubo se colocó a 16°C durante una hora agitándolo permanentemente, posteriormente se le adicionó 1 mL de agua destilada y se agitó por 5 minutos más. Seguidamente se centrifugó a 4500 rpm durante 10 minutos, se tomaron 3 mL de la fase orgánica y se realizaron lecturas de absorbancia en un espectrofotómetro (Jenway, 6320D, Inglaterra) utilizando hexano como blanco, a longitudes de onda 450, 441, 451 y 472 nm. La concentración (mg/g de muestra) se calculó utilizando los siguientes coeficientes de extinción E% en hexano 2560, 2800, 2460, 2480 y 3450 respectivamente para β-caroteno, α-caroteno, β-criptoxantina, zeaxantina y licopeno, mediante la siguiente ecuación (ecuación de Lambe-Beer):
Donde:
A: Absorbancia a determinada longitud de onda (450 nm para β-caroteno, 444 nm para α-caroteno, 451 nm para β-criptoxantina, 451 nm para zeaxantina y 472 nm para licopeno.
V: volumen del extracto en mL.
W: peso de la muestra en gramos.
E 1%: coeficiente de extinción para una solución al 1% en hexano.
Determinación de la actividad antioxidante. El proceso se desarrolló de acuerdo a la metodología propuesta por Martínez et al. [29]. La actividad antioxidante se expresó como el porcentaje de inhibición del radical DPPH (2,2,-diphenyl-1-picrylhydrazyl radicals, marca Sigma-Aldrich Chemical). Se pesaron 0,25 g de la muestra de HEG y se colocaron en un Erlenmeyer cubierto con papel aluminio. Se le adicionaron 25 mL de metanol y se agitó durante un minuto, posterior a lo cual la solución se filtró hasta obtener el extracto. Se tomó 1 mL del extracto y 2 mL de DPPH 0,1 mM recién preparado. La muestra y el control (sin adición de DPPH) se dejaron en reposo durante una hora en un sitio oscuro y a temperatura ambiente. Finalmente, con la ayuda de un espectrofotómetro Jenway 6320D, Inglaterra, se leyeron las absorbancias, para la muestra y para el control, a una longitud de onda de 517 nm. El porcentaje de actividad antioxidante (AA%), se calculó usando la siguiente ecuación:
Determinación de los compuestos fenólicos. El contenido de fenoles se determinó de acuerdo con el método de Folin-Ciocalteu descrito por Singleton et al. [30]. 0,5 g de HEG se colocaron en un Erlenmeyer de 50 mL cubierto con papel aluminio y se le adicionaron 10 mL de una mezcla etanol-agua en relación 80:20 (v/v). La mezcla se mantuvo a temperatura ambiente en constante agitación por tres minutos. Seguidamente, la mezcla se sometió al proceso de ultrasonido, en un equipo Ultrasonic Cleaner-DC PowerPowerFull-Hagavish, Israel durante 20 minutos a 25°C. Posteriormente, la mezcla se filtró y 0,5 mL del filtrado se mezclaron con agua destilada y 0,5 mL del reactivo de Folin-Ciocalteu. Después de tres minutos de reacción a temperatura ambiente se le adicionó 1 mL de carbonato de sodio anhídrido al 20% y se colocó en un baño térmico programado a 45°C por 15 minutos. Después de enfriada la muestra se hicieron lecturas de absorbancia en un equipo Spectrophotometer Jenway 632D, USA, a una longitud de onda de 765 nm. Se realizó una curva de calibración con ácido gálico (patrón) y los resultados fueron expresados en mg de ácido gálico equivalentes por gramo de extracto de HEG.
Análisis estadístico
El utilizó un diseño aleatorio simple de un factor y un tratamiento. Para comparar las diferencias entre medias de los diferentes parámetros analizados se utilizó una prueba Tukey, con un nivel de significancia del 5%. Todos los análisis se realizaron por triplicado y se registran como media ± desviación estándar.
RESULTADOS
Los resultados de los parámetros fisicoquímicos referentes a la HEG se muestran en el cuadro 1. El rendimiento en peso de la muestra analizada fue del 11,5%. Con relación al pH, la HEG presentó un valor de 4,23 siendo ligeramente ácido lo que garantiza la no proliferación de microorganismos patógenos y, por lo tanto, la inocuidad del producto obtenido. Este valor de pH en la HEG concuerda con lo reportado por Ordóñez-Santos et al. (pH 4,29) [15], quienes trabajaron con residuos de guayaba, igualmente con lo presentado por Vasconcelos et al., (pH 3,99) quienes trabajaron con pulpa de arazá (Psidium guineense) [31], pero superior a lo presentado por Rojas-Garbanzo et al. (pH 2,72 - 2,77) en un estudio de caracterización de los compuestos fitoquímicos de la guayaba [20] y lo encontrado por Formiga et al. (pH 3,69) quienes analizaron las características de la piel de guayaba de la variedad “Pedro Sato” [32]. Las diferencias del valor de pH anotadas probablemente se deben a la variedad y al grado de madurez de la guayaba utilizada en las diferentes investigaciones.
Cuadro 1 Propiedades fisicoquímicas para la harina de epicarpio de guayaba (HEG).
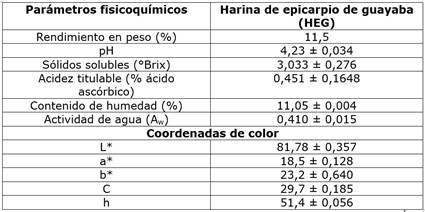
L*: 0 = negro y 100 = blanco; a*: -60 = verde y +60 = rojo; b*: -60 = azul y +60 = amarillo; Ángulo de tono (h): 90° = amarillo, 180° = verde y 0° = rojo; Cromaticidad (C): distancia desde las coordenadas en el origen hasta el punto de color determinado. Resultados reportados como media ± desviación estándar para n = 3.
El resultado obtenido para el contenido de sólidos solubles (°Brix) en la HEG elaborada mostró un valor inferior a lo presentado por Martínez-Ortiz et al. (10,5°Brix) [33], quienes trabajaron con guayabas recubiertas con una película a base de harina de chayote y ácido ascórbico, así como también por lo mostrado por Zambrano-Zaragoza et al. (9,01°Brix) [34] adicionando nanopartículas lipídicas como recubrimiento en guayabas y por Alamar et al. (7,0°Brix) [35] quienes trabajaron con guayabas congeladas. Los resultados para los sólidos solubles encontrados por los autores anotados muestran valores superiores debido, probablemente, a que éstos trabajaron con la pulpa de la fruta, mientras que esta investigación se llevó a cabo con el epicarpio de la fruta en donde evidentemente el contenido de sólidos solubles es menor. Con relación a la acidez titulable, el valor obtenido fue similar a lo reportado por Moon et al. (0,50%) [36] quienes trabajaron con 27 variedades de guayaba en diferentes estados de maduración, y por Murmu y Mishra (0,49%) [37 ] quienes adelantaron la respectiva investigación con guayaba empacada bajo diferentes condiciones de almacenamiento, pero ligeramente inferior a lo obtenido por Silva et al. (0,75%) [38] quienes investigaron con guayaba recubierta con quitosano.
Dentro de los parámetros de calidad referidos a una matriz alimenticia, el color juega un papel preponderante, siendo factor de aceptación o rechazo en la apariencia de dicho producto [39]. Los valores de las coordenadas L*, a* y b*, así como la cromaticidad y el tono se muestran en el cuadro 1. El valor alto de la luminosidad (L*), comparado con lo presentado para la pulpa de guayaba (L* = 25,2) por Suárez et al. [40] y por Martínez-Ortiz et al. (L* = 56,0) [33] da cuenta de una HEG relativamente oscura debido probablemente a la isomerización de los compuestos carotenoides y al proceso de pardeamiento causado por las temperaturas utilizadas durante el proceso de secado. Por otro lado, las coordenadas a*y b*,la cromaticidad (C) y el ángulo de tono (h) ligeramente superan lo presentado por Martínez-Ortiz et al. [33]. Sin embargo, estos valores son inferiores a lo mostrado por Formiga et al. [32], quienes trabajaron con guayaba roja “Pedro Sato”. Las diferencias encontradas se deben, posiblemente, a las variedades de guayaba utilizadas en cada experimentación.
La actividad de agua junto con el contenido de humedad y el pH son parámetros determinantes en la validación de la vida útil de cualquier alimento. Los datos reportados en esta investigación permiten concluir que el contenido de humedad y la actividad de agua garantizan el no deterioro de la HEG ya que los valores son bajos y adecuados para un producto seco y molido, tal como lo afirman Lang et al. [41 ], quienes argumentan que dichos procesos de deterioro se ralentizan considerablemente a valores bajos de actividad de agua (Aw = 0,60).
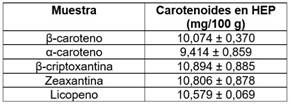
En el cuadro 2 se observan los resultados para el contenido de carotenoides en la HEG.
Se puede observar que el mayor valor se obtuvo para la fracción de β-criptoxantina, mientras que el menor valor fue para la fracción de α-caroteno. Estos datos son superiores a los mostrados por Nora et al. [42], sin embargo, se registra igualmente, que para estos investigadores el mayor valor obtenido fue para la fracción de β-criptoxantina y el menor valor fue para el α-caroteno. Para Bordiga et al. [43] los valores obtenidos para los carotenoides trabajando con epicarpio y pulpa de la fruta caqui (Diospyros kaki L.) fueron supriores, al igual que los resultados mostrados por Sánchez-Camargo et al. quienes investigaron con cáscaras de mango [44 ] y para Noronha et al. quienes adelantaron su trabajo con cáscaras de tucumã (Astrocaryum vulgare) y chontaduro (Bactris gasipaes) [ [45]. Las diferencias presentadas entre las frutas analizadas y mostradas en la literatura, pueden deberse a diferentes factores, tales como los genéticos, los geográficos asociados a la producción de dichas frutas, las condiciones ambientales, grado de maduración, métodos de pre y poscosecha, etc.
El valor obtenido para la actividad antioxidante de la HEG fue de 62,281 ± 1,519%) (promedio ± desviación estándar de tres repeticiones). Este valor fue menor que el mostrado por Kong e Ismail (77,78%) [46] quienes trabajaron con subproductos de la producción de pulpa de guayaba y Murmu y Mishra (84,45%) [47 ] quienes adelantaron su trabajo con un recubrimiento sobre la guayaba. Sin embargo, comparado con el valor referenciado por Nair, Saxena y Kaur (40,2%) para guayaba recubierta con alginato y quitosano es mayor [ 48 ]. Respecto al contenido de compuestos fenólicos, el valor obtenido (75,170 ± 0,241 mg EAG/g), fue considerablemente menor a lo presentado por Murmu y Mishra (122,23 mg EAG/g) 47, así como también con relación a los resultados obtenidos por Nair, Saxena y Kaur (139,5 mg EAG/g) [48], los mostrados por Formiga et al. (271,2 mg EAG/g) quienes trabajaron con guayaba de la variedad “Pedro Sato” [32] y los aportados por Wolf y Cylos (682,29 mg EAG/g) quienes trabajaron con pasta de guayaba [49]. Por el contrario, los datos mostrados por Souza et al. (24,63 mg EAG/g) [50] quienes trabajaron con residuos industriales de guayaba, al igual que los encontrados por Ademiluyi et al. (66,1 mg EAG/g) [51] fueron menores.
Los datos obtenidos en el presente estudio, referenciados a los mostrados por otros autores en sus respectivas investigaciones, permiten afirmar que a mayor o menor concentración de compuestos fenólicos o de su grado de hidroxilación, se presenta una variación en la actividad de captación de radicales del DPPH y por lo tanto en la actividad antioxidante, debido a la dependencia que se presenta con relación a las propiedades de reducción y oxidación, las cuales pueden desempeñar un papel preponderante en la absorción y neutralización de los radicales libres. Por otro lado, el mayor o menor contenido de fenoles en la HEG tiene relación directa con las características genéticas de la variedad de guayaba utilizada y a su grado de maduración y condiciones agronómicas de producción [52].
CONCLUSIONES
Los valores obtenidos tanto para los parámetros fisicoquímicos como para las coordenadas del color y los contenidos de compuestos carotenoides y fenólicos y la actividad antioxidante de estos, permiten establecer que la harina de epicarpio de guayaba puede ser utilizada como fuente de pigmentos naturales para ser agregada a diversas matrices alimentarias. Además, gracias al alto contenido y a las propiedades funcionales de los componentes anotados presentes en la materia prima analizada, la HEG se muestra como una alternativa interesante, de origen natural, para enriquecer y prevenir enfermedades de alto riesgo para el ser humano.