INTRODUCCIÓN
Las hormonas glicoproteínas (GPHs) son una familia de moléculas ricas en cisteínas que se han conservado evolutivamente. entre las GPHs, se encentran las hormonas gonadotropinas (GTH) como la hormona folículo estimulante (FSH) y la hormona luteinizante (LH), también denominadas en la literatura de peces teleósteos como GTH I y GTH II respectivamente. Las GTHs, contienen dos subunidades disimiles designadas como α y β codificadas por genes diferentes [1]; mientras la subunidad α (GP-α) es la misma &re gonadotropinas de una especie, la subunidad β (FSHβ o LHβ) es única para cada hormona y le confiere especificidad biológica [2]. Las estructuras de los de genes de GP-α y FSHβ se han conservado durante la evolución entre peces teleósteos y mamíferos. En contraste, los loci del gen LHβ de los teleósteos y los tetrápodos no muestran ninguna relación sintética [3].
Las funciones de la LH en la activación de la maduración de los ovocitos y la ovulación parecen ser similares entre los vertebrados [4]. En el modelo de teleósteos mejor estudiado que es el pez cebra, la LH mediante la señalización de AMPc regula la expresión de la proteína reguladora aguda esteroidogénica (star), la cual interviene en la maduración de los ovocitos catalizando el primer paso en la síntesis de la hormona inductora de la maduración (MIH) [5]. Por otro lado, en los machos de pez cebra la señalización de las gonadotropinas es esencial para la espermatogénesis y espermiación, sin embargo las acciones de la LH y FSH están altamente superpuestas [4].
Los bagres de la familia Pimelodidae son diversos y abundantes en la vasta red de ríos de tierras bajas que fluyen desde los Andes y los escudos continentales hacia el Océano Atlántico, en la cuenca del Maracaibo y en la vertiente del Pacífico de Panamá [6,7]. Diferentes especies de pimelodidos como Pseudoplatystoma spp., Leiarius spp, Brachyplatystoma spp y Pimelodus spp. son económicam&e importantes en las pesquerías continentales de Suramérica y algunas poseen un alto potencial para la acuicultura. Muchos pimelodidos realizan migraciones reproductivas sincronizadas con el ciclo hidrológico [8,9]. Por esta razón, se presenta una disrupción reproductiva en cautiverio debido a la falta de estímulos ambientales apropiados y que en los machos de Pimelodus spp. se agrava porque los testículos digitiformes [10] impiden que el semen se libere por masaje abdominal durante los procedimientos de reproducción inducida [11]. Por otro lado, la ausencia tanto de maduración final de los ovocitos como de ovulación en pimelodidos en cautiverio, indica que el desove parece estar estrictam&e modulado por la síntesis y liberación de LHβ [12].
Pimelodus grosskopfii es un pez críticamente amenazado, de importancia comercial en las pesquerías artesanales y endémico de las cuencas de los ríos Magdalena, Cauca y San Jorge [13,14]. Al igual que en las demás especies de la familila Pimelodidae, las secuencias codificantes de las GTH de P. grosskopfii son desconocidas. El objetivo de la presente investigación fue aislar, clonar y determinar las secuencias de las subunidades GP-α y LHβ de la LH de P. grosskopfii para generar información básica de las gonadotropinas como requisito importante para estudios de regulación de la gametogénesis en Siluriformes tropicales y como insumo fundamental en la síntesis de hormonas recombinantes especie-específicas que mejoren la eficiencia reproductiva en cautiverio de esta especie.
MÉTODO
Material biológico
Individuos adultos de Pimelodus grosskopfii (200-350gr) fueron obtenidos en el Centro Acuícola Piscícola Santa Cruz (Caucasia, Antioquia). Los peces fueron sacrificados mediante inmersión en una solución de MS-222 a una concentración de 300 ppm. Posteriormente, las glándulas pituitarias fueron extraídas y almacenadas en RNAlater TM (QIAGEN) a -80°C, hasta la extracción de ARN.
Extracción de ARN y transcripción reversa
El procesami&o de las muestras se realizó en el laboratorio de Biología Molecular de la Asociación Colombiana de Acuicultores en Medellín, Colombia.
Las pituitarias fueron congeladas en nitrógeno líquido y pulverizadas con un homogenizador en solución de lisis (QIAGEN). El ARN total fue extraído en el sistema automatizado QIAcube (QIAGEN) empleando la programación para extracción a partir de tejidos con el Kit RNeasy Mini (QIAGEN). La integridad del ARN fue verificada mediante electroforesis de geles de agarosa 1,5% en TBE 0,5X y basado en la absorbancia a 260 nm empleando el Nanodrop 2000 (Thermo Scientific).
La síntesis de la primera cadena de cADN se realizó empleando el Kit RevertAid H Minus First Strand cDNA Synthesis (ThermoScientific) usando Oligo (dT) y cebadores random hexamer. La transcripción reversa se llevó a cabo por 60 min a 42°C en una reacción de 20 µL, con 1 µg de ARN, 4 µL 5X de búfer de reacción, 0,5 mM mezcla dNTP, 20 U RNase Inhibitor, 200 U RevertAid H Minus y finalización a 70°C por 5 min. El producto de la reacción fue almacenado a -80°C hasta su uso en la PCR.
Amplificación GP-α y LHβ mediante PCR
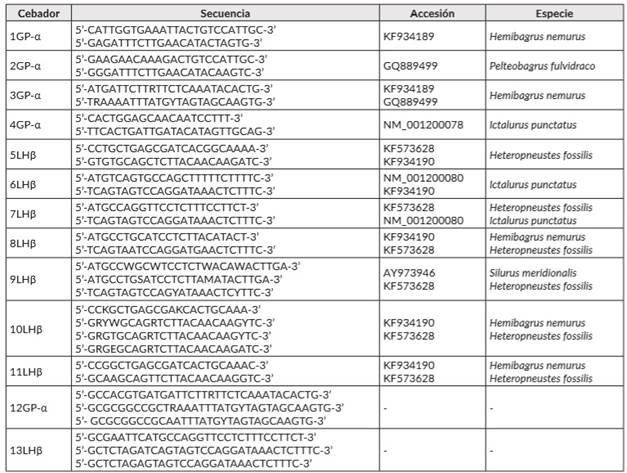
Se diseñaron 13 diferentes grupos de cebadores a partir de las secuencias de las subunidades de la LH de otras especies de Siluriformes depositadas en las bases de datos de NCBI (National Center for Biotechnology Information) (cuadro 1. Para GP-α, se obtuvo amplificación con dos grupos de cebadores denominados como 3GP-α y 4GP-α. El perfil térmico utilizado para estas PCR fue desnaturalización inicial a 94°C por dos minutos, 35 ciclos de 94°C por un minuto, 49,1°C por 30 segundos, 72°C por 40 segundos y una extensión final a 70°C durante 5 minutos. Para la subunidad LHβ, se obtuvo amplificación con los cebadores nombrados como 7LHβ. El perfil térmico utilizado fue desnaturalización inicial a 94°C por 2 minutos, 35 ciclos de 94°C por un minuto, 58°C por 30 segundos y 72°C por 40 segundos y una extensión final a 70°C durante 5. Para todas las PCR, las concentraciones de reactivos fueron: 2 mM MgSO4, 0,2 mM dNTP’s, 0,5 µM cebadores, 2,5 U Pfu DNA Polymerase (Thermo Scientific).
Clonación, transformación y purificación
Los productos de la PCR de las subunidades GP-α o LHβ fueron clonados en el vector pJET1.2/blunt (Life Technologies). Las condiciones de la reacción de clonación fueron: 10 µL de búfer de reacción (2X), 1 µL pJET1.2/blunt (50 ng/ul), 1 µL T4 DNA ligasa (5 U/µl), 7 µL Agua libre de nucleasas, 1 µL producto de PCR. La reacción de clonación se incubó a 20°C por una hora. La transformación de Escherichia coli DH5α (Thermo Scientific), se realizó por choque térmico, empleando 50 uL de células competentes y 5 uL del constructo (vector pJET 1.2/blunt con producto de PCR GP-α ó LHβ), siguiendo las recomendaciones de la casa comercial.
La recuperación del constructo se realizó a partir de colonias transformadas, que se inocularon en medio LB con Ampicilina a 37°C en agitación a 250 rpm por 16 horas. La purificación se realizó con el sistema Miniprep QIAprep Spin (QIAGEN). Posteriormente, se realizó la verificación de la clonación mediante una nueva PCR para cada subunidad.
Secuenciación
Una vez realizada la purificación de los constructos con la inserción de cada una de las subunidades, los clones identificados como positivos fueron enviados a Macrogen (Corea), para realizar secuenciamiento en ambas direcciones. Las secuencias obtenidas fueron editadas manualmente en el programa BioEdit versión 7.2.5. La creación de las secuencias consenso fue realizado en el programa Geneious versión 5.4.6. La comparación de las secuencias de GP-α y LHβ con las depositadas en GenBank se realizó mediante BLAST con las herrami&as en línea de NCBI.
Análisis estructural y filogenético
La predicción de las secuencias de aminoácidos para GP-α y LHβ fueron obtenidas con el programa SignalP versión 4.1. Para predecir la secuencia del péptido señal y los sitios putativos ligados para N-glicosilación se utilizó el programa NetNGlyc 1.0.
Las distancias genéticas, se calcularon mediante comparación por pares usando 1.000 repeticiones de bootstrap con el modelo de Kimura 2-parametros y se construyó un árbol a partir del método Neighbor-Joining usando el programa Mega versión 6.0.
RESULTADOS
El producto amplificado con los cebadores 3GP-α fue de 370 pb. Para estos cebadores las temperaturas óptimas de alineamiento estuvieron entre 48 y 55,5°C. Temperaturas superiores afectaron la eficiencia de la PCR. Por otro lado, con los cebadores 4GP-α se obtuvo un producto de 577 pb con temperaturas óptimas de alineamiento entre 49,1 y 52,7°C. El fragmento amplificado con los cebadores 7LHβ fue de 417pb.
La longitud del marco abierto de lectura para la secuencia de la subunidad GP-α fue de 351 pb, el cual incluyó un codón de inicio ATG y codón de parada TAA (accesión de GenBank KY860907). Por su lado, la longitud del marco abierto de lectura de la subunidad LHβ, fue de 423pb, que incluyó un codón de inicio ATG y codón de parada TGA codificando para un péptido de 140 residuos de aminoácidos (aa). (cuadro 2). En GP-α, se identificó un péptido señal de 24 aa (MILVLKYTGATILLLSVLMDIGQL), dejando una proteína madura de 92 aa, 10 residuos de cisteína así como dos sitios de N-glicosilación NIT y NHT (posiciones Asn53 y Asn78, figura 1). En LHβ, se observó un péptido señal de 22 aa (MPGSSFLLVLCFLVNVFSPAQS), para una proteína madura de 118 aa, 12 residuos de cisteína y un sitio de N-glicosilación NET (posición Asn10, figura 2)

Figura 1 Alineamiento de la estructura primaria del péptido de GP-α de P. grosskopfii con otros teleósteos.
Los residuos de cisteína son identificados con cuadros. Los sitios de N-glicosilación son identificados con cuadros en sombra. Para el análisis se incorporaron los espacios (gaps) marcados con (-).

Figura 2 Alineamiento de la estructura primaria del péptido de LHβ de P. grosskopfii, con otros teleósteos.
Los residuos de cisteína son identificados con cuadros. Los sitios de N-glicosilación son identificados con cuadros en sombra. Para el análisis se incorporaron los espacios (gaps) marcados con (-).
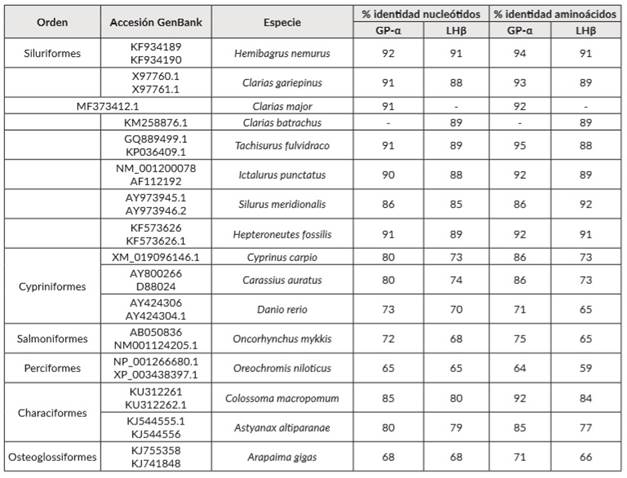
El tamaño del péptido de GP-α de P. grosskopfii y sus características son similares a lo reportado para otras especies de Siluriformes como Clarias gariepinus, Silurus meridionalis y Hemibragus nemurus (ver la figura 1 y el cuadro 3). La presencia de dos sitios de N-glicosilación (posición Asn53 y Asn78) y 10 residuos de cisteína son altamente conservadas entre teleósteos y otros vertebrados [15] debido probablemente a que GP-α es compartido por todas las glicoproteínas pituitarias, incluyendo FSH, LH y Tirotropina (TSH). Se ha sugerido que estas regiones, tienen diferentes funciones, entre ellas, generar la formación de cinco enlaces disulfuro intra-moleculares relevantes para síntesis del péptido maduro y posiblema relacionados con la dirección del dímero en la proteína [16 ]. entre las GP-α de diferentes especies de peces, se identifica una región altamente conservada entre los residuos de aminoácidos 33-66, ubicada entre dos pares de cisteínas adyacentes y el primer sitio de N-glicosilación, que puede estar involucrada en el ensamble de la subunidad y su afinidad para unirse al receptor [17 ].
Cuadro 3 Homología de nucleótidos y predicción de aminoácidos para GP-α y LHβ de Pimelodus grosskopfii.
La longitud de la proteína madura de LHβ de P. grosskopfii de 118 aa está estrictamente conservada entre las especies del orden siluriformes incluidas en el presente análisis (figura 2). En otros grupos de teleósteos en los cuales LHβ ha sido clonada, se ha determinado que las longitudes de la proteína madura y el péptido señal varían entre 115-119 y 21-27 aa respectivamente [18,19 ]. El análisis de la topología de la estructura del péptido maduro de LHβ en P. grosskopfii, indicó la presencia de un sitio de N-glicosilación (posición Asn10) y 12 residuos de cisteína. Esta estructura es conservada en las diferentes secuencias de LHβ previamente reportadas en teleósteos (figura 2). Adicionalmente, se identificó una región ampliamente conservada (HPGVDPHVTYPVALS) que concentra residuos de prolinas, que son esenciales para la estructura proteica de la subunidad LHβ debido a su importancia en el plegamiento de la proteína y direccionamiento del péptido [20 ].
Se encontró una alta homología de las secuencias de nucleótidos (86-92%) y aminoácidos (86-95%) de la subunidad GP-α de P. grosskopfii con otros géneros de Siluriformes como: Hemibragrus, Clarias, Pelteobragus, Ictalurus, Tachisurus y Silurus. En contraste, se evidenció menor homología de la subunidad GP-α de P. grosskopfii con peces de otros ordenes como Characiformes, Cypriniformes, Salmoniformes, Osteoglossiformes y Perciformes a nivel de nucleótidos (65-85%) y para la predicción de aminoácidos (64-92%) (cuadro 3). Igualmente, para LHβ de P. grosskopfii se registró una alta homología de la secuencia de nucleótidos (85-91%) y aminoácidos (88-92%) con otros Siluriformes así como menor homología con peces de los órdenes Characiformes, Cypriniformes, Salmoniformes, Osteoglossiformes y Perciformes a nivel de nucleótidos (65-80%) y para la predicción de aminoácidos (59-84%) (cuadro 3).
La filogenia basada en las secuencias de LHβ separó claramente los diferentes órdenes incluidos en el análisis, comparado con el árbol basado en GP-α (figuras 3 y 4) ya esta última filogenia no agrupó en un solo clado a los miembros del órden Characiformes. Sin embargo, en ambas filogenias los miembros del orden Siluriformes presentaron menor distancia entre sí, comparados con representantes de Osteoglossiformes, Salmoniformes y Perciformes. En ambos árboles, los bagres del viejo mundo (Silurus, Heteropneustes, Clarias, Hemibragrus y Tachisurus) fueron más cercanos &re sí, comparados con uno de los dos bagres americanos (Ictalurus o Pimelodus) según la reconstrucción filogenética analizada.
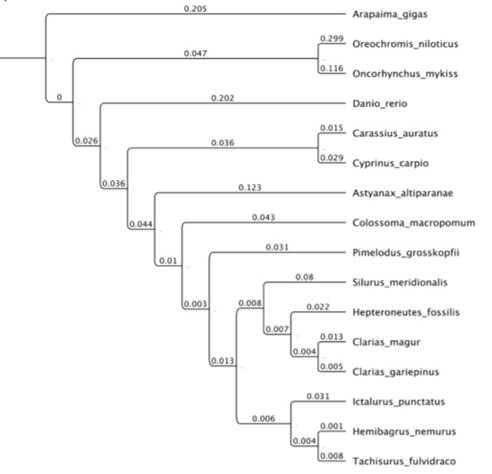
Figura 3 Relaciones filogenéticas de la subunidad GP-α de P. grosskopfii con otras de especies teleósteos.
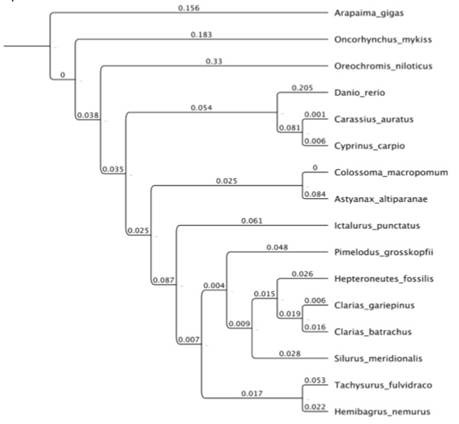
Figura 4 Relaciones filogenéticas de la subunidad LHβ de P. grosskopfii con otras de especies teleósteos.
En general las relaciones presentadas en la filogenia basada en las secuencias de LHβ fueron consistentes con los resultados obtenidos por [21,22 ] para la clase Actinopterygii ya que se identificó a: 1. Osteoglossomorpha (Arapaima gigas) como el linaje hermano de los demás teleósteos analizados y 2. el clado Otophysi (compuesto por Characiformes y Siluriformes como grupos hermanos junto a Cypriniformes). La principal diferencia entre la filogenia basada en LHβ y las propuestas por [21,22 ] fue la relación de Salmoniformes y Perciformes sin la formación del clado Euteleostei que si se presentó en la filogenia basada en GP-α. Las relaciones entre las familias del orden Siluriformes encontradas en las filogenias basadas en GP-α o LHβ conservaron la relación entre Hepteroneustes con Clarias (Claroidea), Tachysurus con Hemibagrus (Bagridae) y Silurus (Siluridae) como linaje independiente que se presentan en [23 ]. La relación de Ictalurus con Bagridae observada en la filogenia basada en GP-α fue consistente con la filogenia presentada por [22 ] pero fue difer&e a la obtenida para LHβ. La posición de Pimelodidae en las filogenias basadas en GP-α o LHβ es diferente a lo descrito por [22] debido a que estos autores encontraron a Pimelodidae como parte del grupo hermano del clado del que hacen parte Ictaluridae más Bagridae
CONCLUSIONES
El presente estudio, es el primer reporte de las secuencias de las subunidades de una gonadotropina en una especie de la familia Pimelodidae. El marco abierto de lectura para las secuencias de las subunidades GP-α y LHβ de P. grosskopfii fue de 351 y 423 pb respectivamente. En GP-α, se identificó un péptido señal de 24 aa dejando una proteína madura de 92 aa. Por otra parte, en LHβ, se observó un péptido señal de 22 aa para una proteína madura de 118 aa. La homología de las secuencias de nucleótidos y aminoácidos de GP-α y LHβ de P. grosskopfii fue mayor con miembros del orden Siluriformes comparados con otros ordenes de peces. Las filogenias construidas a partir de GP-α o LHβ conservan muchas de las relaciones previamente reportadas entre los grandes grupos de peces con aletas radiadas, pero presentan particularidades, entre ellas la posición de Pimelodus al interior de Siluriformes. Estos resultados son un punto de partida para el desarrollo de anticuerpos para cuantificación de hormonas gonadotrópicas y la producción de hormona luteinizante recombinante en P. grosskopfii.