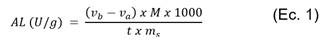INTRODUCCIÓN
Bactris guineensis (L) H.E. Moore 1963 (familia Arecaceae) es una palma tropical que crece en la región Caribe Colombiana, El fruto (corozo) es utilizado en la industria de alimentos para elaborar bebidas refrescantes, mermeladas y vinos que se comercializan a nivel local [1]. En esta región, se producen aproximadamente 25.000 toneladas anuales por hectárea del fruto [2], su procesamiento genera una biomasa residual que es desaprovechada generando un impacto ambiental negativo, debido a la inadecuada disposición final en rellenos sanitarios [3]. Gran parte de esa biomasa la constituye la almendra, cuyo contenido de aceite es mayor al 40% [1]. El ácido láurico (C12), principal ácido graso en el aceite de corozo (AC) (aprox. 65%), posee propiedades nutricionales benéficas, como son la regulación de los niveles de colesterol en la sangre [4] y disminución del riesgo de obesidad [5]. Es así, que debido al alto contenido presentado, el AC puede constituirse en una fuente valiosa para la obtención de ácido láurico. Además, el ácido láurico y su monoacilglicérido (1-monolaurilglicerol) presentan actividad antimicrobiana contra un amplio espectro de bacterias gram positivas como Clostridium difficile, Bacillus cereus y Sarcina lutea (9431), entre otras [6]; al igual que contra hongos y virus, como el de la estomatitis vesicular infecciosa [4,5].
Un método para obtener ácidos grasos (AG) libres de gran valor industrial es a través de la hidrólisis de sus aceites, usando métodos enzimáticos con lipasas (EC.3.1.1.3). Las lipasas bacterianas (e.i. Acinetobacter radioresistens y Staphylococcus caseolyticus) y fúngicas (e.i. Rhizopus y Aspergillus) [7] son las más usadas para la bioconversión de lípidos; no obstante, hay un creciente interés por las lipasas vegetales, debido a su especificidad y estereoselectividad [8].
Las lipasas del látex del fruto de Carica papaya L., son muy estudiadas [8,9,10]; se encuentran naturalmente inmovilizadas en la matriz polimérica del látex [8]. Actualmente, se reconocen tres fracciones con actividad lipolítica, una cruda (P3), otra parcialmente purificada libre de proteasas (CPL-p) y la fracción CPL-e que es libre de esterasa. Estas fracciones presentan diferencias en su especificidad por el sustrato y cinética de reacción [9,11] lo que supone la existencia de diferentes tipos de lipasas [8,12].
El uso de las lipasas del látex de C. papaya en la hidrólisis de triacilglicéridos (TAG), emerge como un método novedoso en la producción de materias primas crudas para la industria de los alimentos y la agroindustria en general, tales como diacilglicéridos, monoacilglicéridos, glicerol y AG libres [13].
En Colombia, la papaya se cultiva en gran parte del territorio nacional, con una producción aproximada de 116,000 toneladas anuales del fruto [14]; no obstante, existe una baja valorización de este cultivo; por tanto, la obtención de sub-productos de valor agregado, como las lipasas del látex, se constituiría en una oportunidad para fortalecer su cadena productiva.
En esta investigación se estudió el efecto de las variables de reacción, temperatura, pH y concentración de sustrato en la hidrólisis enzimática del AC usando como biocatalizador las fracciones P3 y CPL-p del látex de C. papaya.
MÉTODO
Extracción y caracterización del aceite de corozo B. guineensis
Los frutos del corozo obtenidos en fruteras cercanas al campus de la Universidad del Atlántico (10°59’32’’ N y 74°57’10’’ W), se secaron naturalmente a 30°C y 75% de humedad relativa durante 5 días. Se extrajeron las almendras y luego se pulverizaron en un molino de martillos para obtener una harina con tamaño de partícula de 500 micras. El aceite se obtuvo mediante extracción sólido-líquido con n-hexano 98% pureza (JT Baker), en un extractor soxhlet de 100 mL. Las extracciones se realizaron con 50 g de harina de corozo, 100 mL de n-hexano y 3 h de extracción. El AC obtenido fue parcialmente refinado mediante un proceso de desgomado, procedimiento descrito por Paisan [15].
El perfil de AG del AC y del aceite de referencia (oliva) (AO) Marca Carbonell ®, fueron determinados mediante cromatografía de gases acoplada a espectrometría de masas (CG-EM), de acuerdo con los protocolos descritos por la International Organization for Standardization ISO 5509 [16] e ISO 5508 [17]. Los resultados se expresaron en cantidades relativas (% p/p). El análisis se realizó en un cromatógrafo de gases TRACE 1310 equipado con una columna de acero inoxidable Rtx-1614® (15 m de longitud, 0,25 mm de diámetro interno y 0,1 µm de espesor), usando Helio como gas portador. Las condiciones de operación del equipo fueron: velocidad de flujo del gas de 1,5 mL/min, rango temperatura de 330-360°C; el gradiente de temperatura se inició en 100°C durante 4 min, luego se incrementó hasta 160°C a razón de 7°C/min durante 2 min; el incremento se mantuvo hasta una temperatura de 220°C durante 20 min. El volumen de inyección del aceite fue de 1 µL, con modo de inyección tipo Split. El sistema de detección consistió en un MS/MS TSQ™8000 Evo Triple Quadrupolo con temperatura lineal de transferencia de 300°C, fuente de iones a 200°C, modo de ionización por impacto de iones y rango de masas 50-400 masa/carga en modo de adquisición Full Scam. Se utilizó el software integrador (Xcalibur) para el procesamiento de los datos y como estándar FAME® 0053.
Obtención de fracciones del látex de C. papaya
El látex de C. papaya se recolectó durante los meses de julio y diciembre (época de lluvia), en cultivos localizados en el municipio de Sabanalarga, Atlántico (10°37’48’’ N y 74°55’25’’ W) al norte de Colombia (32°C y 84% humedad relativa), de acuerdo con el procedimiento descrito por Ortega et al. [18]. Los frutos seleccionados fueron los clasificados con grado de maduración 1 (fruto verde) y como no aptos para la comercialización, debido a la presencia de arrugas, deformaciones, ablandamiento o daños ocasionados por plagas e insectos (manchas, mordeduras, chupones) de acuerdo al “Protocolo de buenas prácticas para pos cosecha de papaya (Carica papaya L.)”, razón por la que se consideran un residuo agroindustrial [19]. Para la obtención del látex, se realizaron incisiones longitudinales al pericarpio del fruto con una profundidad de 2 a 3 mm [10]. El látex recogido se secó en frío (5ºC), en capas de 3 mm durante 5 días, obteniéndose una pasta dura, que fue pulverizada mediante maceración en mortero. El polvo fino resultante, correspondiente a P3 se almacenó a -20ºC. La fracción CPL-p se obtuvo a partir de P3, mediante lavados con agua destilada a 4°C (cinco lavados), seguidos de centrifugación a 10.000 rpm a 4°C durante 20 min [10,18] en un equipo Thermo Scientific, modelo Legend X1R. El precipitado insoluble en agua (fracción CPL-p) se liofilizó en un equipo SYCLON-18N a -48°C y 0,098 mbar, durante 72 horas. Ambas fracciones (P3 y CPL-p) se almacenaron a -20°C hasta su posterior uso.
Electroforesis en gel de poliacrilamida con dodecil sultafo sódico (SDS-PAGE)
Las fracciones P3 y CPL-p se caracterizaron mediante SDS-PAGE con un equipo Miniprotein Vertical QNX-700 (C.B.S. Scientific). Se prepararon dos geles, un gel de separación del 12% T y un gel concentrador del 4% C, según protocolo descrito por Sambrook y Russell [18]. Las muestras se sembraron en cada pozo (20 µL) a concentraciones de 5,0-2,5-1,25 mg/mL. El corrido electroforético se hizo a 120 V por 3 h; posteriormente, los geles se tiñeron con azul de Coomasie R-250 (Merck., S.A) durante 12 horas, luego se decoloraron en una solución de ácido acético al 10% v/v y se visualizaron en un equipo UVP Imaging Sys EC3410 LMS-26 97-0279-01 (Bio-Rad). Para determinar el peso molecular de las proteínas presentes en las muestras se corrió un marcador de peso molecular preteñido Precision Plus Protein™ Kaleidoscope™ (Bio-Rad., UDA).
Influencia de la temperatura y el pH en la AL de P3 y CPL-p
Diseño experimental. Un diseño de superficie de respuesta central compuesto con una estrella creado con el software Statgraphics Centurion XVI, fue aplicado para estudiar el efecto de la T y el pH sobre la AL de las fracciones del látex de C. papaya (P3 y CPL-p) en dos tipos de sustratos: AC y AO. Las variables y niveles del diseño experimental se presentan en el Cuadro 1. El diseño arrojó 12 combinaciones de experimentos o corridas para cada fracción (P3 y CPL-p), las cuales se realizaron por triplicado, para un total de 36 corridas (Cuadro 4).
Cuadro 1 Diseño de experimento central compuesto con una estrella con sus variables y niveles.
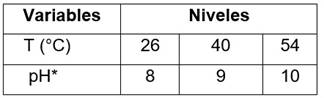
* El pH se ajustó con: Tris-HCl 0,1 M (pH 8-9) y NaHCO3 -/K2CO3 -2 0,1M (pH 10).
Actividad lipolítica. Se empleó el método de titulación de AG libres para medir la AL en solución acuosa de P3 y CPL-p. Inicialmente se preparó una emulsión compuesta por 1,25 g de AC; 1,25 g de agua destilada; 2 mL de solución tampón (de acuerdo al pH) y 0,125 g de Triton X-100 (Merck., S.A). También se preparó una emulsión con AO, para la cual se reemplazó el detergente Triton X-100 con goma arábiga (Merck., S.A) (7% p/p respecto a la cantidad de agua). El AO se usó como referencia debido a su contenido mayoritario de ácido oleico (C18:1), lo que evita que la enzima tenga preferencia por un ácido graso en específico [21].
La hidrólisis del aceite emulsificado se realizó en frascos erlenmeyer de 125 mL en un baño de maría con control de temperatura y movimiento recíproco Dubnoff TPA-304 (Ethik Technology). La velocidad de agitación se mantuvo constante en 200 rpm. Después de 10 min de agitación se agregó a la emulsión 0,05 g de la enzima. La mezcla se mantuvo en agitación constante durante 5 min, luego se agregó 10 mL de una solución de etanol: acetona: agua (1:1:1 v/v/v) para detener la reacción. Para la titulación de los AG libres se adicionó a la mezcla de reacción 10 mL de KOH 0,05 M y tres gotas del indicador fenolftaleína; la valoración se realizó con una solución estandarizada de HCl 0,05 M; además se incluyó un blanco de reacción por tratamiento (emulsión sin enzima). La AL de la lipasa fue calculada utilizando la ecuación 1:
Donde Vb y Va son el volumen de HCl (mL) gastado en el blanco y en el tratamiento respectivamente; M es la molaridad del HCl; t es el tiempo de incubación en (min) y ms es la masa seca de la lipasa en (g). La AL también se expresó en actividad relativa A r , de acuerdo a la ecuación 2.
Donde AL (U/g) es la actividad alcanzada en cada ensayo y ALmáx (U/g) es la actividad más alta.
Efecto de la T y pH sobre la estabilidad de P3 y CPL-p
Esta prueba tuvo como propósito identificar los valores de temperatura y pH a los cuales se logra mayor estabilidad en la AL de las fracciones P3 y CPL-p. Estas pruebas se realizaron con AO. Para determinar la estabilidad térmica, se mezclaron 0,05 g de cada fracción (P3 y CPL-p) con 2 mL de tampón Tris-HCl 0,1M (pH 9). La incubación se realizó a diferentes tiempos (0 min, 5 min, 30 min, 60 min y 24 h) y rangos de temperatura (30, 40, 50 y 60°C). Finalizado el tiempo de incubación, se adicionó 2,5 mL de la emulsión del aceite. La AL de cada tratamiento se midió a 37°C según la metodología descrita en la sección anterior. La estabilidad de P3 y CPL-p a diferentes valores de pH se determinó mediante incubación de 0,05 g de P3 y CPL-p con 2 mL del correspondiente tampón de acuerdo con el pH (Cuadro 2). La incubación se realizó a temperatura constante de 30ºC, durante diferentes tiempos (0 min, 5 min, 30 min, 60 min y 24 h). La AL se midió a 37°C usando la metodología descrita.
Determinación de los parámetros cinéticos de Michaelis-Menten
Los parámetros cinéticos de las reacciones catalizadas por P3 y CPL-p se ajustaron al modelo de Michaelis-Menten, el cual predice el comportamiento de la cinética de las lipasas de C. papaya. Este modelo relaciona la velocidad de una reacción enzimática con la concentración del sustrato y permite medir los parámetros KM, Vmax, Kcat y la relación Kcat/KM, los cuales son constantes específicas para cada enzima en condiciones definidas. Los parámetros cinéticos KM (constante de Michaelis), Vmax (velocidad de reacción alcanzada cuando la enzima se encuentra saturada por el sustrato) se determinaron a partir del ajuste de los datos experimentales mediante un procedimiento de regresión no lineal utilizando el software OriginLab Pro 8; para el cálculo de la Kcat (número de moléculas de sustrato que cada sitio activo de la enzima convierte por unidad de tiempo) se partió de la concentración total de enzima de 3,91x10-4 M, calculada con base en el peso molecular obtenido por SDS-PAGE, utilizando la ecuación 3 . Se prepararon diferentes concentraciones de sustrato (AC y AO) variando la proporción de AG totales en la emulsión entre 5,0-70% p/p (3x104 -5x105 µM). Las hidrólisis se realizaron a las condiciones de pH y temperatura más estables, determinadas en la sección anterior. Las velocidades iniciales de la reacción de hidrólisis fueron determinadas a partir de los resultados de la AL.
Donde Vmax es la velocidad máxima alcanzada por la enzima y
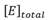 , es la concentración total de la enzima.
, es la concentración total de la enzima.
Análisis estadístico
Los resultados obtenidos en los diseños experimentales se analizaron en el software Statgraphics Centurion XVI. La significancia estadística de los datos fue determinada a partir del análisis de varianza (ANOVA) con un nivel de confianza del 95%, así mismo se usó la metodología de superficie de respuesta para determinar los valores de pH y T óptimos para la hidrólisis de P3 y CPL-p. Las gráficas de superficie fueron elaboradas usando el software OriginLab Pro 8.
RESULTADOS
Extracción y caracterización del aceite de corozo B. guineensis
El rendimiento de extracción fue de 39,99 ± 0,05% p/p; resultado similar al descrito en un estudio previo (39,35% p/p), utilizando n-hexano [1]. Los compuestos mayoritarios presentes en el aceite correspondieron a AGs de cadena mediana (C12:0 y C14:0), con una composición de 85,92 ± 0,21%; mientras que los AGs de cadena larga (C16:0 y C18:1) correspondieron al 14,10 ± 0,21% (Cuadro 3). En cuanto al grado de insaturación, un 93,05 ± 0,45% de los AGs fueron saturados; el ácido oleico (C18:1) fue el único ácido graso insaturado presente en el aceite (7,0 ± 0,40%). Basado en el perfil de AGs (Cuadro 3) se calculó la masa molar del AC, obteniendo un valor de 687,60 ± 0,47 g/mol.
Los resultados del perfil de AG del AO, demostraron que los compuestos mayoritarios corresponden a AG de cadena larga (C18:1 y C16:0) con una composición de 73,73 ± 0,20% y 15,04 ± 0,20% respectivamente (Cuadro 3).
Cuadro 3 Perfil de ácidos grasos de los aceites de corozo y de oliva.
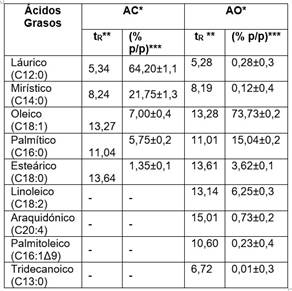
*AC: aceite de corozo; AO: aceite de oliva **Tiempo de retención (min) ***Cantidad relativa (media ± DE dos réplicas)
Obtención y caracterización electroforética de P3 y CPL-p
El látex de C. papaya se obtuvo de árboles cultivados en fincas de la zona rural del municipio de Sabanalarga, en el departamento del Atlántico. El rendimiento de obtención de la fracción P3 fue de 23,23 ± 1,14% p/p (respecto al látex fresco); mientras que para la fracción CPL-p fue de 9,29 ± 2,76% p/p. El análisis electroforético arrojó una banda de peso molecular cercano a 29 kDa, la cual podría corresponder a la lipasa del látex de C. papaya.
Influencia de la temperatura y del pH en la AL de P3 y CPL-p
La máxima AL de la fracción P3, usando AC, fue de 722,43 ± 1,92 U/g a 40°C y pH 9; con la fracción CPL-p fue de 518,65 ± 4,70 U/g a 54°C y pH 8. Cuando se usó AO, se obtuvo una AL máxima con la fracción P3 de 615,06 ± 19,53 U/g a 54°C y pH= 8; mientras que con la fracción CPL-p fue de 385,42 ± 8,30 U/g a 60°C y pH 9 (Cuadro 4). Se observó mayor AL de P3 y CPL-p usando AC, con excepción de la corrida 3 para la fracción P3 y las corridas 1 y 6 para la fracción CPL-p, donde la actividad fue mayor con el AO.
Cuadro 4 Resultados del diseño experimental de la AL (U/g) de las fracciones P3 y CPL-p.
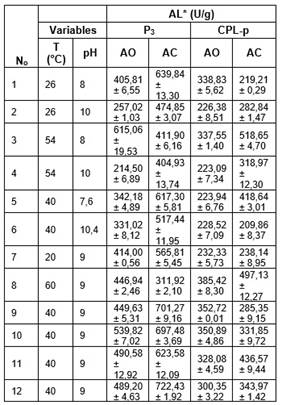
*valores medios ± DE de tres réplicas
La mayor selectividad de ambas fracciones por el AC podría explicarse por el alto contenido de AG de cadena mediana (64,20% C12 y 21,75% C14) que contiene. Este resultado es consistente con estudios previos, donde P3 mostró selectividad más alta por AG de cadena corta como la tri-butirina (C4) y mediana como la trioctanoina (C8), comparada con el AO [7,22]. Otra característica de las lipasas del látex de C. papaya es la estereoselectividad por las posiciones sn-1 y sn-3 (sn1/3) de los TAG. Se ha establecido que en los aceites de algunas palmas, los AG de cadena mediana se encuentran usualmente esterificados en las posiciones sn1/3, esta característica favorecería la selectividad de las lipasas de C. papaya por este tipo de aceites. Por ejemplo, el aceite de la palma de coco posee 54,3% de ácido láurico (C12) en las posiciones sn1/3 [23,24], mientras que el aceite de semilla de palma africana (palm kernel oil) posee 51,41% de C12 en las posiciones sn1/3 [23]. Al igual que en los aceites de estas palmas, el AC está compuesto principalmente por AG saturados de cadena mediana, que se encuentran usualmente esterificados en las posiciones sn1/3 del glicerol [23,24], esta característica favorecería la selectividad de P3 y CPL-p por este tipo de sustratos.
El ANOVA de los resultados mostró que la T influye significativamente en la AL de P3 (ANOVA: Razón-F = 113,35; valor-p = 0,0000) y CPL-p (ANOVA: Razón-F= 57,64; valor-p= 0,0000) con el AC. El pH también mostró efecto significativo en la AL de P3 (ANOVA: Razón-F= 25,76; valor-p= 0,0001) y CPL-p (ANOVA: Razón-F= 26,65; valor-p= 0,0001); así mismo, se observó efecto significativo de la interacción T-pH para ambas fracciones (valor-p < 0,005) con este sustrato.
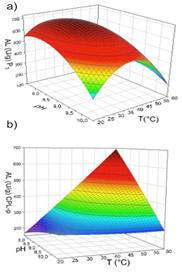
Los gráficos de superficie de respuesta muestran que T > 40°C, causan disminución de la AL de P3 sobre el AC (Figura 1a); mientras que la fracción CPL-p mostró mayor tolerancia a T > 40°C, alcanzándose la T óptima a 50ºC (Figura 1b).
El efecto de la temperatura sobre la actividad de las enzimas es bastante complejo, ya que a medida que esta incrementa, también lo hace la energía cinética de las moléculas y por lo tanto, la velocidad de reacción, alcanzando la temperatura donde la actividad es máxima (T óptima); después de este punto ocurre una inactivación progresiva causada por la desnaturalización de la enzima, resultando en la pérdida completa de la actividad [25].
Para el caso del látex de C. papaya se observó que las fracciones P3 y CPL-p presentaron T óptimas distintas, esto había sido descrito previamente [8,9] , reportando los mismos valores óptimos observados en el presente estudio (40ºC para P3 y 50ºC para CPL-p), lo cual supone la existencia de por lo menos dos tipos de lipasas en el látex.
Respecto al pH, la AL de P3 sobre el AC disminuyó a pH > 9,0 (Figura 1a); en el caso de CPL-p, la AL más alta se obtuvo a pH = 8 (Figura 1b). Para ambas fracciones, la actividad incrementó a partir de pH = 7,5 y decayó significativamente a pH > 9.
Estos resultados son consistentes con los reportados por Rivera et al. [10], quienes determinaron un pH óptimo de 8,5 con P3 y pH óptimo de 9 para CPL-p, lo que indica la presencia de más de una lipasa en el látex de C. papaya. La importancia del pH del medio sobre la actividad de las enzimas es ampliamente reconocida, encontrándose valores de pH donde la actividad es más alta (pH óptimo).
El pH del medio influye en el estado de ionización de las cadenas laterales de los aminoácidos y por tanto, en la estabilidad de los enlaces iónicos que contribuyen a mantener la conformación del sitio activo [26]; adicionalmente, el pH del medio también puede influir en las velocidades de reacción ya que este parámetro es muy sensible a los valores de pKa (constante de ionización) de los aminoácidos directamente involucrados en la catálisis [26,27,28].
De la misma forma, el efecto significativo de la interacción T-pH sobre la AL de P3 y CPL-p podría ser explicado con base en la sensibilidad de los pKa de las cadenas laterales de los aminoácidos a la temperatura; por ejemplo se ha determinado que aminoácidos básicos exhiben cambios relativamente grandes en su carga debido a la temperatura. Dado que los residuos ionizables de las cadenas laterales de los aminoácidos son importantes para mantener la conformación del sitio activo, un cambio de pKa impulsado por la temperatura puede tener un efecto directo significativo sobre la catálisis enzimática [29].
El ANOVA de los resultados con el AO, mostró que el pH tiene un efecto significativo en la actividad de P3 (ANOVA: Razón-F= 16,16; valor-p= 0,0009) y CPL-p (ANOVA: Razón-F = 6,74; valor-p = 0,0188). La T tuvo efecto significativo en la actividad de CPL-p (ANOVA: Razón-F= 6,23; valor-p= 0,0231); pero no en la actividad de P3 (ANOVA: Razón-F=2,30; valor-p=0,1475), esto puede atribuirse, a que P3 posee una composición química más compleja, donde además de las lipasas, existen otras enzimas solubles y macromoléculas en la matriz, dificultando la medición del efecto real de la temperatura sobre la actividad catalítica de las lipasas [30]. Además, se observó un efecto cuadrático del pH sobre P3 (ANOVA: Razón-F= 16,77; valor-p= 0,0008) y CPL-p (ANOVA: Razón-F= 17,71; valor-p= 0,0006). La interacción T-pH sólo afectó a la fracción P3 (ANOVA: Razón-F= 6,42; valor-p= 0,0215).
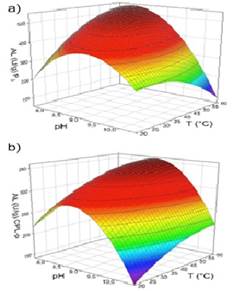
Los gráficos de superficie de respuesta para AO (Figura 2) muestran el efecto de curvatura del pH sobre la AL de las fracciones P3 y CPL-p, obteniéndose pH óptimos de 8 y 8,7 respectivamente. Por el contrario, no se observó un efecto marcado de curvatura en el rango de T evaluadas, razón por la cual fue difícil establecer una T óptima a través del modelo de superficie de respuesta, para este sustrato. A pesar de esto, se pudo observar que la AL de P3 disminuye progresivamente a partir de 30ºC hasta llegar a la actividad más baja a los 60ºC (Figura 2a). En el caso de CPL-p se observó un comportamiento contrario, con un aumento progresivo de la AL a partir de 20ºC (Figura 2b)
Efecto de la T y pH sobre la estabilidad de P3 y CPL-p
Los resultados de los ensayos de estabilidad térmica de P3 y CPL-p, muestran que la AL decae significativamente luego de 5 min de incubación (valor p < 0,0327), en todos los valores de T evaluados. La fracción P3 mostró disminución del 22,67% y 13,66% de la actividad a 30°C y 40°C, respectivamente; sin embargo, la actividad fue significativamente menor a 50°C (30,58%) y 60°C (56,61%). Los resultados con CPL-p mostraron una menor reducción de la AL en comparación con P3 (4,43% entre 30 - 40ºC; 13,65% a 50ºC y 35,13% a 60°C). Después de 24 h de incubación, la actividad de ambas fracciones continuó disminuyendo, observándose una reducción de hasta el 48,74% de la actividad para P3 a 50ºC y de 41,42% en la actividad de CPL-p a 50ºC. Estos resultados confirman que la fracción CPL-p posee mayor estabilidad térmica, particularmente entre 30°C y 40°C. Una posible explicación, es que CPL-p se encuentra inmovilizada en la matriz insoluble del látex, lo cual le proporciona mayor estabilidad [8].
Los ensayos de estabilidad de las fracciones P3 y CPL-p en los pH estudiados mostraron mayor estabilidad a pH 9 entre 5 - 60 min de incubación. Después de 24 horas de incubación, las actividades de P3 y CPL-p decayeron un 21,27 y 39,36% de su valor inicial.
Determinación de los parámetros cinéticos de Michaelis-Menten
Para determinar los parámetros cinéticos de las fracciones P3 y CPL-p, las reacciones lipolíticas se llevaron a cabo a los valores de pH y temperatura más estables (T= 40ºC y pH=9).
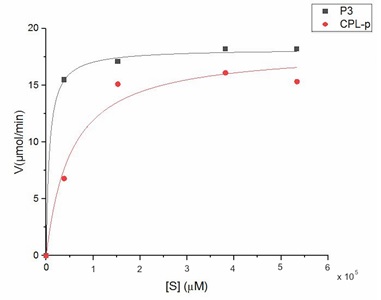
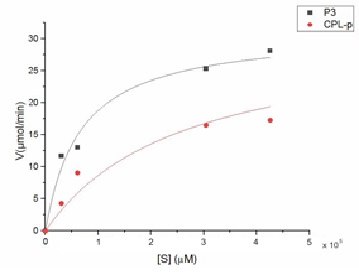
Las Figuras 3 y Figura 4 presentan la cinética de la hidrólisis de ambos sustratos, catalizada por la lipasa presente en la fracción P3 y CPL-p del látex de C. papaya. La velocidad máxima (Vmax) de reacción con el AC (18,66 ± 0,5 µmol/min) fue significativamente menor a la obtenida con el sustrato AO (32,30 ± 0,6 µmol/min) (Cuadro 5), del mismo modo, se evidenció que con CPL-p la Vmax con AC (16,58 ± 0,1) fue menor a la obtenida con AO (20,16 ± 0,3); esta se alcanza cuando la enzima se encuentra saturada por su sustrato, por lo que un aumento en la concentración del sustrato después de este punto no ocasionará incremento en la velocidad de reacción.
La constante de Michaelis-Menten (KM) fue otro parámetro evaluado, esta es una medida de la afinidad de la enzima por el sustrato, y corresponde a la concentración del sustrato en la cual la velocidad de reacción es igual a la mitad de la Vmax [13].
Para el caso de P3, el valor del KM para el sustrato AC (1,3x104±1,3x103 µM) fue 5,54 veces menor al obtenido con el sustrato AO (7,2x104±5,4x103) (Cuadro 5), lo cual indica que la lipasa en P3 presenta mayor afinidad por el AC. Resultados similares fueron obtenidos en la cinética de reacción de la lipasa presente en la fracción CPL-p de C. papaya (Figura 4), obteniéndose valores de Vmax y KM que son 1,22 y 2,85 veces menores en el AC (Vmax = 16,58 ± 0,1 µmol/min; KM = 2,6x104±1,1x103 comparado con el AO (Vmax = 20,16 ± 0,3 µmol/min; KM = 7,4x104± 5,9x103 (Cuadro 5).
Para establecer la eficiencia de las lipasas presentes en las fracciones P3 y CPL-p se calculó el valor de la Kcat (número de recambio) y la relación de la Kcat/KM (Cuadro 5).
Cuadro 5 Parámetros cinéticos de las fracciones P3 y CPL-p.
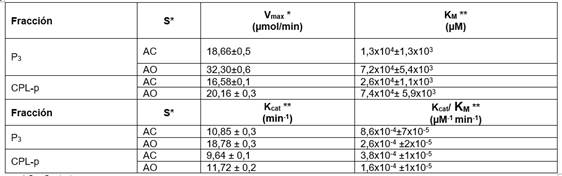
* S = Sustrato **Valores de la media ± desviación estándar de tres réplicas
La fracción P3 presentó la relación Kcat/ KM más alta cuando el sustrato utilizado fue AC (8,6x10-4±7x10-5 µM-1. min-1), mientras que la relación más baja la presentó la fracción CPL-p con AO (5,38 veces menor). Estos resultados indican que P3 posee la mayor eficiencia catalítica a 40ºC y pH = 9 y confirma la afinidad de esta fracción por el AC, lo cual podría estar relacionado con la mayor composición de este aceite en AG de cadena mediana como los ácidos láurico (64,20 ± 1,1%) y mirístico (21,75 ± 1,3%). Así mismo, esto confirma lo reportado en otros estudios, donde la fracción cruda posee alta AL en TAG de cadena corta y media, comparado con TAG de cadena larga, como es el caso de la mayoría de las lipasas [9].
CONCLUSIONES
En esta investigación se determinó la capacidad hidrolítica de las fracciones P3 y CPL-p sobre los AG presentes en el AC, evidenciando que P3 posee mayor AL comparada con CPL-p. Además, la temperatura y el pH afectan de manera significativa la AL de ambas fracciones, presentando diferentes valores de T y pH óptimos. Según los valores de Km obtenidos, P3 presentó mayor afinidad por el AC en comparación con CPL-p, debido a la alta composición de AG de cadena mediana que contiene y a la estereoselectividad de las lipasas por esa clase de AGs. Los frutos verdes no comercializables de C. papaya y los residuos de la almendra del corozo tienen un enorme potencial para ser revalorizados mediante el aprovechamiento de estas materias primas no convencionales, con el propósito de fortalecer las cadenas productivas de estos cultivos en el país.