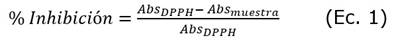INTRODUCCIÓN
Muchos de los metabolitos secundarios que producen las plantas presentan actividad biológica, por lo tanto se pueden usar con fines medicinales [1-4]; es así como han hecho parte de la historia de, quizá, todos los grupos étnicos. Actualmente muchas comunidades, indistintamente de si pertenecen a un grupo étnico determinado o no, utilizan las plantas para el tratamiento de una amplia diversidad de dolencias, enfermedades o para controlar los síntomas asociados a las mismas. Pese a que en el departamento de La Guajira (Colombia) la comunidad Wayúu y su legado tienen una alta influencia como resultado de sus prácticas culturales, el conocimiento y utilización de especies vegetales con fines medicinales está disminuyendo, debido, por lo menos en parte, al poco conocimiento de su diversidad biológica. Adicionalmente, los trabajos etnobotánicos son escasos, lo que a su vez limita la proyección de utilización de la biodiversidad vegetal en beneficio de la población del departamento, la región y el mundo.
Históricamente todas las preparaciones medicinales han derivado de especies vegetales [5], ya sea utilizando partes de la planta o extractos crudos de las mismas. Hoy día, muchos medicamentos son desarrollados a partir de plantas que presentan bioactividad y en la mayoría de los casos se requiere el aislamiento de los mismos y su posterior modificación. En la medicina moderna, las plantas son usadas como fuente directa de agentes terapéuticos, modelos para nuevos compuestos sintéticos y como marcadores taxonómicos para el descubrimiento de nuevos compuestos [6]. Las batatillas (Convolvulaceae) son plantas forrajeras que podrían aprovecharse en la obtención de sustancias bioactivas [7-10]; no obstante, a estas plantas se les considera hierbas invasoras de terrenos no ocupados e incluso han sido reportadas como arvenses y nocivas para el ganado [11-13], desestimando su valor ecológico, nutricional o medicinal.
La obtención de nuevas sustancias para el tratamiento de diversas enfermedades es limitada y la información básica para la elaboración de fármacos menos costosos y con menos efectos secundarios es aún escasa y requiere de la evaluación de materiales que puedan producir de manera sostenida grandes cantidades de compuestos activos de manera controlada. A pesar de que existen metodologías para la extracción y cuantificación de polifenoles a partir de distintos órganos vegetales [14-20] la concentración de este tipo de sustancias depende mucho de la variedad, la fenología, la localización geográfica y la época de colecta, además el contenido de metabolitos secundarios es variable entre una planta y otra, aunque pertenezcan a la misma variedad [6,21]. En este sentido, varias especies del género Merremia han sido objeto de investigación en relación con el contenido de polifenoles y su potencial antioxidante, tal es el caso de M. borneensisMerr. [22], M. hederacea (Burm. f.) Hallier f., M. gangitica (L.) Cufo. [23], M. emarginata (Burm. F.) Hall. F. [24], M. mammosa (Lour.) Hallier f. [25] y M. umbellata(L.) H. Hallier [26]. Así mismo, el uso tradicional de M. aegyptia como antidiabético, cicatrizante, antimicrobiano y antitumoral ha sido reportado [6], lo cual puede estar relacionado con su contenido de polifenoles.
La concentración de fenoles en tejidos vegetales se ha utilizado como indicador del grado de resistencia al estrés [27] y específicamente a los polifenoles se les ha atribuido propiedades medicinales entre las que se destacan su actividad antialergénica, antioxidante, anticancerígena, antihiperglicémica, antimicrobiana y antiinflamatoria [28-32], esto indica la necesidad de conocer los beneficios de la biodiversidad vegetal presente en el territorio guajiro con miras a un mejor aprovechamiento, y aunque una revisión bibliográfica podría mejorar el conocimiento sobre la utilización de las especies vegetales presentes en la región, la proyección de futuras investigaciones y la obtención de bioproductos de interés comercial sólo se logrará con la realización de trabajos que permitan identificar los metabolitos que estas especies producen y qué factores ambientales influyen sobre la producción de este tipo de sustancias. La especie objeto de estudio de la presente investigación tiene la ventaja adicional de estar totalmente adaptada a ecosistemas áridos [33,34], lo que implica disponibilidad de material para trabajar, en caso de comprobarse la alta producción de sustancias bioactivas bajo las condiciones ambientales de La Guajira.
Con la presente investigación se buscó estimar el potencial antioxidante de los extractos foliares de M. aegyptia y determinar las variaciones en la concentración de polifenoles atendiendo a los periodos climáticos regentes en región Caribe colombiana y a la fenología de la especie. La información generada soporta las bases para proponer el cultivo de M. aegyptia, así como la posibilidad de estimar la mejor época de cosecha considerando el contenido de polifenoles en las hojas y de esta manera aprovechar la disponibilidad de suelos que por su aridez no permiten el establecimiento de cultivos convencionales.
MÉTODO
Muestreo y definición de los periodos climáticos
Se tomaron muestras de plantas de M. aegyptia, visiblemente sanas y sin signos de herbivoría que crecían en estado silvestre en un área urbana del municipio de Riohacha (La Guajira), en las coordenadas 11°32'15,7'' de latitud Norte y 72°53'36,7'' de longitud Oeste, con una temperatura promedio de 29,24 ± 1,31°C y humedad relativa de 72,75 ± 4,11%. Las muestras consistieron de hojas procedentes de la parte media de los tallos, las cuales fueron tomadas mensualmente durante un año, en el periodo comprendido entre septiembre de 2017 y agosto de 2018. Con el fin de establecer la concentración de polifenoles en otros órganos, en el mes de marzo de 2018 se colectaron flores completas (incluían todos los órganos florales) y frutos maduros, en perfecto estado, procedentes de las plantas objeto de estudio. Posterior a la colecta, las muestras se trasladaron inmediatamente al Laboratorio de Calidad Ambiental de la Universidad de La Guajira (Riohacha, Colombia), donde fueron procesadas para la obtención de extractos vegetales.
Durante el periodo de estudio se registraron los cambios fenológicos que presentaron las plantas objeto de estudio y se establecieron tres estadíos fenológicos: Crecimiento vegetativo (ausencia de estructuras reproductivas), Floración (desde la aparición de las primeras yemas florales hasta la aparición de los primeros frutos) y Fructificación (a partir de la aparición de los primeros frutos). Los periodos climáticos fueron definidos utilizando los reportes históricos y los datos climatológicos (precipitación y temperatura) correspondientes al periodo evaluado en la presente investigación, publicados por el Instituto de Hidrología, Meteorología y Estudios Ambientales IDEAM [35].
Adicionalmente, se tomaron por duplicado muestras del horizonte A del suelo adyacente a las plantas y se hicieron determinaciones de los siguientes parámetros: densidad aparente (método núcleo), textura (Boyucos), humedad gravimétrica (gravimetría), estructura (manual), retención de humedad a 0,33 atm (plato de Richards), pH (potenciométrico), conductividad eléctrica (conductímetro); siguiendo los protocolos de la sección de física de suelos del laboratorio de Ciencias Ambientales de la Universidad de La Guajira. Al finalizar el muestreo las raíces de las plantas evaluadas fueron extraídas y medidas en miras a asociar las estrategias adaptativas de la especie para superar el déficit hídrico con el contenido de polifenoles.
Obtención de los extractos foliares
Hojas procedentes de tres plantas de M. aegyptia fueron secadas en horno durante 48 h a 40°C, posteriormente se maceraron independientemente en nitrógeno líquido a temperatura de laboratorio (24 ± 1°C), por aproximadamente 5 min, hasta obtener un polvo fino. Se pesó 1 g de cada pulverizado y se les adicionó 10 mL de metanol al 96%, se dejó actuar por 2 horas y se filtró utilizando papel filtro Whattman N°4, siguiendo la metodología descrita en trabajos previos [36]. Los extractos así obtenidos fueron utilizados en los ensayos posteriores.
Cuantificación de polifenoles totales
La cuantificación de polifenoles se hizo de acuerdo con lo establecido por la IAEA [37], utilizando un espectrofotómetro UV-Vis Hach DR 5000. Los límites de detección y cuantificación del equipo fueron estimados como se describe en la guía tripartita armonizada de la International conference on harmonisation of technical requirements for registration of pharmaceuticals for human use [38], mediante el método basado en la desviación estándar del blanco y la pendiente de una curva de calibrado de ácido gálico construida para tal fin.
Se tomaron tres alícuotas de 21 µL de cada extracto y se depositaron en tubos de ensayo, de manera independiente se les adicionó agua destilada hasta un volumen de 1,25 mL, se les adicionó 625 µL del reactivo de Folin-Ciocalteu, se dejaron reposar por 10 minutos y luego se les adicionó 3,125 mL de solución de Na2CO3 al 20%. La mezcla en los tubos de ensayo fue agitada en vortex hasta homogenizar, después de dos horas se midió la absorbancia a 760 nm. Los valores de absorbancia se utilizaron para establecer la concentración de polifenoles totales utilizando la ecuación de la curva de calibración (y = 0,0458x + 0,0092; R2= 0,9998) y el contenido de estas sustancias se expresó en porcentaje sobre una base de masa seca (1 g de tejido pulverizado), como equivalente de ácido gálico (%EAG). Los órganos reproductivos fueron procesaron de manera similar al tejido foliar.
Actividad antioxidante
La actividad antioxidante de los extractos se determinó mediante el método del DPPH [1], como se describe a continuación. Se tomaron cinco alícuotas de 100 µL de cada extracto y se mezclaron, independientemente, con 3,9 mL de una solución de 1,1-Difenil-2-picrílhidrazilo (DPPH) a una concentración de 60 µmol, recién preparada en metanol al 96%; la mezcla se incubó a temperatura de laboratorio (24 ± 1°C) en la oscuridad y se midió la absorbancia a 515 nm a los 0 y 30 minutos de reacción. Se utilizó metanol al 96% como control negativo y soluciones de ácido ascórbico a la misma concentración de polifenoles totales estimada en los extractos como control positivo. Los porcentajes de inhibición del radical DPPH se calcularon de acuerdo con la ecuación 1[39]:
Dónde: AbsDPPH es la absorbancia del control negativo a t = 0 minutos y Absmuestra es la absorbancia de las muestras a t = 30 minutos.
Procesamiento de datos y análisis de la información
Todos los ensayos se ajustaron a un diseño completamente aleatorizado. Los datos correspondientes a la concentración mensual de polifenoles y actividad antioxidante fueron tabulados y graficados en Microsoft Excel®, analizados con ANAVA y las medias fueron separadas mediante el test de Duncan. La relación entre la fenología y el contenido de polifenoles se estableció comparando las variaciones en la concentración mensual de estas sustancias contra el estadío fenológico de las plantas en el mismo periodo; por su parte, la concentración mensual de polifenoles fue correlacionada con la temperatura media mensual y las precipitaciones mediante el coeficiente de correlación de Pearson. Todos los análisis estadísticos fueron realizados utilizando el paquete de análisis estadístico SAS® v. University.
RESULTADOS
Fenología de las plantas, características del suelo y periodos climáticos
Durante el periodo de estudio las plantas evaluadas presentaron la siguiente fenología: Crecimiento vegetativo, de septiembre a mediados de diciembre de 2017; Floración, mediados de diciembre de 2017 hasta mediados de enero de 2018. El estadío de Fructificación se dio desde mediados de enero de 2018 y se prolongó con la presencia simultánea de flores durante el resto del tiempo contemplado en la investigación (agosto de 2018). Los cambios fenológicos coinciden con los descritos para dicha especie [34], resaltando que esta planta, propia de ambientes secos, florece y fructifica mayoritariamente durante los meses de octubre a enero y en menor grado en otros meses del año por influencia de las precipitaciones. Sin embargo, no fue posible establecer la relación entre el contenido de polifenoles y la fenología de las plantas, ya que la concentración de polifenoles varió indistintamente del estadio reproductivo de las plantas, por lo que se consideró que la producción de este tipo de sustancias se ve afectada mayoritariamente por las variables ambientales y no por el estadio fenológico.
El análisis del suelo adyacente a las plantas reveló una densidad de 1,45 g/cm3, lo que indica un alto grado de compactación que puede conllevar a dificultades para la circulación del agua y el desarrollo de raíces; la estructura blocosa angular con desarrollo moderado a fuerte y bloque de tamaño medio de 19 mm es típica en suelos donde la actividad biológica y la materia orgánica no tienen gran influencia como factor formador; la textura franco limosa con contenidos de arcilla de 26,5%, limo del 37%, y arena del 36,55 es coherente con el grado de estructura presente y la baja conductividad y retención hídrica, reflejada en una humedad gravimétrica del 4,96% que indica un déficit hídrico alto y la baja capacidad de retención de humedad a 0,33 atm (11,3%); también, se evidenció alcalinidad (pH 8,48) y baja conductividad eléctrica (1156 µS). Las características predominantes son congruentes con lo reportado para los suelos de la zona [40] y en su conjunto estos parámetros edáficos pueden representar condiciones estresantes para el desarrollo vegetal, más aún bajo las condiciones climáticas predominantes. Por su parte, las raíces de las plantas utilizadas durante la investigación tuvieron una longitud promedio de 163,9 cm (±40,46 cm) y se extendieron hasta una profundidad de 75,5 cm (±14,08 cm).
En cuanto a los periodos climáticos, hubo correspondencia entre el régimen de lluvias evidenciado durante el periodo evaluado y los registros históricos [35], presentándose dos periodos lluviosos: el primero se extendió desde el mes de septiembre hasta noviembre de 2017, siendo octubre y noviembre los meses con mayores precipitaciones (180 y 164 mm, respectivamente) con algunas lluvias esporádicas en el mes de diciembre. Durante este primer periodo se obtuvo un acumulado de 399 mm, concentrando la mayor precipitación del año. El segundo periodo de lluvias se dio entre los meses de abril a junio de 2018, siendo las lluvias menos intensas y abundantes (43,7 mm en total). Los periodos secos se dieron durante los meses de enero, febrero, marzo, julio y agosto de 2018, destacándose por precipitaciones muy bajas (entre 0,5 mm en el mes de marzo de 2018 y 16,3 mm en el mes de agosto del mismo año) y temperaturas más altas durante los meses de julio y agosto (31,22 ± 0,01°C). No obstante lo anterior, se resalta que el terreno adyacente al sitio donde crecieron las plantas objeto de estudio permaneció inundado por varios meses (octubre de 2017 a enero de 2018), evento que fue atribuido a las características físicas del suelo, las cuales dificultaron la conductividad hidráulica que permitiera la percolación del agua del período lluvioso (septiembre - noviembre de 2017), lo que pudo haber influido en la concentración de polifenoles en algunos meses de la temporada seca.
Concentración de polifenoles totales en los extractos foliares
El límite de detección del espectrofotómetro utilizado fue estimado en 0,41 ppm y el límite de cuantificación en 1,24 ppm.
Los resultados obtenidos evidenciaron que la concentración de polifenoles en M. aegyptia varían de un mes a otro durante todo el año y el análisis estadístico de los datos corroboró la existencia de diferencias significativas en el comportamiento de esta variable durante el periodo evaluado (p˂ 0,0001). Se registró un incremento paulatino en la producción de polifenoles totales desde los meses de septiembre de 2017 (0,32% EAG) a enero de 2018 (6,03% EAG); posteriormente se evidenció un descenso en la concentración de estas sustancias durante los meses de febrero y marzo de 2018 (1,24% EAG en ambos meses), seguido de un leve aumento durante los meses de abril a junio de 2018 (2,02 a 2,52% EAG), disminuyendo nuevamente durante los meses de julio y agosto (1,62 y 1,42% EAG, respectivamente) (figura 1).
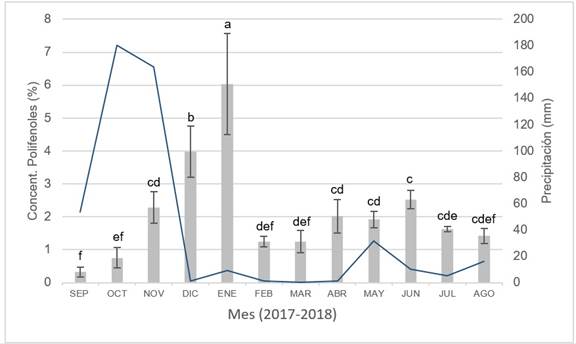
Figura 1. Variación mensual del contenido promedio de polifenoles totales (%) en M. aegyptia (barras ± la desviación estándar). La línea continua muestra la precipitación mensual (mm).Letras diferentesindican diferencias estadísticamente significativas entre el contenido de polifenoles (α = 0,05).
Debido a que en los meses de diciembre de 2017 y enero de 2018 se evidenció la mayor concentración de las sustancias de interés (siendo estos parte de uno de los periodos secos del año y se esperaba que la concentración de polifenoles en las plantas evaluadas disminuyera), no se encontró correlación significativa entre el contenido de polifenoles y el régimen de lluvias (r= -0,2676; p=0,4004). Aun así, varios trabajos de investigación señalan la relación existente entre estas dos variables y se considera coherente con los resultados de la presente investigación teniendo en cuenta que había agua acumulada en el suelo durante los primeros meses del periodo seco. De igual manera, no se evidenció correlación entre la temperatura mensual promedio y la concentración mensual de polifenoles (r= -0,1836; p=0,5678).
El incremento en el contenido de polifenoles desde el mes de noviembre de 2017 hasta enero de 2018 se atribuyen, por un lado, a las lluvias relativamente frecuentes durante los meses de septiembre a noviembre de 2017, así como a la inundación del área colindante con el sitio donde crecían las plantas, la cual se mantuvo desde el mes de octubre de 2017 hasta entrado el año 2018, posiblemente como consecuencia de las características físicas del suelo. Como se indicó en párrafos anteriores, los meses de diciembre a febrero corresponden históricamente al periodo seco; sin embargo, el alto contenido de polifenoles en estos meses se considera que estuvo influenciado por la acumulación de agua en la superficie del suelo y su lenta infiltración como consecuencia de la compactación del mismo. Sumado a su poca estructura (debida a la falta de materia orgánica), los bloques que conforman este suelo presentaron resistencia a romperse y tuvieron un grado fuerte de desarrollo, características que dificultan la capacidad de las raíces de las plantas para explorar horizontalmente; no obstante, las raíces presentaron una longitud considerable y una penetración suficiente como para acceder al agua contenida en estratos bajos del suelo, lo cual proporcionó mayor cantidad de agua a estas plantas, incrementado la producción de polifenoles.
Se ha descrito el efecto de la cantidad de agua disponible para las plantas sobre la producción de polifenoles en Camellia sinensis L. [41], encontrando que el aumento en el contenido de agua en el suelo tiene una relación directamente proporcional con la concentración de polifenoles, variando desde 12% en suelos con el menor potencial hídrico (14% de contenido de agua) hasta 25% en los suelos con mayor potencial hídrico (38% de contenido de agua). Estos hallazgos fueron soportados en el hecho de que al ser el agua uno de los insumos de la fotosíntesis, afecta la producción de sustancias orgánicas en la planta, entre estas los metabolitos secundarios. Los resultados en mención coinciden con los obtenidos en Olea europaea L.Cv.Cobrançosa (un genotipo bien adaptado a ambientes con bajo suministro anual de agua), donde se evidenció que la deficiencia de agua disminuye el contenido de polifenoles, siendo muy evidente en condiciones de secano (disminución en el contenido de polifenoles totales de 61,3 a 15,7 mg EAG g−1) [42].
Los menores contenidos de polifenoles en M. aegyptia durante los meses de septiembre-octubre de 2017 y febrero-marzo de 2018 sugieren una respuesta a la falta de agua en los meses de sequía que los precedieron (julio - agosto y diciembre-enero, respectivamente), disminuyendo la producción de compuestos fenólicos. Así mismo, el incremento en la concentración de estas sustancias en los meses de abril a junio de 2018 coincide con las lluvias registradas en este periodo. La influencia de la variación estacional sobre el contenido de polifenoles en hojas de I. batatas ha sido establecida [43], hallando que la concentración de éstos disminuye durante el verano e incrementaba nuevamente después de dicha estación. Así mismo, se halló una concentración promedio de polifenoles de 6,9%, lo cual contrasta con lo encontrado en la presente investigación al obtenerse una producción promedio de 2,11% EAG en M. aegyptia. No obstante, en el trabajo anteriormente citado no se correlacionó la disponibilidad de agua para las plantas con la producción de polifenoles, en su lugar se encontró que esta variable se correlacionaba directamente (y de forma negativa) con la temperatura ambiental, lo cual difiere con los resultados de la presente investigación, donde no se evidenció correlación entre estas variables.
M. aegyptia es una especie adaptada a condiciones de aridez, por tanto se esperaba que mantuviera altos contenidos de polifenoles como estrategia contra el estrés ambiental, como ha sido evidenciado en Achillea pachycephala y Sesamum indicum [44,45], donde se encontró que la concentración de polifenoles incrementa a medida que las plantas se exponen a mayores niveles de estrés hídrico. Por otro lado, en Brassica rapa [46] se encontró que el estrés hídrico disminuye la concentración de polifenoles de forma leve, lo cual deja en evidencia que el genotipo influye sobre esta respuesta fisiológica. Los trabajos realizados sobre las especies anteriormente citadas reportan que los flavonoides decrecen bajo condiciones de estrés, mientras que los ácidos caféico y clorogénico incrementan, coincidiendo con los resultados obtenidos en Cynara cardunculus [47].
Se ha establecido que el estrés hídrico incrementa el contenido de polifenoles totales en Amaranthus tricolor, (una especie adaptada a dicho estrés) [48] y existen reportes de la producción variable de polifenoles en especies que crecen en un ecosistema árido de Brasil; oscilando entre 2,5% (Macroptilium lathyroides (L) Urban) y 22,0% (Stylosanthes humilis Kunth) [49], lo que supone la influencia del genotipo y las adaptaciones al estrés sobre el comportamiento de esta variable. También se reporta una producción de polifenoles de 6,1% en M. aegyptia, valor similar al encontrado en el presente trabajo para esta especie en el mes de enero de 2018 bajo las condiciones ambientales de La Guajira; sin embargo, debe tenerse en cuenta que los datos tomados en los trabajos aquí citados son puntuales y no consideran una línea de tiempo, lo que no permite evidenciar variaciones en el contenido de estas sustancias. Así, la diferencia en el contenido de polifenoles durante el resto del año puede deberse a las variaciones en las condiciones ambientales a las que estuvieron sometidas las plantas y corresponden con los periodos climáticos.
El contenido de polifenoles totales en seis genotipos de I. batatas fue analizado, encontrando que la concentración de éstos fluctuó entre 12,18 y 16,17% [14]. Posteriormente, se indicó que en esta misma especie el contenido de polifenoles varía entre 6,3 y 13,5% (dependiendo del genotipo) [36], valores que distan de los hallados en el presente trabajo; no obstante, debe resaltarse que M. aegyptia crece abundantemente en suelos marginales del territorio guajiro, por lo que aun así representa un buen insumo para la producción de antioxidantes que merece ser estudiada a fondo con fines de aprovechamiento. Además, las propiedades medicinales de M. aegyptia y otras especies relacionadas han sido reportadas, destacándose su utilización como antimicrobiano, diurético, tratamiento de quemaduras en la piel y trastornos del hígado [2,50,51], bioactividad que también ha sido asociada con la presencia de polifenoles.
La concentración promedio de polifenoles en flores fue de 7,4% (±1,05), mientras que la concentración de estas sustancias en los frutos estuvo por debajo del límite de detección del equipo. En relación con la concentración de polifenoles en tejido foliar en el mes de marzo de 2017 (1,24 ±0,34%), las flores presentaron contenido de polifenoles 5,94 veces superior. La diferencia en el contenido de polifenoles en hojas y flores sugieren que los polifenoles producidos en las hojas son traslocados a las flores donde desempeñarán funciones relacionadas con la atracción de polinizadores o evitar la florivoría [52,53]. A su vez, la mayor concentración de polifenoles en flores explicaría, en parte, los valores marcadamente más bajos de estas sustancias en las hojas durante los estadios de floración y fructificación.
Actividad antioxidante
Los resultados de la presente investigación mostraron que la capacidad antioxidante de los extractos foliares de M. aegyptia (85,15%) es superior a la del ácido ascórbico (38,65%), lo cual es atribuido a la concentración de polifenoles en los mismos. El análisis estadístico de los datos permitió establecer diferencias estadísticamente significativas en el porcentaje de inhibición del radical DPPH para las sustancias evaluadas (p < 0,0001) (Cuadro 1).
Cuadro 1 Actividad antioxidante de extractos de M. aegyptia sobre una solución de DPPH (60 µmolar). Los valores en cada celda representan la media de cada tratamiento ± la desviación estándar.
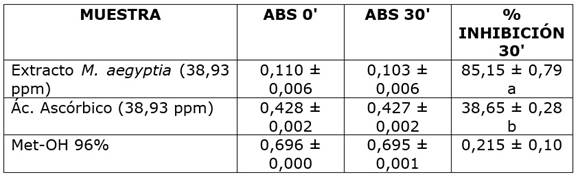
Letras diferentes indican diferencias estadísticamente significativas entre los porcentajes de inhibición de las sustancias evaluadas sobre el radical DPPH (α = 0,05).
Los resultados tabulados en el Cuadro 1 son similares a los obtenidos en trabajos previos [23], donde se reporta la inhibición del radical DPPH en un 60,31% utilizando extractos foliares de M. gangitica, haciendo énfasis en que la actividad antioxidante de los extractos fue superior a aquella obtenida con soluciones de ácido ascórbico a 100 µg mL-1, lo cual fue relacionado con la concentración de polifenoles en los extractos. Así mismo, se ha obtenido correlación positiva alta (R2=0,907) entre la concentración de polifenoles en extractos foliares de I. batatas y la actividad antioxidante de los mismos [36], lo que coincide con otros reportes [39,54,55,56], donde se señala la relación entre un mayor contenido de compuestos fenólicos y la alta actividad antioxidante de extractos vegetales. Por otra parte, la relación directa entre el contenido de derivados de ácidos fenólicos y flavonoides con la actividad antioxidante de extractos crudos de M. borneensis ha sido argumentada (hasta un 80% de inhibición del radical DPPH, utilizando 100 µg de extracto) [22].
No obstante lo anterior, se hace necesario conocer el tipo y concentración individual de los compuestos fenólicos presentes en los extractos más que la concentración total de éstos, ya que este grupo de sustancias es bastante amplio y varios autores [1,43,57] han señalado la presencia de derivados del ácido cafeoilquinico, ácido gálico, ácido cinámico, ácido ferúlico, eriocitrina, hesperidina, ácido rosmarínico y metil-rosmarenato en extractos vegetales, todos ellos con diferente potencial antioxidante. De igual manera, se ha encontrado diferencias en la actividad antioxidante al evaluar fracciones de los extractos de M. borneensis [22], lo que refuerza la idea anterior. Por otro lado, se encontró que en I. batatas la composición y concentración de polifenoles individuales varía entre genotipos de la misma [14], lo cual podría presentarse a nivel individual y que también es susceptible de estar influenciado por variables ambientales.
Aunque algunos autores consideran que los polifenoles son las sustancias con las mayores propiedades antioxidantes en organismos vegetales [36,58], otros reconocen que estos compuestos no son los únicos fitoconstituyentes en un extracto vegetal que pueden inhibir radicales libres [39]. Sobre este hecho, se ha señalado que aparte de los polifenoles, la vitamina E, el ß-caroteno y la luteína pueden contribuir a la inhibición de radicales libres en extractos foliares de I. batatas [36], por lo que no podría descartarse que otras sustancias presentes en los extractos de M. aegyptia hayan contribuido a los resultados obtenidos. Sin embargo, también debe considerarse que la actividad antioxidante de los extractos vegetales (y por extensión el de otras sustancias) puede estar influenciada por los diferentes mecanismos de inhibición de radicales libres que presentan las sustancias que los constituyen, asociados con algunas variables como peso molecular, número de anillos aromáticos y naturaleza de la sustitución de grupos hidroxilo [28]. Adicionalmente, se ha reportado a los ácidos cafeoilquínicos como los compuestos con mayor concentración en las hojas de I. batatas y que esta varía entre periodos climáticos [43], lo que influye sobre la capacidad que tienen los extractos de inhibir radicales libres, dejando en evidencia que la época en que se cosechen las hojas para obtener los extractos definirá, por lo menos en parte, el grado de actividad antioxidante de los mismos.
CONCLUSIONES
M. aegyptia constituye una fuente potencial de polifenoles y la disponibilidad de agua para las plantas de esta especie (y no la fenología, ni la temperatura) determina la concentración de este tipo de sustancias, por lo que la época del año (considerando específicamente las precipitaciones) o la saturación de agua que tenga el suelo son factores a tener en cuenta al momento de planear la cosecha de las plantas si se pretende su aprovechamiento industrial. Así mismo, se requiere la cuantificación individual de polifenoles para garantizar que la extracción se realice en el momento donde aquellos que presenten mayor actividad antioxidante estén presentes en concentraciones relativamente altas.