INTRODUCCIÓN
Los virus, son los patógenos vegetales más importantes, después de los hongos [1]. Estos agentes biológicos provocan daños en muchos cultivos de interés agrícola [2], generando pérdidas económicas de miles de millones de dólares en todo el mundo [3]. Los cuatro virus vegetales más importantes desde el punto de vista científico y económico son: Tobacco mosaic virus (TMV), Tomato spotted wilt virus (TSWV), Tomato yellow leaf curl virus (TYLCV) y Cucumber mosaic virus (CMV) [4 ]. En Colombia se reportado la presencia del CMV en herbáceas (plátano, banano) [5], hortalizas (pepino, pimentón) [6], y frutales como lulo [7], entre otros.
El CMV es probablemente uno de los patógenos vegetales más exitosos, ya que puede afectar a más de 1.200 especies de plantas [8]. Este virus es transmitido por los pulgones de manera no persistente [8], los cuales han sido utilizados como vectores para transmitir patógenos virales en condiciones ambientales controladas, sin embargo, su tasa de trasmisión es muy baja [9], lo que los hace poco prácticos a gran escala. Por su parte, la transmisión mecánica con savia infectiva, por medio de la inoculación, es la estrategia más utilizada en estudios de virus vegetales [10].
La transmisión mecánica efectiva ocurre si el virus puede replicarse en las células epidérmicas infectadas, y luego moverse a otros tejidos de la planta en donde pueda desarrollar centros infecciosos [11]. Se sabe que el CMV puede transmitirse mecánicamente e infectar plantas de manera eficiente, ya que su genoma codifica proteínas involucradas en el movimiento de célula a célula, así como también movimientos a través de los haces vasculares [12]. El genoma de este virus consta de tres segmentos de ARN monocatenarios de sentido positivo (ARN 1, ARN 2 y ARN 3). El ARN 1 (3,4 kb) y el ARN 2 (2,2 kb) codifican para la expresión de las proteínas 1a y 2a respectivamente, las cuales están involucradas en la replicación y transcripción del virus. El ARN 2 igualmente codifica para la síntesis de la proteína 2b la cual participa en la supresión del silenciamiento genético, y el ARN 3 (3,0 kb) codifica para proteínas de la cápside y del movimiento [13].
Debido a estas propiedades genómicas, el CMV causa un deterioro del estado normal de la planta, modificando o interrumpiendo funciones vitales (germinación transpiración, y fotosíntesis) [14]. Estas alteraciones del desarrollo en la planta a menudo conllevan a síntomas específicos como mosaicos, moteados, distorsión de la estructura de las hojas, y retraso en el crecimiento de las plantas afectadas [12]. Sin embargo, los síntomas pueden confundirse con aquellos causados por estrés biótico (infección por otros patógenos, daños por plagas) o por factores abióticos (condiciones climáticas desfavorables, desequilibrios nutricionales) [15]. Por lo tanto, un diagnóstico preciso y eficiente de este virus en etapas tempranas de la enfermedad representa una tarea importante y necesaria a la hora de implementar un manejo eficiente [16].
Actualmente, existen diferentes métodos orientados a la detección de virus, los cuales se basan en el empleo de microscopía electrónica, en técnicas serológicas y en enfoques moleculares. La microscopía electrónica es limitante debido a que solo determina la morfología de la partícula viral [17], las técnicas serológicas tienen una sensibilidad limitada, lo cual genera posibles inconvenientes a la hora de hacer la detección viral [18], y las técnicas moleculares, por su parte, permiten una detección más eficiente y sensible, superando las limitaciones de las técnicas tradicionales y serológicas [19]. Sin embargo, este último tipo de análisis depende, en gran medida, de la calidad del ARN extraído, lo cual puede eventualmente limitar su uso [20].
El objetivo principal de esta investigación fue evaluar, bajo condiciones controladas, la efectividad de dos métodos de inoculación del CMV en plantas indicadoras, y tres técnicas de diagnóstico.
MÉTODO
Los ensayos se llevaron a cabo en el Laboratorio de Biotecnología vegetal de la Universidad de Caldas, en la ciudad de Manizales-Caldas, ubicado a una altitud de 2.153 msnm y cuyas condiciones ambientales promedio son temperatura de 19°C y humedad relativa de 80%.
Las semillas de plantas indicadoras de Nicotiana benthamiana y N. tabacum L. cv Xanthi fueron proporcionadas por el Dr. Sadao Kobayashi del Centro de Investigación Tibaitatá (Agrosavia), y la cepa viral del CMV proporcionada por el Dr. Wilmer Cuellar, director de la Unidad de Virología del Centro Internacional de Agricultura Tropical-CIAT (Palmira-Valle del Cauca). Las plantas indicadoras crecieron en una cámara de ambiente semi-controlado cuyo rango de temperatura fue de 22 a 26ºC, humedad relativa de 60 a 80% y fotoperiodo de 16/8 horas (luz/oscuridad). La siembra y establecimiento del material vegetal de ambas especies consistió en una etapa de pre-germinación de las semillas sumergidas en agua, en condiciones de luz constante durante tres días. Como sustrato se empleó una mezcla de arena y tierra estériles en proporción 1:2.
Inoculación del CMV
El inóculo del CMV fue preparado a partir de una muestra liofilizada de material vegetal infectado, del cual se tomó 0,1 g de tejido y se maceró con 1,5 mL de agua destilada estéril con la ayuda de un mortero mantenido a 4ºC.
Para los tratamientos se evaluaron 24 plantas indicadoras de ocho semanas de edad (12 de N. benthamiana y 12 de N. tabacum) e igual número de plantas para el control. La inoculación del CMV se realizó sobre hojas con un diámetro comprendido entre 1,5 y 3,0 cm, empleando dos procedimientos. El primero fue la transmisión mecánica frotando suavemente la savia con la ayuda del dedo índice sobre las hojas de las plantas indicadoras. El segundo fue mediante infiltración, realizando una punción en la vena principal de la hoja cerca de su ápice; luego, en el lugar de la punción se inyectaron 0,1 mL de la savia infectada con el virus usando una jeringa sin aguja de 1 mL de capacidad. Las plantas control se inocularon con agua destilada estéril siguiendo el mismo procedimiento. En todos los casos, se emplearon seis repeticiones biológicas (unidades experimentales) por cada método de inoculación y por cada especie, en un diseño completamente al azar. Para determinar el grado de saturación de las hojas inoculadas con el extracto se llevó a cabo una infiltración con una solución al 1% de rojo congo o calcofluor, con volúmenes entre 0,1 y 0,5 mL (datos no mostrados).
Detección del CMV en las plantas inoculadas
La efectividad de las vías de inoculación del CMV se evaluó mediante observación de la sintomatología en las plantas, por pruebas serológicas (ImmunoStrip®) y mediante el empleo de análisis molecular (RT-PCR y secuenciación). Los procedimientos se describen a continuación:
Sintomatología
Se evaluaron los síntomas en hojas y el desarrollo general de la planta. Los síntomas se registraron a los 3, 15 y 21 días después de la inoculación (ddi). En la figura 1 se observa la escala de síntomas propuesta para la evaluación del CMV.

Figura 1. . Escala de síntomas para la virosis del CMV en hojas de N. benthamiana. AGrado0= Hoja aparentemente sana. B. Grado 1= Hoja con mosaico leve, sin arrugamiento. C. Grado 2= Hoja con mosaico leve o deformación. D. Grado 3= Hoja con deformación y/o mosaicos moderados. E. Grado 4= Hoja con mosaico y/o deformación severa.
Serología
Esta prueba se realizó diez días después de la inoculación en cada una de las repeticiones biológicas. Para esto se utilizó el kit ImmunoStrip® para CMV (Agdia Inc., Elkhart, IN), colocando 0,1 g de la muestra vegetal en una bolsa con tampón de extracción, siguiendo las instrucciones dadas por el fabricante.
Moleculares
La detección molecular del virus se efectuó por RT-PCR y por secuenciamiento como prueba confirmatoria de los resultados de sintomatología y serología. De N. benthamiana, se tomó una y de N. tabacum dos plantas para los análisis moleculares a los 25 días después de realizada la inoculación; las cuales se codificaron así: P1 (N. benthamiana), P2 y P3 (N. tabacum).
RT-PCR
Se extrajo ARN total, utilizando el kit PureLink™ RNA Mini Kit (Invitrogen, USA). De las muestras P1, P2 y P3 se maceraron 0,1 g de tejido foliar con sintomatología viral en 1 mL de buffer de lisis conteniendo 10 μL de β-mercaptoetanol, siguiendo las instrucciones del fabricante. Al finalizar el procedimiento, el ARN total obtenido fue eluido con 30 µL de agua estéril libre de ARNasas. El producto obtenido se visualizó en gel de agarosa al 1% y se cuantificó con la ayuda de un nanodrop 2000 (Thermo Scientic, USA). La síntesis de ADNc se realizó empleando el kit Maxima H Minus First Strand cDNA (Thermo Scientific) siguiendo un método de dos etapas. En la primera etapa, se usó 1 µg de ARN total de cada muestra, 1 µL (dT) primer, 1 µL de dNasa, 1 µL de dNTPmix (10 mM), y posteriormente el volumen se aforó a 10 µL con agua libre de nucleasas, y el volumen final se dejó a temperatura de 65°C por 5 minutos en un termociclador C1000 Touch (Bio-Rad, Hercules, CA). En la segunda etapa se añadieron 4 µL de buffer (5x) y 1 µL de enzima máxima H. Las muestras se sometieron finalmente a 50°C durante 30 min y después a 85°C por 5 min parar la reacción. El ADNc sintetizado se almacenó a -20°C.
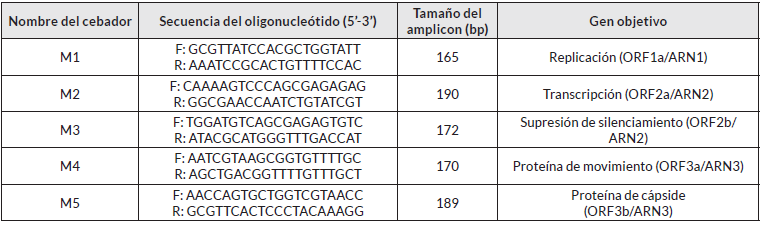
La RT-PCR se realizó con 2 µL de una dilución 1:50 de ADNc, en un volumen final de reacción de 10 µL, el cual incluyó 5 µL de Master-mix (Catálogo No. AB-0575; Thermo Scientific) (solución tampón, MgCl2, dNTP y Taq polimerasa), 0,5 µL de cebadores (10 µM) (sentido y antisentido), y 2,5 µL de agua libre de nucleasas. Finalmente, esta mezcla se llevó a termociclador a 95°C durante 5 min, seguidos 95°C por 30 seg, 60°C por 30 seg, 72°C durante 1 min con 36 ciclos, con una extensión final de 72°C durante 10 min. Los cebadores empleados en la RT-PCR se diseñaron con la ayuda de la herramienta bioinformática Oligoperfect Primer designer (www.thermofisher.com/), cinco juegos de cebadores (Cuadro 1), uno por cada gen del CMV, fueron enviados a Invitrogen (www.thermofisher.com) para su síntesis.
Los fragmentos amplificados se llevaron a cámara de electroforesis (Horizon® 58) en geles de agarosa al 1% en tampón TAE pH 8. La visualización de los productos se efectuó empleando GelRed® (Cat.No.41010. Biotium) en relación 1:1. Como marcador de peso molecular se utilizó el DNA Ladder-1kb (Promega) (Cat.No.M102R GenScript). La electroforesis se llevó a cabo a 120 V por 30 min. Los fragmentos amplificados se visualizaron con la ayuda de un Transiluminador Molecular Imager® Gel DocTMXR (BIO-RAD).
Los amplicones del tamaño esperado se purificaron con el kit ExoSAP-ITTM (Cat.No.78200. Applied Biosciences), siguiendo las instrucciones del fabricante. Las muestras (P1, P2 y P3) para secuenciamiento se prepararon incluyendo el cebador M4 antisentido y se enviaron a Eurofins Scientific (Des Moines, IA, USA). Las secuencias obtenidas se verificaron y editaron manualmente utilizando el software Finch TV_1_4_0 construyéndose secuencias consenso y confirmando su identidad por comparación con los datos depositados en el GenBank del NCBI, mediante BLAST.
RESULTADOS
Métodos de detección del CMV
Detección viral por sintomatología
En plantas de N. benthamiana inoculadas mediante transmisión mecánica se observó corrugamiento leve, mientras que las plantas inoculadas por infiltración presentaban encogimiento de la hoja tratada a los tres ddi. Estas observaciones posiblemente se deban a un estrés ocasionado por las técnicas per se, lo cual no afectó el procedimiento de inoculación.
En la segunda evaluación (15 ddi), el 91,6% de las plantas de N. benthamiana inoculadas mecánicamente mostraron síntomas de posible origen viral, mientras que, solo el 25% de las plantas de esta misma especie inoculadas por infiltración, mostraron igual sintomatología. En ambos casos, las plantas también mostraron síntomas en hojas nuevas como mosaicos cloróticos y encrespamiento, tal y como se observa en la figura 2A con los diferentes grados severidad.
A los 21 ddi, las plantas inoculadas presentaron síntomas evidentes de infección viral, manteniéndose estable el número de plantas enfermas respecto a la segunda observación. Los datos obtenidos muestran que la inoculación mecánica fue más eficiente con un 90% de plantas enfermas en comparación con la metodología de infiltración (21%) (figura 2B).
Respecto de las plantas de N. tabacum inoculadas con CMV mediante transmisión mecánica, solo el 33,3% presentaron sintomatología a los 15 ddi, en forma de manchas cloróticas y mosaicos leves (datos no mostrados); mientras que las plantas inoculadas por infiltración ninguna presentó sintomatología viral.

Figura 2 Sintomatología del CMV en hojas de N. benthamiana evaluadas a dos tiempos después de inoculación A. Hoja control inoculada con agua (Izquierda), hoja grado 2 con leve encrespamiento (centro) y hoja grado 3 con mosaico (derecha) a los 15 ddi. B. Hoja grado 3 con mancha clorótica (izquierda), hoja grado 5 con deformación (centro) y hoja grado 3 con deformación y mosaico fuerte (derecha) a los 21 ddi. .
En este estudio, se identificaron factores que influyen en la transmisión efectiva del CMV, incluida la edad de las plantas al momento de la inoculación y la temperatura del entorno. La trasmisión por inoculación mecánica favoreció la infectividad viral, lo cual se debe posiblemente a que la savia conserva una mayor concentración y estabilidad de las partículas virales [21].
El análisis visual realizado sobre las plantas inoculadas permitió la detección a los 15 ddi de síntomas característicos de infección por CMV (mosaico, enanismo encrespamiento y malformación de las hojas), lo que confirma inicialmente la presencia viral. Estos resultados concuerdan con los reportados por Troiano et al. [22], quienes observaron sintomatología viral 14 días después de la inoculación mecánica en plantas de Nicotiana spp. Del mismo modo, Jalender et al. [23] demostraron que al inocular mecánicamente plantas indicadoras con CMV, se obtienen síntomas evidentes a los 10-15 ddi, indicando que la concentración del virus aumenta a través del tiempo.
No obstante, Dheepa y Paranjothi [24] evaluando métodos de transmisión mecánica del CMV reportaron plantas de tabaco maduras que expresaban síntomas característicos de infección del virus, tres meses después de la inoculación. Estos resultados pueden atribuirse a variables ambientales, a condiciones de crecimiento, y a la edad de la planta al momento de la infección [25]. Este último factor juega un papel importante, ya que en plantas jóvenes el metabolismo es más activo, lo cual es aprovechado por los virus para su replicación y trascripción, lo que se traduce en una aparición más rápida de los síntomas [26].
Es importante destacar que en este estudio las plantas de N. benthamiana y N. tabacum presentaron síntomas típicos causados por el CMV cuando la temperatura osciló entre 24 y 26°C en etapa temprana después de la inoculación. Igual resultado obtuvieron Zhao et al. [27], quienes reportaron síntomas severos en N. tabacum en etapa temprana después de la inoculación del CMV a 28°C, asociado a un mayor nivel de replicación viral, indicando que la temperatura es un factor ambiental importante que controla el crecimiento y la respuesta inmune de la planta.
Detección viral mediante ImmunoStrip®
La prueba serológica para CMV realizada mediante el empleo de las tirillas de ImmunoStrip®, confirma la presencia del virus en las plantas de N. benthamiana, las cuales presentaron sintomatología, independiente del método de inoculación (figura 3A). Sin embargo, al evaluar las plantas de N. tabacum que presentaron sintomatología de posible presencia viral, el resultado de esta prueba fue no concluyente (figura 3B).

Figura 3 Test de ImmunoStrip® para la detección del CMV en plantas indicadoras. A. Test para CMV en N. benthamiana (P1). B. Test para CMV en N. tabacum (P2).
Un estudio realizado por Alhares y Al-Fadhel [28] en plantas indicadoras permitió identificar la presencia del CMV a través del empleo de ImmunoStrip®. Kwon et al. [29] también usaron esta técnica para comprobar que el CMV era el agente causal de manchas cloróticas y de malformación en plantas indicadoras. Del mismo modo, Chikh-Ali et al. [30] confirmaron mediante inmuno-tiras, la presencia de PVY, en la que el extracto de hojas de papa maceradas reaccionó con los anticuerpos específicos para este virus, mientras que en otras investigaciones se ha obtenido buena sensibilidad con el uso de inmuno-tiras [31, 32, 33].
Aunque las publicaciones mencionadas anteriormente reportan una buena sensibilidad para detectar la prevalencia viral, en este estudio, las muestras P2 y P3 no presentaron evidencia de infección tras realizar ensayos con ImmunoStrip®. Una posible explicación a este resultado (no concluyente), podría deberse a la baja concentración de partículas virales en las hojas analizadas [34], a una posible distribución desigual de las partículas del CMV en toda la planta, o a diversas tasas de translocación del virus en la planta [35].
Por lo anterior, los resultados obtenidos con las muestras P2 y P3 están acordes con los reportados por Liebenberg et al. [36], quienes evaluaron tirillas de ImmunoStrip® al compararlas con pruebas de DAS-ELISA y RT-PCR en 23 muestras de Vid para el Virus de la hoja en abanico de la vid (GFLV), encontrando que las tirillas no detectaron la presencia viral en el 17,4% del material evaluado. De forma similar, Simmons et al. [37] realizaron una verificación experimental de la transmisión del Zucchini yellow mosaic virus (ZYMV) usando pruebas de RT-PCR e ImmunoStrip®, mostrando que la prueba serológica no logra la identificación efectiva del virus.
Detección por RT-PCR
Se evaluó la eficiencia del protocolo de extracción de ARN teniendo en cuenta la calidad y la concentración final del ARN obtenido. La calidad, medida en función del radio 260 nm/280 nm presentó valores entre 2,01 y 2,11, indicando una buena calidad del producto. En cuanto a la concentración se obtuvieron valores entre 328 y 734 ng.µL-1. Así mismo, la calidad y cantidad del ARN extraído se evaluó por separación electroforética en geles de agarosa, observando bandas bien definidas de ARN ribosomal (datos no mostrados).
La detección de la presencia del CMV por PCR se realizó en tejidos de hojas sintomáticas a los 25 después de efectuada la inoculación con el virus, utilizando para esto cebadores específicos (cuadro 1). La reacción de PCR con los ADNc de las muestras evaluadas permitió generar amplicones entre 165 y 190 pb, los cuales corresponden a los tamaños esperados (figura 4).
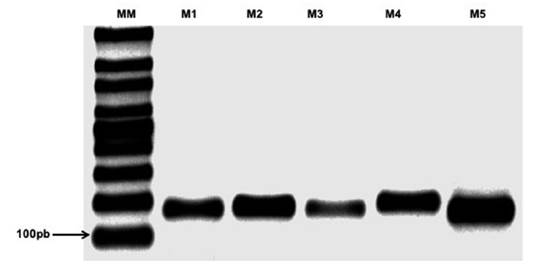
Figura 4 Electroforesis en gel de agarosa de productos de PCR de una muestra positiva para CMV, MM: marcador de peso molecular, M1 al M5; cebadores.
Los productos de PCR de las tres muestras enviadas a secuenciamiento confirmaron la presencia del CMV en las plantas inoculadas. Al comparar las secuencias consenso que codifican para la proteína de movimiento del CMV, con las publicadas en el banco de genes del NCBI, se observó 99% de identidad, resultado que confirma la presencia del CMV en las plantas de N. benthamiana y N. tabacum.
La técnica de RT-PCR permitió la identificación efectiva del CMV en el material analizado, incluidas aquellas muestras en las cuales no se logró la detección mediante la técnica de ImmunoStrip®. Resultados similares se reportan en los estudios de Stammler et al. [38], quienes emplearon técnicas moleculares para la detección de patógenos, como una metodología alternativa para la validación de resultados de diagnóstico basados en pruebas serológicas. Así mismo, Iqbal et al. [39] demostraron la utilidad de los métodos moleculares para evaluar la incidencia del CMV en cultivos vegetales. Por su parte, Culal-Kilic et al. [40] reportan una mayor sensibilidad de la PCR en la detección de Tomato Spotted Wilt Virus (TSWV) con respecto a métodos serológicos.
Por otro lado, los altos niveles de identidad encontrados en este estudio por secuenciación (99%), coinciden con los reportados por Riascos et al. [41] y Mejía et al. [42], quienes identificaron virus vegetales usando RT-PCR y secuenciación de fragmentos de PCR, mostrando alta sensibilidad de detección viral entre las metodologías moleculares evaluadas. A pesar que los resultados de RT-PCR confirmaron la presencia viral en este estudio, resulta importante incluir pruebas de detección que se apoyen en análisis de las secuencias de los productos de PCR generados, esto con el fin de evitar falsos positivos que podrían conducir a generar diagnósticos erróneos.
CONCLUSIONES
La transmisión mecánica del CMV fue más efectiva que la inoculación por infiltración, representando un método que facilita los estudios de diagnóstico y manejo de virus vegetales.
La RT-PCR fue más sensible y confiable que la prueba serológica (ImmunoStrip®) para la detección del virus en estudio.