INTRODUCCION
El hongo Ganoderma lucidum, Lingzhi o Mannetake es conocido en la cultura China y japonesa, desde hace más de 2000 años y se consume con frecuencia, ya que además de ser fuente de nutrientes, tiene propiedades nutracéuticas. En las últimas décadas se han acumulado pruebas científicas sobre la aplicación médica del hongo en el tratamiento de varios tipos de dolencias como bronquitis, anorexia, gastritis, hepatitis, nefritis, hemorroides, dismenorrea, estreñimiento, lupus, enfermedades crónicas como migraña, hipertensión, artritis, asma, diabetes, hipercolesterolemia, enfermedades cardiovasculares, e inclusive el cáncer [1]. Los compuestos bio-activos a los que se les atribuyen estas propiedades son los Ácidos Ganodéricos (A.G.) y los Beta-glucanos, entre otros [2].
Actualmente, los hongos del género Ganoderma, son utilizados, no solo para el consumo en fresco o seco, sino, además para la producción de diversos productos alimenticios funcionales y nutracéuticos [3,4,5].
En Colombia y en el resto del mundo, continuamente, se realizan cultivos con cepas certificadas, sobre residuos agroindustriales, específicos de cada región, buscando encontrar las formulaciones que permitan los mayores rendimientos de producción y concentraciones de compuestos bio-activos, como los A.G. [6,7].
En el Departamento del Quindío se han encontrado cepas silvestres de Ganoderma, adaptadas a nuestros ecosistemas y que pueden contener los compuestos bio-activos en concentraciones que pueden llegar a ser de interés comercial.
Por las anteriores razones, es de gran importancia estudiar en términos de análisis cualitativos y cuantitativos, la presencia y cantidad de los compuestos bio-activos de Ganoderma, presentes en cepas silvestres y comerciales, e inclusive en la biomasa, donde se han desarrollado estos hongos (sustrato agotado o residual) [8 ,9, 10, 11, 12, 13].
Varios métodos de extracción con solventes, han sido desarrollados con el propósito de obtener los compuestos bio-activos del género Ganoderma [14,15,16], siempre buscando aumentar los rendimientos para desarrollar futuras aplicaciones comerciales, disminuir los costos y evitar la degradación de las sustancias de interés.
La extracción con fluido supercrítico (SFC), es una técnica que ha permitido la extracción, de compuestos bio-activos de Ganoderma, utilizando bajas temperaturas y altas presiones [17, 18, 19]. Además, por su reducido consumo y bajo costo de solventes, manejo automatizado de la muestra y alta eficiencia, se convierte en una alternativa viable en éste tipo de investigaciones [20]. De forma alternativa, la técnica de ultrasonido o sonicación intensa, se ha evaluado [21, 22], en este caso, con el fin de extraer ácidos Ganodéricos, la membrana celular debe ser destruida. Para la disrupción, se requiere encontrar un procedimiento adecuado de extracción y así lograr la liberación de todos los productos [23].
Los Ácidos Ganodéricos pueden ser separados, identificados y cuantificados, utilizando la técnica de Cromatografía Líquida (HPLC) [24, 25, 26], acoplada a detector UV-Vis. Está técnica es ampliamente usada, por su rapidez y eficiencia, dado que mediante la comparación con estándares externos e internos, es posible la identificación y cuantificación de las sustancias presentes.
En ésta investigación se comparó la técnica de extracción con fluido supercrítico (SFC) con la técnica de extracción con ultrasonido (EUA), tomando como base la concentración de Ácidos Ganodéricos obtenidos al final del proceso.
En ésta investigación, se extrajeron los Ácidos Ganodéricos, presentes en el cuerpo fructífero y el sustrato agotado del hongo Ganoderma lucidum, mediante las técnicas de extracción con fluido supercrítico (SFC) y extracción con ultrasonido (EUA). Se identificaron y cuantificaron mediante la cromatografía líquida (HPLC), acoplada a espectrofotometría UV-Vis.
MÉTODO
Obtención de Ganoderma sp
Los cuerpos fructíferos de Ganoderma sp, fueron colectados cerca de la reserva el ocaso (4º58’73.8"N - 75º85’52.4"W), en el municipio de Quimbaya, Quindío.
Semilla de Ganoderma lucidum comercial
Para la siembra de G. lucidum sobre residuos de plátano, se utilizó una semilla certificada, proporcionada por la planta de bio-procesos y agroindustria de la Universidad de Caldas. Esta semilla fue obtenida por inoculación del micelio de G. lucidum sobre cebada
Cultivo de G. lucidum
Como sustrato para la producción, se utilizaron subproductos del monocultivo de plátano (pseudotallos, hojas y raquis), fraccionados en cortes de aproximadamente 1 cm2, esterilizados y formulados para obtener relaciones de Carbono/Nitrógeno del orden de 40 a 60. El proceso se llevó a cabo en la granja Bengala (4°41'08.8"N 75°37'02.9"W), propiedad de la Universidad del Quindío, ubicada en el municipio de Finlandia (Quindío). Después de 38 semanas de crecimiento, fueron recolectados los cuerpos fructíferos y además el sustrato agotado.
Tratamiento de la muestra
Los cuerpos fructíferos de G. lucidum cultivado sobre residuos de plátano, de la especie Ganoderma sp y el sustrato agotado, se secaron y deshidrataron a 40°C por 24 horas; de allí, se tomaron por separado para ser triturados, utilizando un molino convencional y luego fueron tamizados hasta alcanzar la pulverización homogénea en un tamaño de 50 µm, de forma similar a lo reportado por algunos autores [1, 27]
Extracción con fluido supercrítico (SFC)
Este procedimiento, se llevó a cabo en el instituto de Biotecnología y Agroindustria de la Universidad Nacional de Manizales. Se utilizó solvente supercrítico (CO2) y solvente etanol, a 300 bar de presión, durante 1 hora y con temperatura de 40°C, secuencialmente controlados [28]. Se colocaron 15 g de muestra pulverizada en la cámara de extracción del reactor dentro de una funda de lienzo. Fueron obtenidos 6 extractos, pertenecientes a cada una de las muestras por duplicado
Extracción con ultrasonido (EUA)
Fue realizada en el laboratorio de catálisis de la universidad del Quindío en un sonicador BRANSON 1800 de 45 MHz, durante 30 minutos [30]. Se depositaron 2 g del pulverizado y se disolvieron en 20 mL de etanol de 95%, contenidos en un vaso de precipitado de 50 mL. Se dejaron reposar durante 24 horas, luego, de la parte sobrenadante de cada uno, se filtró 1 mL dentro de los viales para HPLC, usando PVDF de 0,45 µm Millipore millex-HV.
Preparación del estándar y adición a los extractos
5 mg del estándar de Ácido Ganodérico A, (SIGMA-ALDRICH®) se disolvieron en 5 mL de etanol grado HPLC. De esta disolución madre, se preparó una disolución a 50 µg/mL, usando etanol como disolvente. A cada uno de los extractos, debidamente diluidos, para conservar las proporciones, se les adicionó una concentración fija de Ácido Ganodérico A.
Cromatografía y cuantificación
Los extractos fueron inyectados en el cromatógrafo líquido Thermo Dionex 3000, en las condiciones que a continuación se describen: Columna de separación ACE AQ C-18 (250 mm x 4,6 mm ID, 5 micras), y fase móvil de ácido fórmico al 0,5 % y acetonitrilo en proporciones 60 (A) y 40 (B) en modo isocrático. Se utilizó un sistema de detección UV-Vis con arreglo de diodos (DAD), a 250 y 280 nm. La cuantificación de los Ácidos Ganodéricos se realizó por el método de normalización de áreas, comparando el área del Ácido Ganodérico A (de concentración conocida), con el área de los picos de Ácidos Ganodéricos, presentes en la muestra.
Identificación Ganoderma sp
Aunque de éste hongo se conocen más de 250 especies reportadas en todo el mundo, la cepa silvestre pudo ser clasificada usando la metodología empleada en la taxonomía tradicional, al tener en cuenta el análisis de las características morfológicas del cuerpo fructífero recolectado.
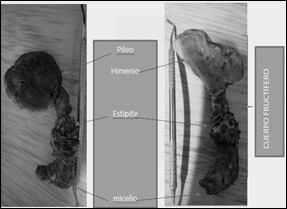
La clave taxonómica que se tuvo en cuenta fue reportada por Weber en 2009 [31]. En éste género, se pudo observar la presencia de un píleo o sombrero en forma de repisa mientras que la parte inferior del esporocarpo presenta una multitud de poros que ratifican de que se trata de una especie polyporaceae (Figura 1). Además, el olor a madera añejada y su color café brillante, son característicos del género, por lo que se pudo clasificar ésta cepa silvestre como Ganoderma sp.
Análisis cromatográfico
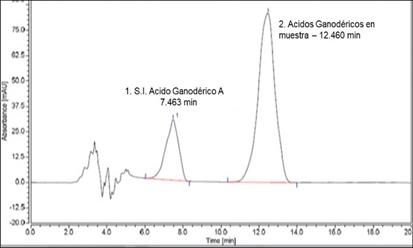
Con el método cromatográfico utilizado, se lograron aislar y detectar dos señales o picos principales (Figura 2). La primera de ellas corresponde al Ácido Ganodérico A, utilizado como estándar, con un tiempo de retención de 7,48 min, que fue confirmada con una corrida cromatográfica del estándar en forma aislada.
La segunda señal corresponde a los Ácidos Ganodéricos presentes en los extractos de las muestras, con un tiempo de retención de 12,45 min. Posterior a éste tiempo no se observan nuevas señales.
Se observa un solapamiento de picos o co- elución en la señal, que aparece de mayor tamaño. Las condiciones del método no fueron suficientes para obtener una mejor resolución y separar cada uno de los Ácidos Ganodéricos presentes en el extracto, posiblemente debido a la composición de la fase estacionaria de la columna cromatográfica..
A pesar de que no fue posible separar los Ácidos Ganodéricos presentes en el extracto, se corroboró su presencia, tomando el espectro UV-Vis del pico a 12,45 min y comparándolo con aquellos reportados en la bibliografía [32]. Con la ayuda del software del detector UV-Vis con arreglo de diodos, se pudo determinar también, el solapamiento de los picos en la señal. Tal como se observa en la Figura 3.
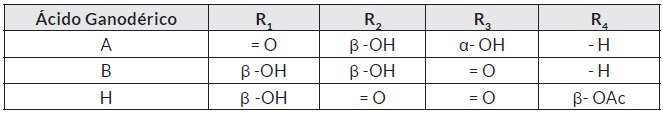
Tanto los espectros y los tiempos de retención, indican que la señal producida se debe a los Ácidos Ganodéricos B y H. Estos ácidos tienen una gran semejanza estructural (son isómeros).
Liu et al. (2011), investigaron condiciones cromatográficas semejantes y encontraron que los Ácidos Ganodéricos B y H aparecieron en un pico superpuesto, probablemente por la determinación concomitante de los Ácidos Ganodéricos B y H; es decir, que la orientación espacial de los radicales o los sustituyentes R1, R2, R3 y R4, tendrían una afinidad análoga por la fase estacionaria [29]. La figura 4 y el cuadro 1, presentan la similitud estructural de los ácidos Ganodéricos, tomando como base información científica actualizada.
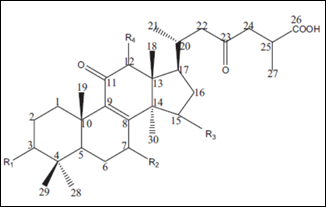
Figura 4. Estructura química de los Ácidos Ganodéricos. Tomado de: http://www.plantasyhongos.es/herbarium/htm/Ganoderma_lucidum.htm
Cuantificación de los Ácidos Ganodéricos
El análisis cuantitativo de los extractos del sustrato agotado y Ganoderma sp, muestra que la técnica de extracción por ultrasonido (EUA) es más eficiente que la técnica de extracción por fluidos supercríticos (SFC), en cuanto a la concentración de Ácidos Ganodéricos obtenidos. En estos casos, las concentraciones fueron: 161,19 µg/g para el sustrato agotado y 265,85 µg/g para Ganoderma silvestre cuando se utilizó extracción con ultrasonido (EUA) y 146,66 µg/g para el sustrato agotado y 181,52 µg/g para Ganoderma cuando se utilizó extracción por fluidos supercríticos (SFC).
Para el caso de la extracción de Ácidos Ganodéricos a partir del cuerpo fructífero de la cepa comercial Ganoderma lucidum, se observan concentraciones similares en ambas técnicas de extracción, con 182,47 µg/g utilizando EUA y 186,19 µg/g, utilizando SFC.
La mayor concentración de Ácidos Ganodéricos se presenta en los extractos de Ganoderma sp, seguida de Ganoderma lucidum comercial, independientemente del método de extracción empleado (Figura 5).
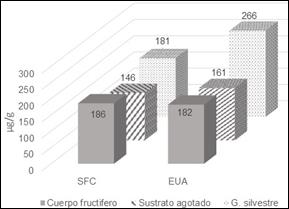
Figura 5. Comparación de las concentraciones de Ácidos Ganodéricos. SFC: Extracción por fluidos supercríticos. EUA: Extracciónpor Ultrasonido
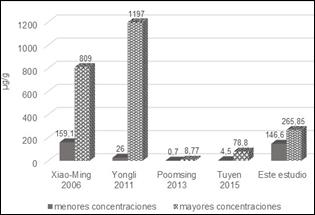
Los rangos de concentraciones de Ácidos Ganodéricos que se obtuvieron en ésta investigación (entre 266 y 147 µg/mL) se pueden comparar con los de otros autores [1, 15 29, 30]. De acuerdo a los mostrado en la figura 6, las concentraciones reportadas en éste estudio, varían o fluctúan entre los rangos reportados en otros artículos.
La mayor concentración de Ácidos Ganodéricos, fue reportada por Nguyen y Yongli en 2011, con 1197 µg/mL pero cabe resaltar que fueron utilizadas las esporas para éste estudio y no el cuerpo fructífero [15]. De igual forma Xiao-Ming Wang et al (2006) [30] reportaron concentraciones de Ácidos Ganodéricos B y H en Ganoderma lucidum. Para el Acido Ganodérico B, desde 32 a 165 µg/mL y para el Ácido Ganodérico H desde 127,1 hasta 643,9 µg/mL, que para efectos prácticos fueron sumadas y aparecen en la gráfica 6 como una sola barra. Los resultados se obtuvieron de los extractos de cinco especies diferentes de Ganoderma originarias de China, usando etanol de 95%, un calentador de inmersión y concentrados por combinaciones de agua caliente, bases y ácidos.
Los resultados de la gráfica 6 permiten dar una visión de la incidencia de los métodos de extracción, la parte del hongo a estudiar y la especie, sobre la concentración de Ácidos Ganodéricos que pueden ser obtenidos. Se observan diferencias muy significativas de concentraciones debido a los factores anteriormente nombrados.
CONCLUSIONES
En ésta investigación, se pudo comparar el efecto de dos métodos extracción sobre diferentes muestras de Ganoderma.
Adicionalmente se determinaron las condiciones cromatográficas, para la cuantificación rápida de Ácidos Ganodéricos (A.G.) presentes en las muestras. Las concentraciones de A.G encontradas. se ubicaron en los rangos publicados por otros autores