INTRODUCCIÓN
La papa Solanum tuberosum L., provee de energía y también contiene importantes promotores de salud como la vitamina C, compuestos fenólicos, fibra dietaría y ciertos minerales como el hierro, pero el efecto positivo o negativo de los componentes en la salud, finalmente está relacionado por la forma en que se degradan por la digestión gastrointestinal del ser humano, lo que afecta la bioactividad final de dichos compuestos (Calliope et al., 2018).
El alto contenido de compuestos fenólicos presentes en la papa, puede evitar el desarrollo de enfermedades crónicas, sin embargo, el ácido fítico, químicamente conocido como Inositol- hexakisfosfato (InsP6) o fitato, cuando se encuentra en forma de sal, ha sido visto como antinutriente por décadas, debido a la quelación de varios metales y su unión a las proteínas, disminuyendo la biodisponibilidad de proteínas y minerales de importancia nutricional (Dahdouh, 2019; Gutiérrez et al., 2020; Dong et al., 2020). En los últimos 20 años, se han encontrado propiedades benéficas a los fitatos como antioxidante, anticancerígeno, inhibidor de las sales de calcio, en la disminución del índice glicémico y el colesterol (Vaz de Melo et al., 2019). Mediante la ingeniería genética se ha reducido el contenido de ácido fítico en semillas en un 50 a 70 %, esta reducción puede proporcionar numerosos beneficios potenciales a la calidad de los alimentos y piensos y la sostenibilidad de la producción agrícola, reducir el impacto ambiental y mejorar la biodisponibilidad de minerales (hierro, zinc, calcio, magnesio) para seres humanos y animales no rumiantes (Raboy, 2020). Se ha reportado la caracterización de P31 utilizando RMN en semillas (sésamo, amapola, mostaza, hinojo y comino) (Oghgho et al., 2017), y en papa solo se reporta el análisis de fitato en diferentes variedades de papa cruda y cocida cultivada en USDA-ARS Small Grains and Potato Germplasm Research Unit, Aberdeen, Idaho utilizando HPLC (Santos et al., 2015).
La escasa información publicada acerca de la significancia del ácido fítico en nutrición y salud humana hace necesario iniciar un estudio para identificarlo y cuantificarlo en la papa que es el cuarto alimento más consumido a nivel mundial y es ingrediente importante de las papillas que ingieren los bebes desde los 4 meses de edad (Schelemmer et al., 2009). La información de los límites de cuantificación para conocer el positivo o negativo efecto es aún limitada y la dosis óptima para terapias clínicas todavía no ha sido determinada. El objetivo de la presente investigación fue identificar y cuantificar el ácido fítico en papa empleando espectroscopia de RMN 31P.
MÉTODO
Material
Se trabajó con papa nativa Huagalina cultivada como cultivo orgánico en la provincia de Julcán, cosechadas el 29 de mayo 2017 en el caserío La Victoria localizado (3.439 m.s.n.m., 8º03’08.10” S y 78º31’11.99” O) con un rango de temperaturas entre 6 y 17 °C y HR del 75 %, en la región La Libertad y se realizó la comparación con papa comercial Canchan adquirida en Supermercado en la ciudad de Lima.
Reactivos
Ácido fítico (sal de sodio hidratada de arroz) y Fosfato de sodio dibásico pureza > 99,9 % de Sigma Aldrich Co.; Hidróxido de sodio y Deuterium oxide (D2O) (Deuterium degree min 99 %) adquiridos en Merck KGaA-Darmstadt-Germany; EDTA ((Ethylenediaminetetraacetic acid)) de BDH Chemicals Ltd. PooleEngland; y el agua utilizada fue purificada a MilliQ en el equipo (Merck KGaA-Darnstadt, HE, DE).
Equipos
Se utilizó un Liofilizador LABCONCO Freeze DrySystem/Free Zone 4,5 (Kansas City, Mo. US) para las rodajas de papa cruda. Los experimentos de resonancia magnética nuclear para determinar 31P se realizaron en un espectrómetro BrukerAscendTM 500 y la consola AVANCE III HD, con una sonda de banda ancha sintonizada para detectar resonancia de 31P a 202 MHz (Bruker, Biospin Gmbh). El equipo cuenta con un sistema de control de temperaturas BCU I-40/50 (Bruker Biospin Gmbh). Los espectros fueron procesados en el software Bruker Topsin 3,5,b,91p17 (BrukerBioSpinGmbH) en los que se muestran los desplazamientos químicos (δ) en ppm y las constantes de acoplamiento (J) en Hertz.
Preparación de las muestras
Las papas nativas Huagalina, se lavaron con agua corriente y se dejaron orear hasta el otro día en la oscuridad. Se cortaron en rodajas de 5 mm de espesor y para reducir toda actividad enzimática fueron liofilizadas. A las rodajas liofilizadas se les separó la cascara de la pulpa con un bisturí y el material separadamente se pulverizó obteniendo un polvo fino de cáscara y pulpa. Las papas Canchan siguieron el mismo procedimiento. Ambas muestras fueron guardadas a -75 °C hasta posterior análisis.
La extracción de los fosfatos se realizó pesando 1,00 g de cáscara o pulpa de papa con 6,25 mL de NaOH 1M, 6,25 mL de agua Milli Q y 12,5 mL de EDTA 0,1 M. Se agitó la suspensión por 4 horas con agitador magnético a temperatura ambiente. Luego se centrifugó a 23000 g por 20 minutos a 10 °C. Los sobrenadantes se liofilizaron hasta peso constante. Se hicieron modificaciones a la metodología de extracción utilizada para la caracterización por RMN 31P de semillas de plantas (Oghgho et al., 2017).
Análisis mediante RMN de compuestos de fósforo en S. tuberosum L.
Para el ensayo de RMN 31P se pesaron 100 mg del extracto liofilizado, se le agregó 700 μL de D2O, 100 μL de solución (1,5M NaOH+0,3 M EDTA) y 100 μL de NaOH 10 M. Se procedió a sónicar por 30 minutos a 21 °C y de esta solución se transfirió 600 μL a tubo RMN, se insertó estándar externo de H3PO4 (0,76-0,98mM) y se realizó la lectura por NMR 31P. La concentración del estándar externo de H3PO4 se calculó a partir de la concentración del estándar interno Na2HPO4 a 14,06 mM: 10 mg en 500 μL de solución (1,5M NaOH+0,3 M EDTA) y 500 μL de NaOH 10 M enrasado a 5 mL con D2O. El estándar de ácido fítico se preparó de manera análoga. El estándar externo de H3PO4 se preparó a partir de H3PO4 (85 %): 250 μL de H3PO4 / 5 mL de agua MilliQ, haciendo una dilución de 1/100 y los 5 capilares preparados, una vez sonicados, fueron sellados herméticamente al calor.
Los espectros de RMN 31P fueron adquiridos por una secuencia de pulsos Zgig30, con 32,768 puntos digitales (TD); 8,192 escaneos (NS) y 64 escaneos señuelos (DS); con resolución de FID de 0,98 Hz (FIDRES), tiempo de adquisición de 1,0 segundo (AQ); ganancia de receptor (RG) de 202,6; tiempo de retraso D1 de 4,0 segundos; D11 de 0,030 seg y ensanchamiento de banda (LB) de 1,0 Hz. La concentración de los compuestos fosforilados (CCF) se obtuvo aplicando la ecuación 1:
RESULTADOS
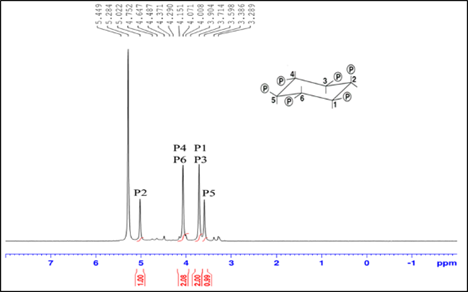
La papa en su composición contiene fósforo en el rango de 0,130-0,261 g/100 g ms (Santos et al., 2015). La metodología utilizada en este trabajo, involucra un tratamiento con NaOH - EDTA, que permite la identificación de ácido fítico, fosfato libre y el glicerol fosfato. Este último, resulta de la degradación por hidrólisis alcalina (Schelemmer et al., 2009). Se han reportado valores bajos de glicerol fosfato en extractos de semillas de canola, que fueron atribuídos tambien al problema de degradación por la extraccion realizados con NaOH-EDTA. En esta investigación, estos tres compuestos fueron detectados mediante RMN 31P. La metodología utilizada de extracción que involucra un tratamiento con NaOH- EDTA, y detección por NMR de 31P de los compuestos mencionados ha sido reportado en la literatura como un protocolo de cuantificación de alta eficiencia (88-110 %) (Oghgho et al., 2017). En la Figura 1, se muestra el espectro de ácido fítico (P2 a 5,022 ppm, P4P6 a 4,151 ppm, P1P3 a 3,714 ppm, P5 a 3,598 ppm) en presencia del estándar interno fosfato dibásico de sodio (5,45 ppm) a condiciones altamente básicas (NaOH -EDTA). Se observa en este espectro que la integral guarda relación con el número de átomos debajo de cada señal.
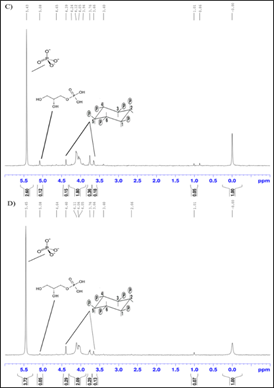
El espectro de RMN 31P del extracto de cáscara y pulpa de papa Huagalina y los correspondientes espectros de la papa Canchan se muestran en las Figuras 2 y 3. Es importante recalcar que en estos espectros además de las señales del 31P del ácido fítico se observan otras, entre ellas la del fosfato a 5,50 ppm y la del glicerol fosfato a 4,42 ppm. Dado que estos desplazamientos químicos coinciden con lo reportado en la literatura para estos tres tipos de fósforo (Oghgho et al., 2017), se emplean las áreas debajo de estas señales para cuantificar su presencia en los distintos extractos de papa abordados. La cuantificación de estos compuestos se refirió a la concentración de un estándar externo, ácido fosfórico en capilar a δ = 0,0 ppm. La concentración de la solución de ácido fosfórico en cada capilar utilizado en ese estudio fue calculada a través de un estándar interno (sodio fosfato dibásico) a una concentración de 78 mM. La concentración hallada del estándar externo, ácido fosfórico en capilar, fue de 0,89 ± 0,06 mM.
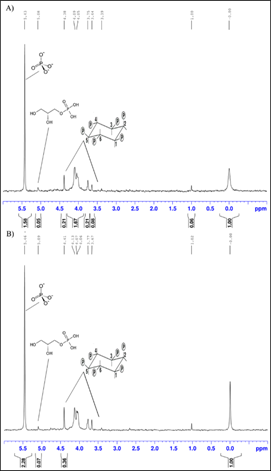
Figura 2 Espectro de RMN 31P (Fosfato, glicerol fosfato y fitato) de A) Pulpa y B) Cáscara Huagalina
En el Cuadro 1, se presenta la concentración de ácido fítico, glicerol fosfato y fosfato inorgánico en los dos tipos de papa estudiadas, cultivo orgánico (Huagalina) y cultivo convencional (Canchan).
Cuadro 1 Fitato, glicerol fosfato y fosfato inorgánico en papa expresado en g/100 g masa seca *.
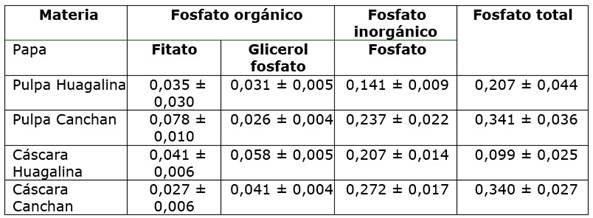
*Resultados basados en tres extracciones de un mismo lote de papa liofilizada.
Los resultados aquí obtenidos sugieren que la papa cultivada con abono químico, tanto pulpa como cáscara de la papa Canchan, contiene una mayor cantidad total de fósforo que la papa bajo cultivo con abono orgánico, pulpa y cáscara de la papa Huagalina. En particular, resalta el contenido de ácido fítico de la pulpa de la papa Canchan (0,078 %) versus el de la pulpa de Huagalina (0,035 %).
El rol del fósforo en la productividad de los cultivos de papa ha sido muy bien documentado (Kashay, 2019). Aunque el fósforo se encuentra en forma abundante en la mayoría de suelos muchas veces no está disponible para que lo absorba la planta debido a que este analito forma compuestos insolubles con los cationes, tanto bajo condiciones acidas como alcalinas. Entre los cultivos, la papa es particularmente sensible a la deficiencia de P en los suelos indicando una baja eficiencia de absorción y esto se debe al tamaño pequeño de sus raíces en relación a otros cultivos como los cereales y las legumbres. El fósforo es un elemento esencial durante el periodo inicial de desarrollo de la planta y durante su tuberización. La mayor cantidad de fósforo se traslada de la planta hacia los tubérculos por lo que aquella tiene que extraer considerable cantidad de fósforo del suelo. La aplicación de fósforo a ambos lados del tubérculo (semilla) mejora la absorción de este elemento, disminuyendo la posibilidad de su fijación en el suelo (Sorato et al.,2020).
Los actuales estudios agronómicos de papa están dirigidos a métodos para aumentar los rendimientos y obtener calidad de papa mediante fertilizantes en diversas aplicaciones, pero no tienen en cuenta los impactos nocivos en la salud pública por el contenido de ácido fítico en el tubérculo (Nurmanov et al., 2019; Grados et al.,2020; El-Azeim et al., 2020). La determinación de fitatos en papa ha sido abordada en otras investigaciones, a través de métodos distintos de extracción y detección. Se reporta la extracción con HCl y la detección con cromatografía de iones con derivatización post columna y detección UV (Wolters et al.,1993). Sin embargo, un método de electroforesis en gel de poliacrilamida (PAGE) representaría una alternativa más universalmente accesible y más rápida que la HPLC, pues requiere menos capacitación, experiencia y costos; al tiempo que permite la separación y detección de IP5 e IP6 (Ravoy et al.,2020).
Dada las diferencias entre metodologías de extracción y cuantificación cualquier análisis resulta infructuoso. La importancia de poder cuantificar el ácido fítico como metabolito aislado radica en que ya ha sido demostrado que la cocción de la papa no afecta su concentración (Phillippy et al., 2004).
Los cereales por su contenido de fibra, vitaminas y compuestos bioactivos han sido relacionados como productos con beneficios para la salud, pero su contenido en fitato que inhibe la absorción de minerales y tiene una acción negativa en sus propiedades nutricionales ha obligado a que se realicen estudios para modificar las recetas para preparar el pan a fin de reducir el efecto negativo del ácido fítico, igualmente probar si las diferentes fuentes dietéticas del maíz y la suplementación de fitasa afecta la digestibilidad del fósforo y aparición de fosfatos de inositol en pollos y pavos en crecimiento (Colby et al., 2017; Ingelmann et al., 2019; Fekri et al., 2020).
La creciente demanda de vegetales atrae a muchos agricultores a esta línea de producción. En las zonas tropicales y subtropicales, las mujeres producen vegetales para la alimentación y para complementar los ingresos del hogar; pero esto puede no estar exento de riesgos. Las verduras cultivadas en ambientes contaminados con metales pesados, se bioacumulan y biomagnifican en humanos, lo que conduce a dolencias y muerte (Kunatza et al., 2020). Otros autores manifiestan que el efecto de fitato en vegetales puede ser reducido por fermentación, remojo en medio ácido y haciéndolos germinar (Udousoro et al., 2018).
Dada la controversia que existe con este metabolito, reportado como antinutriente así como antioxidante y anticancerígeno, su relación frente al tipo de fertilización debe ser abordada sistemáticamente. La metodología aquí implementada servirá como punto de partida para ello. En este estudio preliminar se ha demostrado que la Canchan(pulpa), cultivada comercialmente con abono químico, posee casi el doble de ácido fítico que la papa Huagalina (pulpa), cultivada con abono orgánico. Si bien estos resultados son preliminares, pues se basan en muestreo pequeño, indican la factibilidad de un estudio de mayor envergadura.