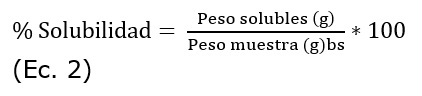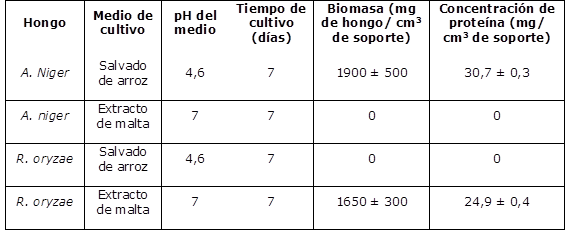INTRODUCCIÓN
El sector agropecuario enfrenta actualmente un reto fundamental, reducir la producción de residuos. En este sentido, el desarrollo de alternativas a los procesos convencionales de síntesis, que eviten las condiciones de reacción agresivas, que disminuyen la biocompatibilidad del producto obtenido ha supuesto un enfoque en la investigación actual (Sheldon and Pereira, 2017). En este orden de ideas, el uso de microorganismos y sus derivados es una alternativa biotecnológica para llevar a cabo este tipo de procesos. El empleo de enzimas libres, por ejemplo, ha permitido obtener compuestos ópticamente puros con alto rendimiento en numerosos procesos, no obstante, su escalado a nivel industrial ha mostrado dificultades debido a su nula reutilización, baja estabilidad catalítica y su alto costo (Sheldon and Pereira, 2017; Zhan et al., 2020).
Trabajar con las fuentes primarias de dichas enzimas (microorganismos), presenta ciertas ventajas frente a los demás sistemas, protección de las biomoléculas frente a cambios en las condiciones del medio (pH y T), reutilización en ciclos sucesivos, bajo costo y facilidad en su cultivo (Karambwalaa et al., 2017), características que se favorecen mediante procesos de inmovilización de los microorganismos, en lo cual recientemente se ha valorado la funcionalidad de soportes generados a partir de subproductos económicos, como el bagazo de caña (Saccharum officinarum), las fibras de coco (Cocos nucifera) y estropajo (Luffa aegyptiaca) (Rosales et al., 2018; Sepúlveda et al., 2020), este último destacando en los procesos en los que ha sido empleado.
En este orden de ideas, microorganismos como Aspergillus niger y Rhizopus oryzae con alta producción de enzimas de interés como esterasas y glucosidasas, entre otras, son una alternativa para mejorar las tasas de rendimiento, disminuir los costes de producción y evitar el uso de condiciones de reacción agresivas a nivel industrial (Lopez-Trujillo et al., 2017; Rosales et al., 2018; Sepúlveda et al., 2020), En este sentido, la consideración como GRAS (Generally Recognized As Safe) por la FDA (US Food and Drug Administration) de estos microorganismos, ha supuesto una alternativa para su empleo en industrias como la alimentaria y farmacéutica.
Por otra parte, el sector arrocero de Colombia presenta un bajo valor agregado en subproductos como el arroz tipo granza (partido) y teniendo en cuenta que el almidón presenta gran versatilidad para su aplicación en diversas industrias, el aprovechamiento de este subproducto como fuente de almidón es una alternativa para la generación de valor agregado a la cadena productiva. No obstante, en los últimos años este material ha requerido mejorar sus propiedades fisicoquímicas para aumentar su gama de usos, debido a características del polímero como su tendencia a retrogradarse, baja estabilidad térmica y falta de afinidad con algunos solventes, evidenciado la necesidad de llevar acabo procesos de modificación estructural para mejorar estas propiedades (Montoya et al., 2015; Zhu et al., 2017).
La inserción de grupos funcionales mediante acilación, eterificación, entrecruzamiento o la obtención de unidades de menor tamaño por su hidrólisis, han sido alternativas que logran modificar las propiedades mecánicas, térmicas, de solubilidad y degradabilidad del polímero, permitiendo obtener materiales con una amplia gama de usos a nivel industrial (Zhu et al., 2017; Monroy et al., 2018).
En este orden de ideas, se planteó evaluar el desempeño de Aspergillus niger y Rhizopus oryzae bajo un sistema de inmovilización con estropajo como soporte en los procesos de acilación e hidrólisis de almidón de arroz.
MÉTODO
El presente trabajo se desarrolló en la ciudad de Ibagué (Colombia) con Altitud de 1.285 m.s.n.m., Temperatura de 25 ºC y Humedad relativa del 85 %).
Materiales y reactivos
El almidón de arroz utilizado para los experimentos se extrajo de la variedad Fedearroz 473 (Federación Colombiana de Arroceros) por el método alcalino (Abbas-Butt et al., 2019), los hongos (Aspergillus niger y Rhizopus oryzae) fueron suministrados por el Grupo de Investigación en Productos Naturales de la Universidad Del Tolima (GIPRONUT). El estropajo (Luffa aegyptiaca) se adquirió en el mercado local. Los ácidos orgánicos (anhídrido acético y ácido maleico), así como el dimetilsulfóxido (DMSO), son reactivos comerciales (MERK®).
Crecimiento e inmovilización de microrganismos
Para el desarrollo de los microorganismos se empleó un medio comercial (Extracto de malta) y uno elaborado a partir de Salvado de arroz. Este último, preparado siguiendo la metodología propuesta por Fernández et al. (2009), con algunas modificaciones, 175 g de la harina se suspendieron en 1 L de agua destilada, la suspensión se agitó (150 rpm) durante 2 días manteniendo constante la temperatura (40 °C), posteriormente se filtró y se almacenó el medio de cultivo hasta su uso.
Trozos de estropajo (1,5 x 0,5 cm) previamente deshidratados en una estufa a 60 ºC, se implementaron como soporte para la inmovilización de los hongos, en relación 1 soporte por cada 50 mL de medio de cultivo, los hongos se dejaron en desarrollo durante 7 días, con agitación constante (100 rpm, 30 ºC).
Concentración de proteína y producción enzimática
La concentración de proteína de cada hongo se determinó mediante el método de Bradford (Valipour et al., 2015).
La capacidad esterasa de los hongos inmovilizados se determinó por colorimetría, siguiendo el principio planteado por Magdaleno y Vargas (2016), empleando como sustrato solución de acetato de metilo 2mM, rojo de metilo 0,45 mM, acetonitrilo 2,5 % (v/v) en buffer fosfato 2 mM (pH 7,2). Una vez obtenida la solución, los biocatalizadores fueron suspendidos en esta, el viraje de una tonalidad amarilla a Rojo-Magenta fue considerada positivo para la presencia de esterasas.
Acilación
El almidón nativo (sin modificar) y el ácido orgánico (Anhídrido acético o Ácido maleico) (1:0,1 m/m) se disolvieron en DMSO, se adicionó un biocatalizador (Cuadro 1) por cada 25 mL, se incubó a 60 ºC con agitación constante (120 rpm/3 h), como control positivo se empleó una lipasa comercial de Candida antarctica (CALB; 40 U/mL). Finalizado el tiempo de reacción el almidón se precipitó adicionando etanol, se centrifugó (1.1000 rpm) y secó en un horno de aire caliente a 40 ± 2 °C (Shah et al., 2017).
El rendimiento de los biocatalizadores se expresó como la actividad específica, relacionando los equivalentes de ácido graso adicionados y los miligramos de proteína de cada microorganismo. Para esto el sobrenadante obtenido del lavado con etanol se tituló con NaOH 0,91 N y fenolftaleína 0,5 %, para determinar los equivalentes de ácido graso adicionados. La acilación del polímero se verificó mediante IR, haciendo un seguimiento de la banda formada entre 1.640 y 1.745 cm-1 (Horchani et al., 2010).
A los materiales (nativos y modificados) se les determinó el poder de hinchamiento (PH), índice de solubilidad en agua (ISA) e índice de absorción de agua (IAA) (Reza-Falsafi et al., 2019), para determinar cómo afectaba la modificación su funcionalidad (ecuaciones 1, 2 y 3).
Cálculo de resultados:
Hidrólisis
La evaluación de los biocatalizadores en la hidrólisis se realizó sobre almidón de arroz y almidón soluble de la marca MERK® como control del proceso. Los almidones se suspendieron en agua destilada, a concentración de 2.500 mg/L, se calentaron durante 15 minutos a 40 ºC, posteriormente se adicionó un hongo inmovilizado por cada 25 mL, el seguimiento de la reacción se realizó a los 5, 10, 15, 30, 60, 120, 180 y 1.080 minutos, mediante la prueba del ácido 3,5-dinitrosalicílico (DNS) (Wang et al., 2017) con una curva de calibración de 25, 50, 100, 200, 400, 800, 1.600, 3.200 y 6.400 mg/L.
Análisis estadístico
Se empleó un diseño factorial (2 medios de cultivo, 2 microorganismos y 2 ácidos orgánicos), los resultados se analizaron en el paquete estadístico Statgraphic Centurión XVI, se implementaron tres réplicas para cada prueba, los resultados obtenidos se expresaron como el promedio ± el error estándar de la media (e.s.m), las diferencias significativas entre las medias para un 95 % de confianza (p<0,05) fueron determinadas empleando el análisis de la varianza (ANOVA) y una prueba de múltiples rangos.
RESULTADOS
Los microorganismos evaluados exhibieron crecimiento en medios de cultivo con pH y composición diferentes como se muestra en el Cuadro 1, esto probablemente debido al contenido nutricional y pH requeridos por cada hongo para su desarrollo. Para A. niger se reportan condiciones óptimas de pH en un rango entre 2 y 5, contenidos de glucosa y oxigeno altos, por su parte, R. oryzae requiere un pH de 5 a 7 (Ahmed and Abood, 2017; Dinarvand et al., 2017). Por otra parte, la inmovilización de estos hongos no se ha reportado en estropajo, R. oryzae ha sido confinado en soportes de espuma de poliuretano de 6 mm, como BSP (partículas soporte de biomasa), generando biomasa de 8,56 mg/cm3 (Ban et al., 2001), de igual forma Hama et al. (2006) sobre el mismo soporte genera 15,78 mg/cm3. Para A. niger, Guldhe et al. (2016) bajo el mismo sistema, obtiene valores de 4 mg/BSP y Rakchai et al. (2016) inmovilizando un hongo del mismo género (Aspergillus nonius) sobre esponja de limpieza en forma de cubos, logrando adherir al soporte 25 mg/cm3 de BSP. Es claro que bajo el sistema planteado en este trabajo se logran mayores porcentajes de agregación de biomasa (7.600 %) (Cuadro 1).
En cuanto a los valores de proteína obtenidos, A. niger desarrollo un mayor contenido a comparación de R. oryzae (Cuadro 1), las diferencias pueden deberse al medio de cultivo en el que se desarrollaron o al ciclo de vida de cada uno, debido a que son hongos diferentes con tiempos de crecimiento variables.
La concentración de proteína observada para cada hongo es elevada contrastada con diferentes investigaciones, Chandra et al., (2007) reportan contenidos de proteína de 5,10 mg/g para A. niger, utilizando una fermentación en estado sólido y sin inmovilizar. Estudios con organismos del mismo género como Aspergillus ficuun (Costa et al., 2009), logran concentraciones de proteína en cultivo sumergido de 5,42 mg/mL. Los resultados obtenidos muestran un mayor porcentaje de proteína obtenida (355 % más en comparación a lo reportado), no obstante, cabe aclarar que la cuantificación se realizó solo sobre la biomasa obtenida en los soportes, la proteína de micelio no adherido al soporte no se tuvo en cuenta.
En este sentido, con base a la carga enzimática reportada para estos hongos (lipasas, amilasas y glucosidasas) es posible postular estos sistemas para realizar modificaciones de tipo esterificación e hidrólisis sobre diferentes materiales como el almidón o la celulosa, que requieren de las enzimas mencionadas para su catálisis (El-Okki et al., 2017; Takó et al., 2017; Avwioroko et al., 2018; Oluwabunmi et al., 2019; Nema et al., 2019). Con esta finalidad, se realizó la prueba cualitativa para la presencia de esterasas, resultados que se presentan en la Figura 1.

Figura 1 . Prueba cualitativa de actividad esterasa. Donde: Amarillo: ausencia de actividad esterasa; Rojo-Violeta: Presencia de actividad esterasa; A: Estropajo; B: R. oryzae; C: A. niger; D: Lipasa CALB.
Evaluación del hongo inmovilizado en la acilación de almidón
La eficiencia de los sistemas catalíticos expresada como actividad especifica en acilación se muestra en la Cuadro 2.
Cuadro 2 Actividad específica en la acilación.
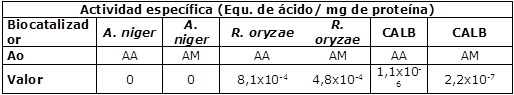
Donde Ao: Ácido orgánico; AA: anhídrido acético y AM: ácido maleico.
La actividad enzimática de los biocatalizadores en este modelo es baja, dada la cantidad de proteína generada por estos, sin embargo, es posible que las esterasas generadas por los microorganismos presenten una baja afinidad por los ácidos orgánicos empleados (Chen et al., 2019), lo cual se contrasta con los espectros IR obtenidos (Figuras 2 y 3). Para los tratamientos con anhídrido acético (Figura 2) se observa una banda en 1.700 cm-1 asociada a los grupos carbonilo (C=O) que verifican la acilación del polímero (Clasen et al., 2018), no obstante, dicha banda se presenta con mayor intensidad en el blanco de reacción, por lo cual, la modificación del material estaría asociada a un proceso químico donde él ácido orgánico cataliza la reacción (Shah et al., 2017).
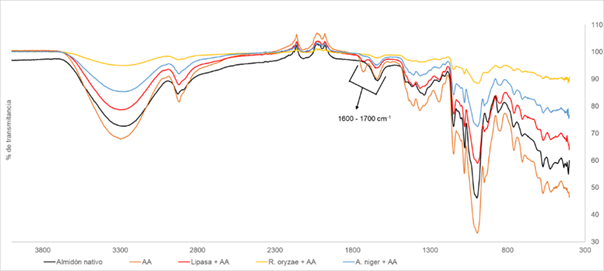
Figura 2. Almidones tratados con anhídrido acético Dónde: AA: Anhídrido acético; Almidón nativo: material sin ningún tratamiento; Almidón + AA: blanco de reacción; Lipasa + AA: almidón tratado con la enzima libre; R. oryzae + AA: almidón tratado con Rhizopus oryzae; A. niger + AA: almidón tratado con Aspergillus niger.
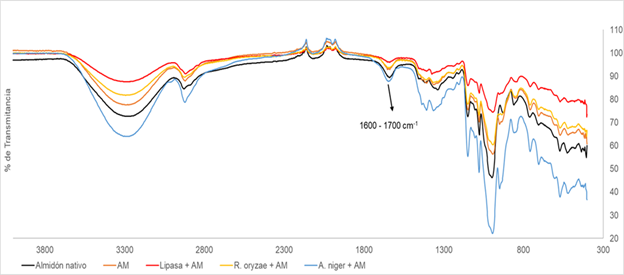
Figura 3 Almidones tratados con ácido maleico. Donde: AM: Ácido Maleico; Almidón nativo: material sin ningún tratamiento; Almidón + AM: blanco de reacción; Lipasa + AM: almidón tratado con la enzima libre; R. oryzae + AM: almidón tratado con Rhizopus oryzae; A. niger + AM: almidón tratado con Aspergillus niger.
Por otra parte, al verificar la formación de ésteres en el tratamiento con ácido maleico (Figura 3). Se evidencia que no hay una acilación del polímero dada la ausencia de la banda a 1.700 cm-1, en este sentido, la disminución del ácido en el medio de reacción, podría estar relacionada con la formación de complejos entre las cadenas de amilosa del polímero y el ácido orgánico, de acuerdo con lo reportado en literatura (Seo et al., 2015; Reddy et al., 2018), donde se han relacionado altos contenidos de amilosa (>20 %), como es el caso (28 %), con la capacidad de formar complejos helicoidales únicos con una variedad de ligandos hidrofóbicos, incluidos alcoholes, fármacos, yodo y ácidos grasos, mediante la formación de puentes de hidrógeno y la repulsión con la cadena hidrófoba de la molécula que permiten esta formación.
En este sentido, al contrastar el impacto de las modificaciones sobre las propiedades funcionales de los materiales obtenidos (Figura 4) se puede observar que los parámetros evaluados (ISA, IAA, PH) tienden a aumentar en todos los tratamientos en comparación con el almidón nativo.
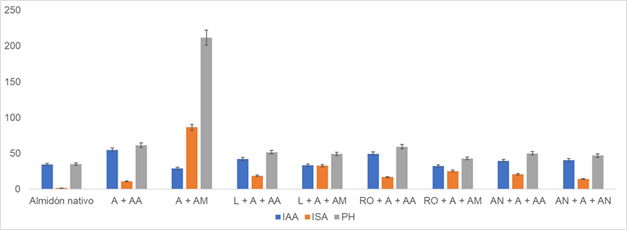
Figura 4 Propiedades funcionales según tratamiento. Donde: IAA: índice de adsorción de agua; ISA: índice de solubilidad en agua; PH: poder de hinchamiento; A: almidón; AA: anhídrido acético; AM: ácido maleico; RO: Rhizopus oryzae; AN: Aspergillus niger; L: lipasa.
Sin embargo, el IAA muestra mayor aumento con el uso de anhídrido acético (158 %). Para el caso del ISA y PH aumentan en mayor grado con los tratamientos de ácido maleico (5.700 y 604 % respectivamente), lo que concuerda con lo reportado por estudios que emplean ácidos orgánicos de cadena corta, logrando modificar propiedades morfológicas del polímero nativo, su cristalinidad, evidenciando que el plegamiento de la molécula cambia a una conformación amorfa, permitiendo que el solvente (Agua) tenga mayor contacto con el almidón, por consiguiente aumentan los valores de ISA, PH y IAA (Clasen et al., 2018).
Evaluación de la Hidrólisis de almidón
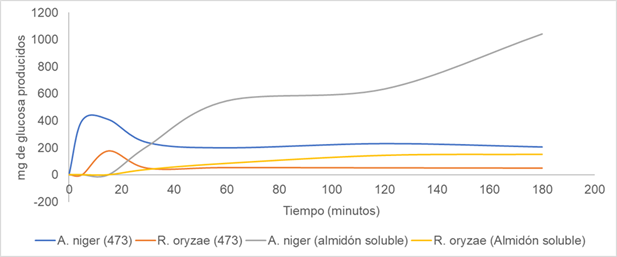
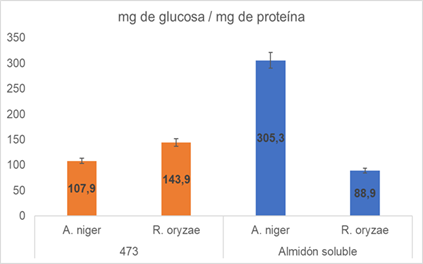
La Figura 5 ilustra el proceso de hidrólisis, se observa que los sistemas catalíticos alcanzan su máximo de reacción a tiempos diferentes para cada almidón evaluado; por otra parte, la actividad especifica de cada sistema catalítico se ilustra en la figura 6.
En la hidrólisis del almidón soluble, para ambos hongos se observa que la reacción inicia entre los 15 y 30 minutos, con el aumento del tiempo de reacción se evidencian diferencias significativas entre los ciclos evaluados, permitiendo afirmar que con un polímero de alta solubilidad los sistemas catalíticos tienen mayor capacidad hidrolítica, siendo que A. niger alcanzo una concentración de 1.041 mg de glucosa/L (41,64 %) y R. oryzae 152 mg/L (6 %) a los 180 minutos, esto se puede deber a un mayor proceso de difusión del material en el medio, lo que facilita la unión enzima - sustrato (Azmi et al., 2017).
Por su parte, con el almidón de la variedad 473 los hongos alcanzan el límite de reacción a los 15 minutos, a partir de este tiempo no se evidencian diferencias significativas. La diferencia en la cantidad de polímero hidrolizado por cada microorganismo puede estar dada por la carga enzimática de estos, para el caso de A. niger se reporta además de las enzimas ya mencionadas, la producción de amiloglucosidasas, enzimas que catalizan la hidrólisis de los enlaces exo 1-4 D glucosídicos (Osho and Salomon, 2020). Por otra parte, la falta de solubilidad del almidón de la variedad 473 es otra posible causa de la diferencia entre la cantidad de polímero hidrolizado frente al almidón soluble.
En este sentido, diferentes estudios han alcanzado porcentajes de hidrólisis de almidón del 90%, empleando enzimas como α-1,4-glucosidasa y Exo-1,4-α-glucosidasa, sin embargo, para lograr estas tasas de reacción es requerida una gran cantidad las mismas, y estas, por efecto de solubilidad y purificación del material obtenido no se pueden recuperar (Ahmed and Abood, 2017; Oliveira et al., 2017).
En el presente trabajo los sistemas catalíticos evaluados presentaron una alta actividad específica (Figura 6), teniendo en cuenta que, en 3 horas se alcanzó un porcentaje de hidrólisis cercano al 40 % con una carga enzimática baja, demostrando que este tipo de sistemas catalíticos podrían usarse para procesos de hidrólisis de almidón previa estandarización y optimización de su desempeño.
CONCLUSIONES
Los sistemas catalíticos han demostrado ser eficientes en el modelo de hidrólisis, estos son producidos de forma económica, teniendo en cuanta que se pueden generar a partir de medios elaborados con subproductos de la cadena productiva del arroz y con un soporte alternativo de bajo coste en el mercado, demostrando así una relación costo beneficio favorable teniendo en cuenta que alcanzaron tasas de hidrólisis del 40%, evidenciando que esta es una posible alternativa a los procesos industriales comunes, en este sentido, el uso de almidón de arroz para la obtención de dextrinas, etanol, edulcorantes, almidón parcialmente hidrolizado, entre otros, es una alternativa para generar valor agregado sobre la cadena productiva del arroz.
Por el contrario, los resultados obtenidos para el modelo de acilación permiten apreciar una modificación mayormente química que bajo las condiciones evaluadas en este modelo es mediada por los ácidos orgánicos empleados. A pesar de esto, se lograron obtener materiales con características variables, lo cual podría ampliar la gama de usos que presenta el polímero.
Cabe destacar el alto contenido proteico producido por los microorganismos en particular en el medio elaborado a partir de salvado de arroz. Por último, resaltar que la falta de actividad de los biocatalizadores bajo las condiciones de reacción evaluadas para el modelo de acilación puede estar dada por una baja afinidad de las enzimas producidas por los hongos hacia los ácidos orgánicos empleados, por tanto, se sugiere para estudios posteriores evaluar ácidos orgánicos con longitudes de cadena mayores con el fin de establecer el potencial que presentan estos sistemas para su empleo en la acilación de almidón.