INTRODUCCIÓN
La avicultura es uno de los sectores pecuarios más importantes en el aporte de proteína de origen animal en Colombia, reflejado en el consumo per cápita de huevo (294 unidades) y de carne de pollo (34 kg), alcanzando una producción de 14.606 millones de unidades y de 1.624.000 toneladas respectivamente, para el año 2018 según la Federación Nacional de Avicultores (FENAVI, 2019). Estos productos avícolas se caracterizan por tener un gran valor nutricional ya que aportan aminoácidos, vitaminas y minerales, fundamentales en la base de la alimentación (FENAVI, 2019).
En la producción avícola, diferentes factores influyen en el bienestar, desempeño y salud de los animales, entre estos el sustrato de la cama donde habitan los pollos de engorde (Dunlop et al., 2016). Este material, habitualmente contiene residuos de antimicrobianos, amoniaco, plaguicidas y patógenos zoonoticos, los cuales representan un peligro para las aves (Brooks et al., 2016). Después de su uso en la avicultura, la cama es utilizada como fertilizante, muchas veces sin un tratamiento correcto, contaminando el medio ambiente e incluso los vegetales cultivados para consumo humano, lo que podría desencadenar brotes de Enfermedades Transmitidas por Alimentos (ETA) (Agostinho et al., 2020).
Por tal razón, es necesario prestar atención a los factores involucrados en el sistema de producción avícola, siendo el manejo de la cama uno de los factores más importantes (Brooks et al., 2016); teniendo en cuenta que patógenos como Salmonella spp. y Campylobacter spp. Son frecuentemente aislados de este material, los cuales son agentes etiológicos de la salmonelosis y campilobacteriosis en humanos y comúnmente son asociadas con el consumo de productos avícolas (Kagambèga et al., 2018). Así mismo, estudios epidemiológicos relacionados a estas enfermedades en aves de corral, junto con las altas incidencias de ETA, indican que las medidas de control de estas enfermedades son insuficientes (Premarathne et al., 2017; Castañeda-Salazar et al., 2018).
Por consiguiente, el objetivo de la presente revisión, es discutir la importancia de la cama de aves de corral en la seguridad alimentaria y sus riesgos como fuente de contaminantes, con el fin de generar un referente en Colombia, para que se realicen controles sobre este material y se asegure su calidad e inocuidad y así puedan ser usados en la avicultura y la agricultura.
DESARROLLO DEL TEMA
Propiedades de la cama
La cama es el material que cubre el piso del galpón, la cual contribuye al bienestar y el desarrollo adecuado a las aves, se utiliza para reducir fluctuaciones de temperatura, absorber el agua, incorporar heces, orina y plumas (Bolan et al., 2010; Dunlop et al., 2016). Además, interfiere en la sanidad del galpón, debido al hábito de consumo de cama y el contacto directo de los animales con este material (Wang et al., 2016; Stojcic et al., 2016). Entre los insumos aprovechados como sustrato para la cama se encuentran: la cascarilla de café, mazorca de maíz molida, viruta de madera, cascarilla de fríjol, paja de heno, cáscara de papa, cáscara de coco, cáscara de maní y cascarilla de arroz (Wang et al., 2016; Stojcic et al., 2016).
Después de la cría de un lote de aves de corral, la cama se composta junto con las excretas y bacterias entéricas de los animales, residuos de la dieta, plumas e insectos (Wang et al., 2016); dando origen a una combinación rica en nitrógeno, fosforo y potasio, nutrientes importantes para la multiplicación de los microrganismos (Paterlini et al., 2017). En un lote de pollo de engorde se producen aproximadamente 6,9 kg de pollinaza por cada 1000 kg de peso vivo por día (Bolan et al., 2010), obligando al sector agrícola a buscar alternativas sostenibles para el uso de estos desechos. Por esta razón, la reutilización de la cama en pollos de engorde es una práctica común en la avicultura moderna, debido a su alto costo, escasez y material contaminante (Vaz et al., 2017). Sin embargo, este reúso causa un aumento en la humedad, pH, amoníaco y diversidad de microorganismos principalmente patógenos, los cuales pueden transmitirse de un ciclo productivo a otro (Wang et al., 2016; Vaz et al., 2017).
Patógenos de transmisión alimentaria en la cama
Entre los microorganismos aislados en camas de aves de corral se encuentran patógenos productores de ETA tales como: Salmonella spp, Streptococcus, Campylo- bacter spp, Corynebacterium, Listeria monocytogenes, Globicatella, Bordetella, Es- cherichia coli, Clostridium perfringens, Clostridium botulinum y Staphylococcus aureus (Bolan et al., 2010) como se muestra en el cuadro 1.
Cuadro 1 Patógenos en cama y heces de aves de corral, fuente de infección para humanos y síntomas de las infecciones.
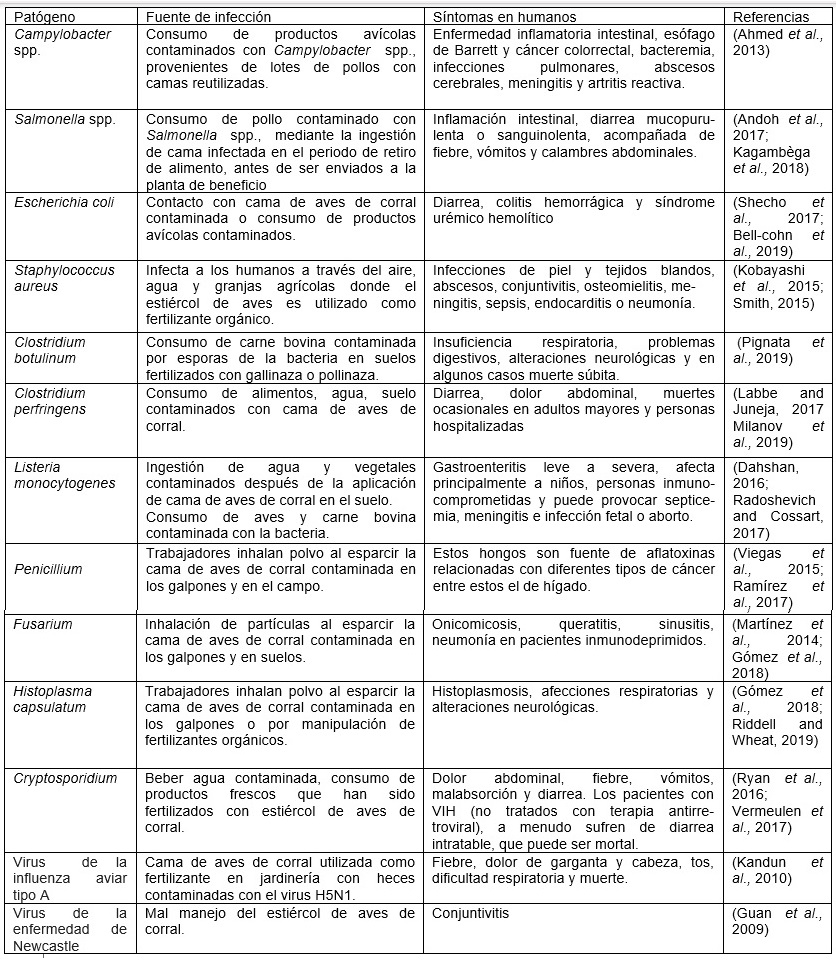
Estos patógenos pueden transmitirse de un ciclo productivo a otro por diversos factores como son el reúso de la cama sin tratamientos adecuados por varios lotes consecutivos, el hábito de consumo de cama por las aves y el contacto directo de los animales con este material, pudiendo provocar un aumento de la trasmisión de estos microorganismos dentro de la cadena alimentaria hasta el consumidor (Dunlop et al., 2016; Wang et al., 2016). Ejemplo de ello son las relaciones fenotípicas y genéticas encontradas entre S. Enteritidis aislada de humanos con gastroenteritis y aves de corral en el Tolima (Fandiño and Verjan, 2019).
Así mismo, los brotes de ETA presentados en Colombia en los últimos tres años (2017- 2019), pueden estar influenciados por la contaminación de los pollos de engorde en las granjas, debido a que los productos de origen animal (cárnicos, principalmente el pollo) fueron los alimentos mayormente involucrados, siendo los agentes etiológicos hallados con mayor frecuencia: Escherichia coli, Salmonella spp, Staphylococus aureus y Coliformes fecales (patógenos reportados en cama de aves de corral) Instituto Nacional de Salud (INS 2017, 2018, 2019).
Otros factores que pueden influir en la transferencia de patógenos presentes en las camas a los humanos es el uso de la gallinaza o pollinaza como acondicionadores de suelos sin un tratamiento correcto, dado que los microorganismos al llegar a este ambiente pueden contaminar vegetales, como la lechuga, espinacas y tomate, que al consumirse de forma cruda representan un mayor riesgo (Fang et al., 2015; Shah et al., 2019).
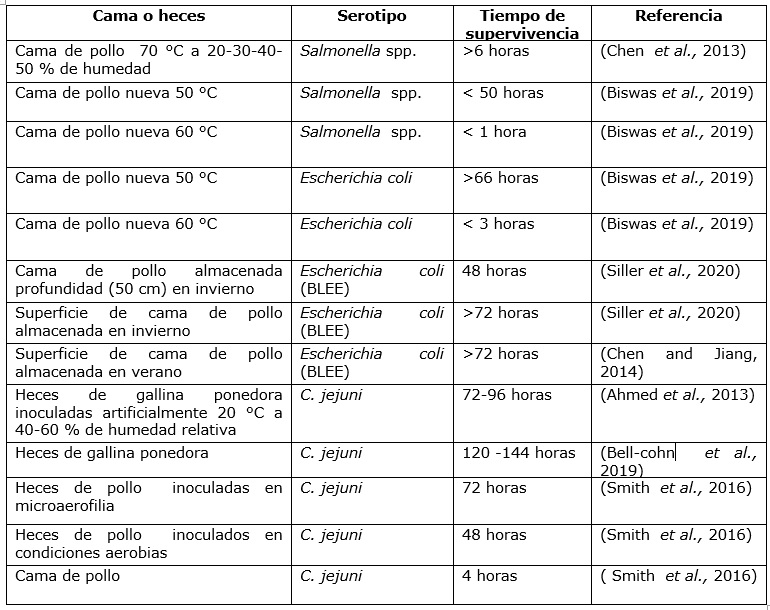
Salmonella spp. y Campylobacter spp. son los microorganismos de mayor distribución en camas de aves a nivel mundial, su supervivencia depende del serotipo, manipulación de la cama, edad de las aves, área geográfica y época del año (Li et al., 2007) (cuadro 2). Salmonella spp. se puede encontrar en cama de pollo de engorde de 1,1 a 4 × 105 UFC/g, (Unidades Formadoras de Colonias); con un porcentaje de aislamiento variable, con valores del 50 % en Mumbai, India; del 53,33 % Gobernación de Beni Suef (Ibrahim et al., 2013); y del 72 % en Kyushu, Japón (Yamazaki et al., 2016).
Cuadro 2 Tiempo de supervivencia de patógenos de transmisión alimentaria en cama y heces de aves corral
Otros de los contaminantes encontrados con frecuencia en la cama son los residuos de antibióticos, utilizados en la avicultura para prevenir y tratar enfermedades infecciosas o como promotores del crecimiento animal (APC) (Xiong et al., 2018), los cuales se suministran en dosis subterapéuticas en la dieta de las aves, con el fin de aumentar la tasa de crecimiento, rendimiento productivo y proteger la salud de los animales al modificar el sistema inmunológico (Gonzalez and Angeles, 2017).
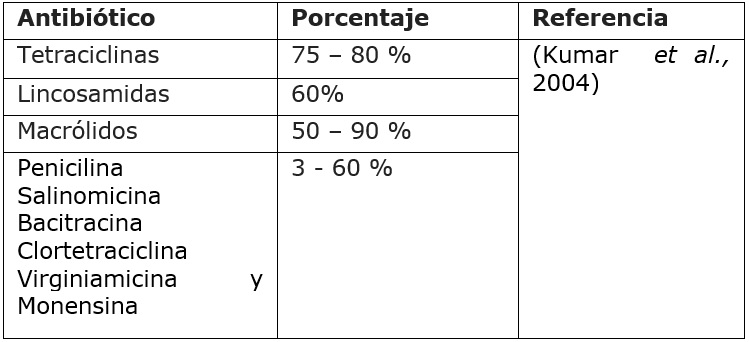
Entre los APC manejados en la industria avícola se encuentran: la enramicina, bacitracina de zinc, virginiamicina, avilamicina, entre otros, los cuales no se absorben completamente en el intestino de los pollos y hasta un 90 % de la dosis administrada puede excretarse en las heces (Yang et al., 2017) (Cuadro 3); motivo por el cual se han detectado trazas de antibióticos y bacterias resistentes a los antibióticos en suelos y cultivos fertilizados con gallinaza o pollinaza, lo que podría generar un riesgo potencial para la salud humana (Kassem et al., 2017).
En este sentido, a nivel mundial se han desarrollado investigaciones con el fin de determinar los mecanismos y perfil de resistencia bacteriana en camas de aves de corral, es así, como Nandi et al. (2004) cuantificaron genes de resistencia a los antibióticos e integrones y encontraron que el reservorio principal para los integrones de Clase 1, son las bacterias Gram-positivas, las cuales constituyen más del 85 % de la comunidad microbiana presente en camas de aves. Islam et al. (2008) investigaron la relación entre el uso de antibióticos y el desarrollo de resistencia en cepas de E. coli aisladas de cama, en Chittagong, Bangladesh, donde encontraron que todos los aislados eran sensibles a imipenem y a su vez expresaron resistencia a múltiples antibióticos, como, ciprofloxacina (30 %), gentamicina (50 %), eritromicina (66,6 %), tetraciclina (96,6 %), penicilina (100 %), y cloranfenicol (100 %). Los investigadores concluyeron que los aislados de E. coli multirresistentes y los plásmidos que contienen genes resistentes a múltiples antibióticos están presentes en las granjas avícolas y las aves pueden actuar como una posible fuente de transferencia de estos estos patógenos y sus genes a humanos.
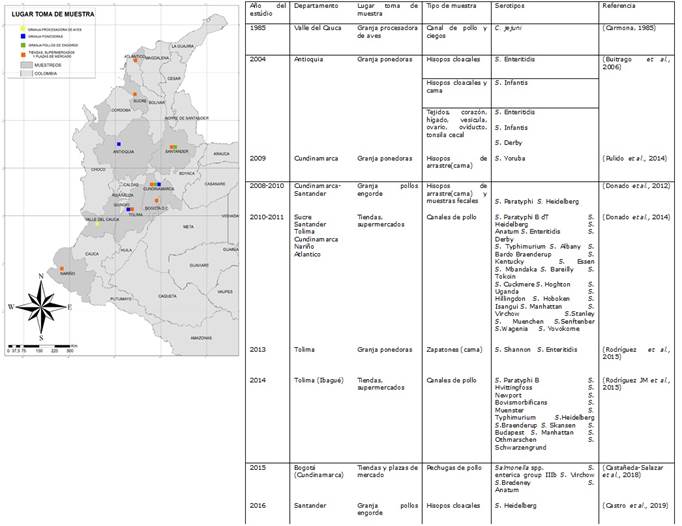
Figura 1 Departamentos y tipos de muestras dentro de la cadena avícola en los cuales se aislado Salmonella y Campylobacter
Según la Organización Mundial de la Salud (OMS, 2014), la resistencia antimicrobiana se ha transformado en un importante problema para la salud pública, principalmente cuando se origina frente a antimicrobianos de primera línea de elección, ya que la principal amenaza es que a corto plazo no existirán antimicrobianos para tratar este tipo de bacterias resistentes en la medicina humana; aproximadamente 7,000,000 muertes por año en el mundo se han asociado a esta problemática (Xie et al., 2018).
Adicional a los contaminantes mencionados, cuando las camas son sometidas a tratamientos térmicos inadecuados, se genera dioxinas como subproducto del uso de antibióticos y anticoccidiales clorados como el amprolio, diclazuril y clopidol (Kyakuwaire et al., 2019; Liu et al., 2019). Las cuales tienen un efecto disruptor endocrino, carcinogénico y mutagénico en animales y humanos (Kyakuwaire et al., 2019; Conesa et al., 2019). Por esta razón es importante tener en cuenta la temperatura y el tiempo de incineración de la cama, cuando se va utilizar como fuente de energía o para su eliminación.
Manejo y tratamientos de la cama
En las buenas prácticas de manejo de la cama en los sistemas de producción avícola, se deben considerar la elección del material que la constituyen, tratamiento y condiciones en las cuales debe ser retirada del galpón al final del ciclo productivo, ya que al tener en cuenta estos factores se contribuye a reducir los malos olores y las características favorables para la supervivencia de patógenos en este ambiente. Con base a lo anterior, en el presente estudio se realizó una encuesta a profesionales directores de granjas productoras de material genético registradas ante el Instituto Colombiano Agropecuario (ICA) con registro vigente al año 2020, a fin de evidenciar las prácticas de manejo de la cama en este sistema de producción. Se encontraron 148 granjas registradas, de las cuales fue posible obtener información de 101. Se elaboró una encuesta con cinco preguntas de tipo cerrada y una de tipo abierto, la cuales fueron enviadas por correo electrónico, datos que fueron tabulados para realizar un análisis descriptivo y porcentual de los mismos.
Se evidenció que la mayoría se encuentran en el Valle del Cauca (53 %) y Cundinamarca (31 %) y en una menor proporción en los departamentos de Tolima (7 %), Atlántico 6 %) y Santander (3 %). Se logró constatar que el material predominante utilizado como cama fue viruta de madera (62 %) y cascarilla de arroz (38 %), lo cual dependía principalmente de la oferta de estos subproductos en la región. Es de resaltar que la viruta de madera resulta ser una elección que favorece la inocuidad de la cama, dado que la madera contiene metabolitos con efecto antimicrobiano (Vainio et al., 2017), además posee una buena capacidad de absorción de la humedad, disminuyendo la supervivencia de patógenos en este material (Farhadi, 2014).
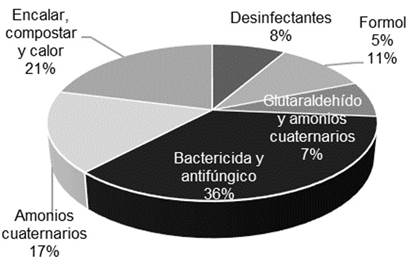
Así mismo, se encontró que antes del ciclo productivo la mayoría de las granjas (98%) realizan algún tipo de tratamiento de la cama, siendo el uso de bactericidas y antifúngicos el de mayor elección, seguido del uso de cal y calor (figura 2). Este tipo de procedimientos reduce el crecimiento de patógenos (Sheffield et al., 2018) y con ello disminuye el riego de infección en las aves.
Por otro lado, también se encontró que terminado el ciclo de producción, el 79 % de las granjas realizaban sanitización como tratamiento final de las camas y el restante compostaje, para realizar un seguimiento del control microbiológico de las camas el 74 % de las granjas realizaban este tipo de análisis, tanto en las camas antes de la entrada de las aves, durante el ciclo productivo o después del tratamiento final. Otro de los resultados encontrados a través de este estudio, fue que el 88 % de las granjas vendían la gallinaza y el 22 % la utilizaban como abono y fertilizante, indicando que todo el material obtenido al final del proceso productivo tenía un uso posterior. Esto indica que realmente es fundamental conocer el estado microbiológico de las camas, para poder plantear y tomar medidas que contribuyan a la reducción de la carga de patógenos y por lo tanto evitar infección en las aves. Igualmente, es necesario resaltar que así el material de la cama sea sometido a algún tipo de tratamiento es necesario realizar de nuevo análisis microbiológicos que permitan verificar la eficacia de los mismos, ya que a pesar de que el compostaje es un método adecuado para eliminar patógenos, antibióticos y genes de resistencia a antibióticos (ARG) en el estiércol (Soliman et al., 2018), se ha encontrado que la eficacia de este proceso es cuestionable, puesto que es posible que la técnica no siempre sea suficiente para garantizar la inactivación completa de los patógenos y la reducción de los ARG dentro de toda la masa de compost (Castañeda-Salazar et al., 2018; Agostinho et al., 2020). Además, existe otra preocupación como es la presencia de los metales pesados, los cuales no se degradan y / o eliminan, por el contrario pueden concentrarse durante el proceso de compostaje, lo que representa una presión de selección bacteriana a largo plazo (Yang et al., 2017).
Es importante resaltar que un tratamiento deficiente de este material podría comprometer la salud y bienestar de los animales, por consiguiente es un riesgo para la salud pública; ejemplo de ello es la contaminación cruzada de las canales en el momento del beneficio, donde animales que han sido criados en camas contaminadas por bacterias causantes de ETA pueden ser fuente de transmisión para los seres humanos, ya que la cama interfiere en la composición de la microbiota gastrointestinal de las aves (Wang et al., 2016).
Por esta razón, un buen tratamiento de las camas es vital para reciclar grandes cantidades de desechos orgánicos que son una fuente importante de fertilizantes para uso agrícola (De Melo et al., 2019). En este sentido, con el fin de disminuir olores desagradables, niveles de amoniaco y carga de patógenos en las camas, son utilizados procedimientos químicos, físicos y biológicos (Kim et al., 2012; Pereira, 2016; Thomas et al., 2019).
Tratamientos químicos. Diversos tratamientos químicos modifican el pH de la cama, entre los que se encuentran; el sulfato de aluminio el cual presenta actividad inhibitoria del crecimiento de Escherichia coli, Salmonella spp. y Campylobacter spp. (Arsi et al., 2017) y la cal viva o cal hidratada, que se utiliza para desinfectar y estabilizar la cama antes del ingreso de las aves al galpón, debido a que reduce la cantidad de agua libre y además eleva el pH por encima de los rangos de tolerancia de la mayoría de los patógenos entéricos (Saraiva et al., 2019). Aunque los tratamientos químicos son recomendados para la reducción de patógenos en cama de aves, se debe tener en cuenta que la microbiota interfiere con la eficacia de estos compuestos haciendo que este tipo de tratamientos a grande escala sea poco rentable (Chen and Jiang, 2014).
Tratamientos físicos. Son aconsejados para reducir o eliminar patógenos en los desechos animales y los principales factores que deben ser considerados para que sean eficientes son: temperatura, duración del proceso y grado de humedad (Kim et al., 2012; Arsi et al., 2017; Thomas et al., 2019). Para producir un producto tratado con calor que arroje un resultado negativo o menor del límite de detección para Salmonella spp. en cama de pollo, el rango de temperatura debe ser de 65 a 80 °C durante 30 a 60 minutos (Kim et al., 2012).
El calor seco con compostaje o sin compostaje es uno de los métodos más empleados, sin embargo, algunos patógenos pueden soportar altas temperaturas, como Salmonella Typhimurium adaptada a la desecación en cama de pollo de engorde, gracias a la activación de los genes rpoS (regulador de larespuestadeestrés general), proV (osmoprotector), dnaK (proteína chaperona) y grpE ( proteínas de choque térmico) (Chen and Jiang, 2017), otro mecanismo de resistencia a condiciones adversas en desechos animales de este patógeno es su entrada en estado viable no cultivable, lo que representa un riesgo para la salud humana ya que las bacterias conservan su potencial infectivo (Chen et al., 2018).
Tratamientos biológicos. Con el fin de acelerar procesos de compostaje, disminuir niveles de amoniaco y malos olores en camas en granjas avícolas, se utilizan microorganismos eficientes como bacterias ácido láctico, levaduras, hongos y actinomicetos, microorganismos inocuos para los seres humanos y los animales (Pereira, 2016).
Compostaje. Proceso biológico mediante el cual los microorganismos trasforman la materia orgánica biodegradable en productos estables similares al humus, donde se genera calor el cual inactiva los patógenos de origen animal presentes en estos residuos (Chen et al., 2018). Su efectividad depende de la temperatura, suministro de oxígeno, contenido de humedad, pH, relación carbono/nitrógeno (C/N), tamaño de partícula, grado de compactación y microbiota autóctona (Kim et al., 2012; Paterlini et al., 2017). Involucra tres fases: mesófila, termófila (etapa de compostaje activo, llega a una temperatura óptima de 60 °C, donde los patógenos entéricos generalmente son inactivados) y una fase de curación donde se da una disminución del calor hasta lograr una temperatura ambiente al final del proceso (Ren et al., 2018); la humedad optima en estas fases es de 40-60 %, vale resaltar que humedades muy altas (> 70 %) o bajas (< 40 %) pueden desacelerar o inhibir el proceso biológico (Singh and Kalamdhad, 2015).
Aunque el producto final del compostaje es considerado como un buen fertilizante, de alta calidad y seguro, prácticas de manejo inapropiadas, como no volcar las pilas, no usar cubiertas aislantes para evitar disparidades en la estratificación de la temperatura, pueden conducir a la supervivencia de patógenos (Thomas et al., 2019). Finalmente, después de este proceso es importante tener en cuenta las condiciones y tiempo de almacenamiento del material antes de ser utilizado como enmienda, debido a que periodos largos, relación carbono/ nitrógeno, propiedades fisicoquímicas y microflora adaptada del compost, afectan la inactivación térmica de patógenos (Kim et al., 2012; Chen et al., 2018).
RECOMENDACIONES
Es recomendable realizar análisis microbiológicos a las camas de aves antes, durante y después del ciclo de producción para asegurar la salud de las aves, medio ambiente, animales y humanos. No se debe utilizar gallinaza o pollinaza fresca sin tratamiento, ya que esta práctica contribuye a la diseminación de residuos nocivos, antibióticos, patógenos y sus genes de resistencia. Por otro parte, en Colombia son necesarios estudios que evalúen la supervivencia de patógenos en camas de aves con materiales como viruta de madera y cascarilla de arroz, igualmente en fertilizantes orgánicos derivados de la avicultura con el fin de evaluar el riesgo del uso de estos materiales ya que la mayoría de estudios son en países desarrollados y con diferentes condiciones climáticas.
CONCLUSIONES
En conclusión, con base a la importancia que tiene la cama de aves de corral como fuente indirecta de patógenos y residuos nocivos para los humanos, independientemente del material utilizado para este fin, es necesario realizar procesos adecuados, enfocados al manejo de olores, residuos de antibióticos, patógenos zoonóticos o de transmisión alimentar, que puedan causar problemas de salud pública y de seguridad alimentaria. Además, en Colombia existe la necesidad de generar normas para regular los límites de residuos de antibióticos y metales pesados permitidos en desechos avícolas, datos que ayudaran a buscar estrategias para el control de la cama y con ello poder direccionar cual es el uso que se le puede dar después de la cría de aves o como debe ser su disposición final.