INTRODUCCIÓN
El propóleo es reconocido en todo el mundo, ha sido registrado en el Chemical Abstracts Service (CAS) 9009-62-5, como un producto natural elaborado por distintos géneros de abejas, a partir de exudaciones mucilaginosas, gomas, materiales lipofílicos, látex y material resinoso de plantas, que traen a sus colmena y mezclan con secreciones glandulares de la hipofaringe y glándulas cereras. Son de consistencia pastosa, con tonalidades castaño, marrón, pardo, rojizo y verde, según el origen botánico y geográfico (Anjum et al., 2019; El-Guendouz et al., 2019). Estos productos han llamado la atención en relación a la salud de las abejas y se ha determinado su papel como protector, antiséptico de la colmena y responsable de la salud e inmunidad frente a los agentes infecciosos (Ciftci-Yilmaz et al., 2017; Anjum et al., 2019). En las regiones tropicales, las abejas encuentran diversas fuentes de elaboración, por tanto, su composición química es diferente y variable debido a la riqueza y diversidad de la flora tropical. Existen en la literatura reportes de un sinnúmero de propiedades biológicas sobre los propóleos que actúan como antitumorales, antiprotozoarios, anticancer (Sforcin, 2016; Omar et al., 2017), antihipertensivos, antimicrobianas, antiinflamatorias, antihepatotóxicos y antivirales, entre otras (Veiga et al., 2017; El-Guendouz et al., 2019; Touzani et al., 2019).
Los componentes químicos de los propóleos varían de acuerdo a las fuentes botánicas y a las áreas biogeográficas donde están instaladas las colmenas. Los métodos instrumentales de análisis, actualmente han permitido identificar en matrices de propóleos alrededor de 350 compuestos fitoquímicos (Guzelmeric et al., 2018; Touzani et al., 2019). Considerando la demanda de este tipo de productos, es indispensable establecer los parámetros para identificar el control de calidad de los propóleos de las regiones. El advenimiento y desarrollo de los métodos cromatográficos de análisis han posibilitado el estudio y cuantificación de principios activos presentes en distintas matrices de propóleos (Ahmed et al., 2017; Drescher et al., 2017).
La actividad antibacteriana es la más estudiada, se conoce el efecto de extractos etanólicos de propóleos frente Salmonella typhimurium, Enterobacter aerogenes, Yersinia enterocolitica, Escherichia coli, Staphylococcus aureus, Staphylococcus epidermidis, Bacillus cereus, Listeria monocytogenes, S. saprophyticus, E. faecalis (Zainullin et al., 2018; Seibert et al., 2019; Przybyłek et al., 2019; Veloz et al., 2019). En Colombia, las investigaciones realizadas sobre actividad biológica in vitro de propóleos han sido reportadas desde la región Andina, Boyacá, Caldas, Cundinamarca y Santander (Bastos et al., 2011; Talero et al., 2012; Herrera et al., 2012; Martínez et al., 2012; Velásquez y Montenegro, 2017). Esta actividad frente a patógenos ha sido atribuida a la presencia terpenos, flavonoides y antraquinonas, principalmente.
La producción de propóleos en Colombia ha sido relacionada desde diversas zonas biogeográficas. Algunos trabajos sobre caracterización y cuantificación en muestras de Arauca, Boyacá y San Andrés (Salamanca y Osorio, 2018) y sobre el perfil mineral de muestras de propóleos del Tolima (Salamanca et al., 2004). Adicionalmente, se han reportado trabajos sobre actividad antioxidante de propóleos colectados en Atlántico y Santander (Rodríguez et al., 2012; Herrera et al., 2012). La concepción de propóleos más actualizada entorno a su control de calidad, consiste en la determinación de sus propiedades fisicoquímicas y la estimación de su actividad biológica. En este contexto, el objetivo de este trabajo se ha centrado en el estudio de las propiedades fisicoquímicas, perfilación organoléptica, estimación de componentes minerales, así como la actividad biológica de muestras de propóleos colectados en tres zonas de biogeográficas de Nariño.
MÉTODO
Reactivos
Todos los reactivos usados en este trabajo fueron de grado analítico: etanol, metanol, acetato de etilo, acido fórmico y tolueno (Sigma Aldrich de Steinheim, Germany), aminoetildifenilborinato (Fluka Steinheim, Germany), polientilenglicol, ácido sulfirico, hidróxido de potasio (Merck, Hohenbrunn, Germany), patrones de pinocembrina, galangina, pinobanksina, naringenina, ácido cafeico, crisina, quercetina y apigenina (Sigma-Aldrich) y 2,4 dinitrofenilhidrazina (2,4D) (Merck, Alemania).
Muestras
Se colectaron nueve muestras de propóleos de tres zonas biogeográficas diferentes, bosque húmedo montano bajo (bh-MB), muy húmedo premontano (bh-PM) y muy húmedo premontano (bmh-PM), para las localidades de Buesaco (1º23´05”N y 77º09´23”O, 1959 msnm, 18 ºC, 1472 mm/año), San Juan de Pasto/Catambuco, Vereda Botana, (Pasto, 1º12´49”N y 77º16´52”O, 2534 msnm, 13 ºC, 1273 mm/año) y La Unión (1º36´19”N, 77º07´47”N, 1726 msnm, 19 ºC). Las colectas se realizaron siguiendo criterios de aleatoriedad, con tres niveles de tratamiento y tres repeticiones. La toma de muestras fue realizada usando raspado directamente desde el interior de las colmenas tipo Langstroth removiendo el producto adherido en las caras laterales, tapa, entretapa y alzas. El material se dispuso en frascos ámbar tipo twist off de 250 mL y almacenado a -10 ºC, hasta el momento del análisis.
Parámetros fisicoquímicos
Se registró el peso, aspecto, textura, color, olor, sabor e impurezas visibles de los propóleos colectados, así como los puntos de fusión, contenido de humedad, sólidos fijos, cenizas, masas mecánicas, resinas y ceras. Para el análisis de cenizas, se evaluó el contenido mineral mediante espectrofotometría de absorción atómica de calcio, cobre, hierro, magnesio, manganeso, níquel, potasio, sodio y zinc. En el extracto etanólico (EEP) se cuantificó la acidez total, pH, fenoles y flavonoides totales, siguiendo los métodos descritos por Salamanca (2017). La acidez se determinó sobre 50 mL de agua destilada, libre de CO2 en presencia de fenolftaleína y el volumen total de la solución de hidróxido correspondió a la fracción ácida presente expresada como porcentaje de ácido tartárico. El contenido de fenoles totales, las flavonas, flavonoles, flavanonas y dihidroflavonoles, se determinaron por espectrofotometría UV-Vis. Los fenoles se determinaron siguiendo los protocolos descritos por Baba y Malik (2015) y se expresaron como mg/g de EEP. Las flavonas, flavonoles, flavanonas y dihidroflavonoles, se realizaron usando metodologías descritas por Kasiotis et al. (2017) y Betances-Salcedo et al. (2017), los resultados fueron expresados como mg/g. Las evaluaciones sensoriales se adelantaron siguiendo criterios de Meilgaard (2015), usando escala hedónica sobre seis atributos que fueron evaluados por cinco jueces entrenados. El perfil densitométrico de los extractos se realizó mediante técnicas cromatográficas de alta eficiencia (HPTLC), conforme a Salamanca y Osorio (2018).
Las determinaciones de minerales se realizaron usando espectrofotometría de absorción atómica, haciendo uso de lámparas de cátodo hueco por elemento: Calcio, Hierro, potasio, magnesio y manganeso. El índice de oxidación se midió en extractos alcohólicos (EEP), siguiendo la metodología descrita por Salamanca (2018). La absorbancia específica de los espectros UV-Vis de los EEP, se obtuvo por el método de Miyataka et al. (1997) a la longitud de onda de máxima absorción, usando espectrofotómetro UV-Vis Genesys 10s. Además, los EEP, se evaluaron usando técnicas de espectroscopía FT-IR en la unidad Perkin Elmer Spectrum One spectrometer (Perkin Elmer, USA(), la proyección final de los espectros se realizó haciendo uso del paquete Origin(2019. Los análisis mediante LC-ESI(−)-MS/MS procedieron tras la homogenización mediante ultrasonido, filtración y centrifugado, a través de espectrometro de masas MS/MS, usando un sistema a 7,2T LTQ FT Ultra (Thermo Scientific), dispuesto con chip-based direct infusión, nanoelectrospray ionisation source, la adquisición de datos se realizó en el rango 150-800 m/z, siguiendo la metodología descrita por Sawaya et al. (2011).
Actividad biológica
La actividad antibacteriana de los EEP, se determinó conforme a los protocolos de Farmacopea Americana USP 24, (Cupull-Santana et al., 2013), operando métodos difusionales sobre bacterias Gram (+) de Streptococcus y bacterias Gram (-) de Escherichiae, las cuales fueron cultivadas en agar tripticasa de soya bajo condiciones aeróbicas por 18 h a 37(1 ºC. En las determinaciones se usaron los métodos de difusión por pozos y de Kirby-Bauer. El crecimiento de los microorganismos y la difusión del antibiótico se estimaron de acuerdo con el tamaño de las zonas de inhibición a 24, 48 y 72 horas. El mismo procedimiento fue aplicado a un control de etanol al 80 %, la solución de concentración de 10 mg/mL fue preparada a partir de la solución estándar de sulfato de estreptomicina (0,1 % p/v) en agua destilada estéril con buffer fosfato pH 8,0.
Estadística
Las determinaciones analíticas se realizaron por triplicado en cada una de las muestras colectadas. En todos los casos se estimó el promedio, desviación estándar y coeficientes de variación de cada parámetro. Las evaluaciones para el análisis de varianza de una vía se efectuaron haciendo uso del paquete estadístico JMP14TM. Las evaluaciones densitométricas de los perfiles de cromatografía de capa fina de alta eficiencia (HPTLC) haciendo uso del software libre ImageJ (Wayne Rasband, NIH, USA).
RESULTADOS
Los propóleos estudiados corresponden a los tipos III, IV y V, que corresponden a las zonas biogeográficas enmarcadas y consistentes con los observados en otras muestras de zonas tropicales (Salamanca, 2017). Los extractos etanólicos de los propóleos de las zonas de estudio presentarón un carácter ácido, las diferencias en este parámetro pueden ser explicadas teniendo como referencia factores climáticos, la oferta floral y el tiempo en el cual las abejas han propolizado las colmenas.
Los promedios para el contenido de cenizas entre muestras presentan diferencias significativas, siendo mayor en los propóleos de Pasto con 1,70 %. Los tenores de cera oscilaron entre 10,1 y 19,0 %. La mayor proporción de masas mecánicas se observaron en las muestras de Pasto, respecto de las otras dos zonas. Las resinas, son indicativas de la calidad del producto en términos de la actividad antioxidante, sus valores oscilaron entre 50,2 y 60,3 % (Cuadro 1).
Cuadro 1 Parámetros fisicoquímicos asociados a muestras de propóleos de tres zonas biogeográficas de Nariño.
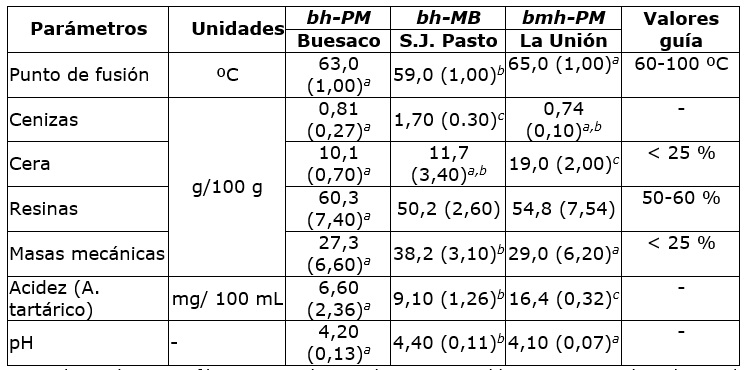
Letras iguales en la misma fila corresponden a valores comparables entre promedios observados en muestras. Desviación estándar (ds).
Las determinaciones de minerales, son menos frecuentes en muestras de propóleos y exponen variabilidad en el perfil de los elementos analizados. Los promedios observados presentaron menor variación para el contenido de hierro en las muestras de Pasto, frente a los de la Unión y Buesaco. Los elementos más representativos en todos los casos correspondieron a sodio y potasio (Cuadro 2).
Cuadro 2 Componentes de la fracción mineral de muestras de propóleos de tres zonas biogeográficas de Nariño.
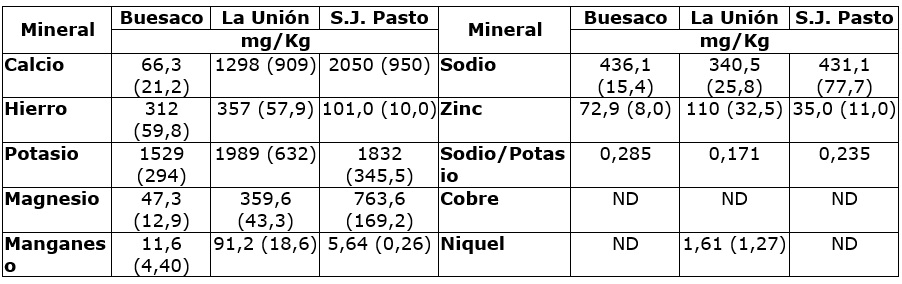
Desviación estándar (ds). ND: No determinado.
Los contenidos de fenoles presentaron diferencias importantes entre los grupos de muestras, valores están correlacionados con los promedios observados para flavanonas, flavonas y flavonoles, que también concuerdan con los tiempos de oxidación (Cuadro 3). El parámetro E1cm 1 % de la absorción UV-Vis, es otro de los parámetros fisicoquímicos usados para evaluar la calidad de los extractos de propóleos y se relaciona con la actividad biológica de metabolitos secundarios como ácidos fenólicos y flavonoides. Los valores de E1cm 1 % de las muestras, presentaron valores entre 77 y 370, siendo menores en los extractos de Buesaco, respecto de los extractos de la Unión y Pasto.
Cuadro 3 Compuestos fenólicos e índices de oxidación de EEP de tres zonas biogeográficas de Nariño.
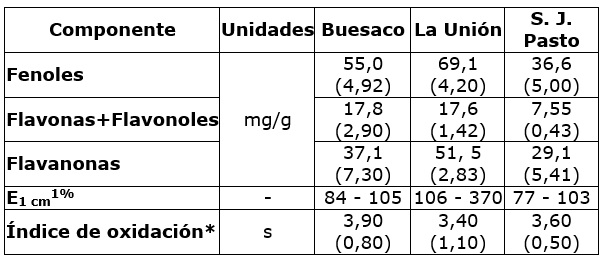
(*) En EEP. Valor guía (22 s). s: seguindos. Desviación estándar (ds).
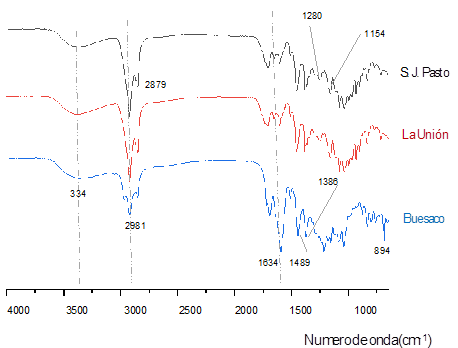
La huella espectral FT-IR de los extractos de propóleos estudiados son característicos (Figura 1), se observaron señales con oscilación y vibración (cm−1) de grupos alifáticos (2930 y 2876), carbonilo (1660-1680), hidroxilo (3200-3650) y anillos aromáticos sustituidos (1500, 1580 y 1600). Las bandas de absorción (3300-3600 cm−1), se relacionaron con grupos -OH de flavonas hidroxiladas, isoflavonoides con una banda significativa a 1680 propia de grupos carbonilo, a 1620 cm−1, otras señales características se presentaron a 1440 cm-1, 1283 y 1231 cm-1 que son frecuencias de vibración C=C-H propias de anillos aromáticos.
La inspección visual de los cromatogramas mediante HPTLC, en principio no revelaron diferencias mayores para los hRF, sin embargo, se identificaron bandas representativas de compuestos fenólicos, propios de los propóleos de Nariño. Se presentaron 13 metabolitos secundarios que se asocian en los cromatogramas con diferentes tonos de color, así: verde (apigenina, naringenina y crisina), naranja (quercetina) y azul (ácido cafeico, galangina, feruloil y p-derivados del ácido coumarico) y que concuerdan con otros reportes (Guzelmeric et al., 2018). Los análisis densitométricos, presentaron gran similitud en la composición de los EEP de las muestras de Buesaco y La Unión, que difirieron ligeramente respecto de las de Pasto (Figura 2).
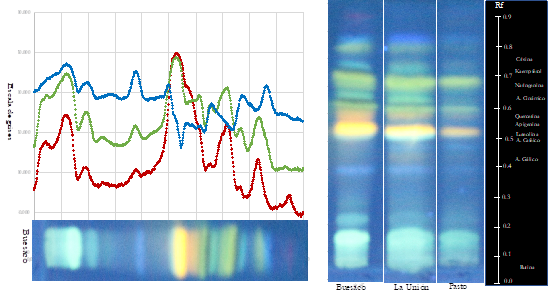
Figura 2 Huella dactilar y perfil densitométrico de cromatogramas de muestras de propóleos de tres zonas geográficas de Nariño.
La huella digital de los cromatogramas mediante técnicas LC-ESI(−)-MS/MS de los extractos de Buesaco y La Unión, presentaron patrones de fragmentación similares (Figura 3). La relación (m/z), reveló la presencia de acacetina (283), ácido cafeico (179), apigenina (269), fenetil éster de ácido cafeico (179), crisina (253), crisin-5-metilester (267), kaempferol (285), naringenina (271), pinocembrina (255), pinobanksina (271), quercetina (253), luteolin-8-O-glucósido (439) y pinocembrin 8-O-glucósido (439). En los análisis LC-ESI(−)-MS/MS de los EEP, se muestran patrones similares con otros tipos de propóleos reportados en la literatura (Hochheim et al., 2019). Las muestras analizadas presentaron un marcador (m/z: 501), que también ha sido identificado en muestras de Cuba y nordeste de Brasil (Cuesta-Rubio et al., 2007; López et al., 2014; Anjum et al., 2019).
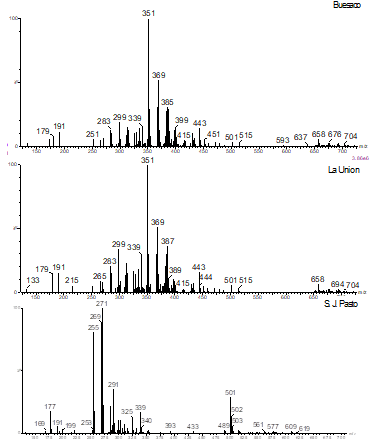
Figura 3 Patrón de fragmentación LC-ESI(-)-MS de muestras de propóleos de Buesaco, La Unión y S.J de Pasto, Nariño.
El perfil sensorial de las muestras de Buesaco y La Unión, presentó diferencias en el aspecto, con similitud en los descriptores olfativos y gustativos, que los diferencian de las muestras de Pasto (Figura 4). Las características organolépticas exhibieron aspectos plásticos, maleables, pegajosos y opacos, de tonos marrón con algunas tonalidades verdosas, aromas resinosos y elevada astringencia en muestras de Buesaco y la Unión, que difieren de las de Pasto, que presentaron tonos marrón, de aspecto terroso, resinoso, pegajoso y opaco, sus puntos de fusión mostraron valores similares entre 59 a 65 ºC.
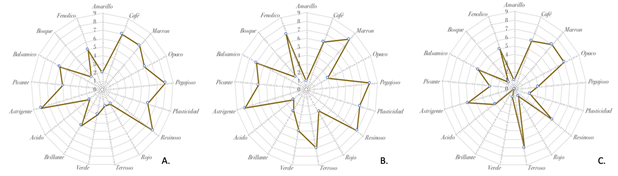
Figura 4 Perfil sensorial de los atributos asociados a muestras crudas de propóleos de las zonas de A. Buesaco, B. La Unión y C. S.J. Pasto, Nariño, Colombia.
En cuanto a la actividad biológica, se observó un importante efecto inhibidor de los extractos frente a S. aureus y E. Coli. Los halos de inhibición para E. coli y S. aureus observados mediante Kirby-Bauer, revelaron un ligero efecto de sensibilidad de los extractos respecto del método de difusión (Figura 5). El uso de estreptomicina como referencia a 10 µg/mL mostró mayores halos de inhibición en relación a los extractos de las muestras estudiadas. Los extractos de propóleos exhibieron mayor actividad frente a microorganismos Gram (+) que Gram (-), resultados que son similares a los reportados para S. aureus, S. saprophyticus, S.epidermidis y S. thermophilus, (AL-Ani et al., 2018), en tanto que los hallazgos y observaciones con los EEP de Nariño son comparables con los datos reportados por Selvaraj et al. (2018).
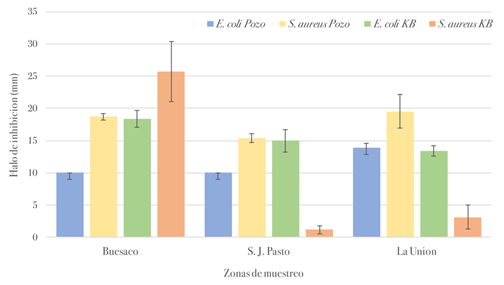
Figura 5 Actividad antibacteriana de extractos alcohólicos de propóleos de Nariño frente a E. coli (ATCC 9.341) y S. aureus (ATCC 25.923) métodos de Kirby-Bauer y difusión en pozos
El contenido de resinas observado en las muestras de Nariño fue superior a los valores encontrados en las de Atlántico (Rodríguez et al., 2012), Bajo Cauca (Viloria et al., 2012) y La Unión, Antioquia (Palomino et al., 2010). En cuanto a los minerales, los valores observados fueron menores respecto a otros propóleos reportados en la literatura (Salamanca et al., 2004). Los rendimientos de resinas del estudio, son concomitantes con los perfil de fenoles y flavonoides totales (mg/g), y con los reportados por otros investigadores (Delgado et al., 2015; Oliveira et al., 2016).
CONCLUSIONES
El trabajo permitió identificar y caracterizar tipos de propóleos de tres zonas biogeográficas del departamento de Nariño sobre atributos fisicoquímicos, sensoriales y actividad biológica. La huella digital de los espectros de infrarrojo y los cromatogramas HPTLC y ESI(−)-MS/MS), permitieron clasificar las muestras como tipo-O y tipo-B y categorías III a V, como propios de zonas altoandinas propias de región cafetera. El uso de técnicas espectrofotométricas complementarias y de cromatografía revelaron la presencia de metabolitos secundarios con potencial actividad biológica. El trabajo ha hecho posible demostrar la sensibilidad de los propóleos de Buesano, La Unión y S.J. Pasto, frente a S. aureus y E. coli, en la técnica de difusión en pozo y uso de sensidiscos. Los hallazgos contribuyen al estudio de matrices complejas asociadas al sistema apícola productivo desde matrices de propóleos colombianos.