INTRODUCCIÓN
Las montañas son ecosistemas mundialmente reconocidos y protegidos por proveer algunos recursos naturales indispensables para el sostenimiento de la vida, tales como el agua y la energía, además albergan una alta diversidad biológica y cuentan con características ambientales únicas. Son hábitats ampliamente distribuidos en el planeta, cuya cobertura verde es importante ya que su disminución afecta la capacidad del ecosistema para suministrar agua, prevenir deslizamientos e inundaciones (Organización de las Naciones Unidas para la Agricultura y la Alimentación, FAO, 2020). Las montañas están constituidas por un conjunto de sub-ecosistemas, clasificados según criterios de altitud, vegetación y ciertas características ecológicas, permitiendo así reconocer, en el caso del territorio colombiano, las zonas de montaña alta - andina, páramo y glaciales o zonas nevadas (Rojas et al., 2018; FAO, 2020).
Los ecosistemas de alta montaña se ubican por encima de los 2.000 m.s.n.m y representan una transición entre los bosques altos andinos y los páramos. Aportan una serie de servicios de aprovisionamiento y regulación, tales como la reserva, regulación del flujo y depuración del agua, el almacenamiento de carbono, la regulación de la calidad del aire, prevención de la erosión y mantenimiento de la estabilidad del suelo (Ruíz et al., 2008; Rojas et al., 2018). En el caso de los páramos, estos comprenden grandes extensiones de terreno desprovisto de árboles, presentes en todos los continentes de la franja intertropical y localizados entre el límite inferior de las zonas nevadas y el límite superior de los bosques altos andinos, por encima de 3.200 m.s.n.m (FAO, 2020). A pesar de que se encuentran ubicados en la parte alta de las montañas, se consideran entornos dinámicos y frágiles (Rojas et al., 2018), los cuales presentan una variedad de condiciones ambientales que puede dificultar o impedir la supervivencia de los diferentes seres vivos, tales como precipitaciones frecuentes, un alto grado de radiación ultravioleta, fuertes vientos, temperaturas medias inferiores a 10 °C, días con presencia de niebla, suelos ácidos, baja presión atmosférica, sequedad y humedad del aire (Ruíz et al., 2008; FAO, 2020). La importancia de los páramos es indudable, debido a que proveen servicios vitales al influir principalmente en los procesos de regulación hídrica, estableciéndose como importantes abastecedores de agua al suplir hasta el 70 % del requerimiento en grandes centros urbanos y para los sectores productivos (Rojas et al., 2018), además de ser considerados ambientes con un elevado grado de diversidad biológica y endemismo de algunas especies (Campos et al., 2018). La diversidad y función microbiana es fundamental para el equilibrio de estos ecosistemas, no sólo por la abundancia que representan, sino por ser partícipes de una gran variedad de procesos tales como la transformación y descomposición de la materia orgánica, ciclos biogeoquímicos, producción de enzimas, probióticos y otros productos, biorremediación y eliminación de compuestos tóxicos, entre otras (Rani et al., 2019; Lobby & Martin, 2020). En el caso de los suelos, los microorganismos promueven su sustentabilidad y fomentan el crecimiento de las plantas al transformar sustancias presentes en el ambiente en formas biodisponibles para estas, ejerciendo biocontrol sobre fitopatógenos o a través de la secreción de hormonas y otros compuestos que les permiten un mejor desarrollo foliar y radical (De Mandal & Pannkaj, 2020). Además, al encontrarse colonizando ambientes tan particulares como los suelos de alta montaña, la función de la microbiota adquiere más relevancia por las potenciales aplicaciones biotecnológicas que podrían representar. No obstante, los reportes y el conocimiento acerca de la diversidad microbiana en este tipo de ambientes, especialmente en la región de los Andes, son dispersos y aún limitados. Por tanto, esta revisión tiene como objetivo consolidar el conocimiento actual acerca de la diversidad microbiana presente en suelos de ecosistemas de alta montaña, así como destacar la microbiota asociada con Espeletia spp. y las interacciones planta-microorganismo que se pueden presentar.
DESARROLLO DEL TEMA
Diversidad microbiana en suelos de alta montaña
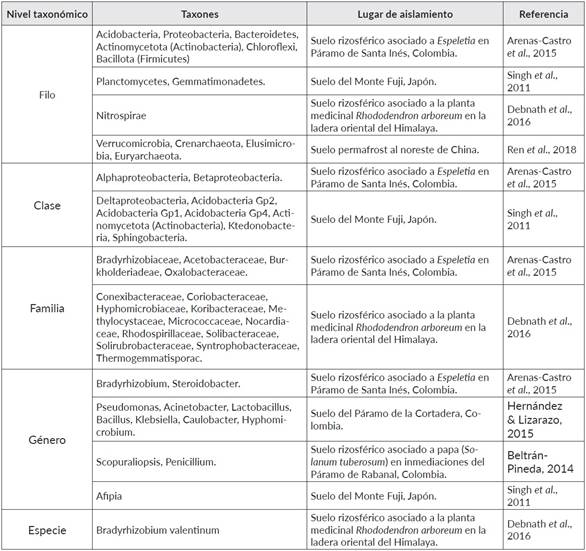
Las zonas que se encuentran ubicadas a grandes altitudes son reconocidas por ser puntos con alta diversidad biológica, y poseedoras de un interesante potencial metabólico (De Mandal & Pannkaj, 2020). En términos de diversidad y estructura de las comunidades microbianas, diferentes autores han identificado a través de metodologías dependientes y no dependientes de cultivo, los microorganismos predominantes presentes en los suelos de páramos y otras regiones de alta montaña a nivel mundial (Cuadro 1). Se han reportado microorganismos clasificados en los tres dominios, con un claro predominio de Bacteria, seguido por Eukarya y Archaea en concordancia con lo descrito para otros tipos de ecosistemas (Calderón et al., 2016; De Mandal & Pannkaj, 2020). Si bien la mayor cantidad de información registrada corresponde a los niveles superiores de clasificación taxonómica, es necesario alcanzar un nivel taxonómico más profundo (por ejemplo, género o especie) para determinar correctamente los índices de diversidad (Escobar-Zepeda et al., 2018).
A nivel de filos, se conoce que Proteobacteria, Acidobacteria, Actinomycetota (previamente conocido como Actinobacteria) y Bacillota (previamente conocido como Firmicutes) son los más abundantes y frecuentes en los suelos (Singh et al., 2011; Arenas-Castro et al., 2015; Hernández & Lizarazo, 2015). Dentro de estos resalta Proteobacteria, filo que comprende un grupo de microorganismos Gram negativos, diverso fisiológica y metabólicamente, lo que les permite adaptarse a diferentes condiciones medio ambientales y participar de procesos como el ciclo del carbono o el nitrógeno (Stein, 2018). Por tanto, es previsible encontrar este filo en los ecosistemas de alta montaña y que además estén desarrollando interacciones benéficas en el suelo. Así mismo, a este filo pertenecen las clases Alphaproteobacteria y Betaproteobacteria, dos grupos microbianos que también son frecuentemente reportados (Arenas-Castro et al., 2015). La clase Alphaproteobacteria sobresale porque incluye el orden Rhizobiales, que agrupa diferentes bacterias que promueven la organogénesis a nivel radical en las leguminosas y fijadoras de nitrógeno (Garrido-Oter et al., 2018). Dentro de Alphaproteobacteria, el género Bradyrhizobium ha sido detectado no sólo en suelos libres, sino en la rizósfera de plantas como Espeletia spp. Por su parte, la clase Betaproteobacteria comprende varias familias, tales como Burkholderiadeae y Oxalobacteraceae, las cuales se encuentran en forma abundante en los suelos; además, comprenden especies patógenas y cuya fuente de carbono es el ácido oxálico (Arenas-Castro et al., 2015). También, se ha reportado la presencia del filo Actinomycetota (antes Actinobacteria), un grupo de bacterias Gram positivas y filamentosas, participes de la descomposición de la materia orgánica del suelo, favoreciendo así la formación del humus (Buresova et al., 2019). Especies pertenecientes a este filo son reconocidas productoras de metabolitos secundarios, tales como la geosmina (Trans-1, 10-dimetiltrans-9-decalol) (Jiang et al., 2007) generada principalmente por Streptomyces coelicolor, así como algunos antibióticos o compuestos con propiedades antiparasitarias, antifúngicas o inmunosupresoras (Lee et al., 2019).
Otros géneros bacterianos que juegan un papel importante como Bacterias promotoras del crecimiento vegetal (PGPB) al interactuar y favorecer el crecimiento de las plantas (De Mandal & Pannkaj, 2020) son Pseudomonas y Bacillus, siendo reconocidos por estimular a la planta a nivel de la raíz y han sido aislados a partir de suelos de páramos (Hernández & Lizarazo, 2015; Pandey & Yarzabal, 2019). Por ejemplo, aislados de Pseudomonas y otros géneros de bacterias Gram negativas tales como Rhanella y Serratia obtenidos a partir de ambientes de alta montaña han sido usados exitosamente como promotores del crecimiento vegetal (Ghyselinck et al., 2013). De manera similar, aislados de Bacillus spp. obtenidos a partir de la rizosfera de papas en las tierras altas de los Andes de Perú y Bolivia no solo promovieron el crecimiento y desarrollo de la papa in vitro, sino que protegieron las plántulas contra la infección por Rhizoctonia solani (Ogata-Gutiérrez et al., 2017). Por otra parte, también se han aislado hongos en los suelos de estos ecosistemas, entre ellos Scopuraliopsis spp. y Penicillium spp., ambos caracterizados por su capacidad de solubilización de fosfatos, permitiendo así obtener formas biodisponibles del fósforo insoluble presente en el suelo para las especies vegetales de la zona (Beltrán-Pineda, 2014). No obstante, es conocido el hecho que varias especies fúngicas, entre ellas algunas de Penicillium, están asociadas a síntomas en plantas, que incluyen reportes en especies endémicas de páramo como Espeletia (Gaitán, 2018). Por último, es fundamental resaltar la importancia de la bioprospección en hábitats que presentan condiciones extremas, debido a que esto ha permitido reconocer microorganismos adaptados, los cuales representan un gran potencial con diferentes aplicaciones biotecnológicas en el sector industrial y para la agricultura (Pandey & Yarzabal, 2019). Por ejemplo, los microorganismos psicrófilos y psicrotróficos se reconocen como fuentes de pigmentos, enzimas extracelulares (lipasas, celulasas, proteasas, amilasas, etc.), productores de exopolisacárido y compuestos anticongelantes (Ruíz-Pérez et al., 2016; Yadav et al., 2017).
Vegetación del páramo y diversidad microbiana asociada
Los ecosistemas andinos de alta montaña cuentan con una elevada diversidad de especies vegetales, las cuales son de interés porque deben contar con mecanismos fisiológicos y metabólicos que les permitan sobrevivir a las condiciones extremas propias de estos ambientes, tales como los altos niveles de radiación ultravioleta, una marcada estacionalidad por la precipitación pluvial, congelamiento y descongelamiento diario del suelo, vientos desecantes, suelos con tendencia a la acidez y oligotróficos, baja presión atmosférica y los cambios abruptos de temperatura en el transcurso del día, entre otros. Los páramos cuentan con vegetación principalmente arbustiva y herbácea (Rojas et al., 2018); no obstante, la distribución de este tipo de plantas se puede ver influenciada según la región del páramo en la que se encuentren. Por ejemplo, en la zona de subpáramo (ubicada entre 3.200 y 3.600 m.s.n.m.) es común hallar matorrales y especies vegetales de tipo arbustivo, tales como Vaccinium y Diplostephium, en la zona de páramo propiamente dicho (localizado entre 3.600 y 4.100 m.s.n.m) predominan chuscales como Chusquea, pajonales como Calamagrotis y rosetales o frailejonales como Espeletia, mientras que en la zona de superpáramo (situado entre 4.100 m.s.n.m y el inicio de la zona nevada), pese a que es común encontrar suelos desnudos y rocosos, es posible hallar algunas especies vegetales tipo prado como Senecio (Rojas et al., 2018). Algunos de los mecanismos de defensa y adaptación con los que cuentan este tipo de plantas son el aumento en la concentración de carbohidratos a nivel tisular para combatir el congelamiento, acumulación de material senescente que actúa como aislante térmico, reducción en el tamaño de algunas estructuras asimilatorias, secreción de resinas para su protección térmica y el desarrollo de formas de vida altamente especializadas, tales como las rosetas, entre otras (Guo et al., 2021).
Entre las plantas más emblemáticas y dominantes del ecosistema de páramo se encuentra el género Espeletia, conocido en Colombia popularmente como frailejón, el cual pertenece a la subtribu Espeletiinae de la familia Asteraceae (Mavarez, 2019). Estas cuentan con un grupo de características morfológicas muy particular, entre las cuales destacan la filotaxia de sus hojas distribuidas en forma opuesta a lo largo del tallo y densamente agrupadas, con abundantes tricomas y disposición en roseta caulescente, entre otras. Además, poseen un papel importante en la estabilidad del suelo, pues influyen en la regulación hídrica del suelo mediante la captación de la humedad presente en el aire, para así almacenar el agua y posteriormente alimentar los ríos que nacen en estos ecosistemas (Cárdenas et al., 2017). Constituyen la mayor parte de la biomasa presente en estos ambientes, previenen la erosión del suelo y regulan el almacenamiento del carbono (Beltrán, 2018; Zomer & Ramsay, 2018).
En la estructura misma de la planta se pueden apreciar sus diferentes etapas de desarrollo, las cuales se clasifican en 1) hojas jóvenes en la parte superior, las cuales se encuentran parcialmente protegidas de las extremas condiciones del ambiente, 2) la zona de hojas maduras, las cuales están expuestas totalmente al ambiente, 3) la zona de necromasa, una región de material senescente y 4) la raíz (Guo et al., 2021). En cada uno de estos niveles se crean microambientes en donde, según las condiciones de exposición de cada zona, las comunidades microbianas presentan una estructura y conformación diferentes. Dentro de estos microambientes, se han reportado algunos microorganismos distribuidos tanto en la rizosfera como en la filósfera de Espeletia, es decir, el fragmento de suelo influenciado por las raíces de una planta viva (Zhalnina et al., 2018) y la superficie de las fracciones aéreas de las plantas, incluyendo hojas, tallos, flores y frutos (Carlström et al., 2019), respectivamente.
De acuerdo con un estudio realizado en el Parque Nacional Natural de los Nevados en Colombia, se reportaron mayores valores de los índices de diversidad microbiana en las regiones de necromasa y raíz de Espeletia hartwegiana, indicando una mayor variedad de microorganismos y una mayor abundancia del filo Acidobacteria en estas zonas (Ruíz-Pérez et al., 2016). No obstante, se registró una elevada abundancia de Bacteroidetes y Alphaproteobacteria en la región de necromasa, mientras que en la raíz se registró una mayor proporción de Crenarchaeota (Archaea). Los filos que se encontraron tanto como endófitos o epífitos en las hojas de Espeletia corresponden a Acidobacteria, Actinomycetota (Actinobacteria), Bacteroidetes, Bacillota (Firmicutes) y Proteobacteria, resaltando este último como el más abundante; de la misma manera, predominaba la clase Gammaproteobacteria y los géneros Corynebacterium sp., Pseudomonas sp. y Rothia sp. (Ruíz-Pérez et al., 2016). En otro estudio también realizado en Colombia, se aislaron e identificaron hongos endófitos presentes en las hojas de Espeletia spp (Miles et al., 2012): los resultados mostraron también que los índices de diversidad alfa son elevados, con un predominio de hongos pertenecientes a las clases Sordariomycetes, Dothideomycetes, Agaricomycetes, Leotiomycetes y Eurotiomycetes. Así mismo, se identificaron aislados a nivel de especie dentro de los cuales estaban Diaporthe phaseolorum, Nigrospora oryzae, Beauveria bassiana, Fusarium proliferatum, Scopulariopsis brevicaulis, Chaetomium globosum, Trichoderma asperellum, Cladosporium tunuissimum, Botrytis fabae, Curvularia oryzae, Paecilomyces sinensis, Phoma glomerata, Penicillium commune, y Trichoderma atroviride. Aunque escasos, los anteriores estudios a nivel de Colombia sugieren que la biodiversidad de microorganismos asociados a Espeletia podría ser alta, pero a su vez, poco explorada.
Las comunidades microbianas que establecen relación con plantas como Espeletia deben contar con mecanismos de adaptación a las condiciones ambientales a las que se encuentran expuestas, además de presentar una plasticidad metabólica que les permita prosperar en este ambiente. Diferentes mecanismos a nivel celular, molecular y de comunidad han sido reportados en los microorganismos aislados de estos ambientes (De Mandal & Pannkaj, 2020). Entre estos mecanismos están, entre otros: 1) la síntesis de moléculas como las proteínas de choque frío (CspA, CspC y CspE), crioprotectores (glicerol, la glicina betaína y trehalosa/dextrano, entre otros) y moléculas anticongelantes, permitiendo estabilizar las proteínas y eliminar radicales libres (Moyer et al., 2017; De Mandal & Pannkaj, 2020); 2) la regulación de la fluidez de sus membranas, debido a que los microorganismos psicrófilos poseen una mayor proporción de ácidos grasos insaturados, poliinsaturados y ramificados en ellas y cuentan con la presencia de grupos metilo, como se ha descrito en Flavobacterium spp (Kralová, 2017); 3) modificación de las cinéticas enzimáticas, de acuerdo con la hipótesis de que los microorganismos adaptados al frío aumentan la flexibilidad en la estructura de sus enzimas (De Mandal & Pannkaj, 2020), entre otras; y 4) las interacciones microbianas sinérgicas, las cuales juegan un rol positivo en la adaptación de las poblaciones microbianas a través de la expresión diferencial de genes como parte la respuesta al choque frío, incrementando su tolerancia y supervivencia en ambientes hostiles de alta montaña (Lobby & Martin, 2020).
Interacciones planta-microorganismo
Como ya se ha mencionado, los microorganismos aislados del suelo con frecuencia se asocian a una función en el mismo, por ejemplo, la estimulación del crecimiento de las plantas que allí se encuentran. Se conoce que las plantas se comunican químicamente con los microorganismos mediante enzimas, iones H+ y diferentes compuestos de carbono que excretan en sus exudados radicales (De Maayer et al., 2014; Mhlongo et al., 2018), ejerciendo un fuerte efecto selectivo sobre las comunidades microbianas asociadas. Igualmente, dichas comunidades influyen en el crecimiento y desarrollo de la planta misma al aumentar el reciclado y la solubilización de los nutrientes minerales y al sintetizar compuestos como auxinas y giberelinas, entre otros (Atlas & Bartha, 2002; Ho et al., 2017).
Dentro de las principales interacciones planta-microorganismo se encuentra la formación de biopelículas microbianas, estimulado por la exudación de ciertos compuestos por parte de la planta (De Maayer et al., 2014). Además, el establecimiento de asociaciones simbióticas, en donde rizobacterias o PGPBs promueven el crecimiento de la planta, y aquellas relacionadas con el reciclaje de nutrientes, puesto que los principales ciclos biogeoquímicos cuentan con varias etapas llevadas a cabo por microorganismos (Wei et al., 2019). Por ejemplo, durante la fijación del nitrógeno atmosférico, los microorganismos rizosféricos interactúan directamente con la planta, ya sea sobre o dentro de la raíz. Cuando los microorganismos ingresan a la raíz a menudo se da la formación de nódulos, dentro de los cuales el nitrógeno atmosférico se transforma en amoníaco, compuesto totalmente asimilable como fuente de nitrógeno para las plantas (Atlas & Bartha, 2002). Por otra parte, además de la fertilización química, la solubilización microbiana es la única forma de incrementar el fosforo disponible y utilizable para las plantas. Se ha demostrado que una gran variedad de bacterias, hongos y algas del suelo pueden solubilizar el fósforo orgánico e inorgánico in vitro, entre los cuales se encuentran especies de los géneros Pseudomonas, Bacillus, Rhodococcus, Arthrobacter, Serratia, Chryseobacterium, Gordonia, Phyllobacterium, Delftia sp., Azotobacter Xanthomonas, Pantoea, Aspergillus, Penicillium y Pichia, entre muchos otros (Babalola et al., 2012; Sharma et al., 2013; Alori et al., 2017; De Mandal & Pannkaj, 2020).
Los principales mecanismos involucrados son la producción de compuestos de disolución de minerales, tales como ácidos orgánicos e inorgánicos, sideróforos, protones e iones hidroxilo, así como la mineralización a través de enzimas fosfatasas no específicas, fitasas y fosfonatasas (Sharma et al., 2013; Alori et al., 2017). La excreción ácidos de origen microbiano tales como el láctico, malónico, aspártico, cítrico y acético, entre otros, va acompañada de una caída del pH que da como resultado la acidificación de las células microbianas y su entorno, facilitando la liberación los iones P mediante la sustitución de H+ por Ca2+ (De Mandal & Pannkaj, 2020). Por otra parte, las plantas también obtienen cantidades importantes de hierro gracias a agentes quelantes producidos por microorganismos, por ejemplo, los sideróforos microbianos (Liu et al., 2017). Varios grupos microbianos son reconocidos productores de fitohormonas tales como el ácido indol acético (AIA) y las giberelinas, hormonas que actúan como moléculas de señalización en los procesos como regulación génica y organogénesis, incluso en ambientes de bajas temperaturas. Los microorganismos también producen la enzima ACC-desaminasa, la cual hidroliza al precursor del etileno, compuesto expresado por la planta en condiciones de estrés tanto biótico como abiótico (De Mandal & Pannkaj, 2020).
Pese a que la mayoría y las más importantes interacciones planta-microorganismo se lleven a cabo a nivel de la raíz, también son conocidas las asociaciones en la filósfera de las plantas. Órganos tales como el tallo o las hojas de las plantas representan hábitats adecuados para el desarrollo de microorganismos epífitos, dentro de los que usualmente se encuentran bacterias heterótrofas, hongos, microalgas y líquenes (Atlas & Bartha, 2002). Es importante resaltar que son los microorganismos epífitos los que, al encontrarse en la superficie de la planta, están más expuestos a las condiciones ambientales. Estos microorganismos pueden entablar tanto interacciones sinérgicas, como antagónicas con las plantas. Algunas especies del género bacteriano Streptomyces son reconocidos como agentes de control biológico, debido a que son productores de antibióticos que protegen las plantas de ataques de otros organismos (Schirawski et al., 2018). Bacillus amyloliquefaciens GB03 se ha relacionado con conferir a la planta una mayor tolerancia a condiciones ambientales adversas, tales como alta salinidad y desecación (Su et al., 2017). Incluso algunas asociaciones de plantas con microorganismos se han visto involucradas en procesos de biorremediación (Singh et al., 2019), tal como es el caso de algunas especies de Bacillus y Stenotrophomonas con la planta Raphanus sativus, los cuales han presentado efectividad en la remoción del níquel (Akhtar et al., 2018). En adición, es importante mencionar que algunos representantes fúngicos también pueden interactuar benéficamente con las plantas, dentro de los cuales se encuentran los hongos micorrizícos arbusculares (Schirawski et al., 2018), siendo un claro ejemplo de esta interacción la que se presenta entre Rhizophagus irregularis y los cultivos de algodón, en la cual el hongo evita el marchitamiento ocasionado por Verticillium spp., sumado al factor promotor de crecimiento adicional que produce (Hang et al., 2018).
A pesar de los evidentes beneficios que pueden representar las asociaciones planta-microorganismo, no todas ellas son benéficas. Uno de los principales ejemplos de estas asociaciones negativas son los microorganismos fitopatógenos, dentro de los cuales se destacan los hongos. Éstos sustentan su crecimiento y desarrollo utilizando los componentes de los tejidos de las plantas, una vez logran someter y superar los sistemas de defensa de éstas (Schirawski et al., 2018). Varios son los ejemplos de esta situación, tal como es el caso de Fusarium proliferatum, el cual ocasiona manchas necróticas en las hojas de la planta de tomate, así como el marchitamiento y reblandecimiento de sus tallos (Gao et al., 2017), o Fusarium fujikuroi, agente patógeno del arroz (Adam et al., 2018). Algunas especies bacterianas también se han visto involucradas como patógenos de plantas; tal es el caso de Pseudomonas syringae pv. actinidiae, que induce la expresión positiva de algunos genes codificantes de compuestos y metabolitos secundarios de protección en la planta de kiwi (Wang et al., 2018). No obstante, es cierto que, conforme los microorganismos adoptan estrategias para colonizar los tejidos vegetales, las plantas igualmente cuentan con diferentes mecanismos para enfrentarlos (Zaynab et al., 2019). Dentro de estos mecanismos destaca la secreción de ciertas proteínas y polisacáridos con propiedades antivirales (Wang et al., 2012), producción de proteínas como defensinas y tioneinas con actividad frente a bacterias u hongos (Patkar & Chatoo, 2006, Thery et al., 2018). Sin embargo, las interacciones microbianas son fenómenos dinámicos y multidimensionales que conducen a que el desenlace positivo o negativo sea relativo a diferentes condicionantes, tales como las comunidades microbianas y sus interacciones intra e inter específicas, los factores ambientales y la planta que sirve como hospedero. En este sentido y teniendo en cuenta que las interacciones planta-microorganismo, ya sean positivas o negativas tienen lugar también bajo las condiciones ambientales de los ecosistemas de alta montaña, resulta interesante y necesario estudiar el papel que tiene la microbiota nativa de los suelos y demás matrices presentes en ecosistemas paramunos sobre el crecimiento de plantas endémicas como Espeletia.
CONCLUSIONES
Las características propias de los ecosistemas de alta montaña los convierten en escenarios de creciente interés para la investigación en ecología microbiana, y la diversidad, estructura y potencial funcional de las comunidades microbianas asociadas a estos ecosistemas son un reflejo de las presiones selectivas bióticas y abióticas a las que son sometidas constantemente. Las comunidades microbianas presentes en ecosistemas de alta montaña están dominadas principalmente por bacterias de los filos Proteobacteria, Actinomycetota (Actinobacteria) y Acidobacteria, dentro de los cuales destacan algunos géneros con acción PGPB tales como Bradyrhizobium y Bacillus. Otros grupos microbianos menos abundantes, tales como los hongos y arqueas, podrían jugar un papel importante en la diversidad y establecimiento de interacciones planta-microorganismo. Si bien no se cuenta con un alto número de reportes, estudios a nivel de Colombia muestran que la diversidad microbiana en los ecosistemas de alta montaña es alta, pero a su vez, poco explorada.
La microbiota asociada a Espeletia varía dependiendo de la región de la planta, encontrándose una predominancia de bacterias de los filos Acidobacteria, Bacteroidetes, Actinomycetota (Actinobacteria) y Proteobacteria, seguido por hongos Ascomicetos de diferentes órdenes en los tejidos aéreos, así como arqueas asociadas a las raíces. Dichas diferencias en la estructura y abundancia de las comunidades microbianas sugieren que, en ambientes paramunos, Espeletia podría establecer asociaciones planta-microorganismo específicas que le permitirían beneficiarse en términos de tolerancia a factores ambientales y promoción de crecimiento vegetal. A falta de información sobre las interacciones microbianas específicas que tienen lugar en Espeletia, así como de su potencial funcional, la expresión diferencial de sus genes y con base en los estudios realizados en plantas de ambientes de alta montaña, la evidencia apunta a que la diversidad microbiana asociada a Espeletia cumple un rol benéfico. Los mecanismos involucrados consistirían fundamentalmente en el establecimiento de asociaciones simbióticas y biopelículas, la fijación del nitrógeno atmosférico, la solubilización de fosfatos, la producción de fitohormonas, el control de microorganismos invasores y en conferir a la planta una mayor tolerancia a condiciones ambientales adversas, tales como alta salinidad y desecación. Lo anterior muestra la importancia de los ambientes de alta montaña como reservorios de diversidad taxonómica y de genes funcionales aprovechables desde el campo de la biotecnología, así como una fuente potencial de biofertilizantes que podrían ser utilizados in situ para incrementar la velocidad de crecimiento y resistencia de Espeletia a diferentes factores bióticos y abióticos adversos.