INTRODUCCIÓN
Las celulasas hacen parte de un complejo enzimático conformado por endoglucanasas, exoglucanasas y β - glucosidasas que hidrolizan los enlaces β 1-4 de la celulosa (Jayasekara and Ratnayake, 2019), componente principal de la pared celular de las plantas y el polímero más abundante de la naturaleza (Li et al., 2021). Este polímero puede ser biodegradado hasta monómeros de glucosa por microorganismos productores de celulasas, lo que permite que la celulosa sea una fuente importante de energía renovable (Patela et al., 2019).
La hidrólisis enzimática de la celulosa presente en material de origen vegetal es ampliamente utilizada a nivel industrial para obtener productos como jarabes de glucosa y sustratos ricos en azúcares para producir bioetanol por fermentación alcohólica (Singh et al., 2019; Portero et al., 2020; DE Souza and Yukio, 2021). Aunque las celulasas se han utilizado tradicionalmente como materia prima para el tratamiento de fibras en la industria textil, de los detergentes y de la pulpa y del papel (Ejaz et al., 2021), actualmente se han encontrado nuevas aplicaciones que incluyen su uso en la extracción de biocompuestos como polisacáridos, aceites y carotenoides a partir de material vegetal (Marathe et al., 2017; Hu et al., 2021).
Las celulasas son unas de las enzimas más comercializadas a nivel mundial por su importancia industrial, sin embargo, su alto costo de producción limita su uso en la hidrólisis de materia prima de origen lignocelulósico, ya que solamente la producción de la enzima implica el 50 % del costo total del proceso de hidrólisis enzimática, costos están asociados al alto valor comercial de la celulosa y carboximetilcelulosa utilizadas generalmente como sustratos en la producción de celulasas (Bhardwaj et al., 2021). Teniendo en cuenta la importancia de las celulasas microbianas a nivel industrial, su creciente demanda y sus nuevas aplicaciones hacia métodos más sustentables, es necesario buscar nuevas enzimas que faciliten la hidrólisis de la celulosa presente en residuos agroindustriales, así como la búsqueda de métodos de producción de enzimas a bajo costo (Sarup et al., 2019).
Debido al contenido de celulosa presente en los residuos agroindustriales, éstos se han utilizado como sustratos en la producción de celulasas con el objetivo de disminuir los costos de producción y utilizar la celulosa disponible en esta biomasa residual, que presenta altos índices de producción y bajas tasas de aprovechamiento. A nivel mundial se producen 2.010 millones de toneladas de residuos sólidos al año y solamente el 19 % del total de residuos orgánicos generados se recupera mediante el reciclaje y el compostaje (Kaza et al., 2018). En Colombia, el 18 % de los residuos vegetales son generados en las centrales de abastecimiento de mercado, teniendo como destino final los rellenos sanitarios (Vargas-Pineda et al., 2019). Así mismo, el 51,32 % de residuos biodegradables generados en Bogotá tienen esta misma disposición a pesar de su alto potencial de aprovechamiento (UAESP, 2020). Como estrategia de valorización de residuos agroindustriales como arroz, maíz, soya, trigo, café, caña de azúcar, remolacha, naranja, uva y aceitunas, han sido utilizados como materia prima en la formulación de sustratos de bajo costo para la obtención de enzimas celulolíticas (Marzo et al., 2019; Bajar et al., 2020; Leite et al., 2021).
Además de obtener sustratos económicos para la producción de celulasas, es necesario contar con cepas microbianas capaces de fermentar dichos sustratos y obtener actividades enzimáticas que permitan ser aplicadas en diferentes procesos industriales. Aunque la mayor producción de celulasas se ha obtenido a partir de hongos filamentosos como Aspergillus sp. y Penicillium sp. (Bajar et al., 2020; Coêlho et al., 2021), especies bacterianas como Streptomyces sp., Bacillus sp., Pseudomonas sp. y Serratia sp. también se han utilizado en la fermentación sumergida de residuos agroindustriales para la producción de enzimas celulolíticas (Khatiwada et al., 2016; Sinjaroonsak et al., 2020; Pangsri et al., 2021).
En este estudio se evaluaron y seleccionaron diferentes cepas bacterianas celulolíticas aisladas previamente de residuos generados en la plaza de mercado distrital de El Restrepo, Bogotá. Adicionalmente, se evaluó el potencial de residuos de ameros de mazorca y vainas de leguminosas como sustratos para la obtención de celulasas, a partir de las bacterias celulolíticas seleccionadas.
MÉTODO
Recolección y pretratamiento de los residuos
Los residuos orgánicos compuestos por ameros de mazorca y vainas de leguminosas se recolectaron en la plaza Distrital de mercado El Restrepo en Bogotá y transportaron en nevera portátil al laboratorio de biotecnología del Centro de Gestión Industrial del SENA. Seguidamente, estos fueron lavados, troceados, deshidratados en horno Binder FED 115 a 90 ºC por 12 horas y preservados en ultracongelador a -80 ºC para su posterior caracterización fisicoquímica y elaboración de medios de cultivo.
Selección de microrganismos celulolíticos
11 cepas bacterianas previamente aisladas de residuos orgánicos generados en plazas de mercado (Sánchez and Heredia, 2022) fueron cultivadas en 50 mL de caldo Mandels (Carboximetilcelulosa - CMC 1 %; (NH4)2SO4 0,14 %; KH2PO4 0,15 %; Urea 0,03 %; CaCl2·2H2O 0,04 %; MgSO4 0,03 %; Peptona 0,075 %) asegurando una concentración bacteriana inicial correspondiente al tubo número 2 de la escala de McFarland. Los cultivos se llevaron a 37 °C y 120 rpm por 72 horas tomando muestras para determinar la actividad enzimática cada 24 horas.
Caracterización fisicoquímica
Cuantificación de celulosa en los residuos. Los residuos deshidratados se llevaron a digestión en reflujo abierto con solución de NaOH 17,5 % m/v por 2 horas y se neutralizó en agitación con HCl concentrado. La recuperación de la biomasa se realizó mediante centrifugación a 4500 rpm, 7 ºC y 20 minutos en una centrifuga Hettich - Rotanta 460R, seguida de una filtraron al vacío. Para la determinación gravimétrica de la celulosa, los residuos digeridos se llevaron a 105 ºC hasta peso constante de acuerdo con el método descrito por Kulic and Radojičić (2011).
Cuantificación de nitrógeno en los residuos. 1,5 g de muestras maceradas de residuos se mezclaron en tubos de digestión con 12,5 mL de H2SO4 al 98 % y un catalizador (K2SO4/CuSO4). Como blanco se realizaron dos digestiones con glucosa. La reacción se realizó en un digestor Foss tecator digestor DT 508 a 400 °C durante 2 horas, luego se enfrió a temperatura ambiente y se destiló en un equipo Kjeltec 8200. Mediante alcalinización, el amoniaco se recuperó sobre una solución concentrada de ácido bórico con indicador Tashiro. El nitrógeno amoniacal se cuantificó por volumetría ácido-base usando HCl 0,15 M estandarizado (Gavidia et al., 2020).
Determinación de Carbono Orgánico Total (COT). La determinación de COT se realizó por el método de adición estándar modificando la técnica de Walkley and Black (1934), en donde 0,1 g de ameros de mazorca y vainas de leguminosas pretratados y macerados se adicionaron en seis tubos que contenían una cantidad creciente de estándar de glucosa (0,0137 a 0,1370 g). Se adicionaron 5,0 mL de una solución de K2Cr2O7 (Merck®) al 10 %, 5,0 mL de H2SO4 concentrado y se dejó en reacción por 30 minutos. Finalmente, se adicionaron 15 mL de agua destilada y se dejó en reacción por 18 horas. Una mezcla similar a la anterior sin residuos fue utilizada como blanco. En un espectrofotómetro Shimadzu UV - 1800 se leyó la absorbancia de las muestras a 600 nm.
Elaboración de los medios de cultivo. De acuerdo con los resultados del porcentaje de celulosa presente en los ameros y vainas, se formularon 3 medios de cultivo a una concentración final del 1 % (A, B y C). Los residuos se mezclaron con 50 mL de una solución base caldo Mandels sin CMC y se llevaron a volumen final de 100 mL. La concentración de las sustancias que aportan nitrógeno en la solución de nutrientes fue recalculada teniendo en cuenta el contenido de este en los residuos ((NH4)2SO4 0,031 %; Urea 0,0065 %; Peptona 0,0168 %). Para el medio de cultivo A se pesaron 2,9 g de residuos de ameros y vainas troceados y deshidratados, para el medio B se pesaron 2,9 g de residuos troceados, deshidratados y licuados y para el medio C se pesaron 12,5 g de residuos sin deshidratar, troceados y licuados. Como control positivo para la producción de celulasas se prepararon 100 mL de caldo Mandels (Medio D). Finalmente, el pH de los medios se ajustó a 7 con NaOH 1M y se llevaron a autoclave SANYO MLS a 113 °C por 7 minutos y 15 psi.
Producción de celulasas. De acuerdo con los resultados de la selección de microorganismos, se utilizó la cepa C6M2 para evaluar la producción de celulasas en los medios A, B, C y D. 1 mL de la cepa previamente ultracongelada a -80 ºC, con una concentración de 1,5x108 celulas/mL, fue adicionado en cada uno de los medios, incubándolos a 37 ºC y 150 rpm por 96 horas, tomando muestras cada 24 horas para determinar la actividad celulolítica.
Determinación de la actividad enzimática (AE)
4 mL de cada una de las muestras fueron centrifugados a 4500 rpm y 7 ºC por 30 minutos en una centrifuga Hettich - Rotanta 460R y el sobrenadante se recuperó para evaluar la AE por triplicado. En un tubo Eppendorf se tomaron 750 μL de sobrenadante y se mezclaron con 750 μL de una solución CMC al 1 % p/v buffer fosfato pH 7,0. Para la selección de microrganismos celulolíticos la AE se evaluó a 37 y 50 ºC, mientras que para la evaluación de los medios se realizó únicamente a 50 ºC. La reacción enzimática se llevó a cabo en un baño termostatado marca Memmert, después de 30 minutos esta se detuvo en un baño de hielo por 5 minutos. Los tubos se llevaron a centrifugar a 5000 rpm, 20 minutos y 7 ºC en una centrifuga Benchmark Z326K y en 500 μL del sobrenadante se cuantificaron los azúcares reductores (AR) por la técnica del ácido 3-5 dinitrosalicílico (DNS) según Olanbiwoninu and Fasiku (2015). La absorbancia de las muestras se determinó a 540 nm en un lector de multimicroplacas marca BIOTEK - SYNERGY H1MG. El cálculo de la AE se hizo de acuerdo con Sánchez et al., (2020) teniendo en cuenta que unidad enzimática (U) se definió como la cantidad de enzima capaz de producir un micro mol de glucosa por mL por minuto bajo las condiciones del ensayo.
Análisis estadístico
Los ensayos de AE a 37 y a 50 ºC se realizaron por triplicado y las diferencias significativas de los resultados obtenidos se evaluaron a través de la prueba de análisis de varianza de un factor (ANOVA) definiendo un α = 0,05 con un p<0,001 y posteriormente se realizó el test de Tukey como prueba de comparación. Las diferencias significativas entre las AE evaluadas a 37 y 50 ºC para las cepas de mayor AE fueron determinadas a través de una prueba ANOVA de dos factores con un α de 0,01 y p<0,001. La producción de celulasas entre los medios A y B se evaluó utilizando un ANOVA de un factor con un α de 0,01 y p = 0,012 seguido del test de Tukey.
RESULTADOS
Las 11 cepas bacterianas previamente aisladas de residuos orgánicos de plazas de mercado presentaron actividad celulolítica, siendo las cepas 7 a 11 las que lograron mayor producción de celulasas a las 48 horas de fermentación en caldo Mandels (Cuadros 1 y 2). De acuerdo con los resultados de la prueba ANOVA hay diferencias significativas en la AE a 37 y 50 ºC de las cepas 1 a 11 (p<0,001), esto se confirmó aplicando el test de comparación Tukey. Adicionalmente, este test demostró que hay diferencias significativas entre las AE de las cepas 1 a 6 respecto a la de las cepas 7 a 11 de mayor actividad celulolítica (p<0,001). De esta forma, las cepas C3M1A, C3M3R5A, C3M3R5B, C5M2 y C6M2, con actividades a 37 ºC entre 21,51 ± 0,2 U/mL y 22,24 ± 0,2 U/mL y a 50 ºC entre 30,83 ± 0,44 U/mL y 30,37 ± 0,29 U/mL, pueden ser utilizadas para la producción de celulasas teniendo en cuenta que son las de mayor actividad celulolítica.
Cuadro 1 Evaluación de la actividad celulolítica a 37 ºC de las cepas 11 aisladas a partir de residuos de plazas de mercado
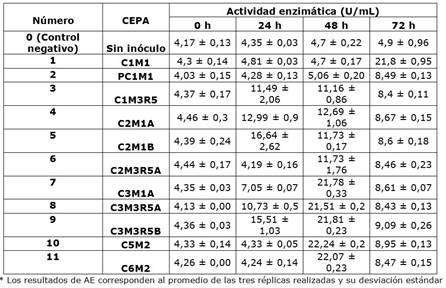
Para el caso de la actividad enzimática a 50 ºC, las cepas C1M1, C1M3R5, C2M1A, C2M1B y C2M3R5A presentaron un comportamiento parecido al del control negativo durante las 72 horas de fermentación (Cuadro 1). Un caso similar se presentó a 37 ºC con las cepas C1M1 y PC1M1 hasta las 48 horas (Cuadro 2), por esta razón, estas seis cepas se excluyeron de las seleccionadas para la producción de celulasas. Mientras que las cepas C3M1A, C3M3R5A, C3M3R5B, C5M2 y C6M2 se seleccionaron como bacterias celulolíticas con potencial en la producción de celulasas a partir de residuos agrícolas debido a sus resultados de AE tanto a 37 como a 50 ºC. La cepa C6M2 fue la seleccionada en este estudio para llevar a cabo la fermentación de los medios de cultivo formulados a partir de ameros de mazorca y vainas de leguminosas, debido a que tanto a 37 como a 50 ºC tuvo la segunda mejor actividad celulolítica (Cuadros 1 y 2).
Cuadro 2 Evaluación de la actividad celulolítica a 50 ºC de las cepas 11 aisladas a partir de residuos de plazas de mercado
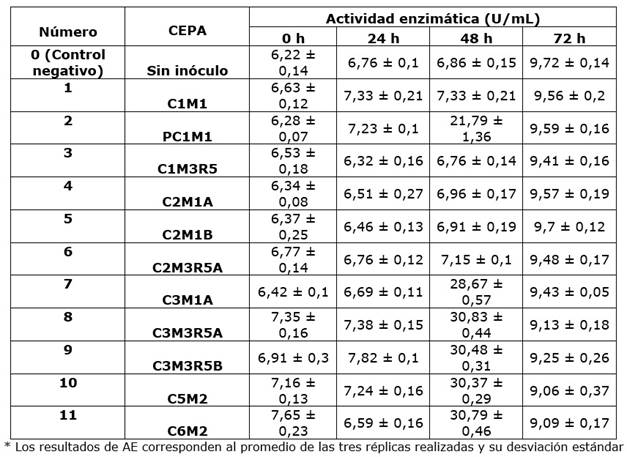
Según la prueba de ANOVA de dos factores, la AE a 37 ºC de las cepas 8 a 11 (Cuadro 1) presentaron diferencias significativas respecto a su AE a 50 ºC (p<0,001), mostrando mayor actividad a esta temperatura. Estudios de caracterización de celulasas bacterianas han demostrado que la mayor actividad de estas enzimas se evidencia a los 50 ºC (Khatiwada et al., 2016; Islam et al., 2019; Camacho et al., 2021, Ibrahim et al., 2021).
La producción de celulasas de las 5 cepas seleccionadas, en general, fue mayor a la reportada para otros microorganismos evaluados en medios formulados a partir de CMC. Hossain et al. (2021) obtuvieron la máxima actividad de celulasas por Pseudomonas sp. de 0,156 U/mL luego de 48 horas de fermentación, Da Silva et al. (2021) lograron una producción de 0,493 U/mL para las enzimas producidas por Bacillus licheniformis a las 96 horas de cultivo y Kazeem et al. (2017) obtuvieron una actividad CMCasa de 0,33 U/mL a partir de B. licheniformis 2D55 a las 18 horas de fermentación.
Los resultados del contenido de celulosa, nitrógeno y COT para los residuos de ameros de mazorca y vainas de leguminosa generados en plazas de mercado se presentan en el cuadro 3. El porcentaje de celulosa determinado es comparable al reportado para otros residuos agroindustriales utilizados en la producción de enzimas como paja de trigo, paja de arroz, caña de maíz y pastos (Sooch et al., 2019).
Teniendo en cuenta que la relación C/N es fundamental para el crecimiento y metabolismo microbiano (Brust, 2019; Lin et al., 2019) y que el objetivo del estudio era evaluar los residuos agrícolas como sustratos para la producción de celulasas, mediante la evaluación de COT y del porcentaje de nitrógeno se determinó un índice C/N de 39 para los ameros de mazorca y vainas de leguminosas. A partir de este resultado, los residuos agrícolas se utilizaron en la formulación de medios con una relación C/N de 9 similar a la del caldo Mandels.
En la figura 1 se encuentran los resultados de la producción de celulasas utilizando la cepa C6M2 en los medios formulados con ameros de mazorca y vainas de leguminosas. En el medio A, preparado a partir de residuos orgánicos troceados y deshidratados, se obtuvo la mayor AE a las 72 horas de fermentación (19,82 ± 3,0 U/mL), seguido por el medio B con una AE de 9,76 ± 1,6 U/mL, actividades que según la prueba de ANOVA y el test de Tukey presentan diferencias significativas (p = 0,012).
Por el contrario, en el medio elaborado a partir de residuos licuados y sin deshidratar (medio C) no se registró AE durante las 96 horas de fermentación (Figura 1), evidenciándose que el pretratamiento de los residuos mediante troceado y deshidratación, probablemente favorece la disponibilidad de celulosa en el medio permitiendo una mayor producción de celulasas por C6M2. Otros estudios también han evidenciado que el pretratamiento físico de los residuos agroindustriales promueve la obtención de celulasas (Waghmare et al., 2018), incluso en algunos casos se han realizado hidrólisis alcalinas buscando una mayor disponibilidad de la celulosa. A pesar de que en el presente estudio no se hidrolizaron previamente los residuos, se lograron mayores AE que en otros donde estos si fueron sometidos a pretratamientos químicos (Kazeem et al., 2017; Gunam et al., 2019).
El pretratamiento fisicoquímico de los residuos es fundamental en su aprovechamiento como sustratos en fermentaciones para la obtención de celulasas que contribuye a la ruptura de la matriz lignocelulósica reduciendo tanto el tamaño de partícula como el grado de cristalinidad de la celulosa e incrementando su fracción amorfa, que es la forma más susceptible a la hidrólisis enzimática durante la fermentación (Sarkar et al., 2012), sin embargo, cuando el tamaño de partícula es pequeño estas se pueden aglutinar limitando el crecimiento microbiano debido a la reducción de la difusión del oxígeno y la transferencia de calor y materia (De Castro and Sato, 2015). Esta situación podría explicar los resultados obtenidos tanto en los medios B y C, en donde los residuos fueron licuados, obteniendo un tamaño de partícula menor que en el medio A.
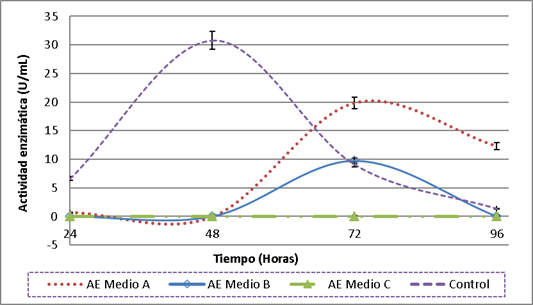
Figura 1. Producción de celulasas en los medios formulados a partir de residuos de plazas de mercado. Los datos de AE corresponden al promedio de las tres réplicas realizadas y las barras de error representan su desviación estándar. Medio A - residuos troceados y deshidratados. Medio B - residuos licuados. Medio C - residuos licuados sin deshidratar. Control/Medio D - Caldo Mandels 1% CMC, medio convencional para la producción de celulasas.
En el medio A, la producción de celulasas a partir de la cepa C6M2 fue mayor a la reportada por Bacillus subtilis P2-5 (0,58 U/mL) a partir de residuos de té (Pangsri et al., 2021), por B. subtilis PJK6 (1,37 U/mL) en salvado de trigo (Kaur et al., 2018), por Bacillus subtilis DSM 17766 (0,175-0,184 IU/mL) usando orujo de uva (Kurt and Cekmecelioglu, 2021) y por Enterobacter sp. (12,24 U/mL) en cascarilla de sorgo (Waghmare, et al., 2018). Así mismo las AE obtenidas luego de la fermentación sumergida en medio A por C6M2 son mayores a las reportadas en fermentaciones sólidas de residuos agroindustriales a partir de especies fúngicas (Kalsoom et al., 2019; Ramamoorthy et al., 2019; Silva et al., 2019; Li et al., 2020; Abdullah et al., 2021; Singh et al., 2021).
CONCLUSIONES
Los ameros de mazorca y las vainas de leguminosas generados en plazas de mercado presentan un contenido de celulosa y nitrógeno que permite su aprovechamiento en la formulación de medios de cultivo que, al trocearlos, deshidratarlos y suplementarlos con peptona, sulfato de amonio y urea, favorecen la producción de celulasas a partir de microorganismos aislados de residuos agrícolas como la cepa bacteriana celulolítica C6M2.















