Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Ciencias de la Salud
Print version ISSN 1692-7273On-line version ISSN 2145-4507
Rev. Cienc. Salud vol.3 no.1 Bogotá Jan./June 2005
Transmisión sináptica-canales de calcio y liberación de neurotransmisores
Synaptic Transmission-Calcium Channels and Neurotransmiters Releasing
Herman Moreno*, Carlos B. Moreno
* Columbia University, Department of Neurology y Sergievsky Institute, New York.
† Unidad de Neurociencia, Grupo Neuros, Facultad de Medicina, Universidad del Rosario, Bogotá. Correo electrónico: camoreno@urosario.edu.co.
Recibido: septiembre de 2004. Aceptado: febrero de 2005.
Resumen
La comunicación neuronal en el sistema nervioso está mediada, en la gran mayoría de animales, por la transmisión sináptica química. Generalmente esta comunicación ocurre mediante la liberación de una sustancia transmisora en el terminal presináptico. Este transmisor sináptico se une a receptores postsinápticos y da lugar a una respuesta postsináptica en la célula blanco.
La liberación del transmisor en la región presináptica, al parecer, es desencadenada por un aumento transitorio del calcio intracelular en el sitio de liberación. Este aumento se logra, principalmente, por la activación de canales de calcio dependientes de voltaje (VGCC), lo que da lugar a un ingreso de iones de calcio en el citosol presináptico, que desencadena la fusión de las vesículas sinápticas y la liberación del neurotransmisor. En este artículo se revisan las características moleculares y funcionales de los VGCC necesarias para la comprensión de alteraciones patológicas como las canalopatías y la transmisión sináptica anormal.
Metodología: se consultaron las bases de datos Medline, Pubmed y los e-journals de la Biblioteca de la Universidad de Columbia, correspondientes a los años 1990 a 2004.
Resultados: durante la última década se han logrado avances significativos en los aspectos moleculares y en la genética de los canales dependientes de voltaje. La integración de este conocimiento con la neurofisiología funcional y la neurología clínica apenas se está iniciando.
Palabras clave: canales de calcio, sinapsis, unión neuromuscular, neurotransmisores.
Abstract
Neuronal communication in the nervous system is mediated, in the vast majority of animals, by chemical synaptic transmission. In most cases this junctional communication occurs via the release of a transmitter substance, from a presynaptic nerve terminal. This synaptic transmitter binds post-synaptic receptors and results in a postsynaptic response on the target cell.
Such release of transmitter from the presynaptic terminal appears to be universally triggered by a transient increase of intracellular calcium at the release site. This transient increase in calcium, is mostly brought about by the activation of voltage gated calcium channels (VGCC) which result in a Ca2+ influx into the presynaptic cytosol that triggers synaptic vesicle fusion and neurotransmitter release.
Methodology: Databases such as Medline, Pubmed and Columbia University Library ejournals were consulted, in order to find articles published from January 1990 to November 2004.
Conclusions: During the last decade significant advances have been achieved in the molecular and genetics of voltage gated channels. The integration of this knowledge with functional neurophysiology and clinical neurology is only starting.
Key words: Calcium channels, synapses, neuromuscular junction, Neurotransmitters
En la gran mayoría de vertebrados e invertebrados la comunicación neuronal en el sistema nervioso se realiza mediante transmisión química. Generalmente, esta unión química ocurre gracias a la liberación de una sustancia transmisora en el terminal nervioso presináptico. Este transmisor sináptico se une a receptores postsinápticos y da lugar a una respuesta en la célula postsináptica.
La liberación de transmisor en el terminal presináptico es iniciada, al parecer en todos los casos, por un aumento transitorio de la concentración intracelular de Ca2+, el cual se debe fundamentalmente a la activación de canales de calcio dependientes de voltaje (VGCC), lo que da lugar a un ingreso de Ca2+ en el citosol presináptico, que desencadena el anclaje y fusión de las vesículas sinápticas con la membrana presináptica, y a la liberación del neurotransmisor (exocitosis).
Un aspecto básico de la transmisión de señales en el sistema nervioso central (SNC) es la velocidad con la que ocurre (milésimas de segundo). La mayoría de las neuronas se comunica entre sí de una manera electroquímica, es decir, debe haber movimiento de iones y, por lo tanto, corrientes eléctricas, y una parte química, que es la liberación del neurotransmisor, la sustancia que transmite la señal a la neurona postsináptica.
Hay muchos tipos de neurotransmisores, unos producen excitación en la neurona postsináptica y otros, inhibición. Ambos son fundamentales para mantener un funcionamiento apropiado del SNC. Para el procesamiento de señales en el cerebro es importante que unas células estén inactivas, mientras otras están activas, es decir, el silencio eléctrico también es una forma de actividad importante. En esta revisión sólo se tratará un aspecto de la transmisión sináptica: la relación de las moléculas que permiten la entrada de calcio al terminal presináptico, el canal de calcio (calcio es el ion que media el acoplamiento electroquímico) y la liberación del neurotransmisor. El interés de esta revisión se debe en parte al gran número de mutaciones en los canales de calcio responsables de diversas enfermedades, tanto neurológicas como de otro tipo, denominadas canalopatías de calcio, por ejemplo: la parálisis periódica hipopotasémica, la hipertermia maligna, la enfermedad de núcleo central y varios tipos de ataxias. Si se quieren entender los aspectos fisiopatológicos de este tipo de enfermedades, es necesario considerar estos temas, que en algún momento pueden parecer distantes al campo médico-práctico.
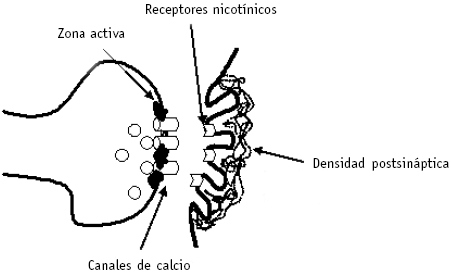
La velocidad del proceso de excitación-secreción (microsegundos) en la porción especializada del terminal nervioso presináptico, conocida como zona activa, implica una vecindad muy estrecha entre los VGCC presinápticos y la maquinaria exocitótica.
Ese aspecto se ha sustentado recientemente gracias a experimentos que utilizaron la técnica de tomografía por microscopía electrónica, que suministra imágenes tridimensionales de la unión neuromuscular (UNM) de rana (1), así como se puede ver en la Figura 1. En estos estudios se encontró que la zona activa de la UNM consta de componentes alargados interconectados y, algunos de ellos, conectados a vesículas sinápticas ancladas. Se propuso que los canales de calcio están incluidos en esta estructura macromolecular, así como lo están las moléculas implicadas en la exocitosis. También se sugirió que la zona activa está implicada directamente en el anclaje vesicular.
Figura 1. Esquema de la unión neuromuscular
Se ha propuesto que la citomatriz presináptica es un elemento clave para definir la organización de este complejo multiproteico, especialmente la restricción espacial de las moléculas, así como la agregación de un subgrupo de vesículas en la proximidad de la zona activa. Por ejemplo, se sabe que una de las proteínas citoesqueléticas presinápticas CASK (proteína CaMK/SH3/guanilatocinasa) (2) interactúa con la subunidad formadora del poro de los VGCC, para constituir así un mecanismo molecular que ayudaría a acoplar los canales de calcio con la maquinaria de fusión de las vesículas.
Además, los iones de calcio pueden entrar en el compartimiento presináptico no sólo por vía de los canales de calcio, aunque ésa sea posiblemente su ruta principal. De manera alternativa, los iones de calcio pueden fluir a través de canales iónicos no selectivos, de canales de cationes dependientes de ligando y por vía reversa del intercambiador sodio/calcio (3-5).
CORRIENTES DE CALCIO DEPENDIENTES DE VOLTAJE Y SUS COMPONENTES MOLECULARES
Clasificación de los canales de calcio
Hay un número importante de canales de calcio en el sistema nervioso. Las corrientes1 de los VGCC se han clasificado basándose en sus propiedades farmacológicas y electrofisiológicas. Según el voltaje necesario para desencadenar el paso de la corriente, se dividen en tres grupos: (a) activados por alto voltaje (tipos L, N, P y Q), (b) activados por voltaje intermedio (tipo R) y (c) activados por bajo voltaje (tipo T). Debe anotarse que algunos autores clasifican los canales tipo R, como HVA (activados por alto voltaje2) (6).
Los VGCC son proteínas heterooligoméricas constituidas por una subunidad formadora de un poro (denominada α1) y un conjunto de subunidades auxiliares o reguladoras, así como se señala en la Figura 2, en la cual se observan tres subunidades: las β (intracelular), la γ, y la α2-δ (parcialmente extracelular), que son reguladoras. La subunidad á, que tiene cuatro dominios transmembrana (I, II, III y IV), es la formadora del poro. Los segmentos S4 de cada dominio (marcados con el signo +) son los sensores de voltaje.
Figura 2. Esquema de un canal de calcio dependiente de voltaje
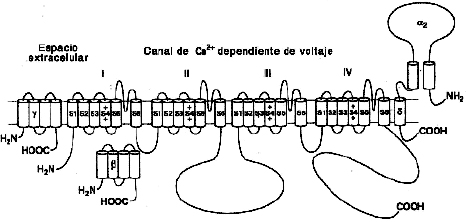
Se sabe que los canales purificados a partir del músculo esquelético (tipo L) contienen cinco subunidades: (i) la subunidad α1 (175 kD), que tiene las señales básicas de identificación del canal (la estructura seudotetramérica, el sensor de voltaje, la región del poro, el sitio de unión de la subunidad β, el sitio de unión del Ca2+ y los sitios de unión de dihidropiridinas y fenilalkilamida); (ii y iii) un dímero α2-δ unido por un puente disulfuro (143 kD y 27 kD); (iv) una subunidad β intracelular (50 kD), y (v) la subunidad γ transmembrana (33 kD). La asociación específica de estas subunidades se ha verificado mediante experimentos de copurificación y coinmunoprecipitación de tejidos neuronales y musculares (7-10).
Las estructuras primarias de estas proteínas se han deducido por clonación de sus cDNA en músculo esquelético de conejo (11-15) y se han empleado posteriormente en muchos laboratorios, como sondas para clonar diferentes subunidades α1, β, γ y α2-δ en varios tejidos y en diferentes especies que incluyen ratas y humanos.
Nomenclatura de las subunidades α1, formadoras del poro
Las subunidades α1 del canal de calcio neuronal son el producto de, por lo menos, diez genes diferentes denominados α1A-I. Recientemente se ha propuesto una nueva nomenclatura para las subunidades α1, que ha sido aprobada por el Comité de Nomenclatura de la Unión Internacional de Farmacología (16). Por lo tanto, para evitar confusiones en este texto se usa las dos nomenclaturas: la alfabética y la nueva, entre paréntesis.
Cuáles son los genes responsables de las corrientes de calcio
Como se mencionó anteriormente, los canales de calcio son proteínas complejas y vale la pena aclarar que la denominación funcional y bioquímica (corriente o corriente sensible a...) puede llamar de igual manera a múltiples complejos moleculares que expresan canales que permiten el paso de corrientes con características muy semejantes, así que una corriente tipo X puede ser producida por diversos arreglos moleculares.
Los canales de calcio tipo L median corrientes sensibles a dihidropiridinas, son HVA y se inactivan lentamente. La subunidad α1 de este complejo proteico puede ser α1C, 1D, 1F o 1S (7, 16). α1S está principalmente restringida al músculo esquelético. Aunque se ha descrito una variedad de corrientes sensibles a DHP, ésta no se ha caracterizado hasta el momento.
Las corrientes tipo N se caracterizan por ser bloqueadas irreversiblemente por ω-conotoxina GVIA3. Se han descrito corrientes sensibles a ω- conotoxina, con diferentes características biofísicas, pero quizá lo más importante sería las diferentes tasas de inactivación (17,18). Se ha propuesto que la subunidad α1 responsable de esa corriente sea α1B. En efecto, la gran afinidad de la ω-conotoxina fue utilizada para aislar y clonar esta subunidad (19). Sin embargo, aún hay dudas con respecto de las diferencias observadas en las cinéticas. Por el contrario, la idea de la existencia de diferentes corrientes ha ganado sustento a partir del hallazgo de diferencias biofísicas entre las variantes por empalme (splice) de α1B (20). También la variabilidad podría deberse a una asociación diferencial con subunidades auxiliares que modifican el comportamiento del canal (21).
Las corrientes de calcio tipo P son corrientes resistentes a dihidropiridinas y a ω-CTX GVIA, se activan por encima de -50 mV, tienen su pico alrededor de +10 mV y muestran, si acaso, muy poca inactivación, en un período de un segundo (22- 23). Las corrientes tipo P se caracterizan principalmente por su sensibilidad a dos fracciones del veneno de la araña Agelenopsis aperta. La primera fracción es la toxina venenosa de la araña (FTX), que es altamente específica para las corrientes HVA insensibles a dihidropiridinas y a ω-CTX, tanto en registro de célula completa como en corrientes unitarias (22-23). La segunda fracción ω-Aga-IVA es un polipéptido que inhibe corrientes P macroscópicas con un Kd entre 2-10 nM. El bloqueo de la ω-Aga-IVA puede ser revertido con un breve tren de despolarización fuerte (24) en diferentes áreas del SNC.
Las corrientes tipo Q son HVA, insensibles a dihidropiridinas y a ω-CTX-GVIA y están bloqueadas potentemente (pero no de manera específica) por ω-CTX-MVIIC4 (25). La corriente tipo Q se inactiva y es parcialmente bloqueada por ω- Aga-IVA 100 nM, pero requiere la eliminación previa de los componentes de las corrientes de Ca ++ tipo P y N, antes de que pueda ser estudiada en forma aislada. Esto puede ser problemático debido a que se han observado efectos bloqueadores de las toxinas que se superponen dentro del rango de concentración considerada típicamente selectiva.
La correlación entre los genes de α1 y las corrientes tipo P y Q ha sido motivo de controversia. Después de la clonación inicial de α1A (27-28) proteína abundante en el cerebelo y su expresión en oocitos de Xenopus, por diferentes grupos (27, 29), se propuso que α1A era la base de la corriente tipo Q y, en menor grado, la de tipo P, debido a su relativa baja sensibilidad a ω-Aga-IVA (inhibición del 50% con 200 nM) y su rápida inactivación.
Sin embargo, experimentos recientes apoyan fuertemente la idea de que en líneas celulares de mamíferos, los canales compuestos por α1A, α2-δ y β1b son la contraparte más posible de los canales tipo P naturales (30-31). Estos hallazgos también están de acuerdo con experimentos de disección molecular que muestran una reducción substancial de las corrientes tipo P, mediante tratamiento de neuronas cerebelosas con oligonucleótidos sin sentido contra la subunidad α1A (32). Sin embargo, ninguna de las combinaciones estudiadas de la subunidad α1A (β1, β2, β3+α2-δ) reproducen completamente las propiedades farmacológicas o electrofisiológicas de los tipos P o Q, pero el consenso general considera que la subunidad α1A puede ser la base del poro de los canales tipo P y Q.
Las corrientes R son definidas como la corriente de calcio HVA residual que se observa luego de la aplicación de una mezcla de toxinas que bloquea selectivamente las corrientes tipo N, L, P y Q (33). Las propiedades biofísicas de esta corriente son difíciles de distinguir de las corrientes tipo N y Q en el modelo de célula completa, y aún hay algunos parámetros que recuerdan las corrientes de tipo T. Debido a la forma como se define esta corriente, muestra una relativa insensibilidad a los bloqueadores de las corrientes de calcio conocidos, sin que se conozca un inhibidor selectivo. Los análisis de canal único en las células granulosas del cerebelo revelaron la existencia de dos poblaciones distintas de corrientes tipo R, conocidas como G1 y G2, con distinto voltaje de activación (-40 mV y -25 mV) (34).
Así como en otros casos estudiados hasta el momento parece que múltiples tipos de canales tipo R pueden coexistir en el mismo tipo de célula. Es posible, entonces, que cualquier subunidad α1 que no sea bloqueada totalmente por el cóctel' de toxinas podría formar canales tipo R. Quizá la correlación entre la corriente tipo R y la subunidad α1 es la más controvertida. Varios grupos (26, 35) han propuesto que α1E es la subunidad formadora del poro de las corrientes tipo R, como se ha determinado por su perfil farmacológico.
De este modo, experimentos recientes han correlacionado el curso temporal de la expresión de transcritos α1 con el de corrientes tipo R, y también con estudios antisentido' α1E (36), lo que nuevamente implica su asociación. Sin embargo, experimentos con ratones knock out para α1E concluyen que en las neuronas granulosas del cerebelo y en las neuronas de ganglios de la raíz dorsal (DRG) la mayoría de la corriente tipo R no depende de la expresión de α1E (37).
Canales tipo T: los canales T clásicos empiezan a abrirse con una despolarización débil, mucho más negativa que la requerida por otros canales de calcio dependientes de voltaje. Las corrientes desencadenadas son transitorias. La inactivación del canal se previene con potenciales muy negativos, mientras que la apertura del canal se inhibe con un potencial mantenido más positivo que -60 mV. Quizá dos de sus más notorias propiedades biofísicas son su pequeña conductancia (8 pS en Ba++ 110 mM) y la lenta cinética de desactivación.
Las subunidades α1G y α1H aisladas por Pérez Reyes, Cribbs y sus grupos (38-39) tienen los motivos característicos de un VGCC, incluida una estructura seudotetramérica, el motivo sensor de voltaje S4 y la región P; sin embargo, les faltan otros motivos conservados en el resto de las subunidades α1 conocidas, como el motivo implicado en interacciones con las subunidades β y el calcio, un aspecto que está de acuerdo con los experimentos que muestran la falta de efecto de los oligos antisentido' de la subunidad β sobre las corrientes naturales de calcio tipo T (40). Recientemente se ha reportado que otra subunidad α1 denominada α1I también permite corrientes tipo T (41).
Canales de calcio presinápticos y su interacción con otras proteínas sinápticas relacionadas
Los estudios inmunocitoquímicos han revelado la distribución diferencial de las subunidades α1 del canal de calcio neuronal: α1A y α1B se expresan principalmente en dendritas y terminales presinápticos. En general, α1A está concentrada en un mayor número de terminales neurales en comparación con α1B (42-43). En la unión neuromuscular de ratas y de humanos, α1A se localiza presinápticamente, mientras que α1A y α1B están presentes en las células de Schwann asociadas al axón. La clase E se localiza principalmente en los cuerpos celulares, en algunos casos en las dendritas proximales y, también, en las ramas dendríticas distales de las células de Purkinje, α1C y α1D están localizadas en los cuerpos celulares y las dendritas proximales de las neuronas centrales (44, 45). La localización y los estudios funcionales de las diferentes subunidades α1 están muy de acuerdo con la caracterización electrofisiológica y farmacológica de los canales de calcio y también con las imágenes de calcio tanto en SNC como en la UNM.
Se sabe que los canales de calcio tipo N, P y Q están implicados en el flujo de calcio en las terminales presinápticas y en la transmisión sináptica (46-48) y se ha propuesto que el tipo L no participa en estos procesos. Sin embargo, el análisis combinado electrofisiológico y de imágenes de calcio de los botones presinápticos de las células bipolares de la retina suministra indicios de unos canales de calcio tipo L que seguramente están involucrados en la liberación del transmisor (49). Utilizando un método farmacológico y electrofisiológico, Bonci et al. han descrito un fenómeno similar en neuronas dopaminérgicas mesencefálicas (50).
Se conoce que las subunidades formadoras del poro en los canales N, P y Q interactúan en forma directa con múltiples proteínas de la maquinaria de liberación de las vesículas sinápticas de una manera compleja y dinámica (51-52). En el caso de la subunidad α1 tipo N (α1B), se ha identificado el motivo estructural implicado en la interacción con sinapsina, sinaptotagmina 1 y SNAP 25 (52). La interacción de α1B con sintaxina y SNAP 25 es regulada por calcio, de una manera bifásica a concentraciones cercanas al umbral para la liberación del transmisor, en contraste con la sinaptotagmina 1, que es independiente de calcio. Estas interacciones también están moduladas por serina/treonina cinasas (53).
Los complejos de multisubunidades de los canales tipo N naturales también están asociados con una subunidad de 95 kD de función desconocida. Los canales P/Q también interactúan con el mismo conjunto de proteínas sinápticas que los canales tipo N, incluida la proteína de 95 kD, la cual se ha propuesto que es una versión corta de α1A (54).
De manera interesante, las isoformas de la subunidad α1 de P/Q (α1A rbA y α1A BI) tienen diferentes patrones de interacciones proteína-proteína, comparadas con α1B. La isoforma α1A rbA interactúa con todas las tres y con una proteína de la vesícula sináptica (parte del complejo SNARE) conocida como proteína de cuerda de cisteína (55).
Algunas de estas interacciones también son calciorreguladas, aunque el tipo de regulación es diferente de la que se ha visto en los canales de tipo N. Se sabe que estas series de interacciones tienen consecuencias funcionales como la coexpresión de sintaxina 1A con α1A o α1B en oocitos de Xenopus, que estabiliza el canal en el estado inactivo (56). Por otra parte, como se podría esperar, la ruptura de la interacción in vivo entre los canales de calcio presinápticos y la sintaxina cambia la neurotransmisión (57). Esta serie de eventos refleja la modulación bidireccional de señales entre los canales de calcio y la maquinaria exocitótica.
Hay varios ejemplos de la asociación entre diferentes canales y las proteínas implicadas en la formación de microdominios funcionales (revisada en 58). Todas las subunidades β de los canales de calcio, identificadas hasta el momento, comparten la homología Scr 3 (SH3) hallada en una variedad de proteínas intracelulares en un amplio rango de organismos. Su presencia en varias moléculas señaladoras y en proteínas citoesqueléticas sugiere un papel en la mediación de interacciones proteínaproteína específicas implicadas en la transducción de señales y en el alcance del objetivo blanco (targeting) específicos. Por ejemplo, se sabe que en canales de K+ hay una asociación directa in vitro entre el dominio SH3 de Src y canales Kv 1.3 (59). Este aspecto no ha sido estudiado hasta ahora en los canales de calcio activados por voltaje, pero es interesante, pues como se reportó en el artículo Calcium dependent activation of P type calcium channel by PYK2 mediated phosphorylation of an auxiliary subunit (60), la tirosincinasa citosólica (PYK2) induce la modificación de los canales de calcio que contienen la subunidad βIb. En este caso, PYK2 posee dos regiones ricas en prolina que potencialmente podrían unirse al dominio SH3 presente en βIb.
Estas interacciones proteína-proteína probadas y potenciales, en las que el complejo del canal de calcio podría unirse en forma directa a proteínas que son socios en una función dada (transmisión sináptica) o que son necesarias para la modulación del canal de calcio (sensibilidad al voltaje), pueden representar precisamente la punta del iceberg, en términos de la dinámica de la organización proteica estructural en la membrana plasmática. Estos fenómenos están en capacidad de suministrar la base molecular que subyace a la eficiencia y a la velocidad de la transmisión sináptica.
ENTRADA DE CALCIO EN EL TERMINAL PRESINÁPTICO POR VÍA DIFERENTE A LOS VGCC
Canales no selectivos
Se ha reportado un canal iónico no selectivo, identificado en la preparación de terminales nerviosos presinápticos de Torpedo, que es dependiente de alto voltaje (3). Basado en el número calculado de iones de calcio transportados, la diferencia de potencial y el tiempo promedio de apertura se puede sugerir que este canal desempeña un papel en la entrada del calcio y en la liberación del neurotransmisor.
Canal del receptor de inositol 1, 4, 5 trifosfato (IP3)
Mediante un enfoque bioquímico se ha demostrado la presencia de un canal de calcio activado por IP3 en las membranas plasmáticas presinápticas de cerebro de rata (4). Así, es posible que IP3 no solamente cause aumento intracelular de calcio mediante la inducción de la liberación de iones de calcio de los depósitos intracelulares, sino también a través de la membrana plasmática.
Receptor nicotínico
La principal función de los receptores presinápticos es la modulación de la eficacia sináptica (revisada en 5). En el SNC se han encontrado receptores presinápticos para prácticamente todos los neurotransmisores. Los receptores nicotínicos están localizados, sobre todo, presinápticamente. La activación de estos receptores puede despolarizar de manera significativa la membrana presináptica y producir un cambio en la concentración de calcio intracelular. Se ha demostrado que en muchas sinapsis la ACh puede inducir exocitosis.
Sitio postsináptico
Aunque muchas de las vías de señalización en los sitios pre y postsinápticos utilizan unos pocos segundos mensajeros comunes (calcio, cAMP y cGMP), la especificidad local se puede lograr mediante el ensamblaje de complejos multiproteicos señaladores, que permitirían una bioquímica eficiente y localizada. Uno de tales casos es el complejo de densidad postsináptica (PSD), una estructura proteinácea de la especialización postsináptica, electrónicamente densa, en las sinapsis excitatorias (Figura 1). Se sabe que la PSD contiene una variedad de proteínas que incluyen las relacionadas con el amortiguador de calcio. También hay crecientes hallazgos de la distribución subcelular específica de proteínas en el sitio postsináptico (especialmente espinas dendríticas) en áreas específicas del cerebro (ejemplos de tales proteínas serán discutidos más adelante). Otros aspectos de la agrupación y el significado de la organización del PSD y de los receptores de neurotransmisores postsinápticos se han revisado últimamente (61).
Señales de un gran número de estímulos externos, que incluyen neurotransmisores, factores de crecimiento y hormonas, convergen al espacio del ion calcio y es mediado luego por diversas proteínas intracelulares portadoras de calcio. Algunas de ellas, como la calmodulina, se expresan en una variedad de células, mientras que otras están limitadas al sistema nervioso y por ello se han llamado sensores de calcio neuronal (62-63).
Varias proteínas neuronales ligadoras de calcio se han localizado en el compartimiento postsináptico. Éstas incluyen fodrina y á-actinina- 2 como elementos estructurales, también la molécula reguladora calmodulina, proteinfosfatasa serina/treonina (PP2B), proteína neuronal sensora de calcio VILIP, calretinina y caldendrín, una proteína recientemente identificada. Hasta ahora, caldendrín ha sido identificada solamente en el compartimiento somato-dendrítico de neuronas y su inmunorreactividad está enriquecida en la PSD.
Se han reportado efectos funcionales de varias de estas proteínas. á-actinina y Ca++/ calmodulina están implicadas en la unión dependiente de calcio del receptor NMDA con la citomatriz sináptica. La calmodulina en su forma ligada al calcio es capaz de activar calmodulin cinasa II (CamKII), una proteína que es prominente en la PSD y participa en una variedad de procesos neuronales que incluyen la promoción de la maduración de sinapsis glutamatérgicas (64) y LTP (65). Por otra parte, se ha reportado un aumento de CamKII en las dendritas de neuronas que reciben estimulación tetánica, debido a un aumento de la síntesis de proteínas dendríticas. También se ha demostrado que PP2B defosforila al receptor NMDA en una manera dependiente de calcio, que produce una disminución en el tiempo promedio de apertura del canal (66).
Entre las enzimas implicadas en la integración de la señal postsináptica está la proteinfosfatasa 1, una serin/treonin fosfatasa que está enriquecida en el cerebro y está localizada específicamente en las espinas dendríticas (67). Se ha demostrado que está implicada en la regulación por dopamina de las corrientes de calcio. Recientemente fue identificada una proteína asociada a PP1, denominada spinofilina, que se ha propuesto como la subunidad objetivo de PP1, que dirige la enzima hacia esos sustratos en el compartimiento de la espina dendrítica (68).
Señales de calcio locales en la dendrita
Los hallazgos de las propiedades dinámicas de las dendritas se obtuvieron inicialmente en las células de Purkinje del cerebelo (69). Más tarde se obtuvieron hallazgos similares en las neuronas piramidales del hipocampo. Actualmente está bien establecido que dendritas de diferentes neuronas del SNC son capaces de una respuesta regenerativa de calcio dependiente de voltaje, y por consiguiente tienen los elementos necesarios para generar microdominios de calcio. Las corrientes dendríticas de calcio se han estudiado tanto en dendritas intactas como en dendritas aisladas (dendrosomas). Hay, así, indicios de la presencia de una variedad de canales dendríticos de calcio dependientes de voltaje (que incluyen todos los tipos) tanto funcionalmente como anatómicamente. La literatura médica actual es consistente con la presencia de diferentes canales de calcio en el soma, comparado con la dendrita. Aún más, en las interneuronas talámicas hay pruebas indirectas que sugieren que sus terminales dendríticas están aisladas eléctricamente de su soma y axones, ya que la activación de receptores metabotrópicos de glutamato produjo, a la vez, la activación de terminales dendríticos en ausencia de potenciales de acción; mientras que un agonista metabotrópico de glutamato no tuvo efecto sobre el soma (70).
Experimentos realizados en diferentes áreas cerebrales han revelado que los canales de calcio dendríticos pueden ser activados por propagación retrógrada de los potenciales de acción, lo que puede ocasionar una elevación importante del calcio dendrítico. Potenciales postsinápticos excitatorios subumbrales también pueden abrir canales de calcio y causar un aumento más localizado en la concentración de calcio dendrítico. Sin embargo, los registros in vivo de las células neocorticales de las capas 2/3 en ratas anestesiadas no pudieron demostrar potenciales de acción dependientes de calcio en las dendritas piramidales neocorticales, lo que sugiere que cualquier aumento significativo de calcio en este compartimiento dendrítico es generado por potenciales de acción desencadenados por sodio en el soma, al menos en este experimento (71).
La excitabilidad dendrítica es un fenómeno altamente modulado, que puede ser influido por la composición iónica, la intensidad de la excitación sináptica y los impulsos inhibitorios. Además, los canales de calcio dendríticos pueden ser modulados por diferentes eventos postraslacionales y las propiedades de los canales de calcio dependientes de voltaje son diferentes cuando son activados con diferentes trenes' de potenciales de acción. Así, es difícil extrapolar entre diferentes condiciones experimentales (in vivo e in vitro) y, aún más, generalizar a diferentes tipos de dendritas neuronales.
La identificación de la mínima unidad de respuesta activa eléctrica en el sitio postsináptico permanece como un problema importante. En las células de Purkinje se ha demostrado que después de la acti- vación de fibras paralelas, una ramita de una espina dendrítica, con sus espinas asociadas, puede descargar como una unidad. Sin embargo, hallazgos recientes (72) apoyan la idea de que la unidad más pequeña de respuesta eléctrica en esa sinapsis (fibra paralela-dendrita de la célula de Purkinje) es la espina y no la ramita de espina, pues éstas fueron capaces de responder como un compartimiento eléctrico y de concentración de calcio bajo la activación sináptica de fibras paralelas. Además, estos experimentos identificaron dos poblaciones funcionalmente distintas de espinas en el árbol dendrítico de las células de Purkinje, lo que demuestra el alto grado de complejidad de este sistema y abre la posibilidad de que espinas en otro tipo de neuronas puedan no ser eléctricamente homogéneas.
Por ende, para agregar elementos adicionales con respecto de la complejidad de las espinas dendríticas, hay indicios experimentales de registros de video, in vivo, que utilizan actina marcada con proteína verde fluorescente, que revelaron cambios anatómicos que ocurren en términos de segundos en la espina de neuronas hipocámpicas maduras (73).
CONCLUSIONES
En este momento es claro que los canales iónicos no son moléculas aisladas, sino que forman estructuras multimoleculares complejas. El diseño en la neurona presináptica está dispuesto de tal manera que permite su función en términos de microsegundos, lo que determina una falta de homogeneidad de la neurona muy característica, que cambia con el tiempo, es decir, el norte' de la neurona es muy diferente al sur', y, aún más, esas diferencias son mayores o menores dependiendo de la actividad de la neurona.
A estos canales se les denomina compartimentos dinámicos, pues no son necesariamente físicos. De hecho, en la mayoría de los casos son funcionales (por ejemplo, el microdominio de calcio sólo existe transitoriamente). Así, necesariamente se llega a otra situación que no se ha discutido en esta revisión: la temporalidad. Dejaremos para los lectores un momento de reflexión sobre este último tema hasta una próxima revisión de este importante aspecto de la transmisión de señales en el SNC.
NOTAS AL PIE
1. Con la tecnología actual no es posible observar directamente los canales sensibles al voltaje, sino solamente las corrientes iónicas que pasan a través de esos canales. Por eso se habla de corrientes de calcio, pues ésos son los eventos observados.
2. Los primeros VGCC descritos fueron los canales L, T y N. L, por permitir el paso de corriente durante un período largo en términos de milisegundos; T, por ser de duración transitoria, y N, por la palabra inglesa none (ninguno de los dos anteriores). Posteriormente se identificaron otros canales en las células de Purkinje, razón por la que se denominaron P. Los canales que se han descubierto a continuación de los anteriores han recibido su nomenclatura siguiendo el orden alfabético: Q, R. Esta nomenclatura está próxima a ser modificada, para unificarse con la que ya está vigente para los canales de sodio y de potasio voltaje dependientes. Según esta última, se usará Cav (canal de calcio voltaje dependiente) seguido de un número asignado según la composición de la cadena peptídico del canal, así: Ca v1, para los canales L; Ca v2.1, canal P/Q; Ca v2.2, canal N; Ca v2.3, canal R; Cav3, canales T.
3. ω-conotoxina GVIA es una toxina componente del veneno del molusco marino Conus geographus.
4. ω-CTX-MVIIC es una toxina componente del veneno de otra especie de Conus: Conus magus.
BIBLIOGRAFÍA
1. Harlow ML, Ress D, Stoschek A, Marshall RM, McMahan UJ. The architecture of active zone material at the frog's neuromuscular junction. Nature. 2001;409:479-84. [ Links ]
2. Garner CC, Kindler S, Gundelfinger ED. Molecular determinants of presynaptic active zones. Curr Opin Neurobiol. 2000;10(3):321-7. [ Links ]
3. Meir A, Rahamimoff R. A voltage-dependent and calcium-permeable ion channel in fused presynaptic terminals of Torpedo. J Neurophysiol. 1996;75(5):1858-70. [ Links ]
4. Ueda H, Tamura S, Fukushima N, Katada T, Ui M, Satoh M. Inositol 1,4,5-trisphosphate-gated calcium transport through plasma membranes in nerve terminals. J Neurosci. 1996;16(9):2891-900. [ Links ]
5. Wonnacott S, Drasdo A, Sanderson E, Rowell P. Related articles presynaptic nicotinic receptors and the modulation of transmitter release. Ciba Found Symp. 1990;152:87-101; discussion 102-5. [ Links ]
6. Reuter H. Diversity and function of presynaptic calcium channels in the brain. Curr Opin Neurobiol. 1996;6:331-7. [ Links ]
7. Curtis B, Catterall W. Purification of the calcium antagonist receptor of the voltage sensitive calcium channel from skeletal muscle transverse tubules. Biochemistry. 1984;23:2113-8. [ Links ]
8. Takahashi M, Seagar M, Jones J, Reber B, Catterall W. Subunit structure of dihydropyridine sensitive calcium channels from skeletal muscle. Proc Natl Acad Sci USA. 1987;84:5478-82. [ Links ]
9. Curtis B, Catterall W. Reconstitution of the voltage sensitive calcium channel purified from skeletal muscle transverse tubules. Biochemistry. 1986;25:3077-83. [ Links ]
10. Flockerzi V, Oeken H, Hofmann F, Pelzer D, Cavalie A, Trautwein W. Purified dihydropyridine binding site from skeletal muscle t-tubules is a functional calcium channel. Nature. 1986;323:66-8. [ Links ]
11. Bosse E, Regulla S, Biel M, Ruth P, Meyer H, Flockerzi V et al. The cDNA and deduced amino acid sequence of the Gamma subunit of the L type calcium channel from rabbit skeletal muscle. FEBS Lett. 1990;267:153-6. [ Links ]
12. Tanabe T, Takeshima H, Mikami A, Flockerzi V, Takahashi H, Hirose T et al. Primary structure of the receptor for calcium channel blockers from skeletal muscle. Nature. 1987;328:313-8. [ Links ]
13. Ellis S, Williams M, Ways N, Ways N, Brenner R, Sharp A et al. Sequence and expression of mRNAs encoding the alpha1 and alpha2 subunits of a DHP sensitive calcium channel. Science. 1988;241:1661-4. [ Links ]
14. Jay S, Ellis S, McCue A, Williams M, Vedvick T, Harpold M et al. Primary structure of the gamma subunit of the DHP sensitive calcium channel from skeletal muscle. Science. 1990;248:490-2. [ Links ]
15. Ruth P, Rohrkasten A, Biel M, Bosse E, Regulla S, Meyer H et al. Primary structure of the Beta subunit of the DHP sensitive calcium channel from skeletal muscle. Science. 1989;245:1115-8. [ Links ]
16. Ertel EA, Campbell KP, Harpold MM, Hofmann F, Mori Y, Pérez-Reyes E et al. Nomenclature of voltage-gated calcium channels. Neuron. 2000;(3):533-5. [ Links ]
17. Plummer M, Hess P. Reversible uncoupling of inactivation in N type calcium channels. Nature. 1991;351:657-9. [ Links ]
18. Fisher T, Bourque C. Distinct omega agatoxin sensitive calcium currents in somata and axon terminals of rat supraoptic neurons. J Physiol. 1995;489 Pt 2:383-8. [ Links ]
19. De Waard M, Witcher D, Campbell K. Functional properties of the purified N type calcium channel from rabbit brain. J Biol Chem. 1994;269(9):6716-24. [ Links ]
20. Lin Z, Haus S, Edgerton J, Lipscombe D. Identification of functionally distinct isoforms of the N-type Ca2+ channel in rat sympathetic ganglia and brain. Neuron. 1997;18(1):153-66. [ Links ]
21. Isom L, De Jongh K, Catterall W. Auxiliary subunits of voltage gated ion channels. Neuron. 1994;12:1183-94. [ Links ]
22. Llinás R, Sugimori M, Lin J.W. Blocking and isolation of a calcium channel from neurons in mammals and cephalopods utilizing a toxin fraction (FTX) from the funnel web spider poison. Proc Natl Acad Sci USA. 1989;86:1689-93. [ Links ]
23. Usowicz M, Sugimori M, Cherksey B, Llinás R. P type calcium channels in the somata and dendrites of adult cerebellar Purkinje cells. Neuron. 1992;9(6):1185-99. [ Links ]
24. Mintz I, Adams M, Bean B. P type calcium channels in rat central and peripheral neurons. Neuron. 1992;9(1):85-95. [ Links ]
25. Randall A, Tsien R. Pharmacological dissection of multiple types of calcium channel currents in rat cerebellar granule neurons. J Neurosci. 1995;15(4):2995-3012. [ Links ]
26. Pearson H, Sutton K, Scott R, Dolphin A. Characterization of calcium channel currents in cultured rat cerebellar granule neurones. J Physiol. 1995;482(3):493-509. [ Links ]
27. Starr T, Prystay W, Snutch T. Primary structure of a calcium channel that is highly expressed in rat cerebellum. Procd Natl Acad Sci USA. 1991;88:5621-5. [ Links ]
28. Mori Y, Friedrich T, Kim M, Kikami A, Nakai J, Ruth P et al. Primary structure and functional expression from complementary DNA of a brain calcium channel. Nature. 1991;350:398-402. [ Links ]
29. Stea A, Tomlison J, Soong T, Bourniet E, Dubel S, Vincent S et al. Localization and functional properties of a rat brain alpha 1A calcium channel reflect similarities to neuronal Q and P type channels. Proc Natl Acad Sci USA. 1994;91:10576-80. [ Links ]
30. Moreno H, Rudy B, Llinás R. B subunits influence the biophysical and pharmacological differences between P and Q type calcium currents expressed in a mammalian cell line. Proc Natl Acad Sci USA. 1997;94:14042-7. [ Links ]
31. Berrow N, Brice N, Tedder I, Page K, Dolphin A. Properties of cloned rat alpha 1A calcium channels transiently expressed in the COS-7 cell line. Europ J Neurosci. 1997;9:739-48. [ Links ]
32. Gillard S, Volsen S, Smith W, Beattie R, Bleakman D, Lodge D. Identification of a pore forming subunit of P type calcium channels: an antisense study on rat cerebellar Purkinje cells in culture. Neuropharmacology. 1997;36(3):405-9. [ Links ]
33. Randall A, Tsien R. Contrasting biophysical and pharmacological properties of T type and R type calcium channels. Neuropharmacology. 1997;36(7):879-93. [ Links ]
34. Nooney J, Lambert R, Feltz A. Identifying neuronal non L calcium channels more than stamp collecting? TiPS. 1997;18:363-71. [ Links ]
35. Wakamori M, Niidome T, Furutama D, Furuichi T, Fujita Y, Tanaka I et al. Distinctive functional properties of the neuronal BII (class E) calcium channel. Receptors Channels. 2002:03-314. [ Links ]
36. Pietrobon A, Tottene B, Hivert R, Rizzuto R, Snutch T. Correlation between native neuronal calcium channels and cloned calcium channel subunits. Soc Neurosc Abstracts. 1997;783.8a. [ Links ]
37. Wilson SM, Toth PT, Oh SB, Gillard SE, Volsen S, Ren D et al. The status of voltage-dependent calcium channels in alpha 1E knock-out mice. J Neurosci. 2000;20(23):8566-71. [ Links ]
38. Pérez-Reyes E, Cribbs L, Daud A, Lacerda A, Barclay J, Williamson M et al. Molecular characterization of a neuronal low voltage activated T type calcium channel. Nature. 1998;391:896-900. [ Links ]
39. Cribbs LL, Lee JH, Yang J, Satin J, Zhang Y, Daud A et al. Cloning and characterization of alpha1H from human heart, a member of the T-type Ca2+ channel gene family. Circ Res. 1998; 83(1):103-9. [ Links ]
40. Lambert R, Maulet Y, Mouton J, Beattie R, Volsen S, De Waard M et al. T type calcium current properties are not modified by calcium channel Beta subunit depletion in nodosus ganglion neurons. J Neurosci. 1997;17:6621-8. [ Links ]
41. McRory JE, Santi CM, Hamming KS, Mezeyova J, Sutton KG, Baillie DL et al. Molecular and functional characterization of a family of rat brain T-type calcium channels. J Biol Chem. 2001;276(6):3999-4011. [ Links ]
42. Sakurai T, Westenbroek R, Rettig J, Hell J, Catterall W. Biochemical properties and subcellular distribution of the BI and rbA isoforms of alpha 1A subunits of brain calcium channels. J Cell Biol. 1996;134(2):511-28. [ Links ]
43. Day N, Shaw P, McCormack A, Craig P, Smith W, Williams T et al. Distribution of alpha1A, alpha1B and alpha 1E voltage dependent calcium channel subunits in the human hippocampus and parahippocampal gyrus. Neuroscience. 1996;71(4):1013-24. [ Links ]
44. Yokoyama C, Westenbroek R, Hell J, Soong T, Snutch T, Catterral W. Biochemical properties and subcellular distribution of the neuronal class E calcium channel alpha 1 subunit. J Neurosci. 1995;15(10):6419-32. [ Links ]
45. Hell JW, Westenbroek RE, Warner C, Ahlijanian MK, Prystay W, Gilbert MM et al. Identification and differential subcellular localization of the neuronal class C and class D L-type calcium channel alpha 1 subunits. J Cell Biol. 1993;123(4):949-62. [ Links ]
46. Katz, B. The release of neuronal transmitter substances. Liverpool: Liverpool University Press; 1969. [ Links ]
47. Choi, DW. Excitotoxic cell death. J Neurobiol. 1992;23:1261-76. [ Links ]
48. Baimbridge K, Celio M, Rogers T. Calcium binding proteins in the nervous system. Trends Neurosci. 1992;15:303-8. [ Links ]
49. Protti DA, Llano I. Calcium currents and calcium signaling in rod bipolar cells of rat retinal slices. J Neurosci. 1998;18(10):3715-24. [ Links ]
50. Bonci A, Grillner P, Mercuri NB, Bernardi G. L-Type calcium channels mediate a slow excitatory synaptic transmission in rat midbrain dopaminergic neurons. J Neurosci. 1998;18(17):6693-6703. [ Links ]
51. Sheng Z, Rettig J, Cook T, Catterall W. Calcium dependent interaction of N type calcium channels with the synaptic core complex. Nature. 1996;379:451-4. [ Links ]
52. Kim D, Catterall W. Calcium dependent and independent interactions of the isoforms of the alpha 1A subunit of brain calcium channels with presynaptic SNARE proteins. Proc Natl Acad Sci USA. 1997;94(26):14782-6. [ Links ]
53. Yokoyama C, Sheng Z, Catterall W. Phosphorylation of the synaptic protein interaction site on n type calcium channels inhibits interactions with SNARE proteins. J Neurosci. 1997;17(18):6929-38. [ Links ]
54. Scott VE, Felix R, Arikkath J, Campbell KP. Evidence for a 95 kDa short form of the alpha1A subunit associated with the omega-conotoxin MVIIC receptor of the P/Q-type Ca2+ channels. J Neurosci. 1998;18(2):641-7. [ Links ]
55. Leveque C, Pupier S, Marqueze B, Geslin L, Kataoka M, Takahashi M et al. Interaction of cysteine string proteins with the alpha1A subunit of the P/Q-type calcium channel. J Biol. 1998;273(22):13488-92. [ Links ]
56. Bezprozvanny I, Scheller R, Tsien R. Functional impact of syntaxin on gating of N type and Q type calcium channels. Nature. 1995;378:623-6. [ Links ]
57. Rettig J, Heinemann C, Ashery U, Sheng Z, Yokoyama C, Catterall W et al. Alteration of calcium dependence of neurotransmitter release by disruption of calcium channel/syntaxin interaction. J Neurosci. 1997;179(17):6647-56. [ Links ]
58. Sheng M, Kim E. Ion channel associated proteins. Curr Opin Neurobiol. 1996;6:602-5. [ Links ]
59. Esguerra M, Wnag J, Foster C, Adelamn J, North R, Levitan I. Cloned calcium dependent K+ channel modulated by a functionally associated protein kinase. Nature. 1994;369:563-5. [ Links ]
60. Moreno H, Lev S, Hernández J, Schlessinger J, Rudy B, Llinás R. Calcium dependent activation of P type calcium channel by PYK2 mediated phosphorylation of an auxiliary subunit. Abstract Soc Neurosci. 1998;650a. [ Links ]
61. Ziff EB. Enlightening the postsynaptic density. Neuron. 1997;6:1163-74. [ Links ]
62. Schaad NC, De Castro E, Nef S, Hegi S, Hinrichsen R, Martone ME et al. Direct modulation of calmodulin targets by the neuronal calcium sensor NCS-1. Proc Natl Acad Sci USA. 1996;93(17):9253-8. [ Links ]
63. Polans A, Baehr W, Palczewski K. Turned on by Ca2+! The physiology and pathology of Ca(2+)-binding proteins in the retina. Trends Neurosci. 1996;19(12):547-54. [ Links ]
64. Wu GY, Cline HT. Stabilization of dendritic arbor structure in vivo by CaMKII. Science. 1998;279:222-6. [ Links ]
65. Fukunaga K, Muller D, Miyamoto E. CaM kinase II in long-term potentiation. Neurochem Int. 1996;28(4):343-58. [ Links ]
66. Lisman J. The CaM kinase II hypothesis for the storage of synaptic memory. Trends Neurosci. 1994;17(10):406-12. [ Links ]
67. Lieberman DN, Mody I. Regulation of NMDA channel function by endogenous Ca(2+)-dependent phosphatase. Nature. 1994;369:235-9. [ Links ]
68. Ouimet CC, Da Cruz e Silva EF, Greengard P. The alpha and gamma 1 isoforms of protein phosphatase 1 are highly and specifically concentrated in dendritic spines. Proc Natl Acad Sci USA. 1995;92(8):3396-3400. [ Links ]
69. Allen PB, Ouimet CC, Greengard P. Spinophilin, a novel protein phosphatase 1 binding protein localized to dendritic spines. Proc Natl Acad Sci USA. 1997;94(18):9956-61. [ Links ]
70. Llinás R, Nicholson C. Electrophysiological properties of dendrites and somata in alligator Purkinje cells. J Neurophysiol. 1971;34(4):532-51. [ Links ]
71. Cox CL, Zhou Q, Sherman SM. Glutamate locally activates dendritic outputs of thalamic interneurons. Nature. 1998;394:478-82. [ Links ]
72. Svoboda K, Denk W, Kleinfeld D, Tank DW. In vivo dendritic calcium dynamics in neocortical pyramidal neurons. Nature. 1997;385:161-5. [ Links ]
73. Denk W, Sugimori M, Llinás R. Two types of calcium response limited to single spines in cerebellar Purkinje cells. Proc Natl Acad Sci USA. 1995;92(18):8279-82. [ Links ]
74. Fischer M, Kaech S, Knutti D, Matus A. Rapid actin-based plasticity in dendritic spines. Neuron. 1998;20(5):847-54. [ Links ]














