Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Ciencias de la Salud
Print version ISSN 1692-7273On-line version ISSN 2145-4507
Rev. Cienc. Salud vol.3 no.2 Bogotá July/Dec. 2005
Análisis de la susceptibilidad de una línea celular de Aedes aegypti (Diptera: Culicidae) a la infección con leishmania (L) chagasi y Leishmania (V) braziliensis§
Susceptibility Analysis of a Cell Line Derived from Aedes aegypti (Diptera: Culicidae) to Leishmania (L) chagasi and Leishmania (V) braziliensis Infection
Carolina Muñoz-Camargo*, Alfonso Barreto, Felio Bello
* Laboratorio de Entomología, Biología Celular y Genética, Universidad de La Salle.
† Departamento de Microbiología. Pontificia Universidad Javeriana
† Instituto de Ciencias Básicas, Facultad de Medicina, Universidad del Rosario, Calle 63D No. 24-31. Bogotá, Colombia. Correo electrónico: fbello@urosario.edu.co
§ El presente trabajo fue financiado por Colciencias, código: 1243-05-12416, y la Universidad de La Salle.
Recibido: agosto de 2005 Aceptado: agosto de 2005
Resumen
Se evaluó la susceptibilidad de los cultivos celulares derivados de tejidos embrionarios de Aedes aegypti a la infección con Leishmania (L) chagasi y Leishmania (V) braziliensis, agentes etiológicos de leishmaniasis visceral americana y leishmaniasis cutánea, respectivamente.
Metodología: Se seleccionaron células de A. aegypti mantenidas en una mezcla de medio de cultivo Grace/L15, suplementado con suero fetal bovino al 15%, albendazol 5,4 mg/ml y una mezcla de antibióticos, e incubadas a una temperatura promedio de 26 °C. Los cultivos celulares fueron inoculados con promastigotes metacíclicos de la cepa MH/CO/84/CI-044B de L. chagasi y la cepa HOM/BR752903 de L. braziliensis en una concentración de 10 parásitos por célula. Como control positivo de la infección se utilizó la línea celular J774.
Resultados: Los registros más altos en el porcentaje de infección y en el número de amastigotes por células en los cultivos celulares A. aegypti y en la línea celular J774 se obtuvieron en los días 6 y 9 pos-infección. Los resultados mostraron interacción, internalización y maduración in vitro de las dos especies del parásito en las células de este insecto no vector de Leishmania. Las células de A. aegypti infectadas mostraron cambios en el área por la influencia de los parásitos, contrario a lo registrado en las células no infectadas (P<0,05).
Conclusión: Los cultivos celulares de A. aegypti emergen como un nuevo modelo in vitro para el estudio del ciclo biológico de L. chagasi y L. braziliensis.
Palabras clave: cultivo celulares, Leishmania, mosquitos, ultraestructura, patogenicidad.
Abstract
The susceptibility of culture cells derived from embryonic tissues of Aedes aegypti to the infection with Leishmania (L) chagasi and Leishmania (V) braziliensis was evaluated.
Methodology: These parasites are etiological agents of American visceral leishmaniasis and cutaneous leishmaniasis, respectively. Selected cells of Aedes aegypti were maintained in culture medium Grace/L15, supplement with 15% bovine fetal serum, 5,4 mg/ml of albendazol and an antibiotic mixture and incubated at an average temperature of 26°C. The cultures were inoculated with metacyclic promastigotes of the strain MH/ CO/84/CI-044B of L. chagasi and the strain HOM/BR752903 of L. braziliensis in a concentration of 10 parasites by cell. The J774 cell line was used as positive control of infection.
Results: The highest percentage of infection represented as the number of amastigotes per cell in A. aegyti cell cultures and in the J774 cell line were obtained on days 6 and 9 post-infection. The results showed interaction, internalization and maturation in vitro of the two species of the parasite in the cells of a non-vector insect of Leishmania. Infected A. aegypti cells showed changes in its area because of the influence of the parasites that differ significantly (P <0.05) compared to not infected cells.
Conclusion: Cell cultures from A. aegypti emerge as a new in vitro model for the study of the biological cycle of L. chagasi and L. braziliensis.
Key words: culture of cell, Leishmania, mosquitoes, ultrastructure, pathogenicity
INTRODUCCIÓN
Los parásitos de Leishmania presentan un ciclo de vida digenético que se refleja en una forma flagelada extracelular móvil (promastigote), la cual se desarrolla en el tracto digestivo del insecto vector, y una forma amastigote intracelular que se desarrolla y multiplica en macrófagos de un hospedero mamífero (1-3). La infección por Leishmania tiene una distribución endémica de aproximadamente el 50% del territorio en Colombia (4) y, según el Ministerio de Protección Social, en el 2003 se notificaron 9.708 casos de leishmaniasis, de los cuales el 98% correspondieron a leishmaniasis cutánea. La leishmaniasis visceral representó el 1%, y el restante lo constituyó la leishmaniasis mucocutánea.
Los primeros estudios in vitro sobre el cultivo de Leishmania se realizaron con promastigotes en medios axénicos, posteriormente se indujo diferenciación de promastigotes en amastigotes mediante variaciones de pH y temperatura en medios libres de células (5, 6). También se ha logrado diferenciación, maduración y replicación in vitro de Leishmania en cultivos celulares de macrófagos, principal célula hospedera durante el proceso de infección (7-11). De la misma manera, se ha demostrado la infección de otros tipos de células tales como: fibroblastos, epiteliales, neutrófilos y dendríticas (12-14). A pesar de los estudios realizados en diferentes líneas celulares y cultivos axénicos sobre los estadios de Leishmania durante su ciclo de vida, son pocos los reportes acerca de la interacción, maduración y multiplicación de éstos en cultivos celulares de insectos.
En este estudio se determinó la susceptibilidad del cultivo celular derivado de tejido embrionario de A. aegypti (15) a la infección con L. braziliensis, agente etiológico de leishmaniasis cutánea, y L. chagasi, agente etiológico de leishmaniasis visceral americana. Se establecieron porcentajes de infección con base en observaciones de microscopía de luz y algunas características ultraestructurales de la infección con L. chagasi. De forma paralela, se realizó el proceso de infección en la línea celular J774 (16) y se comparó con los resultados obtenidos en el cultivo celular de A. aegypti. Además, se realizó un estudio morfométrico de las células de A. aegypti antes y después de la infección con L. braziliensis y L. chagasi para determinar los cambios con respecto al área celular.
MATERIALES Y MÉTODOS
Cultivos celulares. Los cultivos celulares de A. aegypti (15) derivados de tejido embrionario se mantuvieron en una mezcla de medios GraceL- 15 (17, 18), suplementado con SBF al 15% albendazol 5,4 mg/ml y una mezcla de antibióticos (penicilina y estreptomicina) al 1%, en un rango de pH entre 6,3-6,8. La temperatura de incubación en promedio para estos cultivos celulares fue de 26 °C. La línea celular J774 (16), control positivo, se cultivó en medio RPMI, con SFB al 10% e incubada a una temperatura de 37 °C.
Parásitos. Se utilizó la cepa (HOM/BR752903) de L. braziliensis suministrada por el Centro Internacional de Física (CIF) de la Universidad Nacional, y la cepa MH/CO/84/CI-044B de L. chagasi, suministrada por el Instituto Nacional de Salud (INS). Se cultivaron los promastigotes en medio axénico NNN bifásico modificado, con Schneider´s de Drosophila y enriquecido con suero fetal bovino (SFB) inactivado al 10% a una temperatura de incubación de 26 °C.
Infección in vitro. Las células de los cultivos celulares de A. aegypti y J774 seleccionadas en una concentración de 2x105 para el proceso de infección, fueron sembradas en cajas de 24 pozos con laminillas de 12 mm previamente fijadas en la parte inferior de cada pozo. Después de 24 horas de adaptación, adhesión y crecimiento celular se realizó la infección con promastigotes metacíclicos en una proporción de 10 parásitos por célula. Luego, se incubaron los cultivos de A. aegypti a 26 °C y los de J774 a 37 °C. Pasadas 12 horas de incubación se realizó un lavado de los pozos con solución salina para remover los promastigotes no internalizados, continuando así con el proceso de infección. En los días 3, 6 y 9 posinfección se retiraron las laminillas correspondientes, se lavaron con solución salina, se fijaron con metanol puro, se colorearon con Giemsa al 10%, y por último se realizó un montaje permanente en láminas portaobjetos. Posterior al montaje se hicieron observaciones en el microscopio de luz y se registraron los datos de la infección.
Microscopia electrónica. Se realizó un estudio ultraestructural de las células de A. aegypti y J774 infectadas con el parásito de L. chagasi (MH/CO/84/CI-044B) por medio de la técnica de microscopia electrónica. Las muestras fueron procesadas según el protocolo establecido por el laboratorio de microscopia electrónica del Instituto Nacional de Salud. Posteriormente se realizaron cortes de 60 a 90 nm con un ultramicrotomo LKB, coloreados con acetato de uranil y citrato de plomo y observados en el microscopio electrónico ZEISS EM 109.
Morfométria celular. Se realizó un estudio morfométrico en el cual se tuvo en cuenta el área de las células de los cultivos celulares de A. aegypti en ausencia y presencia de la infección. Se hizo la captura de imágenes de las células infectadas en los días 3, 6 y 9 posinfección, y de la misma manera para las células no infectadas, por medio de una cámara Sony Hyper HAD adaptada a un microscopio de luz CH30. Las imágenes transferidas al computador se analizaron por medio del software IMAGE- PROPLUS 5 de Medya Cybernetics
Análisis estadístico. Se determinó el porcentaje de infección teniendo en cuenta la cantidad de células infectadas por campo; además, se calculó el número de amastigotes en cada una de las células infectadas. Debido a que los datos no cumplieron con los supuestos de normalidad y homogeneidad de varianzas se aplicó un análisis no paramétrico, utilizando el software STATISTICA 6 y como alternativa una prueba de Kruskal Wallis y una prueba U de Mann Whitney de comparación de medias independientes con un nivel de confianza del 95%. Del mismo modo se aplicaron estas pruebas para los datos de área en el estudio morfométrico de los cultivos celulares de A. aegypti con un nivel de confianza del 99% (19).
RESULTADOS
Infección celular. 24 horas después de la infección se observaron cada uno de los pozos bajo el microscopio invertido evidenciando una fuerte asociación de los parásitos (L. chagasi MH/ CO/84/CI-044B y L. braziliensis HOM/ BR752903) con las células A. aegypti al igual que con el control positivo J774.
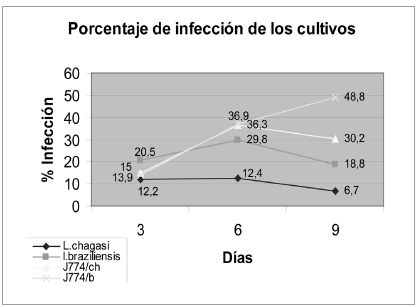
El día 6 posinfección se presentó en promedio el mayor porcentaje de infección tanto para las células de A. aegypti infectadas con L. braziliensis (29,8%) como con L. chagasi (12,5%). Hubo diferencias estadísticamente significativas entre los porcentajes de infección en los días 3, 6 y 9 (P< 0,005) para la infección con L. braziliensis, pero no para la infección con L. chagasi (P>0,05).
Del mismo modo, en la figura 1 se presentan los porcentajes de infección para el control positivo, células J774 con L. braziliensis y L. chagasi. Además, se determinó la diferencia entre los porcentajes de los días posinfección (3, 6 y 9) en las células J774 infectadas con L. braziliensis y L. chagasi con un valor P<0,001.
Figura 1. Porcentaje promedio de infección de los cultivos de Aedes aegypti y J774 inoculados con Leishmania chagasi y Leishmania braziliensis en los días posinfección indicados. Las pruebas de Kruskal Wallis y U de Mann Whitney arrojaron diferencias significativas entre las medias de los diferentes días posinfección (3, 6 y 9) para la infección de A. aegypti con L. braziliensis (p< 0,005) y para J774 con las dos especies de Leishmania (p<0,001).
Por otro lado, en la figura 2 se pueden observar claramente las formas amastigotes de los parásitos de L. braziliensis (A) y L. chagasi (B) en las células de A. aegypti. Se destaca que el mayor número de amastigotes por célula (tabla 1) se observó en los cultivos de A. aegypti infectados con L. chagasi (6, 8) comparado con su control (4, 7) y con la infección con L. braziliensis (4, 9). 02 Analisis suceptibilidad.P65 122 12/2/2005, 1:37 AM
Tabla 1. Promedio del número de amastigotes por célula y el porcentaje de infección de Leishmania braziliensis y Leishmania chagasi en cultivos celulares de Aedes aegypti y J774
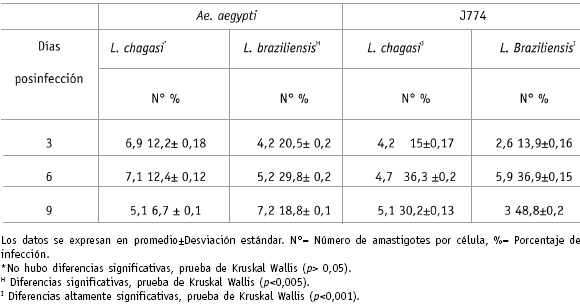
Figura 2. Células de Aedes aegypti con amastigotes que se muestran mediante flechas, a los 3 días posinfección. (A): parásito de Leishmania braziliensis (100X) (B): parásito de Leishmania chagasi (100X) utilizando tinción Giemsa.
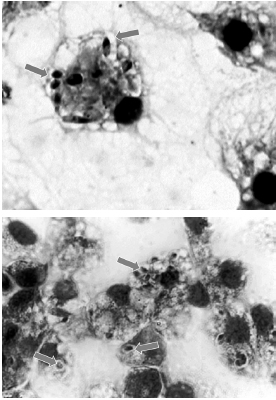
Microscopia electrónica de transmisión. Se observaron células de A. aegypti con una morfología totalmente conservada, identificándose orgánulos característicos tales como núcleo, mitocondrias y vacuolas. Además, con la presencia de un parásito intra-vacuolar con saco flagelar bien definido se confirmó la internalización y transformación de éste (figura 3A). En el estudio ultraestructural realizado a las células control positivo J774 se evidenció la presencia de formas amastigotas estrechamente unidas a la vacuola, en las cuales se observaron las estructuras organelares típicas del parásito como núcleo, saco flagelar y cinetoplasto (figura 3B).
Morfométria celular. La figura 4 ilustra la distribución de los valores de las áreas separadas en rangos en los diferentes días posinfección, donde las células infectadas predominaron en rangos mayores a 2000 μm2, comparadas con las células no infectadas que se distribuyeron en su mayoría entre los rangos 12 a 1332 μm2.
Figura 3. Microfotografías de células a los 6 días posinfección. (A): de J774 con un amastigote (flecha) al interior de una gran vacuola parasitófora, se observan también numerosas vacuolas distribuidas en el citoplasma. 12600X. Barra= 1,5 μm. (B): de Aedes aegypti con un amastigote (flecha) dentro de una estrecha vacuola parasitófora (flecha). 24000X. Barra= 1,0 μm.
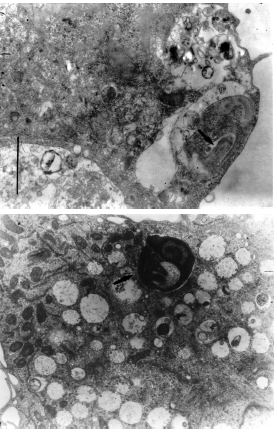
Figura 4. Distribución celular de las células no infectadas de A. aegypti y las infectadas con L. chagasi y L. braziliensis de acuerdo con el área (μm2) y a los días posinfección indicados. Se presentaron diferencias significativas entre el área de las células no infectadas y las infectadas con la prueba de Kruskal Wallis y U de Mann Whitney (p< 0,005).
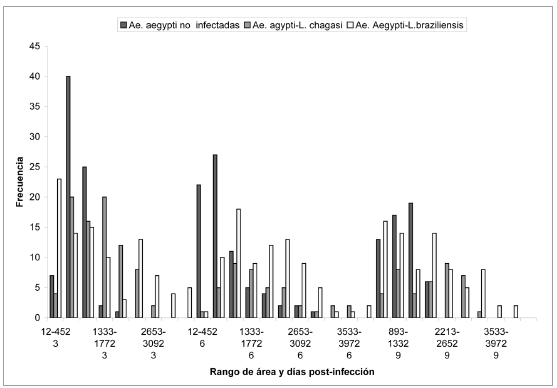
En el análisis morfométrico las diferencias entre los grupos arrojaron un valor P<0,05, lo cual indicó diferencias estadísticas significativas entre el área de las células no infectadas de A. aegypti y las células de A. aegypti infectadas, tanto con L. chagasi como con L. braziliensis.
DISCUSIÓN
Es importante aclarar que A. aegypti no es vector de Leishmania, pero está reportado como vector de otras infecciones tales como: dengue, fiebre amarilla y filariasis humana (20), y también es considerado como uno de los modelos biológicos más importantes en términos de enfermedades transmitidas por insectos al hombre (21). No obstante, en el proceso de infección in vitro se demostró la interacción, internalización y maduración de L. chagasi y L. braziliensis en las células derivadas de tejido embrionario de A. aegypti, hecho que indica la existencia de algún tipo de afinidad del parásito por las células, y que además se confirmó con la presencia de vacuolas y amastigotes en su interior. Estos resultados concuerdan con los reportados por Dedet y Odette en 1977 (22), en uno de los primeros ensayos de infección de L. donovani en una línea celular derivada de tejidos de un mosquito (A. albopictus ), quienes reportaron presencia de amastigotes intracelulares.
Aunque no existen estudios que determinen puntualmente la interacción entre el parásito y las células de sus vectores, los cultivos celulares de A. aegypti, a pesar de no ser un vector de protozoos del género Leishmania, se infectaron con las dos especies de parásitos, posiblemente debido a un sistema ligando-receptor conservado entre insectos. Fampa et al. (23), quienes realizaron un estudio de infección con diferentes géneros de parásitos utilizando líneas celulares de insectos, señalaron la importancia del reclutamiento de receptores de las células para el proceso de fagocitosis en el cual hay una estrecha asociación de la membrana con la superficie de la partícula para la formación del fagosoma. En cuanto a la superficie de los promastigotes, Sacks y Kamhawi (24) identificaron carbohidratos responsables de la adhesión de Leishmania al intestino de los flebótomos, los cuales son de gran importancia para el establecimiento y mantenimiento de los parásitos. Esta posible adhesión, generalmente en la interacción hospedero-patógeno, es determinada por el polimorfismo especie- específico del LPG del parásito (25).
Por otro lado, el porcentaje de infección para los diferentes días en las células de A. aegypti, infectadas con L. chagasi, tuvo valores más bajos que para la infección con L. braziliensis. Sin embargo, la distribución de este porcentaje en los diferentes días posinfección fue similar al reportado para L. braziliensis, presentando el pico más alto de infección el día seis. En cuanto al porcentaje descrito para el control positivo, se encontró que para las células J774 infectadas con L. braziliensis hubo incrementos significativos del día 3 al día 6, hasta llegar al máximo valor en el día 9 posinfección, contrario a lo observado para las células J774, infectadas con L. chagasi, en las cuales se presentó el mayor porcentaje el día 6 posinfección. Probablemente, el éxito de la infección en las células de A. aegypti se deba en parte a que la temperatura de 26 °C es óptima para el mantenimiento de estos cultivos y, simultáneamente, también para los promastigotes de Leishmania. La susceptibilidad de las especies de Leishmania al estrés por temperatura se ve reflejada en su habilidad para establecer la infección de las diferentes partes del cuerpo del mamífero. Además, es un factor muy importante para el establecimiento de la infección en el flebótomo vector (22-28 °C) y en el hospedero mamífero (31-37 °C) (6).
Así los macrófagos sean considerados las células hospederas más importantes para los parásitos de Leishmania, hay otros tipos celulares en los que también se ha demostrado la endocitosis de Leishmania in vitro e in vivo. Éstos incluyen neutrófilos, eosinófilos, células fibroblásticas y epitelioides (10,13), y recientemente células dendríticas (12,14).
Con el análisis ultraestructural de las células de A. aegypti infectadas con L. chagasi se confirmó la internalización y transformación del parásito, demostrando la capacidad de las células de este mosquito para mantener y replicar los parásitos como sucede en las células de hospederos vertebrados. Del mismo modo ocurrió en el trabajo de Lang et al. (26), quienes utilizaron macrófagos Balb/c infectados con L. donovani y observaron diferentes tipos de vacuolas parasitóforas en estrecha relación con los amastigotes y una clara diferenciación de los organelos tanto del parásito como del macrófago.
Con el estudio morfométrico se demostró que la replicación de los parásitos provocó profundos cambios en la morfología celular de A. aegypti, determinados por el área celular expresada en micras cuadradas. Debido al proceso de infección las células experimentaron un aumento en el área hasta alcanzar tamaños mayores a 2000 μm2; rango en el cual se presentaron la mayor cantidad de células infectadas con las dos especies de parásitos. Algo similar ocurrió en una investigación realizada por Nogueira (19), en la cual estudió las alteraciones morfométricas de células de McCoy infectadas y no infectadas con el virus de la rabia, para identificar la relación entre el incremento del tamaño celular y la capacidad de replicación viral. Además, se compararon las medidas obtenidas para las células sin infección de A. aegypti del presente trabajo con las reportadas por Grace (27), cuando estableció un cultivo celular para el mismo mosquito, coincidiendo ambos en el tamaño de las células, ubicándose en el rango de 400 a 800 μm2, lo cual indica que, definitivamente, la interacción de los parásitos con las células de A. aegypti provocó cambios morfológicos significativos.
En el presente trabajo se evidenció la interacción de L. chagasi y L. braziliensis con células de A. aegypti, mosquito no vector natural de estos parásitos, al igual que se obtuvo transformación y replicación intracelular, lo cual permite proponer a estas células como un modelo in vitro alternativo para el estudio de eventos que ocurren en las interacciones de parásitos del género Leishmania y las células de los insectos.
AGRADECIMIENTOS
A las doctoras María Leonor Caldas y Ladys Sarmiento del laboratorio de análisis y procesamiento de imágenes del Instituto Nacional de Salud, por el apoyo en el procesamiento de las muestras con la técnica de microscopia electrónica de transmisión.
A la doctora Martha Ayala del laboratorio de parasitología del Instituto Nacional de Salud, por la colaboración y el apoyo con la cepa de Leishmania chagasi.
REFERENCIAS
1. Alexander J, Russell DG. The interaction of Leishmania species with macrophages. Adv Parasitol 1992;31:175-254. [ Links ]
2. Tanner CE. Immunobiology of visceral leishmanisis. Clin Immunol Immunopathol 1996;78:105-11. [ Links ]
3. Alexander J, Satoskar AR, Russell DG. Leishmania species: models of intracellular parasitism. J Cell Sci 1999;112:2993-3002. [ Links ]
4. Ministerio de Salud de Colombia. Grupo de vigilancia en salud pública. Leishmania. Semana epidemiológica N° 45; 2001. [ Links ]
5. Janovy J. Jr, Poorman AE. Temperature and metabolism in Leishmania. I. respiration in L. donovani, L. mexicana and L. tarentolae. Exp Parasitol 1969;25:276-282. [ Links ]
6. Zilberstein D, Shapira M. The role of pH and temperature in the developmental of Leishmania parasites. Annu Rev Microbiol 1994;48:449-470. [ Links ]
7. Nacy C, Diggs C. Intaracellular replication of Leishmania tropica mouse peritoneal macrophages: comparison of amastigote replication in adherente and nonadherent macrophages. Infect Immun 1981;34:310-313. [ Links ]
8. Madeira MF, Barbosa-Santos E, Marzochi. Experimental infection of canine peritoneal macrophages with visceral and dermotropic Leishmania strains. Mem Inst Oswaldo Cruz 1999;94:645-648. [ Links ]
9. Dedet P, Ryter A, Vogt E, Solí P, DaSilva LP. Uptake and killing of Leishmania mexicana amazonensis amastigotes by human skin fibroblasts. Ann Trop Med Parasitol 1983;77:35-44. [ Links ]
10. Bogdan C, Donhauser N, Döring R, Röllinghoff M, Diefenbach A, Rittig MG. Fibroblasts as host cells in latent leishmaniosis. J Exp Parasitol 2000;191:2121-2129. [ Links ]
11. Scott P, Hunter CA. Dendritic cells and immunity to leishmaniasis and toxoplasmosis. Curr Opin Immunol 2002;14:466-470. [ Links ]
12. Ghosh M, Bandyopadhyay S. Interaction of Leishmania parasites with dendritic cells and its functional consequences. Immunobiology 2004;209:173-177. [ Links ]
13. Engwerda CR, Ato M, Kte PM. Macrophages pathology and parasite perssistence in experimental visceral leishmaniasis. Trends Parasitol 2004;20:524-530. [ Links ]
14. Zuluaga M, Robledo SM. Las células de Langerhans en la inmunidad a leishmaniasis. Biomédica 2004;24:302-317. [ Links ]
15. Ardila A, Escovar J, Bello F. Características de nuevos cultivos celulares derivados de tejidos embrionarios de Aedes aegypti (Diptera: Culicidae). Biomédica 2005;25: 65-75. [ Links ]
16. Ralph P, Prichard J, Cohn M. Reticulum cell sarcoma: an effector cell in antibody-dependent cellmediated immunity. J Immunol 1975;114: 898-905. [ Links ]
17. Grace TDC. Establishment of four strain of cell from insect tissue grow in vitro. Nature 1962;195:788:789. [ Links ]
18. Leibovits A. The growth and maintance of tissue-cell cultures in free gas exchange with the atmosphere. Am J Hyg 1963;78:173-80. [ Links ]
19. Nogueira YL. Morphometric analysis of McCoy cells inoculated with cerebrospinal fluid from patients with rabies. Mem Inst Oswaldo Cruz 1998;93:509-514. [ Links ]
20. Tabachnick WJ. The yellow fever mosquito. Evolutionary genetics and arthropod- born disease. Am Entomol 1991;37:14-29. [ Links ]
21. Blair CD, Adelman ZN, Olson KE. Molecular strategies for interrupting arthropod-borne virus transmission by mosquitoes. Clin Microbiol Rev 2000;13:651-61. [ Links ]
22. Dedet JP, Odette GG. Leishmania donovani multiplication in a cell line of Aedes albopictus. Trans R Soc Trop Med Hyg 1977;70:535-536. [ Links ]
23. Fampa P, Correa Da-Silva MS, Lima DC, Oliveira SM, Motta MC, Saraiva EM. Interaction of insect trypanosomatids with mosquitoes, sand fly and the respective insect cell lines. Int J Parasitol 2003;33:1019-26. [ Links ]
24. Sacks D, Sher A. Evasion of innate immunity y parasitic protozoa. Nat Immunol 2001;3:1041-6. [ Links ]
25. Locksley RM, Louis JA. Immunology of leishmaniosis. Curr Opin Immunol 1992;4:413-18. [ Links ]
26. Lang T, Hellio R, Kaye P, Antoine JC. Leishmania donovani-infected macrophages: characterization of the parasitophorous vacuole and potencial role of this organelle in antigen presentation. J Cell Sci 1994;107:2137-2150. [ Links ]
27. Grace TDC. Establishment of a line of mosquito (Aedes aegypti L.). Cell grown in vitro. Nature 1966;211:366-367. [ Links ]














