Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Ciencias de la Salud
Print version ISSN 1692-7273On-line version ISSN 2145-4507
Rev. Cienc. Salud vol.3 no.2 Bogotá July/Dec. 2005
Establecimiento, mantenimiento y productividad de una colonia de laboratorio de Lutzomyia spinicrassa Morales, Osorno-Mesa, Osorno y Hoyos, 1969 (Diptera: Psychodidae) en Colombia§
Establishment, maintenance and productivity of a colony of laboratory from Lutzomyia spinicrassa Morales, Osorno-Mesa, Osorno & Hoyos, 1969 (Diptera: Psychodidae) in Colombia
Alberto Morales*, Felio Bello, Estrella Cárdenas
* Laboratorio de Entomología, Instituto Nacional de Salud
† Instituto de Ciencias Básicas, Facultad de Medicina, Universidad del Rosario. Correo electrónico: fbello@urosario.edu.co
† Laboratorios de Entomología, Biología Celular y Genética, Universidad de La Salle.
§ El presente trabajo fue financiado por el Instituto Nacional de Salud de Colombia y el National Institute of Health, United States Public Health Service, donaciones AI 20108 y AI 121049.
Recibido: agosto de 2005 Aceptado: agosto de 2005
Resumen
El flebótomo Lutzomyia spinicrassa es vector de Leishmania braziliensis y tiene amplia distribución en plantaciones de café en Colombia y Venezuela.
Metodología: Se estableció una colonia en condiciones de laboratorio a partir de 600 hembras de L. spinicrassa capturadas en el campo y mantenidas a temperatura de 23º C y humedad relativa de 70%. El tiempo de desarrollo desde huevo hasta adulto osciló entre 58 y 78 días, en promedio 11 semanas. Se compararon parámetros poblacionales de la especie obtenidos a partir de cinco generaciones sucesivas mantenidas en grupos, con una generación criada individualmente.
Resultados: Se obtuvieron los siguientes parámetros en cada condición experimental: tasa neta de reproducción (6,92 y 7 hembras por hembra por generación), tasa intrínseca de incremento poblacional (0,17 y 0,18 hembras por hembra por semana) y tasa finita de incremento poblacional (1,06 y 1,19 individuos por hembra por semana).
Conclusión: Estos datos sugieren que la colonia de L. spinicrassa tuvo un incremento constante durante las seis generaciones analizadas.
Palabras clave: etapas del ciclo de vida, colonización, Lutzomyia, estimativas de población.
Abstract
Lutzomyia spinicrassa is a vector of Leishmania braziliensis. This sand fly has a broad geographical distribution in Colombia and Venezuela and it's founded mainly in coffee plantations.
Methodology: Starting from 600 females of L. spinicrassa captured in field a laboratory colony was established. The development time from egg to adult ranged from 58 to 78 days, 11 weeks in average. Population parameters of five successive generations maintained in groups were compared with a generation reared individually.
Results: The following parameters were obtained in each experimental condition: net rate of reproduction (6.92 and 7 females per female per generation), intrinsic rate of population increment (0.17 and 0.18 females per female per week) and finite rate of population increment (1.06 and 1.19 individuals per female per week).
Conclusion: These data suggest that the colony of L. spinicrassa had a constant increment during the six analyzed generations.
Key words: Life cycle stages, colonization, Lutzomyia, population estimates.
INTRODUCCIÓN
La especie Lutzomyia spinicrassa (1) se encuentra principalmente en plantaciones de café en Colombia y Venezuela (2). A esta especie se la conoce como antropofílica y también ha sido incriminada como vector de Leishmania braziliensis (3- 5). Maingon et al. (6) encontraron hembras de L. spinicrassa infectadas con L. braziliensis y L. mexicana.
El mantenimiento de flebótomos exige cuidado especial para lograr establecer una colonia en condiciones de laboratorio. El primer trabajo que se enfocó a colonizar y calcular las tasas reproductivas de L. longipalpis fue el de Killick- Kendrick et al. (7), que sirvió de base para la realización de trabajos posteriores en Colombia con otras especies de Lutzomyia (8-15).
El conocimiento de la biología reproductiva de artrópodos vectores es fundamental para entender la epidemiología de las enfermedades que transmiten. Escovar et al. (16) en un trabajo sobre biología reproductiva de L. spinicrassa, obtuvieron una tabla de vida horizontal, y calcularon algunos parámetros poblacionales con base en una generación de laboratorio.
El presente artículo informa los resultados de un proceso de colonización de la especie y, además, estima los parámetros poblacionales con base en varias generaciones de L. spinicrassa mantenidas en un insectario con temperatura y humedad controladas.
MATERIALES Y MÉTODOS
Recolección de adultos de L. spinicrassa en el campo. La captura de adultos se hizo en un cafetal a 1300 metros de altura sobre el nivel del mar, en la vereda Munantá, municipio de Guateque, departamento de Boyacá, Colombia. Se utilizaron trampas de luz CDC y cebo humano protegido (para evitar las picaduras). Los adultos de este flebótomo se colectaron desde las 18:30 horas hasta las 20:00 horas, los días 29 y 30 de octubre de 1990. Las hembras y los machos obtenidos se introdujeron en una jaula de muselina y la misma noche de la captura las hembras se alimentaron con sangre de un hámster, previamente anestesiado con pentotal sódico. Después de una hora el hámster se retiró de la jaula y a las hembras y los machos se les proporcionó solución de azúcar al 30%, absorbida en motas de algodón, y también agua sola embebida en otra mota de este mismo material, que se colocaron en el exterior, por encima de la jaula. Al día siguiente, un total de 600 hembras de L. spinicrassa que habían ingerido sangre del hámster se transfirieron a vasos plásticos (preparados como se indica adelante). En cada vaso de cría se colocaron 70 hembras con varios machos y se introdujeron dentro de cajas de polystyrene para su transporte al laboratorio de entomología del Instituto Nacional de Salud en Bogotá. Se siguieron las instrucciones de Modi y Tesh (17) para el mantenimiento y cuidado de ejemplares de Lutzomyia obtenidos en el campo, y que se siguen con otras especies de Lutzomyia establecidas en este laboratorio.
Preparación de los vasos de cría. Se utilizaron vasos plásticos de 4 onzas de capacidad preparados así: la parte central del fondo del vaso se perforó con un tubo de metal caliente de 2 cm de diámetro, luego este vaso se puso sobre su tapa respectiva y se llenó hasta una altura de 1 cm con yeso dental diluido en agua. Se dejó secar el yeso por tres días, como paso previo a su empleo. Unos 10 minutos antes de introducir los flebótomos dentro del vaso, para humedecer el yeso, se colocó su parte inferior en contacto con agua hasta que el yeso absorbió la humedad requerida. Luego cada vaso se tapó con un pedazo de muselina, sostenida en el borde del recipiente con una banda de caucho. A la tela se le hizo una abertura redonda de 0,5 cm de diámetro que se tapó con un corcho. Por la abertura de la tela de cada vaso, y con la ayuda de un capturador de boca, se introdujeron en el vaso las hembras alimentadas con sangre y varios machos y luego se tapó con el corcho. Sobre la tela que cubría cada vaso se colocaron dos porciones de algodón humedecidos el uno con una solución de azúcar al 30% y el otro con agua destilada, para que la pudieran tomar los flebótomos. Todos los días se retiraban las motas de algodón hasta la muerte de los adultos. Los vasos de cría se mantuvieron en una incubadora a temperatura de 23 ºC y con humedad relativa controlada de 70%.
Cuidado y mantenimiento de los huevos. Después de tres días de alimentar las hembras con sangre, empezaron a poner huevos sobre la capa de yeso y sobre las paredes del vaso de cría. Todos los días se retiraban de los vasos las hembras que iban muriendo para evitar la proliferación de hongos. Los huevos depositados sobre las paredes del vaso se transfirieron a la superficie del yeso con la ayuda de un pincel fino de pelo de camello a fin de que estuvieran en contacto con la humedad requerida para su desarrollo. Cuando todas las hembras murieron se cambió la tapa de tela de los vasos por la tapa plástica respectiva.
Mantenimiento de las formas inmaduras. Cuando las larvas del primer estadio comenzaron a emerger se les proporcionó una dieta especial, preparada como se indica a continuación: se mezclaron partes iguales de estiércol de bovino y alimento concentrado para perros (Cristina Ferro, comunicación personal), que se molieron y se les adicionó una pequeña cantidad de hígado en polvo (powder liver); a esta mezcla se le agregó un poco de agua y se dejó secar a temperatura ambiente por casi dos meses, revolviendo el contenido de vez en cuando. Sobre esta mezcla que se dejó madurar, al principio crecieron hongos que, por último, desaparecen al cumplir su ciclo. Cuando la mixtura estuvo bien seca, se molió en un molino casero y las partículas finas resultantes se usaron como alimento para las larvas.
Se revisaron a diario los vasos con larvas para proporcionarles humedad y/o alimento; a medida que las larvas pasaban al siguiente estadio hubo necesidad de suministrarles mayor cantidad de alimento.
Mantenimiento de adultos. Al tercer día después de emerger, los adultos (machos y hembras) se liberaron dentro de una jaula construida con muselina y armazón de alambre. Luego se introdujo dentro de la jaula un hámster anestesiado con pentotal sódico para que las hembras se alimentaran. Luego de una hora se retiró el hámster de la jaula y las hembras llenas de sangre se transfirieron a los vasos de cría como se indicó antes. Todos los días se revisaba la humedad del yeso para mantenerla en un nivel adecuado.
Condiciones experimentales para el mantenimiento de la colonia. La colonia se mantuvo en un insectario con temperatura de 23 °C y humedad relativa de 70%. Los vasos de cría con los adultos estaban dentro de cajas de polystyrene y las formas inmaduras, también confinadas en otros vasos, se mantuvieron en una incubadora con una temperatura constante de 23 °C.
Registro de datos para las diferentes generaciones. Se elaboraron tablas de datos para registrar el número de machos y hembras producidos en cada generación, número de hembras alimentadas con sangre, tiempo en días transcurrido entre la toma de sangre por las hembras y el sexo de la primera emergencia de los adultos.
Estimación del ciclo de vida. Para observar la producción de huevos y adultos, machos y hembras, por cada hembra de L. spinicrassa en forma individual, se separaron 200 hembras de la generación G8 inmediatamente después de alimentadas con sangre, y se introdujeron por separado en viales de plástico de 5½ centímetros de alto por 2½ centímetros de diámetro, que se habían preparado de igual manera que los vasos de cría.
Estimación de parámetros poblacionales. Los parámetros poblacionales observados se calcularon con las instrucciones de Southwood (18), Rabinovich (19) y Cárdenas et al. (13).
RESULTADOS
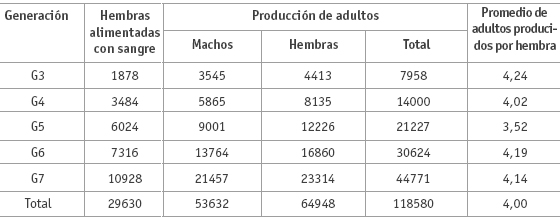
Colonización y productividad de L. spinicrassa en el laboratorio. La tabla 1 muestra la producción de adultos de la colonia desde la generación G3 hasta la generación G7; en todas las generaciones el número de hembras fue superior al de los machos, por lo menos en 11,32%. En cada una de las generaciones el número de hembras que se alimentaba sobre hámster fue inferior al de hembras producidas en la generación precedente, por ejemplo, en la generación G2 se obtuvieron 2617 hembras y sólo se alimentaron con sangre 1878 (G3) (tabla 1). Las hembras de Lutzomyia, al igual que las hembras de mosquitos hematófagos, que dejan de alimentarse con sangre no producen huevos, por tal razón estas hembras no se incluyen cuando se realizan estudios de reproducción. El promedio de adultos por cada hembra alimentada con sangre de hámster osciló entre 3,52 y 4,24 en las cinco generaciones en estudio (tabla 1). Este promedio bajo en la producción de adultos quizá se debió a las siguientes causas: mortalidad de hembras postalimentación con sangre; retención de huevos por las hembras; huevos no embrionados; y por la mortalidad en los distintos estadios de desarrollo (larvas y pupa); sin embargo, en este trabajo no se muestra un análisis de la mortalidad por estadios de desarrollo.
Se llevó un registro de 400 vasos de cría en las generaciones G3 a G7 para observar el sexo de los adultos que emergían primero de las pupas y se encontró que en 82,44% de los vasos la primera emergencia fue de machos, en 4,33% de los vasos la primera emergencia fue hembras y en 13,23% de los vasos la primera emergencia fue de machos y hembras.
Tabla 1. Producción de adultos de Lutzomyia spinicrassa en cinco generaciones mantenidas en condiciones de laboratorio.
Ciclo de vida. Se alimentaron 200 hembras sobre hámster y se separaron individualmente en viales de plástico. De las 200 hembras, 101 murieron antes de la oviposición y solamente 99 sobrevivieron hasta la postura. Las 99 hembras alimentadas pusieron 2775 huevos con un máximo de 72 por hembra; hubo un mínimo de 2 huevos por hembra y un promedio de 28 por hembra.
Del total de huevos depositados emergieron 1590 larvas de primer estadio, por tanto, ocurrió una pérdida aproximada de 43%. Esta pérdida, probablemente, ocurrió por muerte embrionaria o por huevos no fertilizados. Del total de larvas del primer estadio que emergieron, se obtuvieron 706 machos y 694 hembras para un total de 1400 adultos, es decir, que la mortalidad de estadios inmaduros fue de 12%. Este resultado sugiere que las condiciones en las que se mantuvieron los estadios inmaduros fueron adecuadas. En promedio se obtuvieron 14 adultos por hembra alimentada con sangre de hámster.
El ciclo de desarrollo desde la alimentación de las hembras hasta la emergencia del primer adulto fue de 58 días como mínimo y 78 como máximo. Se estimó en promedio una duración de 11 semanas desde el estadio de huevo hasta la emergencia de los adultos.
Parámetros poblacionales observados. Con los datos de la tabla 1 se estimaron los siguientes parámetros: tasa de reemplazo R'o = 34,6 hembras por hembra en las cinco generaciones (equivalente a 6,92 hembras por hembra por generación); tiempo generacional estimado desde G3 hasta G7, T'c = 55 semanas; tasa intrínseca de incremento poblacional r'c = 0,064 hembras por hembra por semana en las cinco generaciones (equivalente a 0,17 hembras por hembra por semana por generación), y tasa finita de incremento poblacional l' = 1,06 individuos por hembra por semana.
Con los datos obtenidos de las 99 hembras que se separaron en forma individual, se estimaron los parámetros siguientes: tasa de reemplazo R'o = 7 hembras por hembra por generación, tiempo generacional T'c = 11 semanas, tasa intrínseca de incremento poblacional r'c = 0,18 hembra por hembra por semana y tasa finita de incremento poblacional l' = 1,19 individuos por hembra por semana.
DISCUSIÓN
El establecimiento de colonias de flebotomíneos en el laboratorio ha contribuido significativamente al estudio de diversos aspectos como: biología reproductiva (20), conocimiento del desarrollo de las distintas especies de Leishmania dentro de los flebótomos vectores, esclarecimiento de la transmisión de algunos virus, comparación genética de poblaciones y análisis de aspectos relacionados con sistemática y taxonomía. Sin embargo, establecer y conservar colonias de estos insectos en el laboratorio requiere un gran esfuerzo para proporcionarles una alimentación adecuada tanto a los inmaduros como a los adultos, y para mantener una temperatura y una humedad relativa acordes con las observadas en el sitio de captura en el campo, que deben ser más o menos constantes para lograr con éxito una colonia en el laboratorio.
Si se equipara la producción de adultos por hembra de L. spinicrassa en las cinco generaciones con la obtenida de hembras individuales (14 vs. 4) se observa un promedio alto en estas últimas, pues es probable que en los viales aislados hubiese condiciones favorables, como menos hacinamiento y menos competencia por el alimento, lo cual generó una mayor producción de adultos.
Al comparar los parámetros estimados en los dos experimentos: tasa de reemplazo (R'o = 6,92 vs. R'o = 7 hembras por hembra por generación) analizada después de la mortalidad, en cada estadio fue similar en los dos experimentos; mientras que Escovar et al. (16) encontraron una tasa de reemplazo de 8,4 hembras por hembra por generación en ausencia de mortalidad; esto indica que las condiciones de temperatura y humedad controladas mejoran la tasa de reemplazo de flebótomos.
La tasa intrínseca de incremento natural (r'c = 0,17 vs. r'c = 0,18 hembras por hembra por semana) fue similar a la tasa intrínseca de incremento natural máxima determinada por Escovar et al. (16) (rm = 1,17); estos datos comprueban, según Rabinovich (19), que la tasa intrínseca de crecimiento natural se determina genéticamente en una particular especie. La tasa finita de incremento poblacional (l' = 1,06 vs. l' = 1,19 individuos por hembra por semana), sugiere que el aumento de la colonia fue más o menos constante durante las cinco generaciones analizadas en el laboratorio. La tasa finita de incremento poblacional (l') indica que la colonia de L. spinicrassa mantuvo su desarrollo en el laboratorio con una tasa estimada de un individuo por hembra por semana, semejante a lo observado por Escovar et al. (16) (l = 1,18) para esta especie y por Cárdenas et al. (13) (l = 1,06 y 1,10) para L. shanonni.
En cuanto al tiempo generacional estimado (T'c = 11 semanas), indica que cada 11 semanas se tiene una nueva generación de L. spinicrassa y está de acuerdo con el valor de T'c = 10,7 semanas, estimado por Cabrera y Ferro (15) para esta especie mantenida en incubadora en el laboratorio con temperatura y humedad controladas; mientras que cuando la misma especie se conservó en cajas de icopor en el laboratorio, sin temperatura ni humedad controladas (16), mostró un tiempo generacional de 12,74 semanas.
En conclusión, a pesar de que la tasa de reemplazo fue baja, la colonia de L. spinicrassa tuvo un incremento continuo hasta la generación G8 y se logró establecer exitosamente en el laboratorio con temperatura y humedad controladas.
AGRADECIMIENTOS
A los señores Enrique Martínez y Marco Fidel Suárez por su colaboración en el trabajo de campo y de laboratorio.
REFERENCIAS
1. Morales A, Osorno-Mesa EA, Osorno F, Muñoz de Hoyos P. Phlebotominae de Colombia (Diptera, Psychodidae). V. Descripción de una nueva especie de Lutzomyia. Rev Acad Colomb Cienc Exact Fís Nat 1969;13:383-390. [ Links ]
2. Alexander B, Agudelo LA, Navarro F et al. Phlebotomine sandflies and leishmaniasis risks in Colombian coffee plantations under two systems of cultivation. Med Vet Entomol 2001;15:364-373. [ Links ]
3. Young DG, Morales A, Kreutzer RD et al. Isolations of Leishmania braziliensis (Kinetoplastida: Trypanosomatidae). J Med Entomol 1987;24:587-589. [ Links ]
4. WHO. Control of the Leishmaniases, Report of the World Health Organization Expert Committee. WHO Technical Report Series 1990;158 pp. [ Links ]
5. Walters LL, Irons KP, Guzmán H, Tesh RB. Peritrophic envelopes of Lutzomyia spinicrassa (Diptera: Psychodidae). J Med Entomol 1995; 32: 711-25. [ Links ]
6. Maingon R, Feliciangeli D, Guzmán B et al. Cutaneous leishmaniasis in Tachira State, Venezuela. Ann Trop Med Parasitol 1994;88:29-36. [ Links ]
7. Killick-Kendrick R, Leany AJ, Ready PD. The establishment, maintenance and productivity of a laboratory colony of Lutzomyia longipalpis (Diptera: Psychodidae). J Med Entomol 1977;13:429-440. [ Links ]
8. Morales A, Ferro C, De Rodríguez C. Establecimiento de una colonia de Lutzomyia walkeri (Newstead, 1914) (Diptera: Phlebotominae). Biomédica 1984;4:37-41. [ Links ]
9. Alexander B, Ferro C, Young DG, Morales A, Tesh RB. Ecology of phlebotomine sand flies (Diptera: Psychodidae) in a focus of Leishmania (Viania) braziliensis in northeastern Colombia. Mem Inst Oswaldo Cruz 1992;87:387-395. [ Links ]
10. Neira M, Díaz-Martínez A, Bello F, Ferro C. Estudio en condiciones de laboratorio de los ciclos de vida de Lutzomyia torvida y Lutzomyia longiflocosa (Diptera: Psychodidae), posibles vectores de Leishmania braziliensis en la zona cafetera colombiana. Biomédica 1998;18:251-255. [ Links ]
11. Montoya J, Cadena H, Jaramillo C. Rearing and colonization of Lutzomyia evansi (Diptera: Psychodidae), a vector of visceral leishmaniasis in Colombia. Mem Inst Oswaldo Cruz 1998;93:263-268. [ Links ]
12. Ferro C, Cárdenas E, Corredor D, Morales A, Munstermann LE. Life cycle and fecundity analysis of Lutzomiya shannoni (Dyar) (Diptera: Psychodidae). Mem Inst Oswaldo Cruz 1998;93:195-199. [ Links ]
13. Cárdenas E, Ferro C, Corredor D, Martínez O, Munstermann LE. Reproductive biology of Lutzomyia shannoni (Dyar) (Diptera: Psychodidae) under experimental conditions. J Vect Ecology 1999;24:158-170. [ Links ]
14. Cabrera OL, Neira M, Bello F, Ferro C. Ciclo de vida y colonización de Lutzomyia ovallesi (Diptera: Psychodidae) vector de Leishmania sp en America Latina. Biomédica 1999;19:223-229. [ Links ]
15. Cabrera OL, Ferro C. Ciclo de vida de Lutzomyia spinicrassa, L. quasitownsendi y L. youngi, especies del grupo verrucarum (Diptera: Psychodidae). Actualidades Biológicas 2000;22:225-232. [ Links ]
16. Escovar JE, Bello FJ, Morales A, Moncada L, Cárdenas E. Life tables and reproductive parameters of Lutzomyia spinicrassa (Diptera: Psychodidae) under laboratory conditions. Mem Inst Oswaldo Cruz 2004;99:603-607. [ Links ]
17. Modi GB, Tesh RB. A simple technique for mass rearing Lutzomyia longipalpis and Phlebotomus papatasi (Diptera: Psychodidae) in the laboratory. J Med Entomol 1983; 20:568-569. [ Links ]
18. Southwood TRE. Ecological methods, with particular reference to the study of insect populations. 2nd ed. London and New York: Chapman and Hall; 1978. [ Links ]
19. Rabinovich JE. Introducción a la ecología de poblaciones animales. México: Compañía Editorial Continental S.A.; 1980. [ Links ]
20. Ward RD. Some aspects of the biology of phlebotomine sandfly vectors. Advan Vector Res 1989;61:91-126. [ Links ]














