Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Ciencias de la Salud
Print version ISSN 1692-7273On-line version ISSN 2145-4507
Rev. Cienc. Salud vol.3 no.2 Bogotá July/Dec. 2005
Análisis de muestras de orina para la detección molecular de enfermedades infecciosas. Aplicación en la identificación de citomegalovirus humano
Analysis of Urine Samples for the Molecular Detection of Infectious Diseases. Application to the Identification of Human Cytomegalovirus
Dora Fonseca*, Andrés Gutiérrez, Heidi Mateus, Claudia Silva§, Nora Contreras**, Alejandro Giraldo
* Biol., MSc, Profesor Principal, Unidad de Genética, Instituto de Ciencias Básicas, Universidad del Rosario. Correo electrónico: dfonseca@urosario.edu.co
† Biol., MSc(c), Fundación Arthur Stanley Gillow.
† MD, MSc, Profesor Auxiliar, Unidad de Genética, Instituto de Ciencias Básicas, Universidad del Rosario.
§ Biol., MSc(c), Profesor Asistente, Unidad de Genética, Instituto de Ciencias Básicas, Universidad del Rosario.
** Biol., MSc, Profesor Asistente, Unidad Genética. Instituto de Ciencias Básicas, Universidad del Rosario.
†† MD, MPh, Departamento de Medicina Interna, Facultad de Medicina e Instituto de Genética, Universidad Nacional de Colombia.
Recibido: agosto de 2005 Aceptado: agosto de 2005
Resumen
La implementación de metodologías de biología molecular como la reacción en cadena de la polimerasa (PCR), ha permitido la realización de diagnósticos sensibles y específicos para múltiples enfermedades, dentro de las cuales son de gran interés las infecciosas. Hasta hoy, los métodos de identificación se basan principalmente en cultivos y serología por su sensibilidad y especificidad, pero consumen tiempo y dinero. Las muestras de orina se han constituido en una alternativa no invasiva de obtención de ADN para la realización de análisis de biología molecular.
Metodología: Implementación de una estrategia para la obtención de ADN a partir de muestras de orina. Las muestras fueron tomadas de niños de guardería, para documentar la presencia o no de inhibidores de PCR a través de la amplificación de genes de Citomegalovirus humano (CMVH).
Resultados: En el 27,1% de las muestras analizadas se evidenció amplificación específica para CMVH, no se encontraron diferencias significativas en la presencia del virus en los tres estratos, pero sí en la intensidad de las bandas.
Conclusión: Se verificó la ausencia de inhibidores de PCR mediante la amplificación del gen de la B-globina. Se estandarizó una metodología molecular para la identificación de CMVH, la cual puede ser aplicada en diagnóstico prenatal de infección congénita.
Palabras clave: citomegalovirus, ADN, infección, diagnóstico, orina.
Abstract
Molecular biology methods like Polimerase Chain Reaction (PCR) has been used for diagnosis of infectious diseases. Until today, the identification methods are based mainly on cultures and serology due to their sensibility and specificity, but they are expensive and time consuming. Urine samples constitute an alternative, noninvasive, method of obtaining DNA for the accomplishment of molecular Biology analysis.
Methodology: implementation of a strategy to obtain DNA from urine samples. Samples were taken from children in daycare centers, to document the presence of inhibitors, PCR amplification of genes of human Cytomegalovirus (HCMV) was done.
Results: In 27.1% of the analyzed samples, specific amplification for HCMV was demonstrated. No viral significant differences were found in the three layers, although it was present in the bands.
Conclusion: The inhibitor absence was verified using PCR by amplificating the gene of the B-globine. A molecular methodology for the HCMV identification was standardized, which can be applied in prenatal diagnosis of congenital infection.
Key words: Cytomegalovirus infection, diagnosis, urine, inhibitors, extraction, DNA, Ethylene glycol.
INTRODUCCIÓN
Las técnicas de biología molecular, ampliamente desarrolladas desde la descripción de la estructura del ADN por Watson y Crick en 1953, y la técnica de reacción en cadena de la polimerasa (PCR) por Karry Mullis en 1986, han permitido la aplicación en investigación básica y diagnóstico clínico, por su mayor sensibilidad y especificidad. Este conocimiento molecular no sólo se ha dirigido al análisis de enfermedades monogénicas, sino ha incursionado en el campo de las enfermedades infecciosas permitiendo realizar diagnósticos rápidos que facilitan la toma de decisiones terapéuticas que disminuyen la morbi-mortalidad asociada a este tipo de entidades (1-4).
Un germen puede generar una enfermedad infecciosa que puede llegar a ser fatal. El huésped atacado puede defenderse de él en forma total o parcial, según el balance que se establezca entre la patogenicidad del germen y la eficacia de la respuesta inmunitaria del huésped. Algunas bacterias, virus, hongos y parásitos poseen una patogenicidad intrínseca, de tal magnitud, que les permite inducir la enfermedad prácticamente a cualquier individuo (5).
El diagnóstico de las enfermedades infecciosas se ha abordado teniendo en cuenta cuatro posibilidades: 1) la detección directa del patógeno (microscopio y/o cultivo); 2) la detección de las proteínas de los patógenos con la ayuda de anticuerpos específicos (Elisa); 3) La detección específica de anticuerpos IgA, IgM, IgG dirigidos contra un patógeno determinado; 4) La detección de ácidos nucleicos de los patógenos a través de reacción en cadena de la polimerasa (PCR) (6).
Debido a su gran sensibilidad, la técnica de PCR se ha convertido en una herramienta potencial para la identificación de infecciones por diferentes patógenos, con miras a ofrecer un tratamiento rápido y efectivo en los pacientes afectados. Se ha documentado la aplicación de técnicas de biología molecular en el análisis de diferentes muestras como líquido amniótico, sangre, humor vítreo, orina, en búsqueda de infecciones como toxoplasmosis congénita, infección con mycobacterium, Chlamydia trachomatis, entre otras, que ofrecen ventajas tales como rapidez, sensibilidad y especificidad frente a los métodos convencionales de cultivo y serología (4, 6-9).
La orina se ha constituido en una importante fuente de obtención de ADN para la identificación de varias enfermedades infecciosas, y ha sido ampliamente utilizada en el diagnóstico de Chlamydia trachomatis, en hombres y mujeres, proporcionando una alternativa de toma de muestra por métodos no invasivos (8). La sensibilidad y especificidad de las técnicas de PCR han sido evaluadas en tamizajes para infecciones genitales de Chlamydia, y al compararse con métodos inmunoenzimáticos convencionales han indicado una alta y específica detección del patógeno en la orina, por lo que ésta se convierte en una herramienta confiable para este tipo de diagnósticos (8, 10, 11).
Otras enfermedades infecciosas, como la producida por el Citomegalovirus humano, son de gran importancia clínica y han usado como fuente de extracción de ADN muestras de orina. El Citomegalovirus humano (CMVH) es el virus más grande de la familia Herpesviridae (1).
Epidemiológicamente el virus existe en todo el mundo y al parecer el único reservorio es el hombre (12), tiene como característica que se excreta durante meses o aún años antes de volverse latente, sobre todo en las infecciones congénitas, perinatales y posnatales tempranas. Frecuentemente se sufren reactivaciones con reaparición de la excreción del virus aunque también se pueden producir reinfecciones con cepas antigénicamente diferentes (13).
La transmisión puede ser vertical u horizontal; en el primer caso hay tres rutas posibles: prenatal (0,2%-2,2%), perinatal durante el parto (virus en el tracto genital), y por alimentación al seno (leche materna frecuentemente infectada con el virus) (1). En el caso de la transmisión horizontal, ésta se puede adquirir de persona a persona (requiere un contacto muy cercano) o por transfusiones de sangre u órganos transplantados (2, 14, 15).
El cuadro más frecuente de la infección con CMVH consiste en la presencia de petequias, hepatoesplenomegalia e ictericia, y microcefalia, prematurez, hernia inguinal y coriorretinitis; se ha reportado algún tipo de autismo (16). Los pacientes susceptibles de sufrir enfermedad sintomática son los fetos en desarrollo, los inmunosuprimidos, y los receptores de órganos transplantados (17-20).
Existen diferentes métodos diagnósticos de la infección activa por CMVH, pero las técnicas de la biología molecular han representado una estrategia diagnóstica rápida y sensible que gracias a la amplificación de segmentos específicos del ADN viral, permiten su detección en diferentes tipos de muestras como orina, líquido cefalorraquídeo, líquido amniótico, leche materna y otros. El proceso de amplificación se realiza de un gen que por su función está altamente conservado en el genoma viral, garantizando de esta forma que no se presenten resultados falsos negativos, o cruzados con especies afines. La aplicación de esta detección mediante métodos moleculares ha permitido realizar diagnóstico prenatal en gestantes con evidencia inmunológica de infección activa, proceso que permite instaurar terapia que evite o atenúe la infección congénita; así mismo, esta metodología ha permitido el monitoreo del efecto de medicamentos en la disminución de la secreción viral en pacientes con infección adquirida por inmunosupresión o transplante (18, 21-24).
A pesar de las importantes ventajas del uso de orina como fuente de ADN para realizar estudios moleculares de enfermedades infecciosas, también se ha documentado la presencia de múltiples inhibidores que pueden llevar a resultados falsos negativos, por lo que es necesario estandarizar metodologías que permitan la remoción de estas sustancias que afectan los procesos de amplificación, dentro de las cuales se destacan los cristales, la hemoglobina y la presencia de hormonas como la beta gonadotrofina coriónica, entre otros (25, 26).
El presente trabajo tuvo como objetivo la implementación de diferentes metodologías de extracción de ADN a partir de muestras de orina obtenidas de niños de guardería de tres estratos socioeconómicos, para evaluar la presencia de inhibidores mediante su amplificación con genes específicos que identifican la presencia de Citomegalovirus humano.
MATERIALES Y MÉTODOS
Universo de estudio
Previa explicación verbal del objeto del presente estudio a los padres y el diligenciamiento del consentimiento informado, se recolectaron muestras de orina de 96 niños con edades comprendidas entre 1 y 3 años procedentes de guarderías infantiles de tres estratos socioeconómicos (alto, medio y bajo) de la ciudad de Bogotá. Del estrato bajo se contó con la colaboración de dos guarderías de barrios de la Localidad 19 (Ciudad Bolívar). Del estrato medio colaboraron dos guarderías de barrios de la Localidad 2 (Chapinero). Y del estrato alto se tuvieron dos guarderías de dos barrios de la Localidad 1 (Usaquén). Se recolectaron 10 ml de orina en recipientes plásticos usados comercialmente para tal fin; la muestra fue mantenida en condiciones de refrigeración mediante uso de cubetas refrigerantes en cajas de poliestireno hasta su traslado al laboratorio de la Fundación Gillow. A todas las muestras se les realizó parcial de orina, para verificar presencia de hemoglobina, cristales u otros metabolitos que pudieran interferir con la técnica de PCR. Posteriormente fueron centrifugadas a 2500 rpm por 10 minutos. Del sobrenadante obtenido, se tomaron 1,5 ml que fueron congelados de 24 a 48 horas para el análisis posterior.
Extracción de ADN
Dado que la orina es un fluido caracterizado por poseer muchos inhibidores de la PCR, se evaluaron diferentes metodologías con el fin de eliminar de las muestras la hemoglobina, el exceso de úrea, cristales y demás partículas del sedimento. Dentro de las estrategias utilizadas se evaluaron los métodos de extracción directa mediante centrifugación (27), extracción directa mediante ebullición (28), extracción mediante técnica salting out (29), y extracción con tratamiento con polietilenglicol (30).
Reacción en cadena de la polimerasa
Para la detección de CMVH en las muestras analizadas se empleó un par de primers que amplifican selectivamente una porción del gen que codifica para la glicoproteína H. Para cada mezcla de reacción se utilizaron 200 ng de ADN en 10 ul, 5 ul de buffer 10X, 2 ul de cada uno de los primers (10 pm/ul), 4 ul de MgCl2 (50 mM), 4ul de dNTP (4 mM) y 1,5 U de Taq ADN polimerasa; los volúmenes finales de reacción se completaron a 50 ul con agua MQ. Para la detección del gen de la B-globina se emplearon primers específicos descritos en la literatura.
Las mezclas de reacción fueron llevadas a un termociclador Perkin Elmer 2400 y fueron sometidas a desnaturalización inicial por 5 minutos a 95 ºC, 35 ciclos de desnaturalización parcial a 94 ºC x 1 minuto, alineación a 60 ºC x 1 minuto, extensión a 72 ºC x 1 minuto y extensión final a 72 ºC por 10 minutos.
Los productos amplificados fueron analizados en el transiluminador mediante visualización directa de geles de poliacrilamida al 12% teñidos con bromuro de etidio. Se concluyó la presencia del virus en los productos amplificados que evidenciaron señal positiva de 225 pb; así mismo, las señales analizadas fueron clasificadas según su intensidad como débiles, nítidas e intensas, tomando como punto de referencia las amplificaciones de controles positivos correspondientes a neonatos con evidencia clínico- serológica de infección. Como control negativo de PCR se usó una mezcla de reacción que contenía agua en lugar de ADN.
Para realizar el análisis estadístico se utilizó el análisis de Ji-cuadrado (2 grados de libertad y a: 0,05) para ver si existían o no diferencias significativas de infección por CMVH en los tres estratos socioeconómicos analizados; así mismo, mediante el test de Fisher (a= 0,05 de una sola cola) se estableció la comparación de la intensidad de las bandas en las muestras positivas de los tres grupos analizados.
RESULTADOS
Evaluación de presencia de inhibidores de PCR en orina: la presencia de sustancias que interfieren con la reacción en cadena de la polimerasa fue evaluada mediante la amplificación del gen de la B-globina y del gen de la glicoproteína H del CMVH en 96 muestras de orina obtenidas de niños de guardería en Bogotá. Se consideró como ausencia de inhibidores el ADN extraído de orina que tuvo amplificación exitosa en el 100% de los casos para la B-globina. La metodología de congelación de la muestra por 48 horas, seguida de tratamiento con polietilenglicol al 20% y NaCl 2M, mostró los mejores resultados, por lo que fue considerada la óptima para este tipo de análisis.
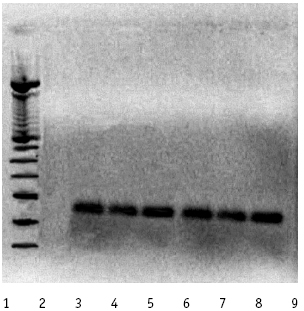
Aplicación en la determinación de CMVH en muestras de ADN obtenidas de orina: del total de los 96 niños estudiados se obtuvo banda positiva de amplificación de 225 pb, y correspondiente al gen de la glicoproteína H en 26 muestras, lo que corresponde a un índice de positividad de 27,1% (figura 1).
Figura 1. Productos amplificados del gen de la Glicoproteína H de CMVH en orina. (Gel de Poliacrilamida al 12%, teñido con Bromuro de Etidio). Carriles: 1. Patrón de peso molecular PBR322 HAE III. 2-7. Banda de 225 pb, amplificación positiva en muestras de orina. 8. Control negativo. 9. Control positivo.
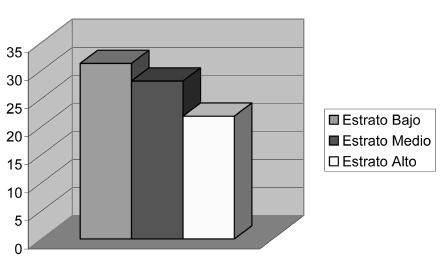
Presencia de CMVH según el estrato socioeconómico: las muestras positivas para la amplificación fueron clasificadas según el estrato socioeconómico de los niños de quienes fueron aisladas, encontrándose para el estrato bajo una positividad de 31,25%, para el medio 28,13% y para el alto 21,88% (tabla 1 y figura 2).
Tabla 1. Índice de positividad según estrato socioeconómico.
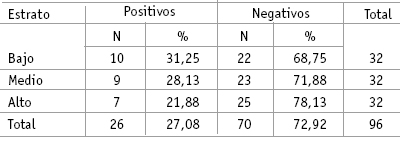
Figura 2. Porcentaje de muestras positivas según estrato socioeconómico.
Determinación de la intensidad de las bandas de amplificación
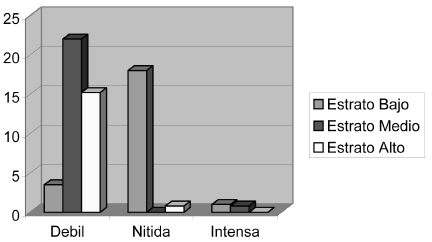
La señal que se obtuvo en los casos positivos se clasificó de acuerdo con su intensidad en tres categorías: débil, nítida e intensa, tomando como punto de referencia las amplificaciones de los controles positivos correspondientes a neonatos con evidencia clínico-serológica de infección. La mayor cantidad de casos positivos se observó en el estrato bajo, con un total de diez casos, en el estrato medio no se observaron señales nítidas y el estrato alto no presentó señales intensas (figura 3).
Figura 3. Porcentaje de positividad según intensidad de bandas y estrato socioeconómico.
Análisis estadístico: para establecer la frecuencia de infección por CMVH se realizó un análisis de Ji-cuadrado (Χ2) para diferencia de proporciones, partiendo de la hipótesis nula Ho:
P1 = P2 =P3 y H1 = P1 ≠ P2 ≠ P3 a= 0,05.
SEÑALES :
P1: proporción de positivos del estrato bajo, 10/32= 31,25%
P2: proporción de positivos del estrato medio, 9/32 = 28,125%
P3: proporción de positivos del estrato alto, 7/32 = 21,875%
El X2 con dos grados de libertad: 0,74, corresponde al valor de P= 0,691266
De acuerdo con lo anterior, no se puede rechazar la hipótesis de las proporciones, por lo que se debe aceptar que P1 y P2 son sustancialmente iguales.
Adicionalmente, se analizaron los estratos bajo y alto de acuerdo con la H0: P1 = P3 y H1: P1 ≠ P3.
El X2 con un grado de libertad = 0,72 corresponde al valor de P = 0,3958, por lo que tampoco se puede rechazar la H0; se concluye entonces que no hay diferencia significativa entre los dos estratos.
Análisis estadístico según intensidad de las bandas: si se asume que la intensidad de la señal puede ser un reflejo de la intensidad de la viruria, entonces se propone analizar la relación entre las dos categorías (nítida, intensa) en los diferentes estratos:
Estrato bajo: 9/32 = 28,12%
Estrato medio: 2/32 = 6,25%
Estrato alto: 2/32 = 6,25%
El análisis de bandas nítidas o intensas con respecto a las débiles en los tres grupos se realizó con el Test de Fisher, por la obtención de valores menores de 5, encontrándose un valor P con una sola cola = 0,048 < 0,05= Rechazo Ho si hay diferencia. a= 0,05. Ho= P1 = P2 = P3 H1 = P1 ≠ P3.
DISCUSIÓN
Los problemas de inhibición de PCR se han documentado principalmente en algunos especímenes clínicos como orina y muestras cervicales, esos inhibidores fueron evidentes cuando algunas muestras que resultaron positivas en cultivos (considerado el gold estándar) resultaron negativos en PCR (26). Estas observaciones hicieron necesaria la implementación de metodologías, principalmente en la extracción de ADN, que evitaran los resultados falsos negativos. Los porcentajes de inhibidores de PCR en orina se han cuantificado como de 1,8% (mujeres) a 2,6% (hombres y mujeres), esos porcentajes de inhibidores son mayores en especímenes cervicales, con valores de hasta 19% (26).
Varias estrategias se han seguido para la remoción o reducción de inhibidores, dentro de las que se encuentran la realización de diluciones de las muestras de orina, la ebullición, el congelamiento y el tratamiento con sales saturadas. En el presente estudio se implementaron varias metodologías en el proceso de extracción de ADN, como la ebullición directa, en la que el sometimiento a altas temperaturas sólo lograba una ruptura de membranas para la liberación directa del ADN, sin lograr la remoción de los inhibidores inherentes a las muestras, como cristales y hormonas, ni de las proteínas asociadas al ADN, esto debido a la ausencia de tratamiento con enzimas proteolíticas como la proteinasa K. Este hallazgo se correlaciona con estudios previos que han indicado que el tratamiento con calor (95 ºC) reduce inhibidores en tan sólo un 9,3% (31). Mohoney et al., reportaron previamente una gran remoción de inhibidores del ADN obtenido de orina a través del almacenamiento de las muestras durante toda la noche a bajas temperaturas, y una dilución posterior a 1:10. Teniendo en cuenta esta observación, en el presente trabajo se realizó congelamiento de las muestras por 24 horas, y dilución posterior, sin obtener amplificación en todos los casos para el gen B-globina, quizás no por la presencia de inhibidores sino por una inefectiva recuperación de todo el ADN en las muestras diluidas dada por la disminución de blancos de amplificación que potencialmente podrían ser reconocidos por los primers utilizados.
De los protocolos analizados se obtuvieron los mejores resultados cuando la orina fue sometida a congelación por 48 horas, seguida por tratamiento con polietilenglicol al 20% y NaCl 2M. El efecto de la temperatura fue quizá directo hacia la ruptura de membranas de las bacterias y daño de los cristales presentes en la orina, dos inhibidores fuertemente asociados a este tipo de muestras. El efecto inhibitorio de los cristales ha sido asociado a las sales que contienen cationes divalentes, particularmente iones magnesio, los cuales tienen un efecto significativo sobre la actividad de la Taq polimerasa.
Alternativamente, la congelación actúa sobre inhibidores lábiles de tipo proteico, induciendo cambios conformacionales y la subsecuente pérdida de la actividad inhibidora. El uso de polietilenglicol conduce a daño de las membranas celulares, facilitando la liberación del ADN. El cloruro de sodio concentrado es rutinariamente utilizado en la técnica de extracción de ADN conocida como salting out, y cumple su función adhiriéndose preferencialmente a las membranas degradadas por el efecto de la temperatura y el polietilenglicol, por lo que luego de centrifugaciones subsecuentes el ADN es fácilmente liberado.
La importancia de remoción de inhibidores de PCR en orina radica en la posibilidad del uso de este tipo de muestras no invasivas en el diagnóstico de enfermedades infecciosas, por ello, una vez se determinó el mejor método para tratar estas muestras, se realizó aplicación en la detección de CMV.
El CMVH es el mayor herpes virus humano y sólo existe un serotipo. La orina constituye una fuente importante de infección en niños y el patógeno puede diseminarse en las embarazadas a través de la sangre, para infectar la placenta y el feto. Muchas veces en la leche materna se encuentran pequeñas cantidades del virus, aunque tal hecho tiene significado dudoso respecto a la transmisión. La investigación sobre la transmisión y prevalencia de CMVH se hace importante debido a la alta prevalencia de infecciones por este virus en algunas poblaciones, y a que éstas, en un porcentaje superior al 99%, no son clínicamente aparentes. También porque se producen infecciones crónicas y latentes. Es claro que este patógeno es una causa significativa de morbilidad y mortalidad en el feto, en el recién nacido y actualmente en los pacientes inmunocomprometidos.
El diagnóstico de infección por CMVH en niños y adultos, inmunosuprimidos o no, requiere una confirmación de laboratorio y no puede hacerse sólo basándose en la clínica. Se requiere por lo tanto de un diagnóstico rápido y simple que permita una detección oportuna del virus. El CMVH no puede hacerse crecer fácilmente en ningún animal de experimentación, aunque se ha logrado cultivar con éxito en fibroblastos humanos. Sin embargo, el tiempo necesario para el desarrollo de su efecto citopático puede estar entre 1 y 4 semanas, constituyéndose este lapso en una gran desventaja.
Recientemente la técnica de PCR ha sido utilizada como un método más sensible y rápido para la detección de CMVH en orina y muestras de sangre. Esta técnica tiene la ventaja de poder detectar la presencia del virus a partir de una pequeña cantidad de muestra de orina que puede ser añadida directamente a la mezcla de PCR sin previa purificación del ADN viral (27, 32).
En los últimos años se ha venido registrando un incremento en la prevalencia de la infección por CMVH en los niños en edad preescolar debido especialmente a que muchos de éstos asisten a guarderías o jardines infantiles. La transmisión en estos centros puede deberse a la excreción de CMVH en orina (30).
En el presente estudio se analizaron un total de 96 muestras de orina de niños entre 1 y 3 años de edad. Teniendo en cuenta que éste es un grupo considerado como de alto riesgo de sufrir la infección por CMVH (33), y que el estrato socioeconómico es un factor determinante del riesgo de infección por CMVH (34), se escogieron al azar seis guarderías de tres estratos socioeconómicos diferentes en la ciudad de Bogotá.
De las 96 muestras analizadas por PCR 26 fueron positivas, lo que representa un 27,1%, encontrándose la mayor positividad para el estrato bajo con un 31,25%, y la más baja para el estrato alto con un 21,87%. Shen realizó un estudio en el cual analizó 103 niños y comparó la tasa de infección en centros de cuidado diario de estratos socioeconómicos alto y bajo, encontrando que en un 80% la positividad estaba referida al estrato socioeconómico bajo (34).
Es importante tener en cuenta que, en muchos casos, las condiciones de aseo y salubridad brindan un ambiente propicio para la diseminación del virus y de otras infecciones. En estos centros, los juguetes pueden pasar de un niño a otro sin un previo aseo o desinfección, además, los niños de estas edades se hallan en fase de desarrollo oral, lo que indudablemente aumenta el riesgo de infección (30, 33).
Adicionalmente se analizó la intensidad de la banda, ya que es posible que ésta refleje el nivel de viruria; es decir, a mayor intensidad de la banda, mayor cantidad de virus en la muestra.
El 50% de las muestras positivas constituyen bandas de intensidad débil, 30,7% de intensidad nítida y 19,2% de nivel intenso. Esto nos lleva a asumir que las muestras positivas tenían una baja cantidad de virus. El menor porcentaje, sin embargo, se presenta en el estrato medio donde no hubo aparición de ninguna banda nítida, mientras que con banda débil se obtuvo un 21,8% de positividad.
El estrato alto no presentó amplificación con banda intensa y el porcentaje de muestras con banda débil y nítida fue relativamente bajo lo cual, en comparación con el estrato bajo, hace presumir que aunque aquí se presenta la infección, la transmisión puede ser menor.
De acuerdo con el análisis estadístico realizado (Χ2), la comparación entre los tres estratos (p=0,69 con 2GL) no muestra una diferencia significativa entre éstos. Adicionalmente, se analizaron en forma conjunta los estratos alto y bajo, en donde tampoco se presentaron diferencias significativas (p=0,39 con 1GL). Contrario a lo reportado por Shen, en nuestro estudio no se obtuvo diferencia significativa entre los tres estratos. Esto se puede explicar debido a que en una guardería infantil de un determinado estrato socioeconómico se pueden encontrar niños con diferentes capacidades económicas, estados nutricionales y otros factores que promueven la infección (34).
Gracias a la alta sensibilidad de esta metodología (100%) para la identificación del CMVH (35), puede ser implementada como método de tamizaje en neonatos con el objetivo de identificar a aquellos pacientes que presentan infección congénita por CMVH para poder brindarles un manejo encaminado a la prevención y corrección inmediata de posibles secuelas de la enfermedad, como lo son el compromiso del sistema nervioso central y la sordera. Esta aproximación al estudio de biología molecular del CMVH nos permite delinear estrategias apropiadas para el análisis de este patógeno en otro tipo de muestras, con lo que podremos ofrecer una alternativa diagnóstica en los pacientes en quienes la infección viral es causa de mortalidad. Técnicas más actuales como la PCR en tiempo real deben ser implementadas para lograr la sensibilidad y especificidad requerida para este tipo de análisis.
CONCLUSIONES
Los resultados obtenidos en el presente estudio utilizando el método cualitativo de reacción en cadena de la polimerasa (PCR) demostraron que la infección por Citomegalovirus humano puede ser detectada en personas asintomáticas que porten grandes cantidades de carga viral.
Quedó demostrado que el fluido urinario con previo tratamiento en congelamiento por 48 horas, el y uso de polietilglicol al 20% y NaCL 2M es una muestra apta para la detección de patógenos como el CMVH.
El análisis realizado determinó que la frecuencia de CMVH es común entre niños de guardería, pero no se encontró una diferencia significativa en la prevalencia del agente infeccioso en los estratos bajo, medio y alto.
Existe una marcada diferencia en la intensidad de las bandas entre los estratos bajo y alto, la cual puede estar relacionada con la cantidad de virus presente en la muestra.
Se evidenció que la PCR puede servir como prueba diagnóstica cualitativa en personas que presenten infección activa por CMVH, aunque se reitera que es necesario implementar metodologías como PCR tiempo real que permitan dar mejores conclusiones respecto a concentración viral en muestras de orina.
AGRADECIMIENTOS
Los autores expresan su agradecimiento a la Fundación Arthur Stanley Gillow, quien financió en su totalidad este trabajo de investigación, y a las directivas, alumnos y padres de familia asociados con las guarderías que permitieron la toma de muestras de orina.
Conflicto de intereses: los autores declaran que no tienen intereses de ningún tipo con las empresas comerciales que puedan beneficiarse de la presente investigación. Esta investigación fue financiada con fondos de la Fundación Arthur Stanley Gillow, organismo privado sin ánimo de lucro, que posee y genera sus propios fondos, de acuerdo con las normas legales vigentes.
REFERENCIAS
1. Yasuda A, Kimura H, Hayakawa M, Oshiro M, Kato Y, Matsuura et al. Evaluation of Cytomegalovirus infections transmited via breast milk in preterm infants with a Real-Time Polymerase chain reaction assay. Pediatrics 2003;111(6):1333-1335. [ Links ]
2. Demmler GJ, Buffone GJ, Schimbor CM, May RA. Detection of Cytomegalovirus in urine from newborns by using polimerase chain reaction ADN amplification. J Infect Dis 1998;158(6):1177-1184. [ Links ]
3. Schlesinger Y, Halle D, Eidelman A et al. Urine polymerasa Chain Reaction as a screening tool for the detection of congenital cytomegalovirus infection. Arch Dis Child Fetal Neon Ed. 2003; 88:F371-374. [ Links ]
4. Mahony J, Luinstra K, Sellors J, Jang D, Chernesky M. Confirmatory Polymerase Chain Reaction Testing for Chlamydia trachomatis in first void urine from asymptomatic and symptomatic men. J Clin Microbiol 1992;30(9):2241-2245. [ Links ]
5. Rojas W. Mecanismos de defensa contra infecciones microbianas. 5 ed. Corporación para Investigaciones Biológicas; 1996. [ Links ]
6. Reischi U. Application of molecular Biology-based methods to the diagnosis of infectious diseases. Frontiers of Bioscience 1996; e72-77. [ Links ]
7. Chernesky M, Jang D, Chong S, Sellors J, Mahony J. Impact of urine collection order on the ability of assays to identify chlamydia trachomatis in men. Sexually Transmitted diseases 2003;30(4):345-347. [ Links ]
8. Templeton K, Roberts J, Jeffries D, Forster G, Aitken C. The detection of Chlamydia trachomatis by DNA amplification methods in uirne samples from men with urethritis. International Journal of STD and AIDS 2001;12(12):793-796. [ Links ]
9. Giraldo A, Fonseca D, Lozano F, Orjuela J, Gutiérrez A, Ruiz I. Reacción en cadena de la polimerasa para la detección de Toxoplasma gondii: hallazgos en 534 casos estudiados en la Fundación Gillow. Revista Colombiana de Ginecología y Obstetricia 2001;4(2):44-47. [ Links ]
10. Harindra V, Underhill G, Tobin J. Screening for genital chlamydia infection: DNA amplification techniques should be the test of choice. International Journal of STD and AIDS 2003;14(11):723-726. [ Links ]
11. Martinez A. Diagnóstico microbiológico de Chlamydia trachomatis: estado actual de un problema. Rev Chil Infectol 2001;18(4). [ Links ]
12. Weller TH. The cytomegaloviruses: ubiquitous agents with protean clinical manifestations I. N Engl J Med 1971;285(4):203-214. [ Links ]
13. Shen CY, Chang WW, Chang SF, Chao MF, Huanng ES, Wu CW. Seroepidemiology of Cytomegalovirus infection among children between the ages of 4 and 12 years in Taiwan. J Med Virol 1992;37(1):72-75. [ Links ]
14. Nelson CT, Demmler GJ. Cytomegalovirus infection in the pregnant mother, fetus, and Newborn Infant. Clin Perin 1997;24 (1):151-159. [ Links ]
15. Lipitz S, Achiron R, Zalel Y. Outcome of pregnancies with vertical transmission of primary cytomegalovirus infection. Obst Gyn 2002;100(3):428-433. [ Links ]
16. Sweeten TL, Posey DJ, McDougle CJ. Brief report: autistic disorder in three children with cytomegalovirus infection. J Autism Dev Disord 2004;34(5):583-586. [ Links ]
17. Maschmann J, Hamprecht K. Cytomegalovirus infection of extremely low birth weigth infants via breast milk. Clin Infect. Dis 2001;33(12):1998-2003. [ Links ]
18. Yoshida A, Hitomi S, Fukui T. Diagnosis and monitoring of human Cytomegalovirus disease in patients with human immunodeficiency virus infection by use of a real time PCR. Clin Infect Dis 2001;33(10):1756-1761. [ Links ]
19. Priparien H, Hockerstedt K. Monitoring of viral load by quantitative plasma PCR during active cytomegalovirus infection of individual liver transplant patients. J Clin Microbiol 2002;40(8):2945-2952. [ Links ]
20. Jaber S, Chanques G, Borry J, Souche B, Verdier R, Perrigault PF et al. Cytomegalovirus Infection in Critically Ill Patients: Associated Factors and Consequences. Chest. 2005;127(1):233-241. [ Links ]
21. Grose C, Meehan T, Weiner CP. Prenatal diagnosis of congenital Cytomegalovirus infection by virus isolation after amniocentesis. Pediatr Infect Dis J. 1992;11(8):605-607. [ Links ]
22. Nicolini U, Kustermann A, Tassis B, Fogliani R, Galimberti A, Percivalle E et al. Prenatal diagnosis of congenital human cytomegalovirus infection. Prenat Diagn. 1994;14(10):903-906. [ Links ]
23. Calvario A, Bozzi A, Ventola C. Herpes consensus PCR test: a useful diagnostic approach to the screening of viral disease of the central nervous system. J Clin Virol. 2002;suppl:71-78. [ Links ]
24. Yamamoto AY, Mussi Pinhata M, Pinto P. Usefulness of blood and urine samples collected on filter paper in detecting cytomegalovirus by PCR technique. J Virol Meth. 2001;97(1):159-164. [ Links ]
25. Tam M. Specimen processing and concentration of chlamydia trachomatis added can influence falsenegative rates in the LCx assay but not in the APTIMA Combo 2 assay when testing inhibitors. J Clin Microbiol 2003;41:778-782. [ Links ]
26. National Chlamydia Laboratory Committee. Inhibition of amplification assays for Chlamydia trachomatis. Association of Public health laboratories; 2003. [ Links ]
27. Lisby G, Dessau RB, Andersen CB, Ladefoged S. Polymerase chain reaction as a rapid diagnostic assay for Cytomegalovirus infection in renal transplant patients. APMIS 1994;102:690-694. [ Links ]
28. Lorina G, Lilli D, Dicuonzo G, Rivanera D, Filadoro F, Alfani D et al. Cytomegalovirus infection followup in renal transplant patients by the polymerase chain reaction. Transplant Proc 1993;25(3):2280-2281. [ Links ]
29. Miller SA, Dykes DD, Polesky HF. A simple salting out procedure for extracting DNA from human nucleated cells. Nucleic Acids Res 1988;16(3):1215. [ Links ]
30. Mahony J, Chong S, Jang D, Luinstra K, Faught M. Urine specimens from pregnant and nonpregnat women inhibitory to amplification of Chlamydia trachomatis nucleic acid by PCR, ligase chain reaction, and transcription-mediated amplification: Identification of urinaly substances associated with inhibition and removal of inhibitory activity. J Clin Microbiol. 1998;36(11):3122-3126. [ Links ]
31. Verkooyen R, Luijendijk W, Huisman W, Goessesns J. Detection of PCR inhibitors in cervical specimens by using the amplicor Chlamydia trachomatis assay. J Clin Microbiol 1996;34:3072-3074. [ Links ]
32. Sanchez P, Britt W, Soong SJ, Whitley RJ. National Institute of Allergy and Infectious Diseases Collaborative Antiviral Study Group. Detection of cytomegalovirus (CMV) DNA by polymerase chain reaction is associated with hearing loss in newborns with symptomatic congenital CMV infection involving the central nervous system. J Infect Dis.2005;191(2):227-233. [ Links ]
33. Adler SP. The Molecular epidemiology of Cytomegalovirus transmission among children attending a day care center. J Infect Diseas. 1985;152(4):760-768. [ Links ]
34. Shen CY, Chang BL, Chang SF, Yang SL, Tseng SL, Chen CY et al. Molecular epidemiology of cytomegalovirus infection in kindergarten children. J Med Virol. 1996;48(1):33-37. [ Links ]
35. Bhatia J, Shah BV, Mehta AP, Deshmukh M, Sirsat RA, Rodrigues C. Comparing serology, antigenemia assay and polymerase chain reaction for the diagnosis of cytomegalovirus infection in renal transplant patients. J Assoc Phys India. 2004;52:297-300. [ Links ]














