Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Ciencias de la Salud
versión impresa ISSN 1692-7273versión On-line ISSN 2145-4507
Rev. Cienc. Salud v.4 supl.1 Bogotá oct. 2006
Bioquímica en la vida diaria: el equilibrio químico y la función transportadora de la hemoglobina
Biochemistry Applied to Everyday Life: Chemical Equilibrium and the Transporting Function of the Hemoglobin
Carlos Mario Echeverría Palacio*, Raúl Ramírez Grueso*, Kelly Coba Torres*, María Orfa Rojas
* Estudiantes de Bioquímica I, primer semestre Programa de Medicina, 2006.
Investigador principal proyecto investigación educativa Aplicación de una estrategia interactiva no convencional para el aprendizaje de la Bioquímica en grupos grandes, profesora Unidad Bioquímica. Autor correspondiente: María Orfa Rojas, Facultad de Medicina, Instituto Ciencias Básicas, Unidad de Bioquímica. mariaorfarojas@yahoo.com
Recibido: 04 de septiembre de 2006. Aceptado: 25 de septiembre de 2006.
Resumen
La hemoglobina es una proteína sanguínea que puede transportar oxígeno, un gas insoluble en medio acuoso, llevándolo a las diferentes partes del organismo en donde es requerido para su buen funcionamiento, así como productos metabólicos como el CO2 y el hidrógeno, para su excreción. Estos procesos se ven condicionados por factores como el pH, la concentración de BPG, las presiones parciales de O2 y CO2, la cooperatividad de la unión entre la hemoglobina y esos compuestos y los cambios conformacionales que la hemoglobina debe sufrir para captar y soltar eficientemente estas moléculas en el sitio del organismo donde son requeridos. Cambios abruptos en la presión atmosférica ligados a la altura, y la exposición a altas concentraciones de otros gases afines a la hemoglobina como el monóxido de carbono, presente en vehículos o recintos cerrados, pueden comprometer el funcionamiento normal del organismo precisamente porque causan efectos sobre esa función transportadora de la hemoglobina. En este escrito, se explicarán fenómenos de la vida diaria relacionados con el transporte de gases por la hemoglobina, como una demostración de que los conocimientos bioquímicos comienzan a ser útiles desde ahora para entender situaciones cotidianas y a dejarnos la expectativa de su valor para entender muchos de los problemas de salud que tendremos en nuestras manos.
Palabras clave: transporte de O2, transporte de CO2, balance ácido-base, estructura función de la hemoglobina, transporte de gases.
Abstract
The hemoglobin is a blood protein which can transport oxygen, a gas insoluble in water, to different organs where it is required for the proper function; this protein also transports the metabolic products, CO2 and H+ for their excretion. This process depends on pH, the BPG concentration, pO2 and pCO2. The cooperative binding between hemoglobin and those compounds and the conformational changes necessary for oxygen and CO2 uptake and release in the specific place where they are required. Abrupt changes of atmospheric pressure associated with height and the exposure to other gases such as CO present in vehicles and closed rooms could compromise the normal functioning of the organism because their presence affects the transport function of the hemoglobin. In this paper, we will explain everyday phenomena related to the transport of gases through hemoglobin as a demonstration that a knowledge of biochemistry begins to be useful from now on to understand everyday situations and give us an expectation of their value to comprehend many health problems that would be faced in the future.
Key words: O2 transport, CO2 transport, acidbases balance, Structure and function of hemoglobin, gas transport.
El proceso evolutivo ha permitido la adaptación de las especies a cambios ambientales, para satisfacer sus necesidades fisiológicas y metabólicas. La mayoría de los vertebrados y en especial los mamíferos han desarrollado complejos sistemas que permiten captar, metabolizar y distribuir los nutrientes y la energía necesaria para cada célula. También han desarrollado mecanismos que median la excreción de residuos. Uno de estos sistemas de enorme complejidad es el sistema circulatorio, encargado por medio de la sangre de distribuir los nutrientes y recoger los desechos del metabolismo (1).
El O2 es fundamental para realizar varios procesos en el metabolismo celular, para lo cual debe ser llevado desde los pulmones hasta los tejidos. Sin embargo, su naturaleza gaseosa apolar le confiere poca solubilidad en soluciones acuosas en las cuales tendería a producir burbujas que en el caso de nuestro organismo le impediría llegar hasta los tejidos. De igual forma el CO2, uno de los principales productos de desecho del metabolismo celular, es un gas que por las mismas razones que el oxígeno, es insoluble en medio acuoso, pero que debe ser transportado hasta los pulmones para ser excretado (2).
El organismo obvia estos problemas utilizando una molécula proteica que posee afinidad por los dos gases de tal forma que puede transportarlos hasta los sitios requeridos bien para su utilización o expulsión. Esta proteína, es la hemoglobina presente en los eritrocitos, y que como se indicó tiene capacidad para fijar O2 en los pulmones y liberarlo a nivel tisular, constituyendo un claro ejemplo de unión reversible de una proteína a un ligando; así mismo, la hemoglobina tiene la capacidad de llevar parte del CO2 de los tejidos a los pulmones para su excreción. Esta reversibilidad de la unión hemoglobina- oxígeno es aprovechada por el organismo para captar pero también para soltar el oxígeno a nivel tisular. En este proceso intervienen factores como el pH, las presiones parciales de O2 y CO2 (pO2 y pCO2), la cooperatividad de la unión de los gases a la hemoglobina, los cambios conformacionales que la hemoglobina debe sufrir para ejercer su función, las concentraciones de bifosfoglicerato (BPG) y aún la presencia de otros compuestos como el monóxido de carbono que puedan competir por los sitios de unión a la proteína (1, 2).
La hemoglobina es una proteína globular constituida por cuatro cadenas polipeptídicas (dos alfa y dos beta). Cada una de las cadenas, contiene un grupo prostético, denominado hemo, el cual a su vez contiene un átomo de hierro, que por su estado de oxidación tiene la capacidad de fijar reversiblemente una molécula de oxígeno (2).
Cuando una molécula de O2 se une a la hemoglobina, se producen cambios conformacionales que modulan una mayor o menor actividad de la proteína para unir o soltar el ligando, en un proceso que se conoce como alosterismo (2). La afinidad de la hemoglobina por el oxígeno es dependiente de esta transición conformacional que define dos estados denominados tenso (T) y relajado (R). En el estado T o de baja afinidad, la hemoglobina se encuentra desoxigenada, y las probabilidades de unión con el O2 son mínimas. El estado R o de alta afinidad, por el contrario, presenta una alta tenden cia a fijar el O2. La transición entre estos dos estados se encuentra determinada por el carácter cooperativo de la unión hemoglobina-oxígeno, sobre la cual influyen los factores anteriormente mencionados (2).
Adicionalmente, la afinidad de la hemoglobina por el oxígeno es directamente proporcional a la presión parcial de oxígeno, pO2, la cual es mayor en los pulmones (12.7 kPA) comparada con la de los tejidos (4 kPA) (2, 3). Por las razones expuestas, la unión del oxígeno a la hemoglobina facilita el cambio conformacional (T a R) para que se adhieran otras tres moléculas, en un proceso conocido como regulación homotrópica.
La hemoglobina también transporta los dos principales productos de la respiración celular, CO2 e H+, desde los tejidos hacia los pulmones y riñones para su excreción. Debido a que al igual que el oxígeno, el dióxido de carbono es un gas apolar, requiere ser transportado como bicarbonato, el cual se forma de acuerdo a la siguiente reacción:
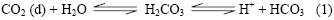
Esta reacción es catalizada por la anhidrasa carbónica, una enzima particularmente abundante en los eritrocitos. Como la reacción lo muestra, la disolución del CO2 genera un aumento en la concentración de iones H+, lo cual implica un descenso del pH; esta variación del pH a su vez determina cambios de afinidad entre la hemoglobina y el oxígeno: a una alta concentración de H+ y de CO2, como ocurre en los tejidos periféricos, la afinidad de la hemoglobina por el oxígeno decrece y entonces este es liberado. De manera contraria, cuando el CO2 llega a los pulmones y es excretado, el pH se eleva permitiendo un cambio conformacional en la hemoglobina y un aumento de su afinidad CO2 (d) + H2O H2CO3 H+ + HCO3 (1) por el oxígeno dando lugar a que comience de nuevo el proceso de su transporte hacia los tejidos (2, 4)
En la reacción (2), se evidencia la dependencia que el proceso de oxigenación y desoxigenación de la hemoglobina tiene de la concentración de iones hidrógeno en el medio celular. De acuerdo con la reacción, y como consecuencia del metabolismo, cuando aparecen en los tejidos los iones hidrógeno causando descensos del pH, la hemoglobina suelta el oxígeno y se protona emprendiendo de nuevo su viaje a los pulmones para reiniciar el proceso de captación de oxígeno.
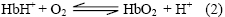
Es pertinente aclarar, que la unión del oxígeno y de los protones a la hemoglobina, ocurre en sitios diferentes: mientras el O2 se fija al Fe++ del grupo hemo, los H+ lo hacen a diferentes residuos aminoacídicos de la proteína, especialmente a la histidina. La fijación H+ a la His146, permite la estabilización del estado T de la hemoglobina, propiciando la actividad cooperativa de esta proteína para la unión del oxígeno. Una pequeña cantidad de CO2 es fijada a los extremos á-amino en forma de carbonato, produciendo un efecto inverso sobre la afinidad hemoglobina - oxígeno- (2).
Otro aspecto que debe tenerse en cuenta, es el efecto de disminución de la afinidad de la hemoglobina por el oxígeno como consecuencia de su interacción con el 2,3-bifosfoglicerato (BPG), un compuesto presente en concentraciones relativamente altas en el eritrocito. Esta molécula, cargada negativamente, se une a la proteína por interacción con aminoácidos cargados positivamente dispuestos en una cavidad formada entre las sub unidades ß cuando la proteína tiene la conformación T. Cuando la proteína pasa al estado R, se produce un cambio conformacional que evita la unión del BPG a la Hb. Cuando el BPG está ausente, se favorece la conformación R de la hemoglobina. El proceso de unión de la hemoglobina al 2,3 bifosfoglicerato, se muestra en la reacción (3)
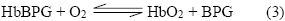
El BPG, se une a la hemoglobina en un sitio distante al de unión al oxígeno, regulando su afinidad por el oxígeno en relación con su presión parcial en los pulmones. Esta molécula juega un papel importante en la adaptación de organismos sometidos a las bajas presiones de oxígeno encontradas a elevadas altitudes. En personas sanas que viven a nivel del mar la cantidad de oxígeno que se une a la Hb es regulada de tal forma que en los tejidos se libere cerca del 40% que puede ser transportado por la sangre. Cuando una de estas personas es trasladada rápidamente a altitudes elevadas, donde la pO2 es considerablemente menor, se reduce la liberación de oxígeno en los tejidos, sin embargo, muy rápidamente la concentración de BPG comienza a elevarse en la sangre. El ajuste en la concentración de BPG tiene un efecto ligero sobre la unión del oxígeno en los pulmones pero es considerable sobre la liberación del mismo en los tejidos en los cuales permite que se restablezca el nivel cercano al 40% que normalmente es transportado por la sangre. La situación es reversada cuando la persona regresa al nivel del mar (1, 2).
La hemoglobina presenta una afinidad aproximadamente 250 veces más alta por otros gases como el monóxido de carbono (CO) con respecto al oxígeno (2). El monóxido es un gas incoloro e inodoro y de una alta toxicidad al cual podemos estar expuestos en ambientes don- HbBPG + O2 HbO2 + BPG (3) de se producen procesos de combustión incompleta como ocurre en los motores de los carros. Cuando el gas es inhalado por una persona, se combina con la Hb desplazando el oxígeno y formando un compuesto conocido como carboxihemoglobina (COHb)
Todo el conocimiento abordado aquí, puede aplicarse a la explicación de situaciones cotidianas a las que el organismo responde extraordinariamente bien mediante el manejo de simples reacciones químicas como las descritas anteriormente. A continuación, discutiremos algunas de estas situaciones que han formado parte de inquietudes que surgieron durante el aprendizaje de los conceptos anteriores en la asignatura Bioquímica I.
Por ejemplo, ha sido evidente que nuestros compañeros de la Costa experimentan una sensación de ahogo al llegar a Bogotá y desde luego surge la pregunta ¿Por qué ocurre esto? Nos hemos preguntado también ¿Qué sucede cuando una persona es expuesta a altas concentraciones de CO2 en un recinto cerrado como ocurre diariamente cuando nos desplazamos de nuestras casas a la universidad en buses que transitan atestados de personas y completamente cerrados?¿Tiene esto alguna relación con el hecho de que nos quedemos dormidos con facilidad en los buses urbanos? ¿Este estado de sueño podría tratarse de un mecanismo de adaptación para minimizar el consumo de oxigeno? y finalmente ¿ Qué es lo que pasa cuando por descuido de los adultos, un niño de dos años se ve expuesto a los gases que despide un auto al ser encendido presentando cefalea, y adormecimiento?
Cuando las personas que llegan a Bogotá procedentes de la costa y de otras partes del país de menor altitud, sienten que les falta el aire, se cansan muy rápido, no pueden realizar los esfuerzos físicos que antes hacían con facilidad, en otras palabras, literalmente se ahogan. Este fenómeno tiene una clara explicación bioquímica: el cambio en la presión atmosférica derivado del aumento en la altitud reduce la disponibilidad de O2 y por lo tanto se hace necesario disponer de una mayor cantidad de moléculas transportadoras que faciliten la llegada de oxígeno a los tejidos periféricos. Ante la disminución de la disponibilidad de oxígeno y puesto que el organismo necesita optimizar su funcionamiento, se genera una importante respuesta adaptativa relacionada con las concentraciones de hemoglobina y de BPG. El organismo consigue esto a través de una mayor producción de eritrocitos en la médula ósea.
Sabemos que la presión atmosférica es inversamente proporcional a la altura, y por ello, en ciudades como Santa Marta (2 msnm) hay mayor pO2 que en Bogotá (2600 msnm ). A nivel del mar no se necesitan altas concentraciones de hemoglobina que transporten el O2, ni de bifosglicerato (BPG) que regule su liberación en tejidos para satisfacer la demanda. El cambio abrupto en la presión atmosférica al llegar a Bogotá, hace que la pO2 sea menor disminuyendo su disponibilidad, por lo cual el O2 que el organismo es capaz de transportar con la concentración de hemoglobina que se posee a nivel del mar es insuficiente, y como consecuencia, la cantidad que llega a los tejidos también va a ser baja. Esta situación se refleja en la sensación de fatiga permanente la cual se acentúa al hacer cualquier tipo de esfuerzo físico.
Como se discutió anteriormente, el BPG es un modulador alostérico de la unión hemoglobina- oxígeno, es decir, se une a la Hb disminuyendo su afinidad por el oxígeno al facilitar la transición del estado R al estado T a nivel tisular. Al llegar a ciudades como Bogotá, la liberación de O2 en los tejidos disminuye en una cuarta parte, alcanzando un máximo del 30%. Como consecuencia, las concentraciones de BPG aumentan, con el fin de que se reduzca la afinidad de la hemoglobina por el O2, haciendo que de nuevo se libere a nivel tisular un 40% del oxígeno transportado. Esto se revierte al volver al nivel del mar.
Esta respuesta adaptativa varía de persona a persona, dependiendo de sus hábitos y su estado físico, así como de la capacidad pulmonar que posea. Los bogotanos, quienes ya están habituados a la baja pO2, presentan elevadas concentraciones de hemoglobina. Sin embargo, independientemente del tiempo que se lleve en la altura, la baja disponibilidad de oxígeno se evidencia al realizar ejercicios físicos prolongados.
La unión de la hemoglobina al oxígeno es un ejemplo de unión reversible proteína-ligando, la cual está determinada por diversos factores que alteran el grado de afinidad. El ahogo que sufren las personas que vienen de la Costa es normal, y desde la bioquímica no es otra cosa que la deficiencia de oxígeno en los tejidos periféricos causada por la baja presión de oxígeno y la baja concentración de proteína transportadora para captar todo el oxígeno requerido, como ya se explicó.
Ahora bien ¿qué sucede con el equilibrio químico cuando una persona se encuentra expuesta a una elevada concentración de CO2? En el evento de que una persona se encuentre sobre expuesta al gas CO2 (como podría suceder en un bus urbano), y la concentración de éste supere los niveles permitidos en el aire, es decir, en concentraciones que impliquen riesgo de toxicidad, podría predecirse que la cantidad de éstos compuestos en los alvéolos tendería a aumentar también.
Un aumento en la presión de CO2 en los alvéolos pulmonares, le permite a este gas te ner una mayor solubilidad en el agua, desde luego en un proceso ayudado por la enzima anhidrasa carbónica, dando lugar a la formación de ácido carbónico H2CO3, el cual se disocia en iones hidrógeno y bicarbonato como ya se mencionó (reacción 1) (2, 4).
Es importante tener en cuenta cómo esta mayor presencia de CO2 en el organismo, y las variaciones que se originan en la concentración de iones hidrógeno, influyen directamente en otros eventos como por ejemplo los cambios de estructura de las proteínas, en este caso la hemoglobina, alterando los mecanismos normales de transporte tanto del oxígeno como del gas carbónico. Anteriormente se enunció, que los cambios en la conformación de la parte proteica de la hemoglobina, son críticos con respecto a la afinidad que la proteína presenta por el O2 (2).
Estos cambios permiten que la hemoglobina pueda adaptarse eficazmente a diferentes ambientes de presión y pH. A pH bajos, ésta tiende a protonarse con lo cual se modifican algunos enlaces intramoleculares responsables de la afinidad de la proteína por el CO2. Este proceso además de contribuir a evacuar el CO2, permite ejercer una acción amortiguadora en el equilibrio ácido-base a nivel tisular (4).
También es importante agregar que el pH en los pulmones es aproximadamente de 7.6 mientras que en los tejidos es aproximadamente de 7.2. Esto explica por qué la hemoglobina capta con mayor facilidad el O2 en los pulmones y lo libera más fácilmente en los tejidos, en los que hay mayor concentración de iones hidrógeno. La parte más interesante de la discusión está relacionada con el hecho de que la hemoglobina proveniente de zonas periféricas que llega a los pulmones necesita encontrar unas condiciones de presión y pH precisos para descargar el CO2 y los iones hidrógeno que trae desde los tejidos periféricos. Es precisamente ahí donde juega un papel muy importante el hecho de que la concentración de CO2 en los alvéolos pueda encontrarse en niveles anormales.
Los hidrogeniones que se producirían por el exceso de CO2, teóricamente le impedirían a la hemoglobina descargar total o parcialmente el gas, impidiendo los cambios conformacionales que conducirían la macromolécula al estado R (de alta afinidad por el O2). La manera como el sistema nervioso se ve afectado por una deficiencia de O2 no se describe puesto que se escapa a los objetivos de este texto.
La acción que ejercen los mecanismos amortiguadores para regular el pH, evita que éste disminuya significativamente (2, 3, 4). Sin embargo, una baja cantidad de hemoglobina oxigenada en la sangre que llega al cerebro, puede llevarnos a perder la conciencia, debido a la sensibilidad de éste a los cambios de O2 y/o a una intoxicación si este estado se torna permanente. El adormecimiento que se siente en un largo recorrido en un bus urbano saturado de CO2 puede explicarse de la misma forma.
En el caso de la exposición del niño al monóxido de carbono emitido por la combustión incompleta del vehículo cuando este es encendido, el gas compite con el oxígeno por la unión a la hemoglobina con ventajas apreciables debido a que la proteína tiene una afinidad mucho mayor por el monóxido como ya se citó anteriormente. El monóxido de carbono al formar la carboxihemoglobina captura aquellas moléculas de hemoglobina que estaban disponibles para unir oxígeno. Adicionalmente, también afecta la afinidad de las sub unidades remanentes de Hb por el oxígeno. Es decir cuando el CO se une a una subunidad del tetrámero de hemoglobina, permite un aumento sustancial en la afinidad por el oxígeno en las subunidades remanentes de tal forma que un tetrámero de Hb que tenga dos moléculas de CO unidas puede también unir oxígeno eficientemente en los pulmones pero lo libera muy poco en los tejidos. Esta situación llega rápidamente a tener las consecuencias cuyo grado de severidad dependerá de la magnitud y tiempo de exposición.
El CO, interacciona además con la mioglobina, la proteína encargada del almacenamiento de oxígeno en el músculo produciendo entonces problemas en órganos como el corazón.
A través del análisis de las tres situaciones descritas, se ha mostrado que la función transportadora de la hemoglobina es un claro ejemplo de cómo el organismo se las ha ingeniado para solventar el aporte permanente de O2 requerido para sus funciones y cómo los procesos ligados al metabolismo no serían posibles sin una proteína con las propiedades bioquímicas de la hemoglobina. Adicionalmente, para nosotros los estudiantes, el aprendizaje de la Bioquímica, se ha hecho más sencillo en la medida en que hemos tenido la oportunidad de adquirir habilidades para aplicar los conceptos a la explicación de sucesos de la vida cotidiana.
AGRADECIMIENTO
Como investigadora principal del proyecto educativo de la Unidad de Bioquímica quiero manifestar a los estudiantes que participaron en esta actividad, mi complacencia por haber aceptado la invitación a buscar aplicaciones de los conceptos básicos de la bioquímica en situaciones cotidianas. Esta complacencia se ha magnificado por el hecho de que su aceptación y empeño no estuvo viciada por los premios corrientes representados en una nota sino más bien por el anhelo de aprender a aprender y de aprender a comunicar los conocimientos adquiridos. Mi voz de aliento y mi apoyo incondicional para seguir adelante estarán siempre a su lado.
María Orfa Rojas
REFERENCIAS
1. Thomas M. Devlin, Bioquímica Libro de texto con aplicaciones clínicas. Cuarta edición, Barcelona. Editorial Reverté, Barcelona-España; 2004. [ Links ]
2. David L. Nelson, Michael M. Cox. Lehninger Principles of Biochemistry. Fourth edition, United States of America. W.H. Freeman and Company, New York; 2005. [ Links ]
3. Andrew Durward and Ian Murdoch. Understanding acid-base balance. Current Pediatrics; 2003 (13): 513-519. [ Links ]
4. Jonathan Greenbaum, Mahesh Nirmalan. Acid-base balance: The tradicional approach. Current Anaesthesia & Critical Care; 2005 (16): 137-142. [ Links ]














