Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Ciencias de la Salud
versão impressa ISSN 1692-7273versão On-line ISSN 2145-4507
Rev. Cienc. Salud v.5 n.3 Bogotá set./dez. 2007
Corticoides: 60 años después, una asignatura pendiente
Corticoids: 60 Years Later a Pending Subject
Silvia Gómez Ordóñez1
Ángela María Gutiérrez Álvarez2
Etna L. Valenzuela Plata3
1. Médica de la Universidad de la Sabana.
2. Médica, MSc. Facultad de Medicina, Universidad del Rosario.
3. Médica especialista en Auditoría Médica y Gerencia en Salud, Team Physician CNS-Pain Unit Business Pfizer Colombia. Correspondencia: Silvia Gómez. Facultad de Medicina. Universidad de la Sabana, Campus Universitario del Puente del Común, km. 21, Autopista Norte de Bogotá. Tel.: 6472126. Correo electrónico: silgonina@gmail.com
Descargos de responsabilidades y financiamiento Laboratorio Pfizer Colombia aportó para la realización de este artículo; proporcionó los recursos económicos para la compra de los artículos citados y el pago de honorarios a Ángela María Gutiérrez, como epidemióloga del equipo de trabajo.
Recibido: 1 de abril de 2007 Aceptado: 2 de julio de 2007
Resumen
El objetivo de este artículo es hacer una breve recopilación de la fisiología del eje hipotálamo-hipofisiario-suprarrenal, para comprender el papelde los corticoides exógenos como herramientas terapéuticas en innumerables patologías,que, utilizados de manera inapropiada, pueden causar efectos deletéreos importantes. La historia de los corticoides empezó hace 164 años, en 1843, cuando Thomas Addison describió los síntomas de la insuficiencia suprarrenal. Casi 100 años después, el 21 de septiembre de 1948, marcó un hito en la historia de la medicina, cuando, en la Clínica Mayo, el Dr. Hench inyectó 100 g de cortisona por primera vez en un paciente con artritis reumatoidea. En 1950, Hench, Kendall y Reichstein recibieron el Premio Nobel de Medicina y Fisiología. En la corteza de las glándulas suprarrenales se sintetizan, a partir del colesterol, tres hormonas diferentes con diversos efectos sobre la homeostasis. Los glucocorticoides sintéticos se clasifican por su potencia antiinflamatoria, vida media y efecto mineralocorticoide; operan en casi todas las células por medio de mecanismos de acción genómicos y no genómicos, lo que genera diferentes respuestas, de ahí su amplio efecto terapéutico en esclerosis múltiple, rechazo de trasplantes, enfermedades respiratorias, como asma y Epoc, entre otras.
Palabras clave: cortisol, hormonas, enfermedad de Addison, mineralocorticoides, glándulas suprarrenales.
Abstract
The objective of this article is to make a brief compilation of the physiology of the hypothalamic-pituitary-adrenal axis in order to understand the role of the exogenous corticoids as therapeutic tools in innumerable pathologies, but when used inappropriately, it can produce important deleterious effects. The history of the corticoids began 164 years ago in 1843 when Thomas Addison described the symptoms of the adrenal gland insufficiency. On September 21st 1948, almost one hundred years after, Dr. Hench injected cortisone for the first time in a patient with arthritis. In 1950 Hench, Kendall and Reichstein received the Nobel Prize in Medicine and Physiology. In the cortex of the adrenal glands, three different hormones are synthesized from cholesterol, and these hormones produce diverse effects on the homeostasis of the body. The synthetic glucocorticoids are classified by their anti-inflammatory power, half life, and mineralocorticoid effect; they operate in almost every cell through genomic and non genomic mechanisms of action producing different responses. This is the reason of their wide therapeutic effect in respiratory diseases like asthma and COPD, multiple sclerosis, rejection of transplants, among others.
Keywords: Cortisol, hormone, Adisson disease, mineralocorticoids, adrenal glands.
INTRODUCCIÓN
La tecnología farmacéutica ha permitido la síntesis de numerosas moléculas corticoesteroideas con diferente potencia y duración de acción. En la actualidad, es común evidenciar que los corticoides son usados indiscriminadamente sin tener en cuenta la patología que se va a tratar, la gravedad de ésta y las adecuadas características del corticoide necesario.
Es sorprendente evidenciar que, frecuentemente, para médicos de diferentes especialidades, su elección de tratamiento está basada en lo que vieron hacer a sus profesores cuando eran estudiantes o en la adopción de una determinada molécula para todo tipo de patologías.
Este artículo de revisión pretende, de manera práctica, abarcar los conceptos básicos de los corticoides, con el fin de que los médicos de cualquierespecialidad fundamenten sus decisiones terapéuticas en el conocimiento de los aspectos más importantes de la fisiología y farmacología de éstos. Esto dará como resultado tratamientos más eficaces, a un menor costo, en términos de los eventos adversos que puedan sufrir los pacientes por el uso inadecuado de dichos medicamentos.
HISTORIA
Para los médicos de las generaciones recientes es difícil imaginar que alternativas terapéuticas tan importantes como los corticoesteroides no existían hace 60 años. Es probable que no exageremos al decir que, mínimo, las últimas 20 generaciones de médicos en todo el mundo desconocen los pormenores del descubrimiento y el temprano uso de la cortisona. Haber tenido la oportunidad, a la luz de un proyecto de revisión de la literatura sobre generalidades de corticoides, de estudiar la historia y los acontecimientos que llevaron a la utilización terapéutica de éstos ha sido una enriquecedora experiencia.
La historia de los corticoides quizá empezó hace 164 años, en 1843, cuando Thomas Addison, médico inglés, describió por primera vez algunos casos de insuficiencia suprarrenal en pacientes que presentaban: un estado general de languidez y debilidad, desfallecimiento en la acción del corazón, irritabilidad en el estómago y un cambio peculiar en la piel y que evolucionabanindefectiblemente a la muerte (1). Las autopsias de los pacientes confirmaron alteraciones de las glándulas suprarrenales e hicieron sospechar a Addison la existencia de una sustancia que dependía de estas glándulas, la cual, al producirse en poca cantidad, causaba la sintomatología clínica. Estas observaciones y conjeturas motivaron muchos años de investigación, que dieron como resultado la descripción de la epinefrina y el cortisol 50 años después de la muerte de Addison, a finales del siglo XIX, así como la descripción de la aldosterona, en 1929. En 1925, Phillip S. Hench, reumatólogo norteamericano y entonces jefe del Departamento de Enfermedades Reumatológicas de la Clínica Mayo, notó síntomas de apatía e hipotensión en pacientes que padecían artritis reumatoidea (AR) y enfermedad de Addison; sin embargo, en la autopsia de estos pacientes no se encontró ninguna alteración estructural de las glándulas suprarrenales, lo que generó el abandono de dichas observaciones.
Más tarde, en 1929, algo más volvió a llamar la atención de Hench y fue la remisión de los síntomas de pacientes con AR que a la vez presentaban ictericia, situación que también observó en mujeres embarazadas con AR; fue así como postuló la relación entre estos fenómenos con una determinada sustancia x antirreumatoidea, que inicialmente asoció a disfunción hepática. Su naturaleza de clínico y los numerosos acercamientos a la investigación en cadáveres no pudieron darle explicación a las asociaciones antes mencionadas ni determinar la misteriosa sustancia x.
En los siguientes años, los químicos Edward Kendall, PhD en química y jefe de bioquímica de la Clínica Mayo, y Tadeusz Reichstein, químico farmacéutico y profesor de Balce, enfocaron sus investigaciones, paralela, pero independientemente, en la glándula suprarrenal; aislaron la cortisona de las glándulas de ganado, en 1935, lo cual sería de gran ayuda para Hench años más adelante.
Los intentos de producir cortisona a partir del macerado de glándulas suprarrenales de ganado en laboratorio era lento y tedioso, pues se requerían 1.000 kg de glándulas para obtener la ridícula cantidad de 25 g de la preciada hormona, cantidad que era costosa para responder a las necesidades planteadas por los pacientes con enfermedad de Addison e insuficiente para la realización de estudios clínicos que demostraran los efectos terapéuticos postulados por Hench a lo largo de sus observaciones.
Para 1937, la industria farmacéutica había logrado producir una cortisona semisintética a partir del ácido desoxicólico procedente del macerado de vesícula biliar de ganado y ovejas en su laboratorio, pero aún el precio de producción permanecía elevado: a razón de 1.000 dólares el gramo de acetato de desoxicortisona, lo cual impedía su comercialización masiva, sin contar con que era relativamente ineficaz.
En los subsecuentes cinco años fue aislado el núcleo de la cortisona con sus dos radicales: cetona en la posición 11 e hidroxilo en la posición 17, y se encontró una fuente externa (ñame mexicano) para la producción semisintética de una molécula más económica y efectiva.
Con toda esta información clara y contextualizada, los experimentos en ratones permitieron la asociación entre las respuestas de estrés y el eje hipotálamo-hipófisis suprarrenal; adicionalmente, en estos años se describieron y diferenciaron los glucocorticoides y mineralocorticoides por Hans Selye, hacia 1940.
Durante la Segunda Guerra Mundial corrió el rumor de la existencia de un medicamento milagroso que era extraído de las glándulas suprarrenales de ganado traído desde Argentina, y que Alemania estaba usando con éxito en sus pilotos de aviones bombarderos y personal de submarinos para mejorar el rendimiento y la tolerancia física; lo cierto es que la historia relata que este rumor llegó a oídos del Reino Unido y de los Estados Unidos (EE. UU.), quienes, en calidad de aliados en contra de Alemania, se sintieron preocupados al respecto. Los EE. UU. Dirigieronsu departamento de salud hacia la investigación de glándulas suprarrenales y su secreción adrenocortical. No sabemos qué relación hubo con el aparentemente rápido desarrollo del conocimiento médico y los avances de la industria farmacéutica.
No está del todo claro si Hench y su investigación estuvieron influenciados por estos hechos, lo cierto es que él pudo integrar todo el conocimiento para concluir que la cortisona poseía efectos antiinflamatorios y que había sido la responsable, en los pacientes con AR e ictericia, de la remisión de los síntomas de su enfermedad.
El 21 de septiembre de 1948 marcó un hito en la historia de la medicina, cuando, en la Clínica Mayo, Hench inyectó 100 g de cortisona por primera vez a un paciente con artritis reumatoidea. Glyn explica, en su artículo de 1998 (1), que dos sucesos nos permiten, hoy en día, gozar de los corticoides: el primero, haber usado una dosis mucho mayor a la dosis terapéutica actualmente conocida, pues, de haberse escogido una dosis subterapéutica, en el ejercicio ensayo-error, se hubieran abandonado los experimentos, y, el segundo, haber escogido un tamaño de cristales adecuado para la solución de aplicación.
Como reconocimiento a 30 años de investigación y arduo trabajo clínico, en 1950, Hench, Kendall y Reichstein recibieron el Premio Nobel de Medicina y Fisiología (1). Posteriormente, se harían grandes aportes al descubrimiento de los corticoides, como la identificación del receptor de los glucocorticoides (GC), la descripción de la activación del eje hipotálamo-hipofisiario-suprarrenal (H-H-S) por citoquinas, el entendimiento del circuito inmune-endocrino, el desarrollo de la técnica de uso local de corticoides, con la consecuente disminución de efectos sistémicos, y otros; todo lo anterior, para dar paso a la amplia gama de usos terapéuticos que hoy en día conocemos en reumatología, endocrinología, neumología, neurología, oncología, traumatología, inmunología, trasplante de órganos, oftalmología, medicina del deporte y cuidado intensivo, en fin, en todas las áreas terapéuticas de la medicina.
GENERALIDADES DE HORMONAS SUPRARRENALES
Anatomía
Las hormonas corticosteroides son producidas por las glándulas suprarrenales, glándulas de secreción endocrina que están situadas en la parte superior de los riñones. Algunos autores refieren que estas glándulas constan de dos órganos endocrinos separados: la corteza suprarrenal y la médula suprarrenal (2). Estos órganos son diferentes por su origen embriológico y por las hormonas que secretan, sin embargo, comparten el riego sanguíneo, y su principal fuente de sangre arterial son las arterias diafragmáticas, aorta abdominal y renal; su vía venosa de drenaje está dada por un sistema porta-intraadrenal, que va desde la corteza hasta la médula suprarrenal. Histológicamente, la corteza está dividida en tres zonas diferentes:
a. La zona glomerular, donde se sintetizan los mineralocorticoides (aldosterona).
b. La zona fasciculada, donde se secretan los glucocorticoides (cortisol).
c. La zona reticular, de donde deriva la síntesis de andrógenos (dehidroepiandrosterona sulfato (DHEAS) y androstenediona). A su vez, la médula produce epinefrina y norepinefrina (3).
Fisiología
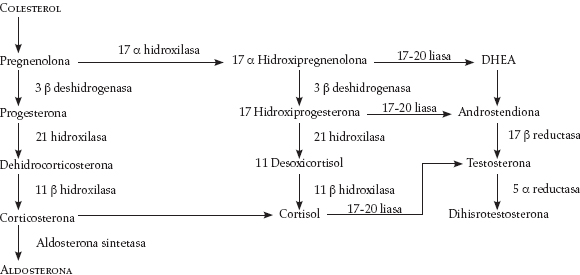
El colesterol es la molécula precursora (80% exógeno) de la cual derivan, por medio de diferentes vías metabólicas, la aldosterona, el cortisol y los andrógenos; las dos primeras hormonas se caracterizan por poseer 21 carbonos (C) en su estructura, en tanto que los andrógenos sólo cuentan con 19 C; sin embargo, su estructura química es similar, lo que hace que la especificidad de unión a sus receptores no sea total, esto explica el concepto de que ninguna de las tres hormonas tiene acciones puras.
La Figura 1 esquematiza el proceso metabólico para la síntesis de las hormonas suprarrenales a partir del colesterol. Esta síntesis es un proceso continuo, ya que en ninguna parte del organismo hay reservorios de estas hormonas (4). El estímulo para la producción de cada una de las hormonas es diferente; la síntesis de aldosterona se aumenta cuando hay bajas concentracionesséricas de sodio (Na) o altas concentraciones de potasio (K), por la acción de la hormona adrenocorticotropa (ACTH) o por la estimulación directa de la angiotensina II y III sobre receptores específicos en la zona glomerular.
Por su parte, el cortisol está autorregulado por el eje hipotálamo-hipofisiario-suprarrenal (H-H-S), el cual tiene un sistema de retroalimentación negativa: al haber aumento de las concentraciones séricas de cortisol, subsecuentemente disminuye la secreción de hormona liberadora de cortisol (CRH) en el hipotálamo y, por lo tanto, de ACTH en la hipófisis anterior. En condiciones fisiológicas el adecuado funcionamiento del eje H-H-S mantiene la secreción de cortisol a razón de 20 mg/día, lo que permite la sincronización con un patrón circadiano; sin embargo, en situación de estrés inflamatorio, la liberación de citoquinas, como el factor de necrosis tumoral alfa (TNF), e interluquinas (IL 1 y 6) estimulan el eje H-H-S y éste bloquea la respuesta inflamatoria; de la misma manera, otras situaciones de estrés, como la hipoglucemia y la fiebre, estimulan la liberación de ACTH.
Así mismo, la regulación de la síntesis de andrógenos está determinada por la ACTH; no obstante, hay que recordar que sólo un 5% de los andrógenos provienen de la glándula suprarrenal, su producción masiva se genera en los testículos y ovarios, por lo tanto allí los sistemas de regulación son otros (3,4).
Figura 1. Origen metabólico de las hormonas suprarrenales (modificada a partir de 2)
Acciones de los glucocorticoides endógenos
Es indiscutible que la supervivencia del ser humano, fisiológicamente hablando, depende del cortisol, pero ¿qué ocurre en cada sistema, cada célula, cada proceso para que estas hormonas sean indispensables para la vida?
Para cumplir con el objetivo de esta revisión abordaremos los efectos de los glucocorticoides endógenos de una manera práctica, que permita no sólo entender sus acciones fisiológicas, sino que, también, contextualice los potenciales riesgos de una inadecuada utilización en el campo terapéutico con moléculas sintéticas. Los glucocorticoides endógenos desempeñan un papel fundamental en la homeostasis de casi todos los sistemas corporales, sus influencias directas e indirectas sobre éstos permiten un adecuado funcionamiento e interacción para mantenernos activos. El cortisol es la hormona biológicamente activa que se metaboliza a cortisona y otros metabolitos inactivos y cuyo papel no ha sido establecido claramente aún. La producción de cortisol fluctúa con el ciclo circadiano, al variar entre 10 mg a 400 mg día en situaciones de estrés. La concentración mayor de cortisol está entre las 6:00 a. m. y las 9:00 a. m. y su menor concentración se encuentra entre las 8:00 p. m. y las 2:00 a. m. Ésta es la razón por la cual los corticoides deben ser administrados en la mañana simulando la producción endógena (5).
El metabolismo de los carbohidratos, proteínas, lípidos y el balance de líquidos y electrolitos, entre otros, está influenciado por el cortisol. En el tejido periférico, los glucocorticoides bloquean la utilización de glucosa y la captación de ésta por adipocitos, fibroblastos, timocitos y leucocitos; inducen lipólisis y proteólisis, lo que genera aminoácidos y glicerol para la gluconeogénesis hepática, y, a este mismo nivel, el depósito de glucosa en forma de glucógeno. Clínicamente, el cortisol actúa antagonizando la insulina, lo que mantiene adecuadas concentraciones séricas de glucosa. Los glucocorticoides en el tejido adiposo facilitan la respuesta lipolítica al AMPc, sin embargo, no ejercen ningún cambio en el perfil lipídico plasmático. Respecto al Ca++, éstos reducen su absorción intestinal, al antagonizar la vitamina D y aumentar su excreción renal. En el estómago mantienen una adecuada producción de ácido clorhídrico. En el espacio renal aumentan la filtración glomerular y la eliminación de ácido úrico, e inducen la reabsorción de Na+ y la excreción de K+ en los túbulos distales. Mantienen el tono vascular por medio de una acción permisiva en el sistema renina-angiotensina y aumenta la sensibilidad a las catecolaminas en el sistema circulatorio.
El sistema nervioso central (SNC) se ve afectado indirectamente por la acción del cortisol, el cual ayuda a mantener un apropiado estado de ánimo y vigilia; la hipótesis planteada es que los glucocorticoides aumentan la excitabilidad neuronal mediada por receptores citoplasmáticos (3).
En el sistema hematopoyético induce la producción de leucocitos y eritrocitos por medio de la estimulación indirecta de la eritropoyetina. Así mismo, reduce:
a. La concentración, distribución y función de linfocitos T (más que de linfocitos B).
b. La cantidad de eosinófilos e histamina liberada por los basófilos.
c. La adherencia, capacidad fagocitaria y citotoxicidad de los monocitos-macrófagos.
d. La síntesis de prostaglandinas y leucotrienos.
El sistema neuroendocrino interactúa con el eje H-H-S regulando la respuesta inflamatoria. Las citoquinas y los mediadores de la inflamación activan receptores periféricos del dolor, sus axones se proyectan al asta dorsal de la médula, donde hacen sinapsis con el tracto lemniscal, el cual lleva señales de dolor al tálamo y la corteza somatosensorial. La activación de esta vía nociceptiva estimula el eje H-H-S (6).
Con lo anteriormente nombrado, se entiende que un aumento suprafisiológico de la concentración de glucocorticoides genera efectos adversos indeseables ampliamente distribuidos en los diferentes procesos.
GLUCOCORTICOIDES SINTÉTICOS
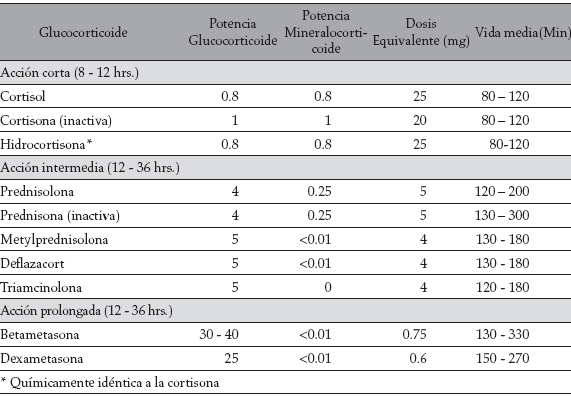
Después de haber explorado el panorama general y los conceptos básicos de los glucocorticoides endógenos, es simple entender las innumerables aplicaciones terapéuticas de los glucocorticoides sintéticos. Existe, en la actualidad,una gran variedad de moléculas de laboratorio, las cuales se asemejan en su núcleo que posee 21 C; pero pequeños cambios, generalmente en sus radicales, las hace diferentes en términos de potencia antiinflamatoria, acción terapéutica y efectos adversos mineralocorticoideos, lo cual impacta de manera importante los resultados terapéuticos, la tolerabilidad y la seguridad de los pacientes (Tabla 1) (2).
Potencia
Aunque la potencia es un término netamente farmacológico, en el manejo de corticoides es importante por su relación directa con los efectos terapéuticos. La potencia en los esteroides hace referencia a la capacidad de éstos para producir efectos sobre el metabolismo de los carbohidratos, la respuestainflamatoria y la dinámica del Na y K. Según lo anterior, los esteroides se han clasificado en glucocorticoides para aquellas moléculas que preferentemente tienen acción sobre los carbohidratos y la inflamación, así como se han llamado mineralocorticoides los que afectan al Na y K.
El cortisol es el referente para el cálculo de la potencia glucocorticoide, mientras que para la potencia mineralocorticoide el referente es la aldosterona.
La eficacia clínica es, entonces, el resultado de esa potencia farmacológica sumado al tiempo que cada molécula logre estar en contacto con el receptor de las células donde el esteroide va a producir el efecto (3).
La potencia antiinflamatoria se mide como la relación entre el efecto (E) producido y la duración de la concentración (C) del fármaco. Esta medición se realiza al observar el cambio en biomarcadores introducidos en un medio celular donde se ha inducido la liberación de fosfolípidos de la membrana citoplasmática, la producción de fosfolipasa A2 y, adicionalmente, los corticoides a los cuales se desea determinar la potencia. A partir de este momento se observa el grado de inhibición de la fosfolipasa A2 y de la ciclooxigenasa 2. El Emax (efecto máximo conseguido) y CE50 (concentración a la que se logra el 50% del máximo efecto) darían lugar a la siguiente fórmula (5):
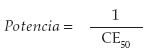
Tabla 1. Moléculas sintéticas corticosteroides

En la práctica clínica es importante tener en cuenta la vida media, así como la potencia glucocorticoide y mineralocorticoide, para lograr el efecto terapéutico deseado en cada condición y disminuir el riesgo de producir eventos adversos (Tabla 2).
Farmacocinética
Los glucocorticoides generalmente son profármacos lipofílicos, que alcanzan una biodisponibilidad del 60% al 100% cuando se administranpor vía oral. Más del 90% de los glucocorticoides se unen reversiblemente a dos proteínas para su distribución; éstas son la albúmina, la cual tiene una alta capacidad de unión, pero baja afinidad por el cortisol, y la transcortina, o también llamada globulina de unión al corticosteroide (CBG), que posee una alta afinidad, pero poca capacidad. Sólo la porción libre de corticoide en sangre obtiene la interfase e interactúa con los receptores de membrana.
El metabolismo de los glucocorticoides es un proceso de dos pasos: en el primero, se adicionan átomos de oxígeno o hidrógeno y, en el segundo, ocurre la conjugación, para posteriormente ser excretados por el riñón en metabolitos inactivos hidrofílicos.
Tabla 2. Tabla comparativa de potencias, tiempo de vida media y dosis equivalentes de corticoides (modificada a partir de 4)
La enzima encargada de controlar la disponibilidad de los glucocorticoides en los receptores de glucocorticoides o mineralocorticoideses la 11 β hidroxiesteroide dehidrogenasa (11β - HSD). La tipo 1 (11β - HSD1) se encuentra bien distribuida en el tejido blanco de los glucocorticoidesy convierte la cortisona inactiva en cortisol, mientras que la tipo 2 (11β - HSD2) está más distribuida en los tejidos blancos de los mineralocorticoides y convierte el cortisol en cortisona; de esta manera, conforma un papel protector para que los receptores de mineralocorticoides no sean ocupados por cortisol. Cuando la capacidad de esta enzima se excede, el efecto de los glucocorticoides aumenta; de esta manera, a dosis bajas de glucocorticoides se esperarían efectos mineralocorticoides reducidos, y a altas dosis de glucocorticoides se esperarían efectos mineralocorticoides aumentados (5).
La influencia de otros fármacos en la farmacocinética de los glucocorticoides: la coadministración de inductores enzimáticos, como barbitúricos, carbamazepina, fenitoína, rifampicina, aumentan la depuración y disminuyen la vida media de la prednisolona y la metilprednisolona. Este concepto es muy importante, ya que en condiciones clínicas en que se utilizan simultáneamente, como en el lupus eritematoso con compromiso del SNC, esta asociación disminuiría la eficacia del corticoide y justificaría dosis más altas de éste. La coadministración de los inhibidores del citocromo p450 como el ketoconazol y la claritromicina disminuyen la depuración y aumentan la vida media de la metilprednisolona y la dexametasona, mientras que la prednisolona no se ve afectada. Sin embargo,la administración de macrólidos a corto plazo no requiere reducción de las dosis de glucocorticoides. Los anticonceptivos orales disminuyen la depuración de prednisolona (5).
Mecanismo de acción
Los glucocorticoides tienen dos vías principales para producir sus efectos:
Mecanismos no genómicos: a dosis altas y de manera rápida, como la alteración de membranas celulares.
Mecanismos genómicos: generados a dosis bajas y de manera lenta; por ejemplo: síntesis de proteínas antiinflamatorias inhibidoras de citoquinas.
Mecanismos no genómicos
Los mecanismos no genómicos están caracterizados por el rápido inicio del efecto < 15 minutos, tiempo en el cual no alcanza a ocurrir transcripción génica ni traducción proteica. Adicionalmente, pueden ser clasificados en mecanismos específicos (cuando los GC interactúan con el RG) y mecanismos inespecíficos (donde no hay interacción con el receptor). El mecanismo no genómico ha sido usado para explicar el aumento del efecto clínico de la terapia de pulso con dosis de GC > 250 mg. El mecanismo no genómico específico está medido por la vía clásica de interacción GC-RG, mientras que el inespecífico se debe a la interacción directa de los glucocorticoides con la membrana celular, que se explica debido a las características lipofílicas de los GC, que hacen que se disuelvan en la membrana celular lipídica y modifiquen las propiedades físico-químicas de ésta, afectando la actividad de las proteínas asociadas a la membrana (2,5,6,7).
Mecanismos genómicos
Los receptores de glucocorticoides pertenecen a una superfamilia que incluye los receptores de hormonas tiroideas, vitamina D, ácido retinoico y hormonas sexuales. Actúan como factores transcripcionales activados por el ligando (la hormona o vitamina correspondiente), que alteran, por diversos mecanismos, la transcripción génica (Figura 2).
Figura 2. Mecanismo de acción genómico de los glucocorticoides
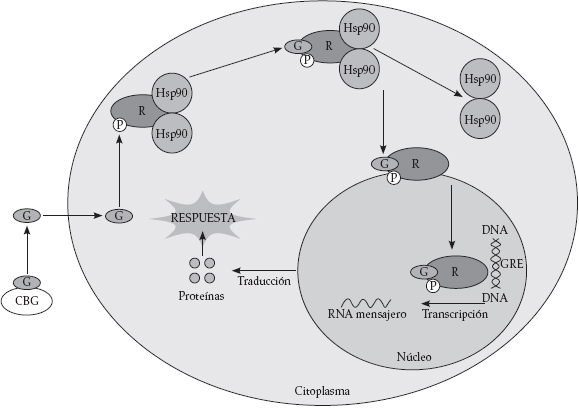
En el espacio plasmático los glucocorticoides (GC) se encuentran ligados a las proteínas ligadoras de glucocorticoides (CBG). Al penetrar el GC al interior celular, en el citoplasma se unen a su receptor específico (R), se dimerizan y se traslocan al núcleo donde ejercen su acción sobre el ADN, se une a secuencias específicas de bases, denominadas elemento de respuesta a glucocorticoides (GRE); de esta manera, actúa sobre el gen promotor, e induce la síntesis de ARN mensajero. Éste sale al citoplasma y es traducido en los ribosomas, para formar proteínas que son secretadas o permanecen dentro de la misma célula, lo que constituye el brazo efector de la respuesta (2,4,5,6,7).
USOS TERAPÉUTICOS
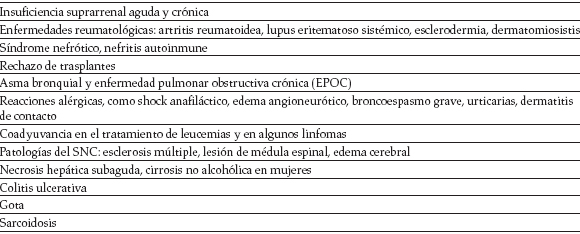
Como antiinflamatorios, los glucocorticoides logran la reducción de la concentración, distribución y función de los leucocitos periféricos, de la síntesis de prostaglandinas, leucotrienos, enzimas proinflamatorias, producción de peróxido por los neutrófilos, eosinófilos e inmunoglobulinas,desencadenando la apoptosis y disminuyen do factores quimiotácticos, como la IL 3, IL5 (7). Causan vasoconstricción, lo que disminuye la permeabilidad capilar, inhibiendo la actividad de kininas, endotoxinas bacterianas y cantidadde histamina liberada por basófilos (4). A continuación se listan algunas de las múltiples indicaciones de los glucocorticoides en la práctica clínica (Tabla 3) (2,3,4).
Tabla 3. Indicaciones de los glucocorticoides en la práctica clínica (3,4)
EFECTOS INDESEADOS DE LOS GLUCOCORTICOIDES
Si la farmacovigilancia de los glucocorticoides se hiciera de manera controlada, se encontrarían muchos más eventos adversos reportados por los pacientes y por los médicos y serían subsecuentemente relacionados con el uso de dichos esteroides. Lo que ocurre en la práctica clínica real es que moléculas de alta potencia y larga duración están generando eventos adversos hasta por doce meses después de su utilización, momento en el cual el paciente no hace la asociación, se obvia el reporte del evento adverso y la retroalimentaciónque los médicos deberían recibir en torno al manejo cuidadoso y racional de los corticoides se pierde en el tiempo.
A continuación describimos los principales efectos indeseables de una terapia a altas dosis, por largo tiempo, o de esquemas terapéuticos inapropiados (4).
1. Aumento de la gluconeogénesis y resistencia a la insulina; esto puede llevar a diabetes mellitus.
2. Aumento del catabolismo proteico; esto puede generar emaciación, osteoporosis y adelgazamiento de la piel.
3. Aumento y redistribución de la grasa corporal: se produce obesidad de predominio central, facie de luna, joroba de búfalo (acumulo dorsal de grasa), pero manteniendo las extremidades relativamente delgadas.
4. Involución del tejido linfático y disminución de la respuesta inflamatoria: se produce una disminución de la inmunidad celular y humoral, con lo que aumenta la susceptibilidad a infecciones.
5. Aumento de la secreción de ácido por el estómago, lo que lleva a una predisposición a úlcera gastroduodenal.
6. Retención de sodio y redistribución de los fluidos corporales, lo que genera edema e hipertensión arterial.
7. Función gonadal: los glucocorticoides afectan la secreción de gonadotrofinas. En los hombres disminuye la concentración de testosterona. En las mujeres, suprime la respuesta de LH a la GnRH, lo que produce supresión de la secreción de estrógenos y progestinas, anovulación y amenorrea.
CONCLUSIONES
Los glucocorticoides son un arsenal terapéutico con una gama de moléculas que se diferencian en potencia, vida media y efectos mineralocorticoides, cada una con indicaciones específicas; su uso está sustentado en la evidencia científica publicada y en los resultados de la práctica clínica.
El balance entre el efecto terapéutico, la seguridad y la tolerabilidad es diferente para cada molécula.
El adecuado análisis de la patología que se va a manejar y del corticoide que se va a usar en virtud de su potencia y duración de acción es responsabilidad del médico, fundamentada en el conocimiento.
REFERENCIAS
1. Glyn J. The discovery and early use of cortisona. J R Soc Med 1998;91:513-7. [ Links ]
2. Guyton A, Hall J. Hormonas corticosuprarrenales. En: Tratado de fisiología médica. 9th Ed. México: McGraw-Hill Interamericana editores; 1997. [ Links ]
3. Hardman J, Limbird L, Ruddon R, Gilman A. Goodman y Gilman´s the pharmacological basis of therapeutics. 10th Ed. New York: McGraw-Hill; 2001. [ Links ]
4. Ibáñez A, Berrocal A, Calvo A. Terapia con glucocorticoides. Diagnóstico 2002;41(4):177-82. [ Links ]
5. Czock D, Keller F, Rasche M, Haussler U. Pharmacokinetics and pharmacodynamics of systemically administered glucocorticoids. Clin Pharmacokinet 2005;44(1):61-98. [ Links ]
6. Rhen T, Cidlowski J. Anti-inflammatory action of glucocorticoids new mechanisms for old drugs. N Engl J Med 2005;353:1711-23. [ Links ]
7. Jares E, Pignataro O. Mecanismos moleculares de acción de los corticoides. Arch Alergia Inmunol Clin 2002;33:9-21. [ Links ]














