Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Ciencias de la Salud
Print version ISSN 1692-7273On-line version ISSN 2145-4507
Rev. Cienc. Salud vol.6 no.1 Bogotá Jan./Apr. 2008
Dispepsia: un real desafío diagnóstico
Dyspepsia: A Great Diagnosis Challenge
Carlos E. Pinzón Flórez, MD,1 John Ospina Nieto, MD2
1. Grupo de Investigaciones Epidemiológicas. Instituto Nacional de Cancerología, Bogotá, Colombia. Correo electrónico: cpinzon@cancer.gov.co, cepinzon@gmail.com
2. Departamento de Gastroenterología, Clínica Cardiovascular del Niño de Cundinamarca. Correo electrónico: johnosni@yahoo.com
Recibido: 15 de septiembre de 2007 Aceptado: 19 de noviembre de 2007
Resumen
La presente es una revisión no sistemática de literatura con la siguiente estrategia de búsqueda: (((((Dyspepsia [Mesh] OR Peptic Ulcer [Mesh]) OR Helicobacter pylori [Mesh]) AND (Diagnosis[Mesh] OR (Therapeutics [Mesh OR therapy [Subheading])) OR Epidemiology [Mesh]. La indagación contempló el periodo comprendido entre los años 1966 y 2007. La estrategia de búsqueda fue adaptada a cada una de las bases de datos consultadas: MEDLINE, COCHRANE, LILACS y SCIELO. Se encontraron, por título y abstract, 689 artículos, a criterio de los autores, de los cuales fueron seleccionados 138 para esta revisión. No se obtuvieron 6 artículos por no tener acceso a los correspondientes journals. El propósito de esta revisión es dar a conocer y aclarar algunos puntos sobre el diagnóstico y tratamiento de la dispepsia.
Palabras clave: dispepsia, úlcera péptica, Helicobacter pylori, diagnóstico y tratamiento.
Summary
We performed a review not systematic of the literature, taking into account the following search strategy: (((((Dyspepsia [Mesh] OR Peptic Ulcer [Mesh]) OR Helicobacter pylori [Mesh]) AND (Diagnosis[Mesh] OR (Therapeutics [Mesh OR therapy [Subheading])) OR Epidemiology [Mesh]. Search was conducted between 1966 to 2007. Search strategy was adapted each of the databases consulted MEDLINE, COCHRANE, LILACS and SCIELO. We were selected 689 articles by title and abstract with authors criteria, of whom 138 were selected for this review. 6 articles were not obtained because we didn't have access to these journals. The aim of this review is to be able to publicize and clarify certain points in the diagnosis and treatment of dyspepsia.
Key word: Dyspepsia, peptic ulcer, Helicobacter pylori, diagnosis, therapeutics.
INTRODUCCIÓN
La dispepsia es un motivo de consulta común, tanto en la externa de medicina general como en la atención especializada. Además, existe un porcentaje elevado de personas que aunque presentan síntomas de dispepsia no acuden al médico y optan por automedicarse. Diversos estudios epidemiológicos nos muestran su alta prevalencia; 15-30% de la población adulta manifiesta de manera intermitente dispepsia; es causal de entre el 5 y el 7% de la consulta al médico general en Gran Bretaña y, en países como Suecia, es el cuarto diagnóstico más común de las consultas médicas [1,2,3].
En la mayoría de los casos, la dispepsia se considera una enfermedad benigna, pero la persistencia y recurrencia de sus síntomas pueden interferir con las actividades diarias de la vida y producir una importante morbilidad. La dispepsia se clasifica en funcional y orgánica, siendo la funcional la de mayor presentación clínica. Las causas orgánicas que pueden explicar los síntomas de la dispepsia son diversas y pueden deberse tanto a una posible patología benigna, como la úlcera péptica, o a patología maligna, como el cáncer gástrico. Todas estas posibilidades hacen que exista controversia en cuanto al manejo del paciente con dispepsia y que las recomendaciones sobre las estrategias iniciales (estudiar o tratar) varíen ampliamente.
DEFINICIÓN
Según los criterios discutidos en la Segunda Reunión Internacional de Roma (Roma II) [4], la dispepsia se define como cualquier dolor o molestia localizado en la parte central de la mitad superior del abdomen. La duración de los síntomas no está especificada [4], aunque, para efectos prácticos, algunos autores consideran que éstos sucedan en por lo menos un 25% del tiempo/días, durante las últimas 4 semanas [1,5].
Este dolor puede estar asociado a una sensación de plenitud en la región abdominal superior, saciedad temprana, distensión abdominal, náuseas y/o vómito [4,6]. Los síntomas pueden ser continuos o intermitentes, y no guardan necesariamente relación con la ingesta de alimentos. El dolor localizado en los hipocondrios no se considera característico de la dispepsia. La pirosis y la regurgitación son síntomas relacionados más con enfermedad por reflujo gastroesofágico (ERGE) [7], por lo cual no se contemplan en la definición de dispepsia de Roma II [4].
Para Roma III, la dispepsia funcional es catalogada como una entidad para la investigación debido a la heterogeneidad de este complejo sintomático. El comité recomienda dos condiciones que están bajo la dispepsia funcional: a) síndrome de molestia postprandial, y b) síndrome de dolor epigástrico. Éstos son similares a dispepsia tipo dismotilidad y dispepsia tipo úlcera de Roma II. En la actualidad se definen más como un complejo de síntomas con soporte fisiológico que como una base en requerimientos previos del síntoma, predominante de molestia epigástrica o dolor, respectivamente [4].
EPIDEMIOLOGÍA
La prevalencia de los síntomas de dispepsia en la población varía entre el 8 y 54%, obteniéndose los porcentajes más elevados a partir de los estudios cuya definición de dispepsia es menos precisa [8]. En general, los estudios epidemiológicos que han estimado la frecuencia de la dispepsia presentan problemas en su operabilidad y metodología [9]. Así mismo, existe una gran variabilidad en la descripción de los síntomas de dispepsia por parte del paciente y en la correspondiente interpretación por parte de los profesionales de la salud [2]. Algunos autores sugieren la posible superposición entre los síntomas de la dispepsia, la ERGE y el síndrome de intestino irritable (SII), además de la presencia de cambios en el predominio de unos u otros síntomas a lo largo del tiempo [6].
Según datos del estudio internacional DIGEST10, la prevalencia de la dispepsia en población general en los últimos 6 meses, cuando se consideran todos los síntomas gastrointestinales localizados en el hemiabdomen superior, es del 40,6%, y cuando se consideran aquéllos de moderada severidad y que, por lo menos, ocurren una vez por semana, se sitúa en el 28,1%. La dispepsia se considera uno de los motivos de consulta más frecuentes en la consulta externa [10]. Sin embargo, se estima que el 50% de las personas que presentan síntomas de dispepsia no acuden al médico y muchas de ellas optan por automedicarse [11,12]. El estudio DIGEST estima que hasta un 27% de las personas que presentan síntomas gastrointestinales altos se automedican con antiácidos y/o antagonistas de los receptores H2 (anti-H2) (Ranitidina) [13]. La etiología más común, tomando como base los resultados de la dispepsia investigada con el procedimiento de endoscopia, es la dispepsia funcional (60%), seguida de la úlcera péptica (15-25%), la esofagitis por reflujo (5-15%) y el cáncer de esófago o el gástrico (<2%) [14,15]. Estudios realizados en nuestro país reproducen este patrón de distribución [16].
En general, la prevalencia de la úlcera péptica, en los últimos 20 años, debido en parte a la erradicación del Helicobacter pylori, ha venido en descenso [10]. Así mismo, la incidencia del cáncer gástrico, en las últimas décadas y en muchos países, incluido Colombia, donde también está disminuyendo [17].
CLASIFICACIÓN Y CAUSAS
Una clasificación de la dispepsia útil para el manejo clínico es la que viene definida por el momento del diagnóstico en que se encuentra [4,2]. Según esto la clasificación será:
– Dispepsia no investigada. Dentro de este grupo entran todos los pacientes que presentan por primera vez síntomas compatibles con dispepsia y aquellos que presentan síntomas recurrentes y a quienes no se ha realizado una endoscopia y no existe un diagnóstico concreto.
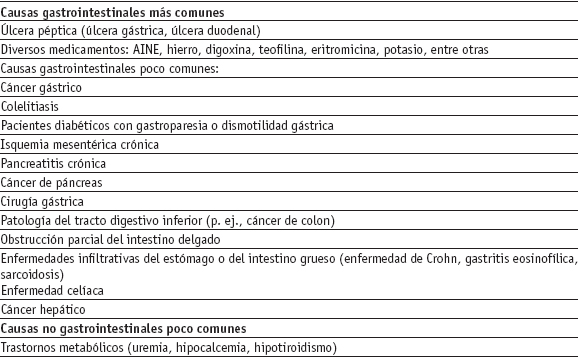
– Dispepsia orgánica. Ingresaran a este grupo los pacientes que presentan causas orgánicas que explican los síntomas de dispepsia y éstas han sido diagnosticadas a partir de pruebas específicas para dicha patología. Se han identificado diversas causas de dispepsia orgánica [3], las cuales se enuncian en la tabla 1. La úlcera péptica no es la única causa de dispepsia orgánica, por lo que se debe evitar el término de dispepsia ulcerosa como sinónimo de dispepsia orgánica.
– Dispepsia funcional. Cuando tras realizar pruebas diagnósticas (incluida la endoscopia) no se observe ninguna causa orgánica o proceso que justifique la sintomatología actual. En este caso no es apropiado el término de dispepsia no ulcerosa, ya que ésta es un diagnóstico de exclusión, una vez descartadas las diversas enfermedades orgánicas posibles.
FACTORES DE RIESGO PARA LA DISPESIA FUNCIONAL
Los trastornos psiquiátricos han presentado una asociación significativa con la dispepsia funcional [18,19]. Se ha establecido que existe una asociación entre los diversos problemas de salud mental (ansiedad, depresión, neurosis, estrés crónico, hostilidad, hipocondriasis, crisis de pánico, entre otros) y la dispepsia funcional [6,18,20-22].
La infección por H. pylori parece no jugar un papel primordial en la dispepsia funcional [23-25]. La evidencia disponible en la literatura indica que no existe una asociación estadísticamente significativa entre esta bacteria y la dispepsia funcional, pero esta evidencia no es suficiente para confirmar o negar la existencia de una asociación [24]. Para determinados factores de riesgo, los resultados disponibles son controversiales, mientras que algunos estudios han demostrado asociación con el café [26,27], el tabaco [27], la obesidad [28], el estrés [22] y los estratos socioeconómicos bajos [29].
Tabla 1. Causas de dispepsia orgánica
FACTORES DE RIESGO PARA LA ÚLCERA PÉPTICA
Según los resultados de una revisión sistemática [30], los antiinflamatorios no esteroideos (AINE), la infección por H. pylori y el consumo de cigarrillo son los factores de riesgo identificados con mayor asociación con el desarrollo de una úlcera péptica. Existe acuerdo en que los AINE incrementan el riesgo de dispepsia y úlcera péptica [3,31-33]. Así mismo, los AINE producen hasta un 5% de las úlceras duodenales y un 30% de las gástricas [34]. En la patogenia de la úlcera péptica ya ha sido establecido el papel del H. pylori [3,30]. En el 95% de las úlceras duodenales y en el 80% de las gástricas fue identificado el H. pylori en los primeros estudios acerca del tema, aunque, en la actualidad, estos porcentajes son más bajos y su tendencia es hacia la baja [35]. Los estilos de vida y las condiciones socioeconómicas precarias y desfavorables han mostrado una asociación con el incremento del riesgo de la infección por H. pylori [36]. Otros factores como el género, la edad, la historia personal o familiar de úlcera, los estilos de vida no saludables y la utilización crónica, incluso a dosis bajas, de ácido acetilsalicílico (AAS), también se han asociado a la úlcera péptica y sus complicaciones [3]. Los antecedentes de úlcera péptica aumentan la probabilidad de un nuevo episodio de dispepsia debido a una úlcera recurrente [34].
La historia familiar de úlcera gástrica puede ser importante si existe una infección por H. pylori a nivel familiar [3]. La ingesta esporádica de AAS produce lesiones agudas de la mucosa gastroduodenal, pero ésta, pocas veces, tiene importancia clínica [34]. El alcohol y el tabaco se han asociado con un incremento del riesgo de sangrado o perforación de una úlcera péptica [34,37].
FACTORES DE RIESGO PARA EL CÁNCER
Desde el año de 1994, el H. pylori es considerado como un carcinógeno tipo I por la Agencia Internacional para la Investigación del Cáncer (IARC) [38]. La infección por H. pylori está asociada con el proceso carcinogénico del adenocarcinoma gástrico y del linfoma tipo tejido linfoide asociado a la mucosa (MALT) [39]. Sin embargo, la patogenia de este tipo de tumores es un proceso multifactorial que también incluye otros factores como la ingesta de sal y la presencia de nitrato (condimentos, consumo de tubérculos) y otros componentes químicos en los alimentos [39].
HISTORIA CLÍNICA
Una historia clínica minuciosa debe guiar a la hora de establecer un probable diagnóstico entre las diferentes etiologías gastrointestinales o sistémicas de la dispepsia (tabla 1). En ocasiones, una valoración inicial adecuada permitirá sospechar la presencia de otras enfermedades y descartar aquellas que también se presentan con síntomas compatibles con la dispepsia, como es la ERGE y el SII [40].
Se debe tener en cuenta la información sobre características del dolor, existencia de posibles factores de riesgo medioambientales (dieta, hábito tabáquico y consumo de alcohol), ingesta de fármacos (sobre todo AINE), antecedentes personales de úlcera péptica, cirugía gástrica e infección por H. pylori e historia familiar de úlcera péptica. Inicialmente es necesario valorar también la presencia o no de signos y síntomas de alarma y la edad del paciente [41].
El examen físico del paciente dispéptico presenta un pobre valor diagnóstico. Los estudios que lo han evaluado [40-42] muestran que la presencia del dolor epigástrico a la palpación no permite diferenciar entre los pacientes que presentan una úlcera péptica y los que no. Sin embargo, determinados hallazgos en el examen físico (palpación de masa abdominal, adenopatías y mucosas pálidas que sugieren anemia, o amarillas sugestivas de ictericia, etc.) son útiles para diferenciar entre dispepsia funcional, dispepsia orgánica u otras patologías.
A partir de la anamnesis realizada por medio de la historia clínica, la validez del diagnóstico clínico de presunción para las diferentes etiologías de dispepsia por parte del médico es baja, situándose alrededor del 55-60% [42,43]. Este porcentaje aumenta cuando se trata de pacientes con dispepsia funcional, ya que la prevalencia es más elevada, lo cual conlleva un mayor valor predictivo positivo (VPP) (alrededor del 70- 75%) [43]. Por el contrario, el VPP para la dispepsia orgánica es más bajo (30%). Estos resultados indican que la probabilidad de diagnosticar una dispepsia funcional es mucho más alta que en el caso de la dispepsia orgánica [42]. El elevado valor predictivo negativo (VPN) para la dispepsia orgánica (90-95%), comparado con el de la dispepsia funcional [40-45%], permite confirmar con mayor certeza la ausencia de patología orgánica asociada [42]. Así mismo, la variabilidad entre los profesionales a la hora de valorar los síntomas y los signos de dispepsia es amplia [43-46], y los diagnósticos de sospecha de los médicos de consulta médica externa y valoración especializada no siempre coinciden [43].
La escasa validez e imprecisión de los síntomas y signos de la dispepsia para diferenciar una funcional de una orgánica han llevado a desarrollar medidas de evaluación más complejas (escalas de puntuación de signos y síntomas) [7]. Estas medidas integran y dan peso a los diferentes síntomas y signos, antecedentes y factores de riesgo, recolectados mediante encuestas y test con el objetivo de seleccionar a aquellos pacientes con mayor probabilidad de presentar una patología orgánica. Es el caso del modelo predictivo para la dispepsia orgánica, diseñado por el grupo de la Asociación Española de Gastroenterología que, a la vez, hace parte del Centro Iberoamericano Cochrane. Ellos tomaron factores innatos del individuo como son: edad, género y peso; factores de riesgo medioambientales (alcohol, tabaco e ingesta de AINE), síntomas (pirosis, dolor epigástrico, alivio del dolor) y antecedentes de historia de úlcera péptica. Cuando la suma de los diferentes puntajes arroja un resultado mayor o igual que 7, se deberá remitir para estudio por endoscopia [7].
Signos y síntomas
Se consideran signos y síntomas de alarma en un paciente con dispepsia: la pérdida de peso significativo no intencionado, el vómito recurrente, la disfagia, el sangrado digestivo (hematemesis, melenas, anemia crónica) y la presencia de una masa abdominal palpable en el examen físico [47]. En el caso del cáncer gástrico, varios estudios retrospectivos han demostrado que prácticamente en la totalidad de los pacientes con dispepsia se presenta por lo menos un síntoma de alarma en el momento del diagnóstico [48-52].
Edad
En la mayoría de las revisiones de la literatura, las guías de práctica clínica y los documentos de consenso se recomienda realizar endoscopia a todos los pacientes dispépticos con edad igual o superior a 40 años [5,53,54]. Esta recomendación surge de la relación que guarda el progresivo aumento de la incidencia de cáncer gástrico con la edad [55]. Los ensayos clínicos aleatorizados que actualmente han comparado diferentes estrategias del manejo de la dispepsia no tienen un suficiente poder estadístico para indicar un límite de edad en la detección oportuna de los pacientes con diagnóstico de cáncer gástrico [56-58].
Dispepsia no investigada
El siguiente paso es tomar la decisión de investigar la posible existencia de una patología orgánica o lesión que justifique los síntomas (endoscopia, detección de la infección por H. pylori) o iniciar un tratamiento empírico [59]. Las recomendaciones sobre la posible estrategia inicial varían según las políticas de los países, las áreas geográficas y las sociedades científicas, entre otros; posiblemente no existe ninguna estrategia ideal aplicable en todos los casos. Independientemente de estas estrategias, y a pesar de que no existen estudios que demuestren la eficacia de las medidas de prevención primaria (dieta e higiene personal) o del tratamiento sintomático, en la consulta externa por medicina general, la mayoría de los pacientes con dispepsia son manejados a partir de un diagnóstico sindromático [59-63]. Existen datos que muestran que más de la mitad de los pacientes tratados de forma empírica con antisecretores, acuden a la consulta por estos síntomas una única vez durante el mismo año de tratamiento [64].
Tratamiento empírico antisecretor
En los últimos años y hasta la incorporación de la detección temprana no invasiva y el tratamiento del H. pylori, la terapéutica empírica ha sido la estrategia más utilizada [59]. Esta estrategia tiene un bajo costo, permite el alivio rápido de los síntomas y, en muchos casos, su remisión; además, optimiza y evita la realización de endoscopias innecesarias. Entre sus riesgos se ha de considerar la posible demora diagnóstica de patologías orgánicas en un pequeño grupo de pacientes y el retraso de un tratamiento efectivo de erradicación del H. pylori en quienes presenten una úlcera péptica [61].
Este tipo de terapéutica contempla el tratamiento con inhibidores de la bomba de protones (IBP), anti-H2 o procinéticos. Los IBP, comparados con los anti-H2 y con los antiácidos, presentan una mayor eficacia en la resolución de los síntomas según resultados de una revisión sistemática [65-67], con unos RR calculados a partir de los datos originales de 1,62 (IC del 95%: 1,40-1,87) y 1,48 (IC del 95%: 1,30-1,68), respectivamente. Un 40% de los pacientes mejoraron con anti-H2 y antiácidos, y un 20% adicional mejoraron con los IBP. No se encontraron diferencias entre anti-H2 y antiácidos, entre IBP (omeprazol) y procinéticos (cisaprida), ni entre los distintos IBP. No se han encontrado diferencias significativas en el manejo de la dispepsia entre los anti-H2 y procinéticos [68]. No obstante, los posibles efectos adversos cardíacos de la cisaprida restan relevancia a estos resultados. En cuanto a la cinitaprida, no existen datos suficientes que permitan conocer su eficacia en este contexto. A pesar del cuestionado valor de los diferentes subgrupos de síntomas de la dispepsia, algunos estudios tienen en cuenta la posible causa subyacente a la hora de seleccionar el tipo de tratamiento empírico [69,70] . Los anti-H2 y los IBP serían de elección ante los síntomas que sugieren relación con la secreción ácida (tipo ulceroso) y los procinéticos, cuando sugieren un trastorno de motilidad. En este sentido, los resultados de un reciente ensayo clínico con todas las características de rigor [71] con cuatro diferentes opciones de tratamiento empírico,4 brazos de estudio (con omeprazol, con procinéticos; a partir de los síntomas con anti-H2 o con procinéticos) concluyen que los síntomas guía podrían ser útiles a la hora de escoger la terapia empírica. A pesar de que no existen estudios sobre la duración óptima del tratamiento con IBP, en general, éste se realiza durante 4 semanas por consenso médico y mejoría clínica. Al finalizar este período se ha de valorar si los síntomas han cesado, en cuyo caso, se interrumpirá el tratamiento. Si no existe mejora o ésta es parcial, el tratamiento se prolongará durante otras 4 semanas. Cuando los síntomas no mejoran tras 8 semanas de tratamiento, es necesario indagar su causa con otras estrategias diagnósticas [2,5,66,72].
PRUEBAS DIAGNÓSTICAS PARA LA DISPEPSIA
En nuestro medio, según señala el único estudio de costo-efectividad disponible [72], la estrategia inicial basada en el tratamiento empírico antisecretor podría ser el más costo-efectivo posible. No obstante, en determinados pacientes (debido a síntomas de dispepsia acompañados de signos y síntomas de alarma o por el hecho de tener más de 55 años, o fracaso en el tratamiento empírico antisecretor inicial), es necesario indagar antes de tomar alguna decisión terapéutica [7]. A continuación se revisan las diferentes técnicas y las pruebas diagnósticas disponibles para identificar o, por lo menos, presumir la causa de la dispepsia.
Endoscopia
La endoscopia se considera la prueba de referencia para iniciar la investigación de las lesiones de la mucosa gástrica; además, permite tomar muestras para biopsia o detección del H. pylori, si es necesario. La endoscopia es una prueba con un elevado rendimiento diagnóstico para úlcera péptica, lesiones premalignas y cáncer gástrico (especificidad del 96%) [73]. La realización de una endoscopia da una luz a la posible causa de los síntomas dispépticos; en algunos casos se ha podido identificar que sólo el hecho de realizar el procedimiento endoscópico ofrece mejoría clínica por la tranquilidad que representa una endoscopia negativa para el paciente, pero tiene un costo elevado, y no todos los pacientes tienen acceso [74].
Cuando la endoscopia realizada a los pacientes con síntomas de dispepsia descarta la presencia de una causa orgánica y ésta se ha realizado sin demoras importantes y en ausencia de tratamiento antisecretor prolongado, se realizará el diagnóstico de dispepsia funcional por exclusión. No obstante, en presencia de signos y síntomas sugestivos, se deben investigar otras causas de dispepsia (tabla 1).
Los resultados de una revisión sistemática Cochrane con un RR calculado a partir de los datos originales de: 1,08 (IC del 95%: 0,99-1,17) [67], otras revisiones [75], algunos ensayos clínicos aleatorizados realizados posteriormente [76,77] y estudios observacionales analíticos [78] no apoyan la superioridad de estrategias terapéuticas basadas en la endoscopia inicial frente al tratamiento empírico en los pacientes con dispepsia no investigada. No obstante, la heterogeneidad de los estudios y su baja calidad dificultan la interpretación de estos resultados [75]. Además, estos estudios no son relevantes en la práctica clínica actual, ya que el papel del H. pylori ha modificado en los últimos años el manejo de esta enfermedad.
Radiología de contraste
Aunque no se dispone de estudios que comparen la radiología de contraste y la endoscopia, los diferentes estudios disponibles muestran un menor rendimiento en dichas pruebas diagnósticas (especificidad del 70%) [79] tanto para la detección de las úlceras pépticas [80] como de las erosiones duodenales [79]. En las lesiones de menor tamaño se observa con mayor preocupación el menor rendimiento operativo de estas pruebas [79-81]. Además, con esta prueba se somete al paciente a una radiación considerable [82]. La realización de esta prueba, a pesar de su amplia utilización en la consulta externa de medicina general (40%) [35], únicamente se podría justificar en aquellos pacientes que se niegan a someterse a una endoscopia, incluso con anestesia.
DETERMINACIÓN DE LA INFECCIÓN POR HELICOBACTER PYLORI
La principal razón para evaluar la presencia del H. pylori es predecir qué pacientes tendrán una úlcera péptica asociada a esta infección. El descubrimiento de esta bacteria, hace más de dos décadas, ha cambiado el manejo de la dispepsia y fundamentalmente el de la úlcera péptica. Si excluimos las úlceras debidas a la ingesta de los AINE, el H. pylori está asociado prácticamente a la totalidad de las úlceras pépticas (el 95% a la duodenal y el 80% a la gástrica) [35]. No obstante, la mayoría de pacientes con síntomas de dispepsia e infectados por el H. pylori no presentan una úlcera péptica. Las estrategias que incluyen la identificación inicial de la infección por H. pylori son: la detección del H. pylori y endoscopia (test and scope) y la detección del H. pylori y tratamiento de erradicación (test and treat). Estas estrategias tienen en cuenta la detección del H. pylori mediante métodos no invasivos [36].
Pruebas para la detección de la infección por Helicobacter pylori
Las pruebas de investigación del H. pylori se utilizan como método diagnóstico para confirmar su erradicación. El método de elección para su detección en los pacientes dispépticos dependerá de si a éstos se les debe o no realizar una endoscopia diagnóstica. Los test realizados a partir de la endoscopia, con o sin biopsia, se consideran métodos invasivos, e incluyen: el test rápido de la ureasa, la histología y el cultivo. Entre los métodos no invasivos se encuentran: la prueba del aliento de urea, la serología, la detección de antígenos en heces y la detección de inmunoglobulinas tipo G (IgG) específicas en orina y saliva. La prueba del aliento con urea C13 es el método diagnóstico no invasivo de elección en los pacientes dispépticos y el test rápido de la ureasa en los pacientes que precisan una endoscopia [36,83].
La serología podría tener un papel en el diagnóstico para la detección del H. pylori, especialmente en poblaciones con prevalencias altas [84]. Para evitar falsos negativos, tanto en los métodos invasivos como en la prueba del aliento con urea C13, es necesario evitar la toma de fármacos antisecretores, en especial con los inhibidores de bomba de protones (IBP) durante las 2 semanas previas; en el caso de los antibióticos, durante las 4 semanas previas al examen [85-89].
TRATAMIENTO DE ERRDICACIÓN DEL HELICOBACTER PYLORI
La estrategia de investigación del H. pylori y el tratamiento de erradicación beneficia a la mayoría de pacientes con úlcera, y podría favorecer a algunos pacientes con linfoma MALT y, probablemente, a los pacientes con una historia familiar de cáncer gástrico [90-92] . No obstante, esta estrategia conlleva tratar tanto a los pacientes con úlcera péptica como con dispepsia funcional; actualmente se considera que la erradicación del H. pylori ejerce un papel poco importante en estos pacientes [35,93]. Además, el tratamiento de erradicación no evita que casi la mitad de los pacientes con úlcera vuelvan a presentar síntomas después de la curación [93-95] y podría generar un aumento importante en la resistencia microbiana a los antibióticos.
La estrategia de sospecha clínica de infección por H. pylori y tratamiento de erradicación es menos efectiva en los servicios de consulta médica general o programas de prevención primaria [95], ya que los síntomas de dispepsia, sobre todo cuando la tasa de infección por H. pylori es elevada, discriminan poco la presencia de úlcera péptica. En este sentido, algunos estudios indican que la detección del H. pylori en los pacientes que consultan por síntomas de dispepsia en la consulta general y en zonas donde la prevalencia es alta, como es el caso de Colombia (90%), no añade valor a la historia clínica [16,96,97]. La estrategia también resulta menos efectiva, a medida que en algunos medios la prevalencia de úlcera y de infección por H. pylori en la población general están disminuyendo [98], (efecto cohorte). Debido a esta problemática, la Sociedad Europea de Gastroenterología en Atención Primaria recomendó reservar la detección y el tratamiento del H. pylori para los pacientes con alteraciones endoscópicas documentadas [99]. En los servicios de consulta externa, casi no se utilizan las estrategias que incluyen los estudios iniciales para la detección del H. pylori [60-63]. Un reciente estudio en España [60] señala que más de la mitad de los médicos de atención primaria (AP) nunca han estudiado la presencia del H. pylori en un paciente dispéptico. Otro estudio europeo confirma resultados similares [100].
Las actuales controversias acerca de la detección del H. pylori en los servicios de consulta externa de nuevo han dado gran importancia a la historia clínica y a las escalas de puntuación de signos y síntomas para la selección de los pacientes con patología orgánica [16,95,101]. Otros autores han propuesto como alternativa del tratamiento empírico, seguido [93] o no [71] de la detección del H. pylori en aquellos pacientes en los que no se observa mejoría.
Tratamiento empírico de erradicación del Helicobacter pylori
La estrategia del tratamiento de erradicación empírico se ha planteado como opción terapéutica en algunos medios en los que la prevalencia de úlcera duodenal es muy elevada. Esta estrategia lleva consigo el tratamiento de erradicación sin previa confirmación diagnóstica de la infección por H. pylori. Esta opción sólo estaría justificada en aquellos pacientes con úlcera duodenal (el 95% asociadas a H. pylori) o con antecedentes de úlcera duodenal que vuelve a ser sintomática o que requieren tratamiento antisecretor (IBP) a largo plazo [67,70].
Erradicación del Helicobacter pylori en la úlcera péptica
El tratamiento erradicador de los pacientes infectados por el H. pylori se ha mostrado superior al tratamiento antisecretor en la cicatrización, tanto a corto como a largo plazo, y en la reducción de las recidivas ulcerosas [102,103]. Así mismo, disminuye el tiempo para conseguir la cicatrización [104] y el riesgo de sangrado por úlcera duodenal [105] . En los pacientes con úlcera duodenal sangrante, el tratamiento erradicador comparado con el no erradicador reduce el riesgo de sangrado recurrente en los siguientes 12 meses de forma significativa [106]. En el caso de la úlcera duodenal, la fuerte asociación causal hace que no sea primordial investigar la presencia de infección por H. pylori. En la úlcera gástrica, con una asociación menos fuerte, es recomendable confirmar la infección previamente en todos los casos [107]. No obstante, el hecho de que los porcentajes de asociación entre infección por el H. pylori y la úlcera péptica estén disminuyendo podría modificar la epidemiología y, por consiguiente, las conductas diagnósticas y terapéuticas en un futuro.
Pautas para la erradicación del Helicobacter pylori
La terapia de erradicación debe ser efectiva (tasa de erradicación superior al 80%) [54,99], tener pocos efectos adversos y ser de fácil cumplimiento por parte del paciente [5,54,99,108,109]. Actualmente no se dispone de revisiones sistemáticas o estudios clínicos sobre las diferentes pautas de erradicación, cuyo objetivo primario haya sido valorar su efecto sobre la sintomatología dispéptica, la calidad de vida o la mortalidad [103]. La más utilizada es la pauta basada en la triple terapia, e incluye un inhibidor de bomba de protones (IBP) o ranitidina-citrato de bismuto (RCB) más 2 de los siguientes antibióticos: claritromicina, amoxicilina o metronidazol [109-112]. La asociación de amoxicilina y metronidazol presenta resultados inferiores de erradicación, comparado con las otras combinaciones de antibióticos [113]. Dentro de los IBP, el más utilizado es omeprazol, pero también lansoprazol, pantoprazol [110], rabeprazol [114-116] y esomeprazol [117-119] han mostrado ser eficaces, pero sus costos son superiores al omeprazol. La estrategia que contempla la terapia cuádruple se recomienda en caso de fracaso de erradicación, e incluye un IBP más metronidazol y una tetraciclina y subcitrato de bismuto [110]. Los tratamientos con sólo dos fármacos se han mostrado menos eficaces, y actualmente no se contemplan como terapia de primera línea [120,121]. Los efectos adversos, aunque frecuentes (aproximadamente el 30%) [108], suelen ser leves y causa de una pequeña tasa de abandonos terapéuticos por parte del paciente [111]. A corto plazo, los efectos más frecuentes son: el bismuto puede provocar diarrea leve y cambios en el color de las heces [111], como las alteraciones gastrointestinales (náuseas, dolor abdominal, diarreas, disgeusia), producidos por los antibióticos, sobre todo la claritromicina y el metronidazol. Para mejorar la adherencia al tratamiento es conveniente advertir al paciente sobre la existencia y la probable aparición de estos efectos secundarios y explicarle la importancia de un adecuado cumplimiento del tratamiento. En relación con la duración del tratamiento, la pauta triple de una semana [108,110,122,123], aunque ligeramente menos eficaz a la de 14 días, es la más aceptada por su mayor simplicidad, mejor adherencia y un menor número de efectos secundarios. Además, presenta mejor costo-efectividad [110]. En cuanto al esquema cuádruple, una revisión sistemática confirmó que los regímenes de 2 semanas frente a una semana no incrementan la tasa de erradicación [120].
Tratamiento erradicador de primera línea
El esquema más recomendado (tabla 2) es la que combina un IBP con claritromicina y amoxicilina, durante una semana [5,108,110]. De manera alternativa puede utilizarse ranitidina- citrato de bismuto en vez del IBP. En los pacientes alérgicos a la penicilina, se recomienda reemplazar amoxicilina por metronidazol [113]. La razón para no emplear inicialmente la pauta con metronidazol consiste en que las resistencias bacterianas secundarias son frecuentes tras el fracaso del tratamiento, de modo que su uso podría afectar la eficacia de la terapia de segunda línea. En la práctica clínica no parece necesaria la realización rutinaria de un cultivo previo a la administración del tratamiento erradicador de primera línea [110]. No obstante, es recomendable que los laboratorios de referencia realicen cultivos rutinarios puntuales para conocer las cepas bacterianas existentes en la población en relación con la proteína citotóxica (Cag A) y la proteína vacuolizante (Vac A); además, tanto de la prevalencia de las resistencias como de la influencia de éstas en la eficacia terapéutica [110]. En España, la resistencia a la claritromicina se estima alrededor del 12% y al metronidazol del 25%, con amplias variaciones, según los estudios [122,23], mientras que las resistencias a la amoxicilina o tetraciclina son raras.
Fracaso inicial del tratamiento erradicador
Las causas más frecuentes del fracaso de la terapia de erradicación del H. pylori son las resistencias a los antibióticos, seguidas por una mala adherencia al tratamiento por parte del paciente y una mala prescripción de la posología por parte del médico [124]. En general, las estrategias más complejas han mostrado peores resultados [105].
Cuando el tratamiento inicial de primera línea fracasa, se recomienda utilizar el esquema de terapia cuádruple, con IBP, subcitrato de bismuto, metronidazol y tetraciclina, durante 7 días [103]. En la práctica médica no parece necesaria la realización rutinaria del cultivo previamente a la administración del tratamiento erradicador tras el fracaso de éste, debido a la elevada eficacia obtenida al administrar en estos casos un tratamiento empírico cuádruple [103].
Tabla 2. Tratamiento erradicador del Helicobacter pylori
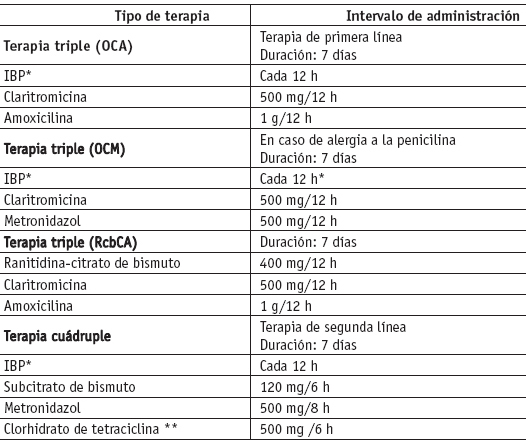
* Omeprazol (20 mg/12 h), lansoprazol (30 mg/12 h), pantoprazol (40 mg/12 h), rabeprazol (20 mg/12 h) y esomeprazol (20 mg/12 h) muestran una eficácia similar.
** La doxiciclina no está indicada.
Seguimiento posterior al tratamiento erradicador
El seguimiento posterior al tratamiento de erradicación del H. pylori dependerá del tipo de patología subyacente y de las terapias de erradicación previamente utilizadas.
Control tras el tratamiento de la infección por Helicobacter pylori
En caso de precisarse, la prueba del aliento con urea C13 se considera el método de elección para la confirmación de la erradicación de la infección en pacientes con úlcera duodenal, ya que una vez que el H. pylori ha desaparecido, cesa completamente la producción de ureasa [125].
A pesar de que la detección de los antígenos en heces es una prueba que ha demostrado una alta efectividad diagnóstica [88], sus resultados contradictorios entre múltiples estudios y su limitada accesibilidad, por sus costos, en la actualidad, no permiten equipararla a la prueba del aliento. La variabilidad en la desaparición de los anticuerpos en sangre una vez erradicado el H. pylori hacen que la serología no sea recomendable para el control de la efectividad del tratamiento erradicador. En el caso de úlcera gástrica, dado que se precisa repetir la endoscopia para comprobar la cicatrización, puede realizarse el test rápido de la ureasa para confirmar la erradicación.
Úlcera péptica
El H. pylori ha demostrado un papel importante en la patogenia de la úlcera péptica, ha transformado su enfoque diagnóstico y, por consiguiente, su manejo en las últimas dos décadas [31-33]. Actualmente existe consenso internacional, tanto en las distintas revisiones sistemáticas [102,126-129] como en las guías de práctica clínica [5,125,130] y conferencias de consenso [52,103,129] acerca de la eficacia de la erradicación del H. pylori en los pacientes con úlcera péptica. La infección por H. pylori está presente en un 95% de los pacientes con úlcera duodenal y hasta en un 80% de los pacientes con úlcera gástrica, y aunque las tendencias de su presentación son hacia la baja [35], la erradicación del microorganismo ha sido eficaz en ambos tipos de patologías [132]. La duodenitis erosiva se considera un equivalente a la úlcera duodenal y debe ser tratada como esta condición.
AGRADECIMIENTOS
Agradecemos al Instituto Nacional de Cancerología por prestar sus instalaciones para la redacción y desarrollo de este artículo.
REFERENCIAS
1. Institute for Clinical Systems Improvement. Health Care Guideline: Dyspepsia. Institute for Clinical Systems Improvement, 2002. http://www.icsi.org/guide/Dyspep.pdf. [ Links ]
2. Veldhuyzen van Zanten SJO, Flook N, Chiba N, Armstrong D, Barkun A, Bradette M et al, for the Canadian Dyspepsia Working Group. An evidence-based approach to the management of uninvestigated dyspepsia in the era of Helicobacter pylori. CMAJ 2000; 162 (Supl. 12):3-23. [ Links ]
3. Kellow JE. Organic causes of dyspepsia, and discriminating functional from organic dyspepsia. Best Pract Res Clin Gastroenterol 2001;15:477-487. [ Links ]
4. Drossman DA. Senior Editor. Rome III. The functional gastrointestinal disorders. 3rd Ed. Virgina, USA. Degnon Associates, Inc. Mc Lean; 2006. p 887-936. [ Links ]
5. Aymerich M, Baena JM, Boix C, Carrillo R, Madrilejos R, Mascort JJ et al. Dirección clínica en l'atenció primària. Dispepsia - H. pylori. Guies de pràctica clínica i material docent. http://www.gencat.net/ics/professionals/guies/dispepsia/dispepsia.htm. [ Links ]
6. Agreus L. Natural history of dyspepsia. Gut 2002; 50 (Supl. 4):2-9. [ Links ]
7. Grupo de trabajo de la guía de práctica clínica sobre ERGE. Manejo del paciente con enfermedad por reflujo gastroesofágico (ERGE). Guía de práctica clínica. Barcelona: Asociación Española de Gastroenterología, Sociedad Española de Medicina de Familia y Comunitaria y Centro Cochrane Iberoamericano; 2001. Programa de Elaboración de Guías de Práctica Clínica en Enfermedades Digestivas, desde la Atención Primaria a la Especializada: 1. http://www.guiasgastro.net. [ Links ]
8. Heading RC. Prevalence of upper gastrointestinal symptoms in the general population: a systematic review. Scand J Gastroenterol Suppl 1999;231:3-8. [ Links ]
9. SBU-The Swedish Council on Technology Assessment in Health Care. Stomach pain-evidence ased methods in the diagnosis and treatment of dyspepsia. Stockholm, 2000. [ Links ]
10. Schwartz MD. Dyspepsia, peptic ulcer disease, and esophageal reflux disease. West J Med 2002;176:98-103. [ Links ]
11. Talley NJ. Dyspepsia: management guidelines for the millennium. Gut 2002;50 (Supl. 4):72-78. [ Links ]
12. Bazaldua OV, Schneider FD. Evaluation and management of dyspepsia. Am Fam Physician 1999;60:1773-1788. [ Links ]
13. Haycox A, Einarson T, Eggleston A. The health economic impact of upper gastrointestinal symptoms in the general population: results from the Domestic/International Gastroenterology Surveillance Study (DIGEST). Scand J Gastroenterol Suppl 1999;231:38-47. [ Links ]
14. Talley NJ, Silverstein MD, Agreus L, Nyren O, Sonnenberg A, Holtmann G. AGA technical review: evaluation of dyspepsia. American Gastroenterological Association. Gastroenterology 1998;114: 582-595. [ Links ]
15. Fisher RS, Parkman HP. Management of non ulcer dyspepsia. N Engl J Med 1998;339:1376-1381. [ Links ]
16. Barenys M, Abad A, Pons JM, Moreno V, Rota R, Granados A et al. Scoring system has better discriminative value than Helicobacter pylori testing in patients with dyspepsia in a setting with high prevalence of infection. Eur J Gastroenterol Hepatol 2000;12:1275-1282. [ Links ]
17. Ferlay J, Bray F, Pisani P, Parkin DM. GLOBOCAN 2000: cancer incidence, mortality and prevalence worldwide, Version 1.0.IARC Cancer Base n.º 5. Lyon, IARC Press, 2001. Limited version available from: http://www-dep.iarc.fr/globocan/globocan.htm. Last updated on 03/02/2001. [ Links ]
18. Olden KW. Are psychosocial factors of aetiological importance in functional dyspepsia? Baillieres Clin Gastroenterol 1998;12:557-571. [ Links ]
19. Olden KW, Drossman DA. Psychologic and psychiatric aspects of gastrointestinal disease. Med Clin North Am 2000;84:1313-1327. [ Links ]
20. Kay L, Jorgensen T. Epidemiology of upper dyspepsia in random population. Prevalence, incidence, natural history and risk factors. Scan J Gastroenterol 1994;29:1-7. [ Links ]
21. Yuyuan LI, Yuqiang NIE, Weihong SHA, Hua SU. The link between social psychosocial and functional dyspepsia: An epidemiological study. Chin Med J 2002;115:1082-1084. [ Links ]
22. Stanghellini V. Relationship between upper gastrointestinal symptoms and lifestyle, psychosocial factors and comorbidity in the general population: results from the Domestic/ International Gastroenterology Surveillance Study (DIGEST). Scand J Gastroenterol Suppl 1999;231:29-37. [ Links ]
23. Pantoflickova D, Blum AL, Koelz HR. Helicobacter pylori and functional dyspepsia: a real causal link? Bailleres Clin Gastroenterol 1998;12:503-532. [ Links ]
24. Danesh J, Lawrence M, Murphy M, Roberts S, Collins R. Systematic review of the epidemiological evidence on Helicobacter pylori infection and nonulcer or uninvestigated dyspepsia. Arch Intern Med 2000;160:1192-1198. [ Links ]
25. Bazzoli F, De Luca L, Pozzato P, Zagari RM, Fossi S, Ricciardiello L et al. Helicobacter pylori and functional dyspepsia: review of previous studies and commentary on new data. Gut 2002;50 (Supl. 4):33-35. [ Links ]
26. Elta GH, Behler EM, Colturi TJ. Comparison of coffee intake and coffee-induced symptoms in patients with duodenal ulcer, nonulcer dyspepsia, and normal controls. Am J Gastroenterol 1990;85:1339-1342. [ Links ]
27. Nandurkar S, Talley NJ, Xia H, Mitchell H., Hazel S, Jones M. Dyspepsia in the community is linked to smoking and aspirin use but not to Helicobacter pylori infection. Arch Intern Med 1998;158: 1427-1433. [ Links ]
28. Woodward M, Morrison CE, McColl Ke. The prevalence of dyspepsia and use of antisecretory medicatioin in North Gasgow: role of Helicobacter pylori vs lifestyle factors. Aliment Pharmacol 1999;13: 1505-1509. [ Links ]
29. Bytzer P, Howell S, Leemon M, Young LJ, Jones MP, Talley NJ. Low socioeconomic class is a risk factor for upper and lower gastrointestinal symptoms: a population based study in 15000 Australian adults. Gut 2001;49:66-67. [ Links ]
30. Kurata JH, Nogawa AN. Meta-analysis of risk factors for peptic ulcer. Nonsteroidal anti inflammatory drugs, Helicobacter pylori, and smoking. J Clin Gastroenterol 1997;24: 2-17. [ Links ]
31. Huang JQ, Sridhar S, Hunt RH. Role of Helicobacter pylori infection and non-steroidal anti inflammatory drugs in peptic-ulcer disease: a meta-analysis. Lancet 2002;359:14-22. [ Links ]
32. Chan FK, To KF, Wu JC, Yung MY, Leung WK, Kwok T et al. Eradication of Helicobacter pylori and risk of peptic ulcers in patients starting long-term treatment with non-steroidal anti-inflammatory drugs: a randomised trial. Lancet 2002;359:9-13. [ Links ]
33. Straus WL, Ofman JJ, MacLean C, Morton S, Berger ML, Roth EA et al. Do NSAIDs cause dyspepsia? A meta-analysis evaluating alternative dyspepsia definitions. Am J Gastroentrol 2002;97:1951-1958. [ Links ]
34. Aalykke C, Lauritsen K. Epidemiology of NSAID-related gastroduodenal mucosal injury. Best Pract Res Clin Gastroenterol 2001;15:705-722. [ Links ]
35. The National Prescribing Center. Managing dyspepsia: the role of Helicobacter pylori. MeReC Bulletin 2001;12(1):1-4. [ Links ]
36. Gispert JP, Pajares JM. Helicobacter pylori Test and Scope Strategy for Dyspeptic Patients. Blackwell Publishing 2000;5(2):57-68. [ Links ]
37. Andersen IB, Jorgensen T, Bonnevie O, Gronbaek M, Sorensen TI. Smoking and alcohol intake as risk factors for bleeding and perforated peptic ulcers: a population-based cohort study. Epidemiology 2000;11:434-439. [ Links ]
38. International Agency for Research on Cancer. Infection with Helicobacter pylori. IARC Monogr Eval Carcinog Risks Hum 1994; 61:177-240. [ Links ]
39. Correa P. Gastric neoplasia. Curr Gastroenterol Rep 2002;4:463-470. [ Links ]
40. Priebe WM, DaCosta LR, Beck IT. Is epigastric tenderness a sign of peptic ulcer disease? Gastroenterology 1982;82:16-19. [ Links ]
41. Numans ME, Van der Graaf Y, de Wit NJ, Touw-Otten F, de Melker RA. How much ulcer is ulcer-like? Diagnostic determinants of peptic ulcer in open access gastroscopy. Fam Pract 1994;11:382-388. [ Links ]
42. Johannessen T, Petersen H, Kleveland PM, Dybdahl JH, Sandvik AK, Brenna E et al. The predictive value of history in dyspepsia. Scand J Gastroenterol 1990;25:689-697. [ Links ]
43. Danish dyspepsia study group. Value of the unaided clinical diagnosis in dyspeptic patients in primary care. Am J Gastroenterol 2001;96:1417-1421. [ Links ]
44. Heading RC, Wager E, Tooley PJ. Reliability of symptom assessment in dyspepsia. Eur J Gastroenterol Hepatol 1997;9:779-781. [ Links ]
45. Westbrook JI, McIntosh JH, Duggan JM. Accuracy of provisional diagnoses of dyspepsia in patients undergoing first endoscopy. Gastrointest Endosc 2001;53:283-288. [ Links ]
46. Barenys M, Rota R, Moreno V, Villafafila R, García-Bayo I, Abad A et al. Validación prospectiva de un modelo clínico predictivo de dispepsia orgánica en el ámbito de la atención primaria y de las consultas de gastroenterología (Abstract). Gastroenterol Hepatol 2003;26(2):103. [ Links ]
47. Madsen LG, Bytzer P. The value of alarm features in identifying organic causes of dyspepsia. Can J Gastroenterol 2000;14:713-720. [ Links ]
48. Williams B, Luckas M, Ellingham JH, Dain A, Wicks AC. Do young patients with dyspepsia need investigation? Lancet 1988;2:1349-1351. [ Links ]
49. Christie J, Shepherd NA, Codling BW, Valori RM. Gastric cancer below the age of 55: implications for screening patients with uncomplicated dyspepsia. Gut 1997;41:513-517. [ Links ]
50. Gillen D, McColl KE. Does concern about missing malignancy justify endoscopy in uncomplicated dyspepsia in patients aged less than 55? Am J Gastroenterol 1999;94:75-79. [ Links ]
51. Heaney A, Collins JS, Tham TC, Watson PR, McFarland JR, Bamford KB. A prospective study of the management of the young Helicobacter pylori negative dyspeptic patient can gastroscopies be saved in clinical practice? Eur J Gastroenterol Hepatol 1998;10:953-956. [ Links ]
52. Canga C 3rd, Vakil N. Upper GI malignancy, uncomplicated dyspepsia, and the age threshold for early endoscopy. Am J Gastroenterol 2002;97:600-603. [ Links ]
53. American Gastroenterological Association medical position statement: evaluation of dyspepsia. Gastroenterology 1998;114:579-581. [ Links ]
54. Malfertheiner P, Megraud F, O'Morain C, Hungin AP, Jones R, Axon A et al. The European Helicobacter Pylori Study Group (EHPSG). Current concepts in the management of Helicobacter pylori infection -the Maastricht 2-2000. Consensus Report. Aliment Pharmacol Ther 2002;16:167-180. [ Links ]
55. Ofman JJ, Rabeneck L. The effectiveness of endoscopy in the management of dyspepsia: a qualitative systematic review. Am J Med 1999;106:335-346. [ Links ]
56. Lassen AT, Pedersen FM, Bytzer P, Schaffalitzky de Muckadell OB. Helicobacter pylori test and-eradicate versus prompt endoscopy for management of dyspeptic patients: a randomized trial. Lancet 2000;356:455-460. [ Links ]
57. Laheij RJ, Severens JL, Van de Lisdonk EH, Verbeek AL, Jansen JB. Randomized controlled trial of omeprazole or endoscopy in patients with persistent dyspepsia: a cost effectiveness analysis. Aliment Pharmacol Ther 1998;12:1249-1256. [ Links ]
58. Pajares JM. Helicobacter pylori infection and gastric cancer in Spain. Hepatogastroenterology 2001;48:1556-1559. [ Links ]
59. Bodger K, Daly MJ, Heatley RV. Prescribing patterns for dyspepsia in primary care: a prospective study of selected general practitioners. Aliment Pharmacol Ther 1996;10:889-895. [ Links ]
60. Folkersen BH, Larsen B, Qvist P. General practitioners' handling of patients with dyspepsia. Ugeskr Laeger 1997;159:3777-3781 [resumen]. [ Links ]
61. Martínez-Sánchez G, Saperas E, Benavent J, Mearin F, Pinol JL, Barenys M et al. Actitud de los médicos de atención primaria del área metropolitana de Barcelona frente al diagnóstico y tratamiento de la infección por Helicobacter pylori en enfermedades gastroduodenales. Gastroenterol Hepatol 1998;21:473-478. [ Links ]
62. Gené E, Calvet X, Azagra R, López T, Cubells MJ. Manejo de la dispepsia, la enfermedad ulcerosa y la infección por Helicobacter pylori en atención primaria. Aten Primaria 2002;29:486-494. [ Links ]
63. Weijnen CF, de Wit NJ, Numans ME, Quartero AO, Verheij TJ. Dyspepsia management in primary care in the Netherlands: to what extent is Helicobacter pylori diagnosis and treatment incorporated? Results from a survey among general practitioners in the Netherlands. Digestion 2001;64:40-45. [ Links ]
64. Meineche-Schmidt V, Fly G. Helicobacter pylori test-and-treat strategy in dyspepsia patients in general practice. Too many patients to treat? Gut 1999;43 (Supl.):A355. [ Links ]
65. Delaney B, Moayyedi P, Deeks J, Innes M, Soo S, Barton P et al. The management of dyspepsia: a systematic review. Health Technol Assess 2000;4(39). http://www.ncchta.org/fullmono/mon439.pdf. [ Links ]
66. Delaney BC, Innes MA, Deeks J, Wilson S, Cooner MK, Moayyedi P et al. Initial management strategies for dyspepsia (Cochrane Review). En: The Cochrane Library, No. 3, 2002. Oxford: Update Software. [ Links ]
67. Spiegel BM, Vakil NB, Ofman JJ. Dyspepsia management in primary care: a decision analysis of competing strategies. Gastroenterology 2002;122:1270-1285. [ Links ]
68. Quartero AO, Numans ME, de Melker RA, Hoes AW, de Wit NJ. Dyspepsia in primary care: acid suppression as effective as prokinetic therapy. A randomized clinical trial. Scand J Gastroenterol 2001;36:942-947. [ Links ]
69. Ghosh S, Kinnear M. Dyspepsia in primary care to prescribe or to investigate?. Br J Gen Pract 2001;51:612-614. [ Links ]
70. Hession PT, Malagelada J. Review article: the initial management of uninvestigated dyspepsia in younger patients -the value of symptom-guided strategies should be reconsidered. Aliment Pharmacol Ther 2000;14:379-388. [ Links ]
71. Lewin van den Broek NT, Numans ME, Buskens E, Verheij TJ, de Wit NJ, Smout AJ. A randomised controlled trial of four management strategies for dyspepsia: relationships between symptom subgroups and strategy outcome. Br J Gen Pract 2001;51:619-624. [ Links ]
72. García-Altés A, Rota R, Barenys M, Abad A. Test and treat and endoscopy are the most cost-effective strategies for the management of dyspepsia depending on the age of the patient. 18th Annual Meeting of the International Society of Technology Assessment in Health Care. ISTAHC. Berlín: 2002. [ Links ]
73. Dooley CP, Larson AW, Stace NH, Renner IG, Valenzuela JE, Eliasoph J et al. Doublecontrast barium meal and upper gastrointestinal endoscopy. A comparative study. Ann Intern Med 1984;101:538-545. [ Links ]
74. Shaw PC, van Romunde LK, Griffioen G, Janssens AR, Kreuning J, Eilers GA. Peptic ulcer and gastric carcinoma: diagnosis with biphasic radiography compared with fiberoptic endoscopy. Radiology 1987;163: 39-42. [ Links ]
75. Rabeneck L, Souchek J, Wristers K, Menke T, Ambriz E, Huang I et al. A double blind, randomized, placebo-controlled trial of proton pump inhibitor therapy in patients with uninvestigated dyspepsia. Am J Gastroenterol 2002;97:3045-3051. [ Links ]
76. Ofman JJ, Rabeneck L. The effectiveness of endoscopy in the management of dyspepsia: a qualitative systematic review. Am J Med 1999;106:335-346. [ Links ]
77. Brignoli R, Watkins P, Halter F. The Omega-Project - a comparison of two diagnostic strategies for risk -and cost-oriented management of dyspepsia. Eur J Gastroenterol Hepatol 1997;9:337-343. [ Links ]
78. Gisbert JP, Pajares JM. Helicobacter pylori test-and-scope strategy for dyspeptic patients. Helicobacter 2000;2: 57-68. [ Links ]
79. Galloway JM, Gibson J, Dalrymple J. Endoscopy in primary care: a survey of current practice. Br J Gen Pract 2002;52:536-538. [ Links ]
80. Shaw PC, Romunde IKI, Griffioen G, Janssens AR, Kreuning J, Lamers CBHW. Detection of gastric erosions: comparison of biphasic radiography with fiberoptic endoscopy. Radiology 1991;178:63-66. [ Links ]
81. RCR Working Party. Making the best use of a Department of Clinical Radiology, 4.ª ed. Londres: The Royal College of Radiologists, 1998. [ Links ]
82. Logan RP, Walker MM. ABC of the upper gastrointestinal tract: epidemiology and diagnosis of Helicobacter pylori infection. BMJ 2001;323:920-922. [ Links ]
83. Gold BD, Colletti RB, Abbott M, Czinn SJ, Elitsur Y, Hassall E, et al. Helicobacter pylori infection in children: recommendations for diagnosis and treatment. J Pediatr Gastroenterol Nutr. 2000 Nov;31(5):490-7. [ Links ]
84. Vakil N, Rhew D, Soll A, Ofman JJ. The cost-effectiveness of diagnostic testing strategies for H. pylori. Am J Gastroenterol 2000;95:1691-1698. [ Links ]
85. Savarino V, Bisso G, Pivari M, Zentilin P, Bilardi C, Dulbecco P et al. Effect of gastric acid suppression on 13C-urea breath test: comparison of ranitidine with omeprazole. Aliment Pharmacol Ther 2000;14: 291-297. [ Links ]
86. Savarino V, Tracci D, Dulbecco P, Mele MR, Zentilin P, Mansi C et al. Negative effect of ranitidine on the results of urea breath test for the diagnosis of Helicobacter pylori. Am J Gastroenterol 2001;96: 348-352. [ Links ]
87. Connor SJ, Seow F, Ngu MC, Katelaris PH. The effect of dosing with omeprazole on the accuracy of the 13C-urea breath test in Helicobacter pylori-infected subjects. Aliment Pharmacol Ther 1999;13: 1287-1293. [ Links ]
88. Connor SJ, Ngu MC, Katelaris PH. The impact of short-term ranitidine use on the precision of the 13C-urea breath test in subjects infected with Helicobacter pylori. Eur J Gastroenterol Hepatol 1999;11: 1135-1138. [ Links ]
89. Laine L, Estrada R, Trujillo M, Knigge K, Fennerty MB. Effect of proton-pump inhibitor therapy on diagnostic testing for Helicobacter pylori. Ann Intern Med 1998;129:547-550. [ Links ]
90. Alberta Clinical Practice Guideline Working Group. Guideline for Diagnosis and Treatment of Chronic Undiagnosed Dyspepsia in Adults. The Alberta Clinical Guideline Program. June, 2000. [ Links ]
91. Breslin NP, Thomson AB, Bailey RJ, Blustein PK, Meddings J, Lalor E et al. Gastric cancer and other endoscopic diagnoses in patients with benign dyspepsia. Gut 2000;46:93- 97. [ Links ]
92. De Wit NJ, Quartero AO, Numans ME. Helicobacter pylori treatment instead of maintenance therapy for peptic ulcer disease: the effectiveness of case-finding in general practice. Aliment Pharmacol Ther 1999;13:1317-1321. [ Links ]
93 National Institute for Clinical Excellence. Guidance on the use of proton pump inhibitors (PPI) in the treatment of dyspepsia. Londres: National Institute for Clinical. Excellence (NICE). Technology Appraisal, 2000. [ Links ]
94. Khan Z, Nair P, O´Shea C, Spiers N, Playford RJ, Wicks AC. Does Helicobacter pylori eradication reduce the long-term requirements for acid suppressants in patients with a history of peptic ulcer disease in general practice? Results from a four-year longitudinal study. Scand J Gastroenterol 2002;37:144-147. [ Links ]
95. Weijnen CF, Numans ME, de Wit NJ, Smout AJ, Moons KG, Verheij TJ et al. Testing for Helicobacter pylori in dyspeptic patients suspected of peptic ulcer disease in primary care: cross sectional study. BMJ 2001;323:71-75. [ Links ]
96. Kolk H, Maaroos HI, Kull I, Labotkin K, Loivukene K, Mikelsaar M. Open access endoscopy in an epidemiological situation of high prevalence of Helicobacter pylori infection: applicability of the guidelines of the European Society for Primary Care Gastroenterology. Fam Pract 2002;19:231-235. [ Links ]
97. Harvey RF, Spence RW, Lane JA, Nair P, Murray LJ, Harvey IM et al. Relationship between the birth cohort pattern of Helicobacter pylori infection and the epidemiology of duodenal ulcer. QJM 2002;95:519-525. [ Links ]
98. Management of upper dyspepsia in general practice (funded by DACEHTA). Primary Research (project). Danish Centre for Evaluation and Health Technology Assessment (DACEHTA). http://www.dihta.dk/projekter/230_uk.asp. [ Links ]
99. The European Helicobacter Study Group. Current European concepts in the management of Helicobacter pylori infection. The Maastricht Consensus Report. Gut 1997;41:8-13. [ Links ]
100. Hallissey MT, Allum WH, Jewkes AJ, Ellis DJ, Fielding JW. Early detection of gastric cancer. BMJ 1990;301:513-515. [ Links ]
101. Talley NJ, Weaver AL, Tesmer DL, Zinsmeister AR. Lack of discriminant value of dyspepsia subgroups in patients referred for upper endoscopy. Gastroenterology 1993;105:1378-1386. [ Links ]
102. Moore RA. Helicobacter pylori and peptic ulcer: a systematic review of effectiveness and an overview of the economic benefits of implementing what is known to be effective. Oxford: Health Technology Evaluation Association, 1995. [ Links ]
103. Delaney B, Moayyedi P, Forman D. Helicobacter pylori infection. Clin Evid 2002; 7:414-428. [ Links ] 203. Howden CW, Hunt RH. Guidelines for the management of Helicobacter pylori infection. Ad Hoc Committee on Practice Parameters of the American College of Gastroenterology. Am J Gastroenterol 1998; 93: 2330-2338.
104. McColl KE. The role of Helicobacter pylori eradication in the management of acute leeding peptic ulcer. Eur J Gastroenterol Hepatol 1995;7:753-755. [ Links ]
105. Sharma VK, Sahai AV, Corder FA, Howden CW. Helicobacter pylori eradication is superior to ulcer healing with or without maintenance therapy to prevent further ulcer haemorrhage. Aliment Pharmacol Ther 2001;15:1.939-1.947. [ Links ]
106. Buring SM, Winner LH, Hatton RC, Doering PL. Discontinuation rates of Helicobacter pylori treatment regimens: a meta-analysis. Pharmacotherapy 1999;19:324-332. [ Links ]
107. Scottish Intercollegiate Guideline Network (SIGN). Dyspepsia. Edimburgh: SIGN, 2003 [en prensa]. [ Links ]
108. Scottish Intercollegiate Guideline Network (SIGN). UPDATE H. pylori: eradication therapy in dyspeptic disease. Edimburgo: SIGN, 1999. [ Links ]
109. Penston JG, McColl KE. Eradication of Helicobacter pylori: an objective assessment of current therapies. Br J Clin Pharmacol 1997;43:223-243. [ Links ]
110. Leodolter A, Kulig M, Brasch H, Meyer-Sabellek W, Willich SN, Malfertheiner P. A meta analysis comparing eradication, healing and relapse rates in patients with Helicobacter pylori associated gastric or duodenal ulcer. Aliment Pharmacol Ther 2001;15:1949-1958. [ Links ]
111. Laheij RJ, Rossum LG, Jansen JB, Straatman H, Verbeek AL. Evaluation of treatment regimens to cure Helicobacter pylori infection - a meta-analysis. Aliment Pharmacol Ther 1999;13:857-864. [ Links ]
112. Lind T, Veldhuyzen van Zanten S, Unge P, Spiller R, Bayerdorffer E, O´Morain C et al. Eradication of Helicobacter pylori using one-week triple therapies combining omeprazole with two antimicrobials: the MACH I Study. Helicobacter 1996;1:138-144. [ Links ]
113. Miwa H, Ohkura R, Murai T, Sato K, Nagahara A, Hirai S et al. Impact of rabeprazole, a new proton pump inhibitor, in triple therapy for Helicobacter pylori infection-comparison with omeprazole and lansoprazole. Aliment Pharmacol Ther 1999;13:741-746. [ Links ]
114. Wong BC, Wong WM, Yee YK, Hung WK, Yip AW, Szeto ML et al. Rabeprazole-based 3 day and 7-day triple therapy vs. omeprazole-based 7-day triple therapy for the treatment of Helicobacter pylori infection. Aliment Pharmacol Ther 2001;15:1959-1965. [ Links ]
115. Murakami K, Sato R, Okimoto T, Nasu M, Fujioka T, Kodama M et al. Eradication rates of clarithromycinresistant Helicobacter pylori using either rabeprazole or lansoprazole plus amoxicillin and clarithromycin. Aliment Pharmacol Ther 2002;16:1933-1938. [ Links ]
116. Veldhuyzen Van Zanten S, Lauritsen K, Delchier JC, Labenz J, De Argila CM, Lind T et al. One-week triple therapy with esomeprazole provides effective eradication of Helicobacter pylori in duodenal ulcer disease. Aliment Pharmacol Ther 2000;14:1605-1611. [ Links ]
117. Tulassay Z, Kryszewski A, Dite P, Kleczkowski D, Rudzinski J, Bartuzi Z et al. One week of treatment with esomeprazole-based triple therapy eradicates Helicobacter pylori and heals patients with duodenal ulcer disease. Eur J Gastroenterol Hepatol 2001;13:1457-1465. [ Links ]
118. Laine L. Esomeprazole in the treatment of Helicobacter pylori. Aliment Pharmacol Ther 2002;16 (Supl. 4):115-118. [ Links ]
119. Schmid CH, Whiting G, Cory D, Ross SD, Chalmers TC. Omeprazole plus antibiotics in the eradication of Helicobacter pylori infection: a meta-regression analysis of randomized, controlled trials. Am J Ther 1999;6:25-36. [ Links ]
120. Fischbach LA, Goodman KJ, Feldman M, Aragaki C. Sources of variation of Helicobacter pylori treatment success in adults worldwide: a meta-analysis. Int J Epidemiol 2002;31:128-139. [ Links ]
121. Jovell AJ, Aymerich M, García-Altés A, Serra-Prat M. Guia de pràctica clínica del tractament erradicador de la infecció per Helicobacter pylori associada a l´úlcera duodenal en l'atenció primària. Barcelona: Agència d´Avaluació de Tecnologia Mèdica. Servei Català de la Salut. Departament de Sanitat i Seguretat Social. Generalitat de Catalunya: setembre de 1998. [ Links ] 230. Huang J, Hunt RH. The importance of clarithromycin dose in the management of Helicobacter pylori infection: a meta-analysis of triple therapies with a proton pump inhibitor, clarithromycin and amoxycillin or metronidazole. Aliment Pharmacol Ther 1999;13:719-729.
122. Gisbert JP, Pajares JM. Resistencia de Helicobacter pylori al metronidazol y a la claritromicina en España. Una revisión sistemática. Med Clin (Barc) 2001;116:111-116. [ Links ]
123. Cuchí E, Forné M, Quintana S, Lite J, Garau J. Evolución de la sensibilidad de 235 cepas de Helicobacter pylori entre 1995 y 1998 e impacto del tratamiento antibiótico. Enferm Infecc Microbiol Clin 2002;20: 157-160. [ Links ]
124. Caballero AM, Kotoyannis S, Valenzuela M, Casado FJ, Guilarte J. Epidemiología de la dispepsia en una población aleatoria mediterránea. Prevalencia de la infección por Helicobacter pylori. Rev Esp Enferm Dig 2000;92:781-792. [ Links ]
125. Hession PT, Malagelada J. Review article: the initial management of uninvestigated dyspepsia in younger patients-the value of symptom-guided strategies should be reconsidered. Aliment Pharmacol Ther 2000;14:379-388. [ Links ]
126. Hsu PI, Lai KH, Tseng HH, Lo GH, Lo CC, Lin CK et al. Eradication of Helicobacter pylori prevents ulcer development in patients with ulcer-like functional dyspepsia. Aliment Pharmacol Ther 2001;15: 195-201. [ Links ]
127. Koelz HR, Arnold R, Stolte M, Fischer M, Blum AL; The Frosch Study Group. Treatment of Helicobacter pylori in functional dispepsia resistant to conventional management: a double blind randomised trial with a six month follow up. Gut 2003;52:40-46. [ Links ]
128. Penston JG. Review article: clinical aspects of Helicobacter pylori eradication therapy in peptic ulcer disease. Aliment Pharmacol Ther 1996;10:469-486. [ Links ]
129. Laine L, Hopkins RJ, Girardi LS. Has the impact of Helicobacter pylori therapy on ulcer recurrence in the United States been overstated? A meta-analysis of rigorously designed trials. Am J Gastroenterol 1998; 93:1409-1415. [ Links ]
130. Forman D, Bazzoli F, Bennett C, Broutet N, Calvet-Calvo X, Chiba N et al. Therapies for the eradication of Helicobacter pylori (Protocol for a Cochrane Review). En: The Cochrane Library, No. 4, 2002. Oxford: Update Software. [ Links ]
131. Delaney BC, Wilson S, Roalfe A, Roberts L, Redman V, Wearn A et al. Randomised controlled trial of Helicobacter pylori testing and endoscopy for dyspepsia in primary care. BMJ 2001;322:898-901. [ Links ]
132. Gisbert JP, Calvet X, Gomollón F, Sainz R. Conferencia de consenso. Tratamiento erradicador de Helicobacter pylori. Recomendaciones de la Conferencia Española de Consenso. Med Clin (Barc) 2000;114: 185-195. [ Links ]














