Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Ciencias de la Salud
Print version ISSN 1692-7273On-line version ISSN 2145-4507
Rev. Cienc. Salud vol.6 no.2 Bogotá May/Aug. 2008
Evaluación de la terapia larval en el proceso de curación de heridas infectadas con Pseudomonas aeruginosa en conejos
Evaluation of the larval therapy in the healing process of infected wounds with Pseudomonas aeruginosa in rabbits
Mauricio Rey, MV1, Adriana Castañeda, MV2, Juliana González, MV3, Víctor Acero, MV4, Alexandra Segura, Lic. Biol., MSc5, Cristina Zapata, Biol., MSc6, María A., Gaona, Microb., esp.7, Dora Ríos, Biol. Microb., esp.8, Felio J. Bello, Lic. Quim. Biol., MSc, PhD9
1. Estudiante, Universidad de La Salle de Medicina Veterinaria.
2. Estudiante, Universidad de La Salle de Medicina Veterinaria.
3. Estudiante, Universidad de La Salle de Medicina Veterinaria.
4. Profesor, Universidad de La Salle de Medicina Veterinaria.
5. MSc. Laboratorio de Entomología Médica y Forense, Universidad del Rosario.
6. MSc. Laboratorio de Entomología, Biología Celular y Genética, Universidad de La Salle. Correo electrónico: angezapata@lasalle.edu.co
7. Esp. Profesora, Universidad del Rosario.
8. Esp. Profesora, Universidad del Rosario.
9. PhD. Laboratorio de Entomología Médica y Forense, Universidad del Rosario. Correo electrónico: fbello@urosario.edu.co.
Recibido: 4 de julio de 2008 Aceptado: 28 de julio de 2008
Resumen
Introducción. Durante las últimas dos décadas, la terapia larval ha resurgido como una alternativa confiable y segura para la cura de úlceras cutáneas que no responden a los tratamientos convencionales.
Objetivo. Evaluar el uso de las larvas de Lucilia sericata en el tratamiento de heridas infectadas con Pseudomonas aeruginosa en un modelo animal.
Materiales y métodos. Se tomaron 12 conejos, los cuales fueron divididos al azar en 3 grupos homogéneos: al primero se le aplicó terapia larval, el segundo se trató con terapia antibiótica y el tercero fue establecido como control. A cada uno de los animales se les realizó una herida, luego se inoculó en ésta una suspensión de P. aeruginosa y, finalmente, al registrarse el desarrollo de la infección, se procedió, en los dos primeros grupos, a los tratamientos correspondientes. Para la evaluación macroscópica de las heridas, se tuvo en cuenta la presencia de edema y exudado, mal olor, inflamación alrededor de la herida y apariencia del tejido de granulación. Al proceso de cicatrización se le hizo seguimiento a través de una técnica dermohistológica.
Resultados. Se registraron claras diferencias entre el grupo de animales tratados con terapia larval vs. el grupo tratado con terapia convencional de antibióticos, estableciéndose un periodo de 10 días para alcanzar la cicatrización en el grupo de terapia larval mientras que en el segundo grupo el proceso se cumplió en 20 días.
Conclusiones. S e demostró la eficacia de las larvas de L. sericata en el tratamiento de heridas infectadas con P. aeruginosa.
Palabras clave: terapia larval, Lucilia sericata, cicatrización de las heridas, Pseudomonas aeruginosa, dermohistopatología.
Summary
Introduction. During the last two decades the larval therapy has reemerged as a safe and reliable alternative for the healing of cutaneous ulcers that do not respond to the conventional treatments.
Objective. To evaluate the use of the larvae of Lucilia sericata as a treatment for infected wounds with Pseudomonas aeruginosa in an animal model.
Materials and methods. Twelve rabbits were randomly distributed in 3 groups: the first group was treated with larval therapy; the second was treated with antibiotics therapy and to the third no treatment was applied, therefore was established as a control group. To each animal a wound was artificially induced, and then a suspension of P. aeruginosa was inoculated into the lesion. Finally, every rabbit was evaluated until the infection development was recognized and treatment was set up for the first two groups according with the protocols mentioned above. Macroscopic evaluation of the wounds was based on the presence of edema, exudates, bad odor, inflammation around the wound and the presence of granulation tissue. The healing process was evaluated by monitoring histological changes in the dermal tissue.
Results. Differences in the time required for wound healing were observed between the first group treated with larval therapy (10 days) and the second group treated with conventional antibiotics therapy (20 days).
Conclusion. The L. sericata larva is and efficient tool as a therapy for infected wounds with P. aeruginosa.
Key words: larval therapy, Lucilia sericata, wounds healing, Pseudomona aeruginosa, histopathology.
INTRODUCCIÓN
La terapia larval es una tecnología antigua, empleada y reconocida en la década de los treinta [1-4], siendo popular su uso en muchos países de Europa y de Norte América. en estos últimos, más de 300 hospitales la utilizaron, pero luego, en el año de 1940, se abandonó como consecuencia del auge de los antibióticos y de los avances quirúrgicos [5]. Sin embargo, se volvió a retomar en 1989 como alternativa al surgimiento de la resistencia bacteriana a los antibióticos, y en la cura de heridas de difícil pronóstico que no respondían favorablemente a los tratamientos convencionales [6,7].
Actualmente, el uso de la terapia larval se ha venido incrementado en muchos países del mundo al establecerse como una tecnología sencilla, rápida y efectiva en el tratamiento de lesiones cutáneas [5,8-11]. Los efectos benéficos de las larvas sobre las heridas se producen debido a la acción de varias sustancias que ellas secretan y excretan, participando en tres mecanismos fisiológicos diferentes: debridamiento, actividad antimicrobiana y estimulación del tejido de granulación. La articulación de todo el proceso conduce, finalmente, a la cura y cicatrización de las lesiones cutáneas [12]. La aplicación de la terapia larval está indicada para heridas que contienen membranas adherentes o con tejido necrótico, que están clínicamente infectadas y no responden a los tratamientos antimicrobianos.
Las larvas de la mosca L. sericata (Diptera: Calliphoridae) son consideradas como las más eficaces para ser empleadas en los tratamientos de terapia larval [13-15]. Las características biológicas y etológicas que hacen a las larvas de L. sericata las más convenientes para utilizar en biocirugía incluyen su rápido desarrollo larval, la relativa facilidad para criar estos insectos en condiciones de laboratorio y la continua disposición para la toma de los huevos y su esterilización. No obstante, lo más relevante en el comportamiento biológico es la acción efectiva de las larvas al actuar como parásitos facultativos que se alimentan sólo del tejido necrótico en las heridas, sin intervenir los tejidos vivos del hospedero.
Las heridas crónicas, infectadas, algunas de difícil pronóstico, representan un problema de importancia en salud pública a nivel mundial. En Inglaterra, por ejemplo, se hizo un estimativo anual de 1 billón de libras de esterlinas en gastos por parte del Servicio Nacional de Salud (NAO, 2004), y a nivel mundial los costos en los tratamientos anuales podrían estar en el orden de los US$7 billones. En los anteriores gastos no se incluyen las incapacidades laborales y las secuelas que ocasionan estas lesiones, cuyos valores podrían ser incalculables, además del impacto negativo que tienen en la calidad de vida del paciente y de su familia. Las heridas crónicas de mayor impacto se refieren principalmente a úlceras varicosas, úlceras por presión y úlceras de pie diabético. Como alternativa de tratamiento para estas heridas que no responden positivamente a los tratamientos convencionales, se ha venido usando la terapia larval, que es un método más económico, de evolución más rápida y segura. La acción antibacterial de sustancias producidas por las larvas han sido evaluadas, en condiciones in vitro, con varias especies de estos microorganismos, entre las cuales mencionamos Staphylococcus aureus, Streptococcus pyogenes, Micrococcus luteus y Pseudomonas aeruginosa [5,16]. Sin embargo, menos trabajos se han realizado en condiciones in vivo, tomando modelos animales de experimentación.
En el presente trabajo se evaluó la acción de la terapia larval derivada de la mosca L. sericata, cepa Bogotá, en heridas infectadas con P. aeruginosa, previamente inducidas en conejos. Adicionalmente, se comparó este tratamiento con otro de terapia convencional con antibióticos, desarrollado paralelamente en estos animales.
MATERIALES Y MÉTODOS
Desinfección de huevos de L. sericata y evaluación microbiológica
Se tomaron, periódicamente, para los tratamientos de terapia larval grupos de 100 a 200 huevos que fueron recolectados de la cepa Bogotá-Colombia, previamente establecida en el Laboratorio de Entomología de la Universidad del Rosario. Estos huevos se sumergieron en una solución de hipoclorito de sodio al 0,05%, con agitación continua durante 2 minutos; luego fueron pasados por formaldehído al 5% durante otro minuto y finalmente lavados con agua destilada estéril por 3 minutos. Los huevos desinfectados se transfirieron a cajas de petri estériles que contenían agar sangre; aquí ocurrió la eclosión de las larvas, previa incubación de los huevos a 27°C. En cada esterilización, algunos huevos y larvas, seleccionados al azar, se sembraron en caldo soya tripticasa para detectar cualquier indicio de contaminación mediante turbidez. Las larvas estériles, bajo las condiciones señaladas anteriormente, se refrigeraron a 4°C, cajas de Petri, en algunas ocasiones hasta por 72 horas, antes de ser utilizadas en los tratamientos.
Animales de experimentación e inducción de las heridas
Como biomodelo experimental se emplearon 12 conejos Nueva Zelanda, 6 machos y 6 hembras destetos, los cuales fueron divididos en 3 grupos homogéneos de 4 animales (2 machos y 2 hembras ). Durante el desarrollo del trabajo se tuvo en cuenta la ley 84 de 1989 para el uso de animales de experimentación y las normas éticas para investigación sin riesgos de acuerdo con la resolución 008430 de 1993 del Ministerio de Salud de Colombia. Previamente se obtuvo la aprobación del Comité de Ética de la Facultad de Medicina de la Universidad del Rosario. A los conejos se les efectuó sedación y anestesia, utilizando una premedicación de morfina 1,2-5,0 mg/kg intramuscular, luego inducción con isoflurano al 3-4% inhalada en oxígeno y el m antenimiento se hizo también con la anterior sustancia a la concentración del 0,5-2%. Todo el tratamiento anterior indujo a los pacientes a un estado de neuroleptoanalgesia, situación en la cual se le retiró a cada animal una porción de piel del dorso caudal a la cabeza correspondiente a un área total de 5 cm 2, con una profundidad de corte de 0,5cm. Posteriormente, se inoculó a la herida 2 ml de una suspensión de P. aeruginosa (cepa ATCC 27853), en una concentración de 10 6 microorganismos viables/ml. Para el manejo postoperatorio del dolor, se administró Meloxicam 1-2 mg/kg, cada 4 horas [17]. Cuando los animales presentaron signos de infección, ésta fue confirmada para P. aeruginosa, mediante estudio microbiológico, así: a las 72 horas se tomaron muestras de la secreción de la herida infectada de cada animal con la ayuda de hisopos estériles, luego se sembraron en agar sangre y medio EMB, finalmente se incubaron a 35°C por 24 horas. También, se realizaron frotis directos, tomados de las lesiones, en láminas portaobjetos desengrasadas, donde se fijaron, y posteriormente se realizó tinción de Gram. Se finalizó con la observación microscópica de las muestras.
Después de 10 días de inoculados los animales con P. aeruginosa, se iniciaron los respectivos tratamientos, asignados a los dos grupos, previa limpieza de las heridas con solución salina estéril. Se procedió, por grupo, de la siguiente manera:
Evaluación macroscópica de las lesiones
Antes, durante y después de establecidos los tratamientos, s e realizó para cada animal una evaluación de las lesiones tomando como día cero, aquel en que se estableció el tratamiento, hasta el día 20 con intervalos de 5 días, para valorar la evolución macroscópica del proceso de cicatrización en los grupos. Las observaciones se anotaron en una escala de 0-3 de la siguiente manera: presencia de edema (0 ausente, 1 leve, 2 moderado, 3 abundante), presencia de exudado (0 ausente, 1 leve, 2 moderado, 3 abundante), mal olor (0 ausente, 1 leve, 2 moderado 3 intenso), inflamación alrededor de la herida (0 ausente, 1 leve, 2 moderado, 3 abundante), tejido de granulación (0 muy bueno, 1 bueno, 2 insuficiente, 3 ausente) y número de colonias (0 ausente, 1 leve, 2 moderado, 3 abundante). Se tuvo en cuenta que la sumatoria máxima podría ser 15 en el peor de los casos y 0 en el mejor [19].
Toma de biopsias
Después de 5 días de tratamiento se procedió a tomar la primera biopsia de piel de las lesiones, con la técnica punch, a cada uno de los animales de los 3 grupos; así mismo, este procedimiento se repitió cada 5 días hasta completar 4 biopsias en un tiempo total de 20 días. Posteriormente, se realizaron placas dermohistológicas de cada biopsia, las cuales fueron fijadas y luego coloreadas con hematoxilina-eosina, tricrómica de Masson y Gram para, finalmente, ser observadas con la ayuda de un microscopio. Los resultados obtenidos fueron evaluados teniendo en cuenta variables cuantitativas y también las etapas de cicatrización (inflamación, proliferación y maduración). Para el análisis comparativo de los cortes dermohistológicos, se tomó como parámetro un patrón de piel sana. Durante estos procedimientos se previno el dolor en cada animal usando el protocolo de analgesia y anestesia señalado anteriormente en la realización de las heridas.
Análisis estadístico
El análisis estadístico se aplicó a los datos obtenidos de las variables cuantitativas, es decir a heterófilos, histiocitos, linfocitos, células plasmáticas, número de vasos, fibroblastos, fibras de colágeno y número de colonias de P. aeruginosa; inicialmente con parámetros de estadística descriptiva y luego se estableció la normalidad de los datos mediante la prueba de Shapiro-Wilks (a 0,05). Posteriormente, se empleó el test de Kruskal-Wallis (a 0,05) para establecer si existían diferencias significativas entre el comportamiento celular de los tres grupos; finalmente, se emplearon los test de Tukey y Scheffe, que corresponden a pruebas de comparaciones múltiples. Estas pruebas permitieron determinar el origen de la varianza y comparar el comportamiento de dichas variables [19].
RESULTADOS
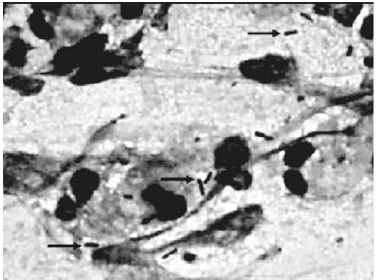
En las pruebas microbiológicas, posterior a la inoculación de la suspensión de P. aeruginosa en las heridas de los conejos e iniciadas a partir de la siembra de las muestras en los medios de cultivos y de los frotis directos. Se pudo observar la formación característica de colonias de la bacteria indicada y también en las preparaciones microscópicas fue evidente la morfología propia de estos bacilos Gram negativos, observándose rectos o ligeramente curvados, no helicoidales, con tamaños que oscilaron entre 0,6 y 2,0 µm de longitud (ver figura 1). Lo anterior, permitió comprobar la infección de las heridas en los animales con la bacteria seleccionada.
Figura 1. Frotis directo de la secreción de la herida, se observan bacilos Gram negativos. Coloración de Gram, objetivo 100X.
De los cinco antibióticos evaluados a través de los antibiogramas, se observó que todos produjeron un halo de sensibilidad en cultivo, razón por lo cual, para seleccionar uno de ellos, se tuvo en cuenta otras características, tales como: la facilidad para su aplicación (intramuscular), fácil manejo del tiempo entre dosis (24 horas) y en el tratamiento total (7 días), y también el costo relativamente bajo, condiciones que ofreció Gentamicina.
Evaluación macroscópica del proceso de cicatrización
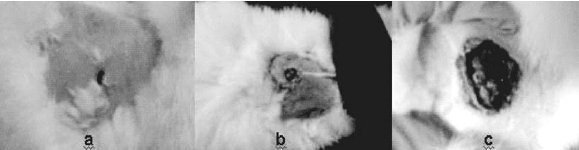
La evolución de la cicatrización fue diferente en los 3 grupos. Para el grupo 1 de conejos tratados con larvas de L. sericata, el proceso se cumplió en un periodo de 10 días, en tanto que en el grupo con Gentamicina o Antb, la cicatrización se completó a los 20 días (ver figuras 2 y 3). En los animales del grupo control, se observó a los 10 días irritación y alopecia alrededor de los ojos, complicándose la herida cada vez más con el paso del tiempo.
Figura 2. Inicio del proceso de cicatrización día 5. a) Grupo 1 (TL). b) Grupo 2 (Antb). c) Grupo 3 (control).
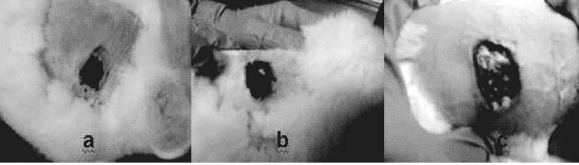
Figura 3. Finalización del proceso de cicatrización día 20. a) Grupo 1 (TL). b) Grupo 2 (Antb). c) Grupo 3 (control).
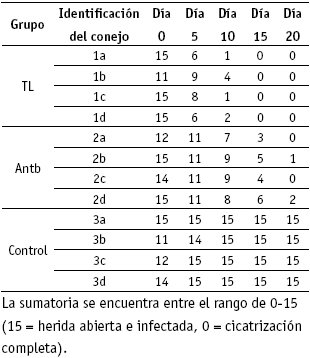
En la tabla 1 se muestra La suma total, con respecto a la presencia de edema, exudado, mal olor, inflamación alrededor de la herida, tejido de granulación y número de colonias de P. aeruginosa, obtenida a partir de la evaluación y calificación seleccionada.
Tabla 1. Sumatoria de la evaluación macroscópica de las heridas, teniendo en cuenta la asociación de los parámetros seleccionados en los diferentes tiempos, aplicados a los tres grupos de animales. La sumatoria se encuentra entre el rango de 0-15 (15= herida abierta e infectada, 0= cicatrización completa).
Evaluación microscópica del proceso de cicatrización
En la primera biopsia, realizada a los 5 días de instaurado el tratamiento, se observó en los 2 primeros grupos, una fase de inflamación terminal con signos evidentes de reparación, más acentuada en TL, en tanto que la fase de inflamación persistió en el control, con una pústula intracorneal y una gran cantidad de bacterias en este estrato, al contrario de lo registrado para los otros 2 grupos, en los cuales hubo progreso en la evolución de las heridas. En TL, se observó neovascularización y pequeños capilares en tejido conectivo, mientras que en Antb hubo presencia de fibroblastos (flechas), capilares en formación (V) y escasas células inflamatorias (ver figura 4).
Figura 4. Características histológicas de la herida en el día 5. a) Grupo 1 (TL). b) Grupo 2 (Antb). c) Grupo 3 (control). V, capilares. Objetivo (a-b) 100X, c. 40X
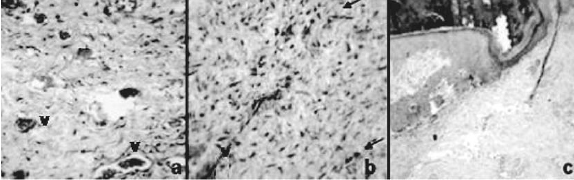
A los 10 días, correspondiente a la segunda biopsia, se observó para el TL presencia de tejido de granulación, notándose la orientación de los fibroblastos (flechas) perpendiculares a los capilares. Para el grupo Antb hubo presencia de pequeñas hemorragias (flechas), neovascularización (V) tejido de granulación y persistencia de escasas células inflamatorias (CI). Mientras que en el grupo control se identificó pérdida de la epidermis con una severa infiltración supurativa en dermis superficial (DS) y profunda (DP) (ver figura 5).
Figura 5. Características histológicas de la herida en el día 10. a) Grupo 1 (TL). b) Grupo 2 (Antb). c) Grupo 3 (control). V, capilares, DP, Dermis 0rofunda, DS, Dermis superficial. Objetivo (a-b) 100X, c. 40X.
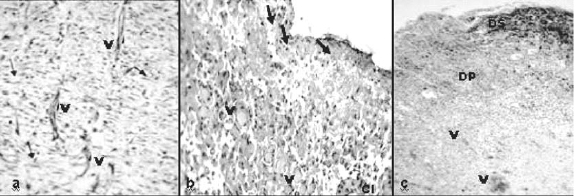
En las observaciones realizadas a los 15 días, tercera biopsia, para los animales pertenecientes al TL, se observó abundante V, fibroblastos y fibras de colágeno. Para el grupo Antb, se observó V, gran cantidad de fibroblastos (flechas) con infiltrados de algunos linfocitos polimorfonucleados. En el grupo control la mayor cantidad de células correspondió a linfocitos polimorfonucleados (ver figura 6).
Figura 6. Características histológicas de la herida en el día 15. a) Grupo 1 (TL). b) Grupo 2 (Antb). c) Grupo 3 (control). V, capilares, N, Polimorfonucleados. Objetivo 100X.
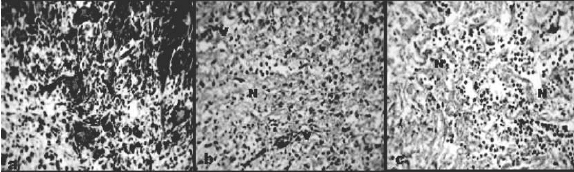
En la cuarta biopsia, realizada a los 20 días de instaurado el tratamiento, para el TL la apariencia del tejido fue similar al tejido control de piel sana, en tanto que en el Antb se observó continuidad en la epidermis, gran proliferación celular (PC), reparación por tejido de granulación, neovascularización y presencia de colágeno en los lados del defecto (FC). También hubo pocos macrófagos (flechas) (ver figura 7).
Figura 7. Características histológicas de la herida en el día 20. a) Grupo 1 (TL). b) Grupo 2 (Antb). c) Grupo 3 (control). V, capilares, N, Neutrófilos, PC, Proliferación celular, FC, Fibras de colágeno. Objetivo 100X.

Para confirmar la reducción de colonias en todos los especimenes de los 3 grupos, a los 5 días de tratamiento, se hizo maceración de tejido de las heridas y mediante cultivos microbiológicos 24 horas después de la siembra por método de agotamiento en agar sangre y agar EMB, se pudo observar que no hubo crecimiento de colonias para el TL, en contraste con los grupos Antb y 3 control, los cuales presentaron crecimiento de 2.500 y 17.000 UFC, respectivamente.
A continuación se describe el comportamiento cuantitativo y la significancia estadística de las diferencias entre el número de cada tipo de células y algunas estructuras asociadas encontradas en las biopsias realizadas, correspondientes a los diferentes grupos en los períodos de tiempo seleccionados. Para estos análisis, inicialmente, se realizaron pruebas de normalidad de los datos mediante la aplicación de la prueba de Shapiro-Wilks; posteriormente, se empleó el test de Kruskal-Wallis, el cual mostró que hubo diferencias estadísticamente significativas entre el comportamiento celular de los tres grupos (p=0,017). Debido a esto, se analizaron los datos obtenidos para cada tipo celular, mediante las pruebas de Tukey y Scheffe.
Heterófilos. En general, el número de heterófilos que se observó en las placas de los cortes dermohistológicos realizados los días 5, 10, 15 y 20, para los 2 tratamientos TL y Antb, no presentaron diferencias estadísticamente significativas. Aunque al aplicar pruebas de comparación entre grupos para cada día se obtuvieron los siguientes resultados:
Específicamente en el día 5 de tratamiento hubo un número menor de heterófilos en el TL en comparación con los otros dos grupos, diferencias estadísticamente significativas del grupo TL con los grupos, Antb (p=0,0325) y control (3) (p=0,0325). En el día 10, la diferencia se hizo más evidente entre los grupos TL y control (p=0,0114), mientras que para el día 15, los heterófilos observados en el grupo TL fue mayor que en los otros dos, con diferencias significativas entre el TL y el Antb (p=0,0481). Mientras que en los cortes observados el día 20, para todos los tratamientos la cantidad de este tipo de células no mostró diferencias estadísticamente significativas (ver figura 8a).
Histiocitos. La comparación inicial realizada para el número de histiocitos arrojó diferencias estadísticamente significativas en las observaciones realizadas para los días 15 y 20 (p=0,0046).
Particularmente, al comparar los cortes realizados en los 3 grupos el día 5, se encontró un mayor número de estas células en el TL con diferencias estadísticamente significativas con los grupos Antb (p=0,0204) y control (p=0,007). Mientras que en los siguientes días de las biopsias, 10, 15 y 20, no se registró estadísticamente un número mayor de histiocitos entre los diferentes grupos (ver figura 8b).
Linfocitos. Se encontraron diferencias significativas en las observaciones hechas el día 20 con el día 5 (p=0,0180), el 10 (p=0,0008) y el 15 (p=0,0005), lo que significa que en el día 20, en los tres grupos, el número de linfocitos observado fue bajo en comparación con los otros días. Específicamente, para los cortes observados el día 5, se encontraron diferencias estadísticamente significativas entre los grupos TL y Antb (p=0,0123) y también entre TL y control (p=0,005), con un menor número para el grupo TL. El número de linfocitos se equilibró entre los días 10 y 15, mientras que para el día 20 se volvieron a presentar diferencias estadísticamente significativas entre los grupos 2 y 3 (p=0,0429) (ver figura 8c).
Células plasmáticas. Con respecto al número de células plasmáticas, se presentaron en general entre todos los grupos diferencias estadísticamente significativas entre los días 10 y 15 (p= 0,0135) y también entre los días 15 y 20 (p= 0,0163). Pero no hubo diferencias entre grupos en cada uno de los cortes realizados en los días 5, 10, 15 y 20 (ver figura 8d).
Número de vasos. Hubo diferencias significativas en el número de vasos observados en los cortes realizados a partir de cada una de las biopsias tomadas el día 5 con respecto a la del día 20 (p=0,00153) y entre los días 15 y 20 (p=0,00675) para todos los tratamientos.
Figura 8. Promedio general del número de células en cada uno de los tratamientos durante los 20 días. a) Heterófilos. b) Histiocitos. c) Linfocitos. d) Células plasmáticas. e) Número de vasos. f) Fibroblastos.
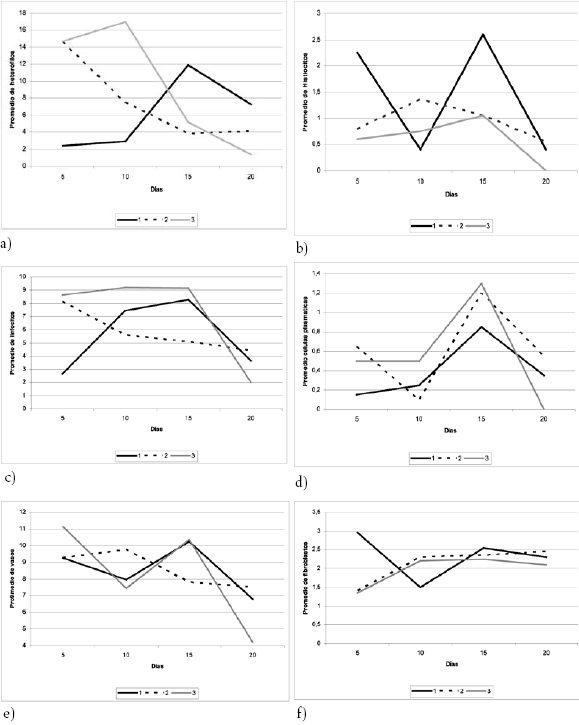
No se presentaron diferencias estadísticamente significativas entre los grupos de tratamiento, en ninguno de los días correspondientes a los tratamientos 5, 10 y 15, mientras que para el día 20 se presentaron diferencias significativas entre los grupos TL y control (p=0,0253) y entre los grupos Antb y control (p=0,0033), con un número menor de capilares para el grupo control en comparación con los otros dos (ver figura 8e).
Fibroblastos. En el análisis de la abundancia de fibroblastos, a través del tiempo, en todos los grupos, se presentaron diferencias estadísticamente significativas entre los días 5 y 15 (p=0,0049), 5 y 20 (p= 0,0426) y 10 y 15 (p=0,0426). En particular, para el día 5 se presentó un mayor número de este tipo celular para el grupo TL en comparación con los otros dos, con diferencias altamente significativas entre los grupos TL y Antb (p=3,09E-9) y TL y control (p=1,241E-9). Para el día 10 en el TL se observó un número menor de células de esta clase, con diferencias significativas con los grupos Antb (p=0,0123) y Control (p=0,0326). En los días 15 y 20 se observó un número similar de fibroblastos para los 3 grupos (ver figura 8f ).
Fibras de colágeno. En general no se encontraron diferencias estadísticamente significativas en el número de fibras de colágeno entre los grupos de tratamiento en el transcurso de todo el experimento. Sin embargo, sí hubo diferencias significativas, en particular, para algunos días. Así, por ejemplo, en el día 5, entre los grupos TL y control (p=0,0014); en el día 10 entre los grupos TL y Antb (p=0,0221) y entre los grupos TL y control (p=0,0414); en el día 15 hubo diferencias significativas entre los grupos Antb y control (p=0,0474). En el día 20 no se presentaron diferencias estadísticamente significativas entre los grupos.
Número de colonias de P. aeruginosa. Con respecto al número de colonias de P. aeruginosa, se encontraron diferencias estadísticamente significativas entre las muestras tomadas en los días 5 y 15 (p= 0,0319) y los días 10 y 20 (p=0,004) y altamente significativas entre las muestras de los días 5 y 20 (p=8,98E-05).
En general, en todas las biopsias, el conteo de número de colonias siempre dio un número mayor en el grupo control con respecto a los otros dos. Así, para el día 5 hubo diferencias estadísticas altamente significativas entre los grupos TL y control (p=3,59E-9) y entre los grupos Antb y control (p=3,59E-9). Para el día 10 las diferencias se mantuvieron altamente significativas entre los grupos TL y Antb (p=1,184E-7) y los grupos TL y control (p=1,184E-7). Al igual que para el día 15 entre los grupos TL y Control (p=6,90E-7) y los grupos Antb y control (p=6,90E-7). En el día 20, se observó una disminución en el número de colonias del grupo control, por lo cual no se presentaron diferencias estadísticamente significativas entre los grupos.
DISCUSIÓN
La evaluación macroscópica de las heridas infectadas con P. aeruginosa mostró, con base en los parámetros utilizados en el presente trabajo y previamente reportados por Wollina [19], que el proceso de curación fue de mejor calidad y menor duración (10 días) para el grupo TL de tratamiento larval, comparado con el tratamiento convencional con Antb. En este último grupo, aunque también se registró la curación de las heridas en cada uno de los especimenes, ocurrió de manera más lenta, teniendo el proceso una duración de 20 días. Estos resultados de eficiencia de la terapia larval sobre las heridas, coinciden con un trabajo previo efectuado por Sherman et al. [20], aplicado a grupos de pacientes humanos con sintomatología de pie diabético, los cuales fueron tratados con terapia larval y terapia convencional, en el cual se demostró que el proceso de cicatrización finalizó a los 15 días al utilizar el primer tratamiento, mientras que en los grupos con tratamiento convencional se produjo en un tiempo mayor. De igual forma, a través del proceso de intervención se observó que las heridas tratadas con terapia larval no sólo presentaron debridación, sino que fueron cubiertas en la base, en un 56% de su superficie, con un excelente tejido fino de granulación sano. En contraste, este tejido cubrió solamente el 15% de la base de las heridas tratadas convencionalmente en el mismo período de tiempo.
Se reconoció la acción antibacterial de las larvas de L. sericata en las heridas infectadas con P. aeruginosa en los conejos de TL, demostrado a través de la reducción en el crecimiento de las colonias observadas en las pruebas microbiológicas, siendo controladas y erradicadas de las lesiones el día 5 de tratamiento. Aunque la desinfección de las heridas por las larvas fue observada por primera vez por Baer, en 1931, [1], se demostró posteriormente que dicha acción se debía, en parte, a las propiedades bactericidas del intestino y/o a las exo-secreciones larvales [4,21]. Más recientemente, se determinó que la reducción bacteriana ocurre primariamente en el intestino medio de las larvas (Mumcuoglu et al., 2001) y la presencia de un comensal Proteus mirabilis en esta región contribuye a la eliminación de los microorganismos. Sin embargo, el efecto bactericida puede deberse, además, a péptidos de bajo peso molecular (catiónicos) que cumplen esta función en todo el organismo o en las excreciones y secreciones de las larvas [5,16,22]. Es posible que la actividad antibacterial de las larvas contra P. aeruginosa que infectaron las heridas en los conejos del TL, se haya dado como resultado de la combinación de las variables señaladas anteriormente.
Los resultados obtenidos, a partir de los registros de observaciones tomadas de las placas dermohistológicas, mostraron que el tratamiento del TL tuvo una rápida neovascularización y, concomitantemente, se observó un gran número de pequeños capilares en el tejido conectivo. Fue evidente, en estas muestras, la presencia de fibroblastos y células endoteliales; estas últimas probablemente intervinieron en el crecimiento de nuevos capilares que participaron como activadores del plasminógeno para convertirlo en plasmina, sustancia responsable de la fibrinólisis y ruptura del esqueleto original de fibrina que se forma en el coágulo [23]. La presencia de fibroblastos en el tejido examinado, como consecuencia de una probable migración hacia éste [24], permite inferir que la fibrina pudo ser reemplazada por colágeno, producida por estas células, siendo observado a los 10 días del tratamiento como fibras de colágeno en la dermis superficial y profunda, las cuales pudieron tener considerable impacto en el proceso de reepitelización.
En días más avanzados del proceso de cicatrización de las heridas, se registró la disminución de fibroblastos en el TL, hecho que sirvió para marcar el final de la fase de proliferación y el comienzo de la etapa de maduración. Por el contrario, en esta misma etapa de la cicatrización, el grupo Antb mostró neovascularización, haciéndose presente un tejido de granulación y escasas células inflamatorias, suceso que señaló el predominio de la fase proliferativa en las heridas de los especimenes de este grupo. La situación descrita, en general, indica que las etapas en el proceso de cicatrización de las heridas se produjeron primero en los animales del grupo TL, comparadas con los del Antb, en la cual los períodos de proliferación y maduración prácticamente se iniciaron cuando los ejemplares del grupo anterior finalizaron dichos eventos. Por el contrario, en el grupo control estas etapas, además de la inflamatoria, estuvieron alteradas y el tiempo en ellas fue mucho mayor.
La cantidad de células y sus estructuras asociadas, analizadas en conjunto (Figuras 8a a 8f ), que fueron observadas en las muestras histológicas tomadas de las heridas, a partir de los especimenes de los grupos experimentales en los diferentes tiempos, permite inferir que la función desarrollada por éstas, en el proceso de cicatrización, estuvo también relacionada con las diferentes fases de dicho proceso y con la acción quimiotáctica ejercida por la secreción de las larvas en el TL. Así por ejemplo, los histiocitos presentaron en los primeros días (0-5) el mayor número de estas células en el TL (Figura 8b), comparado con los otros dos grupos, mostrando diferencias estadísticamente significativas. Sin embargo, en los días siguientes (5-10) el número de estas células bajó drásticamente en el TL, mientras que en el Antb aumentó de manera sustancial. Posteriormente, en los días siguientes (10-15) se produjo un nuevo ciclo de aumento de histiocitos en el TL para, finalmente, reducirse el número de dichas células entre los días 15 y 20. Este comportamiento de los histiocitos en el TL podría ser explicado teniendo en cuenta la respuesta inicial rápida que ejercieron dichas células frente a la infección bacteriana; pero, de igual manera, pudo haberse potenciado dicho efecto por la presencia de las secreciones larvales al actuar como agentes quimiotácticos estimulantes de la migración celular al sitio de la lesión. En este sentido, cobra validez y son concordantes con esta función los hallazgos de Horobin en 2003 [25] y Chambers y Woodrow en 2002 [26], quienes reportaron en las secreciones de las larvas la presencia de citoquinas, que cumplen propiedades quimiotácticas para atraer leucocitos que se encuentran en la circulación sanguínea hacia el área de la herida. La disminución posterior en el número de histiocitos en el TL pudo deberse a que había cesado el estímulo por ausencia de infección y las células que quedaron tuvieron un papel menor en el proceso de reparación y remodelación de la herida. El incremento en el número de estas células que se presentó entre los días 10 y 15, probablemente, coincidió con el cambio final de las larvas por otras en las heridas, las cuales, al igual que las anteriores, siguieron ejerciendo dichas funciones a través de los potentes agentes quimiotácticos presentes en la saliva y no como respuesta a una infección latente, en razón a que ésta ya había desaparecido y el proceso de cicatrización prácticamente había culminado.
Con los resultados del presente trabajo se demuestra la eficacia de la terapia larval, aplicada a heridas infectadas con P. aeruginosa en un biomodelo experimental con conejos, su acción se fundamentó en una mejor calidad y menos tiempo de duración en el proceso de cicatrización de las heridas, comparado con el tratamiento convencional con antibióticos; además, con esta tecnología natural, hubo incremento en las etapas de la curación de las heridas, con base en la multiplicación celular, la formación de fibras de colágeno, la regeneración de vasos y la reepitelización del tejido dañado.
AGRADECIMIENTOS
A la Universidad del Rosario y a la Universidad de La Salle por la financiación del presente trabajo. Al doctor Jorge Hernando Forero, docente de la Universidad de la Salle, por el apoyo y la colaboración brindados durante el proceso con los animales de experimentación. De igual forma, a la doctora Yovana Castellanos, docente en patología de Universidad de La Salle, por la colaboración en la lectura de las placas dermohistológicas.
CONFLICTO DE INTERESES
En la realización del presente trabajo no se presentó ningún conflicto de interés financiero, político ni académico.
REFERENCIAS
1. Baer WJ. The treatment of chronic osteomyelitis with the maggot (larva of the Blowfly) J. Bone Joint Surg 1931;13:438-75. [ Links ]
2. Robinson W, Norwood V. The role of surgical maggots in the disinfection of osteomyelitis and other infected wounds. J. Bone Joint Surg 1933;15:409-412. [ Links ]
3. Weil GC, Simon RJ, Sweadner WR. A biological. Bacteriological and clinical study of larval or maggot thertapy in the treatment of acute and chronic pyogenic infections. Am J Surg 1933;19:36-46. [ Links ]
4. Simmons SW. Stimulation of healing in nonhealing wounds by allantoin occurring in maggot secretions and of wide biological distribution. JBJS Apr 1935;17:267-271. [ Links ]
5. Kerridge A, Lappin-Scott H, Stevens JR. Antibacterial properties of larval secretions of the blowfly, Lucilia sericata. Med Vet Entomol 2005;19:333-337. [ Links ]
6. Sherman RA, Wyle F. Medicinal maggots: an ancient remedy for some contemporary afflictions. Annu Rev Entomol 2000;45:55-81. [ Links ]
7. Mumcuoglu KY. Clinical applications for maggots in wound care. Am J Clin Dermatol 2001;4:219-27. [ Links ]
8. Stoddard SR, Sherman RM, Mason BE, Pelsang DJ. Maggot debridement therapy. an alternative treament of nonhealing ulcers. J Am Podiatr Med Assoc 1995;85(4):218-221. [ Links ]
9. Mumcuoglu KY, Ingber A, Gilead L, Maggot therapy for treatment of intractable wounds. Diabetes Care 1999;21(11):2030-1. [ Links ]
10. Mumcuoglu KY, Ingber A, Gilead L, Maggot therapy for treatment of intractable wounds. Diabetes Care 1998;21(11):2030-1. [ Links ]
11. Thomas AML, Harding K.G. & Moore K. The structure and composition of chronic wound eschar. J. Wound Care 1999; 8:285-286. [ Links ]
12. Parnés A, Lagan KM. Larval therapy in wound management: A review. Int J Clin Pract 2007;61(3):488-493. [ Links ]
13. Courtenay M, Church JCT, Ryan TJ. Larva therapy in wound management. JRSM. 2000;93(2):72-74. [ Links ]
14. Church S. The traditional use of maggots in wound healing and the development of larval therapy (biosurgery) in modern medicine. J Altern Complement Med 1996;2(4):525-27. [ Links ]
15. Namias CJ. A case report of maggot therapy for limb salvage after fourth-degree burns. J Burn Care Rehab 2000;21(3):254-57. [ Links ]
16. Huberman L, Gollop N, Mumcuoglu KY, Breuer E, Bhusare SR, Shai Y, Galun R. Antibacterial substances of low molecular weight isolated from the blowfly, Lucilia sericata. Med Vet Entomol 2007;21(2):127-31. [ Links ]
17. Carpenter JW, Mashima TY, Rupiper DJ. Hedgehogs, in Exotic Animal Formulary (ed2). WB Saunders, p 268, 2001. [ Links ]
18. Loui M, Cockenil F. Infectious disease. Clinics of North America 2001; 4:15. [ Links ]
19. Wollina U. Biosurgery supports granulation and debridement. Int J Dermatol 2002;41:635–39. [ Links ]
20. Sherman RA. Maggot Therapy for treating diabetic foot ulcers unresponsive to conventional therapy. Diabetes Care 2003;26:446-451. [ Links ]
21. Pavillard ER, Wright EA. An antibiotic from maggots. Nature. 1957; 180 :916-917. [ Links ]
22. Bexfield A, Nigam Y, et al. Detection and partial characterization of two antibacterial factors from the excretions/secretions of the medicinal maggot Lucilia sericata and their activity against methicillin-resistant Staphylococcus aureus (MRSA). Microbes Infect 2004;6(14):1297-30 4. [ Links ]
23. Swaim SF, Riddell KP, McGuire JA. Effects of topical medications on the healing of open pad wounds in dogs. J Am Anim Hosp Assoc 1992;28(6):499-502. [ Links ]
24. Horobin AJ, Shakesheff KM, Pritchard DI. Maggots and wound healing: an investigation of the effects of secretions from Lucilia sericata larvae upon the migration of human dermal fibroblasts over a fibronectin-coated surface. Wound Rep Regen 2005;13 (4):422-33. [ Links ]
25. Horobin AJ, Shakesheff KM, Woodrow S, Robinson C, Pritchard DI. Maggots and wound healing: an investigation of the effects of secretions from Lucilia sericata larvae upon interactions between human dermal fibroblasts and extracellular matrix components. Br J Dermatol 2003;48: 923-33. [ Links ]
26. Chambers L, Woodrow S, Brown AP, Harris PD, Hillips DP, Hall M, Church J, Pritchard DI. Degradation of extracellular matrix components by defined proteinases from the greenbottle larva Lucilia sericata used for the clinical debridement of non-healing wounds. Br J Dermatol 2003;148: 14-23. [ Links ]














