Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Ciencias de la Salud
versión impresa ISSN 1692-7273versión On-line ISSN 2145-4507
Rev. Cienc. Salud v.6 n.2 Bogotá mayo/ago. 2008
Evaluación del efecto tóxico de extractos de Eupatorium microphyllum L.F. (Asteraceae) sobre larvas de Aedes aegypti (Diptera: Culicidae) en condiciones de laboratorio
Evaluation of the toxic effect from Eupatorium microphyllum L.F. (Asteraceae) extracts on Aedes aegypti larvae (Diptera: Culicidae) in laboratory conditions
Álvaro Rozo,1 Cristina Zapata,2 Felio J. Bello3
1. MSc. Departamento de Ciencias Básicas; Universidad de La Salle, Bogotá, DC, Colombia.
2. MSc. Departamento de Ciencias Básicas; Universidad de La Salle, Bogotá, DC, Colombia.
3. PhD. Departamento de Ciencias Básicas, Facultad de Medicina, Universidad del Rosario, Bogotá, DC, Colombia. Correo electrónico: fbello@urosario.edu.co.
Recibido: 12 de mayo de 2008 Aceptado: 10 de junio de 2008
Resumen
En el presente trabajo se evaluó la actividad tóxica de extractos de Eupatorium microphyllum L.F. sobre larvas de IV estadio del mosquito Aedes aegypti (Linneaus), bajo condiciones de laboratorio. Se utilizaron extractos acuosos en concentraciones del 500 mg L-1, 1.500 mg L - 1 y 2.500 mg L-1 y acetónicos en concentraciones de 10 mg L-1, 20 mg L-1, 30 mg L-1, 40 mg L-1 y 50 mg L-1. Los bioensayos se realizaron por triplicado, cada uno con 20 larvas, expuestas durante 24 horas a 150 mL de solución. En todos los ensayos biológicos se emplearon grupos control. En la evaluación de los extractos acetónicos, se empleó un control negativo para evitar que la mortalidad de las larvas ocurriera a causa del solvente. Los extractos acuosos mostraron acción moderadamente baja en la mortalidad de larvas, menor del 20%. Por el contrario, la acción de los extractos acetónicos se observó a 10 y 20 mg L-1, con 15% de mortalidad, mientras que a 30 y 40 mg L-1 se registraron 22 al 38% de mortalidad, en tanto que a 50 mg L-1 la mortalidad fue del 95,4% con resultados estadísticos altamente significativos. Las concentraciones de los extractos acetónicos mostraron ser las más eficientes para el control de los mosquitos seleccionados. Ambos tipos de extractos mostraron efecto tóxico en larvas de A. aegypti; sin embargo, se observó mayor efecto en los extractos acetónicos en relación con los extractos acuosos de E. microphyllum, lo cual constituye una alternativa viable en la búsqueda de nuevos larvicidas a partir de compuestos naturales.
Palabras clave: Eupatorium microphyllum, Aedes aegypti, bioensayos, extractos acuosos y acetónicos, concentraciones letales CL50 y CL95.
Summary
In the present work the toxic activity of extracts of Eupatorium microphyllum L.F. was evaluated on 4 th instar larvae of the mosquito Aedes aegypti (Linneaus), under laboratory conditions. Aqueous extracts were utilized in concentrations of 500 mg L-1, 1,500 mg L-1 and 2,500 mg L-1 and acetone in concentrations of 10 mg L-1, 20 mg L-1, 30 mg L-1, 40 mg L-1 and 50 mg L-1. The bioassays were carried out for triplicate each one with 20 larvae, exposed for 24 hours to 150 mL of solution. In all the bioassays were employed control groups. In the evaluation of the acetone extracts, a negative control was employed to avoid that the mortality of the larvae to occur on account of the solvent. The Aqueous extracts showed low moderate action in the mortality of larvae, less than 20%. On the contrary, the action of the acetone extracts was observed to 10 and 20 mg L-1 with 15% of mortality, while to 30 and 40 mg L-1 were registered 22 to 38% of mortality. However, to 50 mg L-1 the mortality was of 95.4% with highly significant statistical results. The concentrations of the acetone extracts showed to be the most efficient for the control of the mosquitoes selected. Both types of extracts showed toxic effect in larvae of A. aegypti, nevertheless, greater effect in the acetone extracts was observed relating to the aqueous extracts of E. microphyllum, which constitutes a viable alternative in the search of new larvicides from composed natural.
Key words: Eupatorium microphyllum, Aedes aegypti, bioassays, aqueous and acetone extracts, lethal Concentrations LC50, LC95.
INTRODUCCIÓN
Aedes aegypti es un mosquito doméstico, vector de diversos arbovirus. Su mayor importancia epidemiológica radica en ser el principal transmisor de dengue y fiebre amarilla; sin embargo en otras latitudes, también ha sido reportado como vector de filariasis humana [1,2].
La Organización Panamericana de la Salud (OPS) señala una constante dispersión y reinfestación de A. aegypti en diversas regiones de la América, con frecuentes e importantes epidemias de dengue en Argentina, Colombia, Bolivia, Ecuador, Paraguay, Perú, Venezuela, México, Estados Unidos y todos los países de Centroamérica y el Caribe [3]. Este fenómeno amenaza extenderse hasta la actualidad; particularmente, en Colombia los primeros brotes de dengue, asociados con los serotipos 2 y 3, se presentaron en la década de los setenta y, desde 1984 hasta nuestros días, han circulado los 4 serotipos, lo que periódicamente ha originado brotes de la enfermedad, los cuales han sido transmitidos por A. aegypti. Varias investigaciones señalaron que en Colombia los casos reportados de fiebre amarilla entre 2003 y 2005 provienen principalmente de zonas selváticas [3-7]. Se han considerado dos casos transmitidos por especies de mosquitos diferentes al vector doméstico, probablemente de los géneros Haemagogus y Sabethes. No obstante, existe el riesgo latente de la urbanización de la enfermedad, debido a la presencia de A. aegypti en la cercanía de algunas áreas enzoóticas del país [6].
Para el control de los vectores adultos de A. aegypti, corrientemente se utilizan insecticidas piretroides de acción residual en paredes y sitios de reposo de estos mosquitos. Con frecuencia también se usan insecticidas organofosforados (principalmente temefos) que se aplican mediante tratamiento focal y perifocal en los sitios de cría de las larvas. Sin embargo, los problemas de la aplicación de estos insecticidas químicos de carácter comercial están relacionados con la creciente resistencia que ocasionan en los mosquitos y también por la contaminación ambiental que generan [8-9]. En Colombia se evidenció la resistencia de A. aegypti a insecticidas como el DDT en 13 poblaciones; en un 54% a la lambdacialotrina; 8 poblaciones fueron resistentes a temefos [10]. En consecuencia, una alternativa de control surge del concepto de manejo integrado de plagas, incluyendo controladores biológicos, manejo ambiental y utilización de insecticidas de origen vegetal, los cuales proporcionan modos de acción novedosos y reducen el riesgo de resistencia cruzada [11-12].
En el contexto anterior, se hace necesario evaluar insecticidas vegetales que presenten la ventaja de ser opciones de bajo riesgo para el ser humano, efectivos en el control de mosquitos e inocuos para el ambiente. Las propiedades antes señaladas que se logran con los insecticidas de productos naturales, además de su bajo costo, posibilitaría un amplio uso en programas de manejo integrado de plagas y enfermedades [11].
La mayoría de los insecticidas vegetales son extractos constituidos por un grupo de ingredientes activos de diversa naturaleza química. Desde el punto de vista de la resistencia, la baja estabilidad de los insecticidas vegetales, se convierte en un factor positivo pues la probabilidad de que dos extractos sean iguales es mínima, en razón a que la presión ejercida por el insecticida sobre los mosquitos no es siempre la misma. Esto se debe a que, aunque en el extracto se encuentren los mismos principios bioactivos, no siempre se encontrará en las mismas concentraciones. En general, la resistencia por parte de los insectos tarda más tiempo en desarrollarse cuando se usa una mezcla de ingredientes activos naturales, que cuando se utiliza cualquiera de sus componentes por separado, lo cual puede deberse a que es más difícil detoxificar un complejo de sustancias que a un solo compuesto [13].
Las evaluaciones realizadas con extractos acuosos de plantas [14- 18], extractos acetónicos [19-21] y aceites vegetales [22-23] contra larvas de mosquitos, han incrementado la lista a más de 140 especies de plantas con propiedades larvicidas, número inicialmente reportado por Grainge y Ahmed [24]. Entre las plantas que se han destacado contra larvas de mosquitos se encuentran las del género Annona: A. bullata (Rich), A. densicoma (Mart), A. glabra (L), A. muricata y A. squamosa (L), tóxicas para larvas de los mosquitos A. aegypti, Culex quinquefasciatus y Anopheles spp. De las anteriores plantas se han extraído nueve principios activos pertenecientes a las acetogeninas y a los alcaloides, los cuales se encuentran principalmente en la corteza y la semilla, aunque también se han reportado en raíz, fruto y hoja. En Colombia, recientemente, se evaluó la toxicidad de extractos etanólicos de A. muricata, Melia azedarach y Ricinus communis sobre larvas de IV estadio de A. aegypti, con resultados que fueron caracterizados por los autores como promisorios para el control de este mosquito [12].
Eupatorium microphyllum es un arbusto conocido vulgarmente como patinegra, trébol aromatizador, chilca, salvia o jarilla que suele encontrarse en las región andina de Colombia. Presenta ramas pequeñas, tallos cortos redondos, hojas opuestas pecioladas; ápice agudo acuminado, base más o menos angosta de 5- 8 mm de larga y de 4- 5 mm de ancha, haz verde oscuro, envés blanco lanuginoso, con bordes festonados; inflorescencia en corimbos terminales, ramificados, tubulosos de 1,5 cm de ancho por 7 mm de longitud; cabezuelas homógamas, con flores hermafroditas de color lila, 25-35 flores; involucro cilíndrico de unos 0,5 cm; receptáculo subconvexo, desnudo y papo o vilano lila [25].
Las especies del género Eupatorium se han reconocido como útiles por sus efectos medicinales ya que se han preconizado como digestivos, carminativos, emenagogos, febrífugos, antisífiliticos, antiinflamatorios, antimicrobianos y anticancerígenos [25-27].
El objetivo principal del presente trabajo fue evaluar, por primera vez, la actividad tóxica de extractos acuosos y acetónicos de Eupatorium microphyllum sobre larvas de IV estadio de A. aegypti, en condiciones de laboratorio.
MATERIALES Y MÉTODOS
La presente investig ación se efectuó en el laboratorio de Entomología, Biología Celular y Genética de la Universidad de La Salle, Bogotá, Colombia.
Preparación del material vegetal
El material vegetal (arbustos de E. microphyllum) se recolectó en varios sitios de la Sabana de Bogotá y en el municipio de Machetá, Cundinamarca, Colombia (5º37´00''LN- 73º37´00''LO). La preparación de la muestra y los extractos se realizó según las metodologías propuestas por Rodríguez y Lagunas [14], Bowers et al [16] y Sánchez et al [18].
Las plantas se recolectaron en etapa de floración. Luego, todo el material vegetal (flores, tallos, hojas y raíz) se secó por ventilación natural y bajo sombra por 48 a 60 horas hasta obtener un peso constante por pérdida de agua. Posteriormente se molió el material vegetal (tallos, hojas, flores y raíces) en un molino eléctrico, hasta obtener un polvo fino.
Preparación de los extractos
La preparación de los extractos acuosos crudos se realizó en maceración por 24 horas en una proporción de 5, 15 y 25 g por 100 mL de agua destilada (P/V), respectivamente, con concentraciones finales de 500 mg L - 1, 1.500 mg L - 1 y 2.500 mg L - 1. Luego se llevó a cabo la filtración al vació a través de un papel de filtro Whatman Nº 1.
Posteriormente se preparó el extracto acetónico, mediante maceración en frío por 48 horas, en una proporción de 75 gr de polvo de la planta por 500 mL (P/V) de acetona grado analítico. Luego se evaporó el solvente en un rotavapor tipo flash a presión reducida y temperatura constante (temperatura de ebullición de la acetona 56,2ºC ), hasta obtener el extracto concentrado, sin presencia del solvente. A partir del extracto crudo se prepararon las concentraciones de 10 mg L-1, 20 mg L-1, 30 mg L-1, 40 mg L-1 y 50 mg L-1.
Bioensayos
La evaluación de la toxicidad se efectuó con larvas de IV estadio, recién emergidas del mosquito A. aegypti, cepa Riohacha, colonizada en el laboratorio de Entomología de la Universidad de La Salle [28].
Extracto acuoso
Se seleccionaron cuatro grupos con 20 larvas cada uno: tres experimentales y uno control en vasos de plástico de 150 mL de capacidad con 50 a 70 mL de las respectivas concentraciones (500 mg L - 1, 1.500 mg L - 1 y 2.500 mg L - 1) para los experimentales y agua para el control.
Extracto acetónico
Se utilizaron siete grupos larvales: dos como control con dosis del extracto cero por ciento, uno con solvente y el otro con agua, para verificar que la mortalidad de las larvas no ocurriera a causa de la acetona, y los 5 restantes con las concentraciones experimentales de 10 mg L-1, 20 mg L-1, 30 mg L-1, 40 mg L-1 y 50 mg L-1.
Cada experimento se realizó por triplicado. Los bioensayos se establecieron bajo un diseño experimental completamente aleatorio a una temperatura promedio de 27 o C, humedad relativa de 69±10%, con 12 horas de fotoperiodicidad. A las 24 horas después de la aplicación de los tratamientos se verificó la mortalidad de las larvas.
Análisis estadístico
La corrección de mortalidad se efectuó con base en la ecuación de Abbott [29]. No se tuvieron en cuenta mortalidades menores al 4% y superiores a 12%, en cuyo caso, el experimento se repetía. Los bioensayos se establecieron bajo un diseño experimental completamente aleatorio (cada individuo utilizado para el experimento fue seleccionado al azar de la población total de la colonia). Los datos de mortalidad se analizaron con los modelos Probit [30] (Logit y Log) para determinar la concentración letal media (CL50) y la concentración letal al 95% (CL95 ). Además, para comparar dichos modelos en función de los valores de significancia sobre la mortalidad larval y seleccionar el más ajustado, se utilizó un análisis de varianza (ANOVA) y el test de Hosmer y Lemeshow [31].
RESULTADOS
Mortalidad larvaria de extractos de de larvas con los extractos acuosos y acetónicos de E. microphyllum
Concentraciones de 500 mg L-1, 1.500 mg L-1 y 2.500 mg L-1 de los extractos acuosos de E. microphyllum alcanzaron mortalidades de 8,3%, 11,6% y 19,29%. respectivamente, siendo este último valor moderadamente bajo.
Concentraciones de 10 mg L-1, 20 mg L-1, 30 mg L-1, 40 mg L-1 y 50 mg L-1, de los extractos acetónicos de E. microphyllum registraron, para la mortalidad larval, los siguientes valores: 5, 15, 22,2, 38,6 y 95,4%, respectivamente. Se observa el aumento de las concentraciones en proporción directa al incremento de la mortalidad, alcanzando un valor significativamente alto la concentración de 50 mg L-1.
Modelos estadísticos en la mortalidad larvaria por extractos acuosos y acetónicos de E. microphyllum
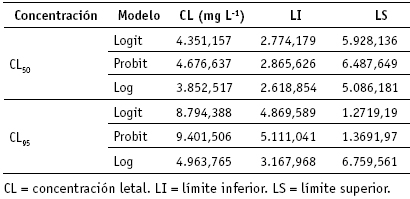
La utilización de un análisis de varianza y del test Hosmer y Lemeshow [31] para comparar los modelos Logit, Probit y Log, al emplear extractos acuosos extraídos de los arbustos, mostraron valores de p mayores a 0,05, los cuales indicaron, en todos los casos, ningún efecto estadísticamente significativo sobre la mortalidad de los insectos (tabla 1).
Tabla 1. Concentraciones letales CL50 y CL95, intervalos de confianza bajo los modelos Logit, Probit y Log en la m ortalidad de larvas A. aegypti, por extractos acuosos a 500 mg L-1, 1500 mg L-1 y 2500 mg L-1
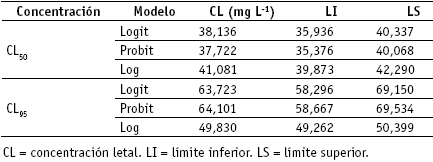
Contrariamente, con el uso de extractos acetónicos se registraron valores de p menores de 0,01, indicando efectos altamente significativos sobre la mortalidad larval. Sin embargo, al comparar los valores de los tres modelos (Logit, Probit y Log) se constató que el más ajustado correspondió a los datos del modelo Log, en razón a la menor diferencia entre los valores del límite superior e inferior.
En la tabla 2 se muestran los datos de las concentraciones letales CL50 y CL95. Los valores del modelo Log coinciden, en ambas concentraciones letales, con la mayor mortalidad larval alcanzada a 50 mg L-1, dependiente de los extractos acetónicos de E. microphyllum.
Tabla 2. Concentraciones letales CL50 y CL95, intervalos de confianza bajo los modelos Logit, Probit y Log en la m ortalidad de larvas de A. aegypti, por extractos acetónicos a 10 mg L-1, 20 mg L-1, 30 mg L-1 ,40 mg L-1 y 50 mg L-1
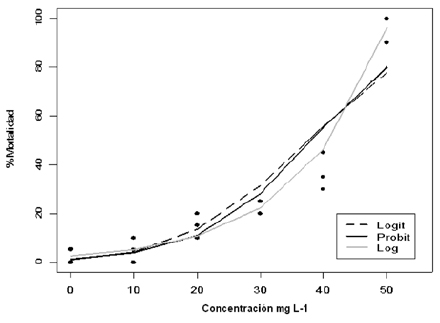
En la gráfica 1 se aprecian los tres modelos ajustados y las mortalidades observadas. En este gráfico se verifica lo obtenido con el test de Hosmer y Lemeshow [31], es decir, el modelo que mejor describe el conjunto de datos es el modelo Log.
Gráfica 1. Mortalidad en larvas de IV estadio de A. aegypti, por extractos acetónicos a 10mg L-1, 20mg L-1, 30mg L-1, 40mg L-1 y 50mg L-1
DISCUSIÓN
Los bioensayos con extractos acuosos a las concentraciones de 500 mg L-1, 1.500 mg L-1 y 2.500 mg L-1 mostraron acción moderadamente baja en la mortalidad de larvas de IV estadio del mosquito A. aegypti, menor del 20%. Brattsten [32] reporta este fenómeno de mortalidad baja debido a que los insectos son capaces de metabolizar una gran variedad de compuestos exógenos para hacerlos más hidrofílicos y, generalmente, menos tóxicos. Probablemente esta habilidad fisiológica evolucionó en el mosquito para detoxificar los metabolitos secundarios presentes en el extracto acuoso.
En la actualidad no existen reportes de extractos de la especie E. microphyllum utilizados para control de insectos transmisores de enfermedades, pero sí de otras especies de dicho género con efecto citotóxico, antitumoral y antileucémico [33-34]. En contraste con los resultados obtenidos a partir de los extractos acuosos, en los cuales no fue significativa la mortalidad larval del mosquito A. aegypti, otros estudios desarrollados por Rodríguez y Lagunas [14] demostraron que las plantas del género Annona son potencialmente tóxicas para larvas de A. aegypti, C. quinquefasciatus y Anopheles sp, en ensayos evaluativos tanto con extractos acuosos como acetónicos. Con los tratamientos del extracto acuoso de A. squamosa al 25% se presentó mortalidad larval de C. quinquefasciatus mayor del 20%. A la vez, los resultados de mortalidad ocasionados por el extracto acetónico a la dosis 0,01% evidenciaron un rango de efectividad del 100%, en larvas de IV estadio de C. quinquefasciatus. Otros autores, como Sánchez et al [18], utilizaron extractos acuosos de A. muricata a una dosis del 66% y determinaron el 100% de mortalidad de larvas de A. aegypti. Por su parte, Phukan y Kalita [35] mencionan bioactividad tóxica relativamente alta a partir de extractos acuosos en una concentración de 70 mg L-1 de Litsea salicifolia contra A. aegypti y C. quinquefasciatus. Sin embargo, hubo algún grado de coincidencia en la eficacia de los extractos acetónicos, tanto en los trabajos antes señalados como en el presente, en el cual se alcanzó mortalidad larval hasta del 95,4%.
A partir de los resultados de los modelos estadísticos, en la mortalidad ocasionada por los extractos acuosos, se observó que para este conjunto de datos no fue significativa en ninguno de los modelos propuestos, lo cual indica que el extracto vegetal acuoso en sus diferentes concentraciones no tuvo efectos sobre la tasa de mortalidad; por lo tanto, l as concentraciones letales no fueron confiables porque el modelo arrojó como resultado la no efectividad de éstas en la mortalidad larval del mosquito A. aegypti.
Por el contrario, los extractos acetónicos presentaron diferentes niveles de mortalidad larval. Así, para las dosis del 10 mg L-1 y 20 mg L-1 fue moderadamente baja, la mortalidad fue menor del 15%, mientras que en las dosis de 30 mg L-1 y 40 mg L-1 fue moderadamente alta (22-38%), y para la concentración de 50 mg L-1, la mortalidad fue alta y muy significativa. Así mismo, los parámetros de los modelos estadísticos permitieron establecer que el extracto acetónico en la concentración de 50 mg L-1 presentó un efecto estadísticamente significativo sobre la mortalidad larval, tal como se registró en el análisis de varianza en los modelos cotejados y concomitantemente tuvo el mayor grado de coincidencia con las concentraciones letales obtenidas.
En un trabajo reciente realizado en Colombia, Parra et al [12], evaluaron la actividad de extractos etanólicos obtenidos de las semillas de A. muricata, Melia azedarach y Ricinos communis contra larvas de IV estadio de A. aegypti y nauplios de Artemia salina, encontrando que el más activo de estos vegetales fue R. communis con una concentración letal media de 860 ppm y una concentración letal, al 95%, entre 450 y 1.400 ppm, seguido por el extracto de A. muricata, con una LC50 de 900 ppm y LC95, entre 380 y 1.300 ppm. Finalmente, la menor toxicidad la tuvo M. azedarach con una LC50 de 1.800 y LC95 entre 1.500 y 2.100 ppm. Estos resultados, comparados con los obtenidos en el presente trabajo. muestran que los extractos acetónicos de E. microphyllum (CL50 de 41.081 ppm y CL95 de 49.830 ppm) fueron más activos sobre las larvas del mosquito A. aegypti, en razón a que las concentraciones de los extractos requeridas para lograr tales tasas de mortalidad fueron menores.
Los valores de la estadística de Hosmer y Lemeshow [31], para los tres modelos considerados, permite señalar que la prueba de Log es la que más se ajusta a los resultados obtenidos. Para la presente investig ación, sólo este modelo describe satisfactoriamente el comportamiento de la mortalidad en relación con la concentración de extracto vegetal; por tanto, es recomendable usarlo para la estimación de las concentraciones letales CL50 y CL95 en investig aciones de este tipo, bajo condiciones de laboratorio.
En conclusión, la utilización de los extractos de E. microphyllum contra las larvas de IV estadio de A. aegypti, principalmente los acetónicos a las mayores concentraciones usadas en el presente trabajo (40 mg L-1 y 50 mg L-1), permiten validarlos como potenciales larvicidas naturales contra esta especie de mosquito y, probablemente, también contra otras de la familia Culicidae. Sin embargo, se requiere la evaluación a nivel de campo para poder determinar, además de la toxicidad contra los mosquitos en su hábitat natural, la estabilidad de los compuestos y su impacto a nivel ambiental.
AGRADECIMIENTOS
A la Universidad de La Salle y a la Universidad del Rosario por la financiación de esta investig ación. Al Departamento de Investigaciones de la Universidad de La Salle por el apoyo brindado y, particularmente, a la doctora Estrella Cárdenas, por la asesoría y colaboración recibida en el desarrollo del presente trabajo. Al auxiliar del laboratorio de Entomología de la Universidad de La Salle, Gilberto Torres, por suministrar las muestras del insecto y su colaboración en el mantenimiento de este material biológico.
REFERENCIAS
1. Tabachnick WJ. The yellow fever mosquito. Evolutionary genetics and arthropod-born disease. Am Entomol 1991; 37:14-29. [ Links ]
2. Maillard M, Marston A, Hostettmann K. Search for molluscicidal and larvicidal agents from plants. In M Balandrin, Human Medicinal Agents From Plants, Washington DC: American Chemical Society; 1993. [ Links ]
3. Organización Panamericana de la Salud. Dengu e y dengue hemorrágico en las Américas: guía para su prevención y control. Publicación Científica; 548. Washington D.C; 1997, p. 109. [ Links ]
4. Groot SJ, Gacharná MG. Dengue en Colombia. Biomédica 1986;6:101-6. [ Links ]
5. Rodríguez G, Velandia M, Boshell J. Fiebre amarilla. La enfermedad y su control. Bogotá: División de Biblioteca y Publicaciones, INS; 2003, p.47. [ Links ]
6. Velandia MP. La fiebre amarilla y su control. Biomédica 2004;24:5-6. [ Links ]
7. Informe Quincenal Epidemiológico Nacional-INS. Sivigila. Consolidados de las semana 47 a 52, 2005, p. 381. [ Links ]
8. Urano AF, Maciel VM, Craveiro AA, Lacerda MI, Braga M, Fontenele E. Larvicidal activity of the essential oil from Lippia sidoides Cham. against Aedes aegypti Linn. Short Communication. Mem Inst Oswaldo Cruz 2003;98:569-571. [ Links ]
9. Coria C, Almiron W, Valladares G, Carpinella C, Ludueña F, Defago M and Palacios S. 2008. Larvicide and oviposition deterrent effects of fruit and leaf extracts from Melia azedarach L. on Aedes aegypti (L.) (Diptera: Culicidae) Bioresour Technol 2008;99: 3066-3070. [ Links ]
10. Santacoloma L, Brochero HL, Chaves B. Estado de la susceptibilidad a insecticidas de A aegypti (Linnaeus 1762) (Diptera: Culicidae) en cinco departamentos de Colombia. Memorias XIII Congreso Colombiano de Parasitología y Medicina Tropical. Ibagué. Colombia; 2007, p. 175. [ Links ]
11. Arnason JT, Philogene BJ, Morand P. Insecticides of plants origin. Washington, DC: Americal Chemical Society; 1989, p. 213. [ Links ]
12. Parra G, García C, Cotes J. Actividad insecticida de extractos vegetales sobre Aedes aegypti (Diptera: Culicidae) vector del dengue en Colombia. Revista CES Medicina. 2007;21:47-54. [ Links ]
13. Bowers WS, Ohta T, Cleere JS, Marcella PA. Discovery of insects anti-juvenile hormones in plants. Sci. 1976 193: 542-547. [ Links ]
14. Rodríguez HC, Lagunas R. Combate de mosquitos Aedes aegypti y Culex quinquefasciatus (Diptera: Culicidae) con sustancias acuosas vegetales. Primer Encuentro Estatal sobre Entomología Médica y Veterinaria. Cuernavaca: Morelos; 1989, p. 133-142. [ Links ]
15. Rivera RI. Toxicidad de extractos acuosos vegetales en larvas de Aedes aegypti (Diptera: Cullicidae). Tesis de licenciatura. Parasitología Agrícola, UACH. Chapingo, México; 1992, p. 59. [ Links ]
16. Bowers WS, Sener B, Evnas H, Bingol F, Erdogan I. Activity of Turkish medicinal plants against mosquitoes Aedes aegypti and Anopheles gambiae. Insect Sci Appl. 1995;16:339-242. [ Links ]
17. Chansang U, Zahiri NS, Bansiddhi J, Boonruad T, Thongsrirak P, Mingmuang J, Benjapong N, Mulla MS. Mosquito larvicidal activity of aqueous extracts of long pepper (Piper retrofractum vahl) from Thailand. J Vector Ecol 2005;30:195-200. [ Links ]
18. Sánchez MC, González N, González E. Efecto larvicida de extractos acuosos vegetales sobre Aedes aegypti. Manejo Integrado de Plagas 1997;45:30-33. [ Links ]
19. Rahuman AA, Gopalakrishnan G, Ghouse BS, Arumugam S, Himalayan B. Effect of Feronia limonia on mosquito larvae. Fitoterapia 2000;71:553-555. [ Links ]
20. Chaubal R, Pawar PV, Hebbalkar GD, Tungikar VB, Puranik VG, Deshpande VH, Deshpande NR. Larvicidal activity of Acacia nilotica extracts and isolation of D-pinitol-a bioactive carbohydrate. Chem Biodivers 2005;2:684-8. [ Links ]
21. Rahuman AA, Venkatesan P. Larvicidal efficacy of five cucurbitaceous plant leaf extracts against mosquito species. Parasitol Res. En Prensa. 2008. [ Links ]
22. Ho SH, Goh PM, Lee KM. Evaluation of two pine oil-based formulations of kits agains varius life stages of Aedes aegypti. Inter Pest Cont 1992;34:180-181. [ Links ]
23. Samarasekera R, Weerasinghe IS, Hemalal KP. Insecticidal activity of menthol derivatives against mosquitoes. Pest Manag Sci 2008; 64:290-295. [ Links ]
24. Grainge MS, Ahmed. Handbook of plants pest-control properties. New York: John Wiley & Sons; 1988, p. 470. [ Links ]
25. García-Barriga H. Flora medicinal de Colombia. Tomo III Instituto de Ciencias Naturales. Bogotá: Universidad Nacional de Colombia; 1975, p. 296-299. [ Links ]
26. El-Seedia HR, Oharaa BT, Sataa N, Nishiyama S. Antimicrobial diterpenoids from Eupatorium glutinosum (Asteraceae). J Ethnopharmacol 2002;81:293-296. [ Links ]
27. Sasikumar M, Pichai A, Doss A. Antibacterial activity of Eupatorium glandulosum leaves. Fitoterapia 2005;76:100-103. [ Links ]
28. Ardila A, Escovar J, Bello F. Características de nuevos cultivos celulares derivados de tejidos embrionarios de Aedes aegypti (Diptera: Culicidae). Biomédica 1995;25:65-75. [ Links ]
29. Abbott WS. A method of compting the effectiveness of an insecticide. J Econ Entomol 1925;18:265-267. [ Links ]
30. Raymond M. Presentation d' un programe Basicd' analyzes log-probit pour microordinater. Cah. ORSTOM. Serie Entom Med Paras 1985;28:117-121. [ Links ]
31. Hosmer DW, Lemeshow S. Applied Logistic Regression. New York: John Wiley; 1989, p. 660. [ Links ]
32. Brattsten LB. Inducibility of metabolic insecticide defenses in boll weerils and tobacco budworm caterpillars. Pest Biochem Physiol 1987; 27:13-23. [ Links ]
33. Kupchan SM, Maruyama M, Hemingway RJ, Hemingway JC, Shibuya S, Fujita T. Structural elucidation of novel tumor-inhibitory sesquiterpene lactones from Eupatorium cuneifolium. J Org Chem 1973;38:2189-96. [ Links ]
34. Takahashi T. Hiyodorilactones A and B, new tumor inhibitory germacradienolides from Eupatorium sachalinense. Makino Chemistry Letters 1978;12:1345-48. [ Links ]
35. Phukan S, Kalita MC. Phytopesticidal and repellent efficacy of Litsea salicifolia (Lauraceae) against Aedes aegypti and Culex quinquefasciatus. Indian J Exp Biol 2005;43:472-4. [ Links ]














