Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Ciencias de la Salud
Print version ISSN 1692-7273On-line version ISSN 2145-4507
Rev. Cienc. Salud vol.6 no.2 Bogotá May/Aug. 2008
Fundamento biológico y aplicación clínica de los marcadores tumorales séricos
Biological basis and clinical application of serum tumor markers
Paola Andrea Cruz Tapias,1 Victoria Eugenia Villegas Gálvez,2 Sandra Rocío Ramírez Clavijo3
1. Estudiante de Maestría en Ciencias Biomédicas, Facultad de Ingeniería, Universidad de los Andes, Facultad de Medicina, Universidad Colegio del Rosario.
2. MSc. Profesor asistente, Facultad de Medicina. Universidad del Rosario.
3. PhD. Directora Departamento de Ciencias Básicas. Facultad de Medicina. Universidad del Rosario. Laboratorio de Biología Celular y Molecular. Departamento de Ciencias Básicas, Facultad de Medicina. Universidad del Rosario. Correo electrónico: sramire@urosario.edu.co.
Recibido: 14 de mayo de 2008 Aceptado: 30 de junio de 2008
Resumen
El cáncer es el resultado de la acumulación de alteraciones en moléculas con importante función en procesos celulares como proliferación, apoptosis, muerte celular y reparación génica. Las moléculas, sustancias o procesos alterados pueden constituirse en marcadores o biomarcadores tumorales de gran utilidad clínica en el seguimiento de pacientes oncológicos ya que han demostrado ser idóneos para la valoración del tratamiento y su eficiencia. La determinación de biomarcadores tumorales no ha sido muy exitosa debido a la baja sensibilidad y especificidad de las técnicas usadas y al requerimiento de muestras biológicas en volúmenes grandes o de métodos invasivos para su recolección. Los marcadores tumorales séricos surgen, entonces, como una herramienta útil en la obtención de información sobre el estado de la enfermedad y constituye un reto científico mejorar su aplicabilidad en el diagnóstico temprano, pronóstico, seguimiento de la enfermedad y evaluación de la eficacia terapéutica.
Palabras clave: marcadores biológicos, diagnóstico/tamizaje, clasificación.
Summary
Cancer is the result of the accumulation of changes in molecules with important functions in processes such as cell proliferation, apoptosis, cell death and gene repair. Molecules, substances or altered pathways constitute tumor markers or biomarkers useful in clinical monitoring of cancer patients, because they have demonstrated to be suitable for the valuation of the patient's treatment and it efficiency. Determination of tumor markers has not been very successful due to the low sensitivity and specificity of the techniques used and the requirement of large volumes of biological samples or the use of invasive methods for collecting them. The serum tumor markers arise, as a useful tool to obtain information about the disease progress and constitute as a scientific challenge to improve its applicability in early diagnosis, prognosis, monitoring of the disease and evaluation of therapeutic efficacy.
Key words: biological tumor markers/serum markers, diagnostic use, classification.
El desdichado no tiene otra medicina que la esperanza.
The miserable have no other medicine but only hope
William Shakespeare
INTRODUCCIÓN
En la ciencia, como en otras actividades humanas, se tiende a predecir el futuro con base en el conocimiento del pasado y el entendimiento del presente, pero esto no siempre logra materializarse o de hacerse realidad puede ser un proceso de larga duración. Los avances científicos realizados durante las últimas décadas en el campo de las ciencias biomédicas han permitido el pronóstico, el diagnóstico y el adecuado seguimiento a enfermedades que en la antigüedad cobraron la vida de miles de personas.
Se tienen como ejemplos los avances en geonómica y proteómica que han permitido explicar el curso de muchas enfermedades e incluso la predisposición de un individuo a padecerlas. La terapia génica con una gran posibilidad de aplicaciones en prevención y tratamiento de algunas enfermedades, la implementación de técnicas menos invasivas en cirugía y el aumento en la frecuencia, la diversidad y el éxito de los transplantes de órganos y tejidos. De igual manera, los tratamientos en fertilización que hacen posible que parejas con dificultad de procrear logren tener hijos y el uso de células madre para la regeneración de tejidos. Lo anterior para mostrar cómo, en el ámbito médico, la investigación y el conocimiento acumulado ha impactado y, en muchos casos, sobrepasado las expectativas.
Los marcadores tumorales surgen, entonces, como una luz de esperanza para el pronóstico a tiempo de los procesos oncológicos y como una forma de seguimiento y tratamiento de la patología del cáncer. Aunque el concepto de marcador tumoral no es nuevo, sí lo son los avances en biología molecular para su detección temprana.
CONCEPTO E HISTORIA DE LOS MARCADORES TUMORALES
Un marcador tumoral (o también llamado marcador biológico o biomarcador) es una molécula, sustancia o proceso que está alterado cuantitativa o cualitativamente en una condición precancerosa o cancerosa detectable por una prueba. Esta alteración puede ser producida por el tumor mismo o por tejido normal circundante como respuesta a la lesión tumoral [1].
La naturaleza del marcador tumoral es diversa, desde un ácido nucleico (DNA o RNA), un péptido, una proteína, hasta procesos como apoptosis, angiogénesis y proliferación, entre otros, medibles por una técnica apropiada. Adicionalmente pueden ser detectables en tejido, plasma sanguíneo, saliva, orina y otros fluidos corporales [2].
Los marcadores tumorales séricos son aquellos detectados en sangre periférica de pacientes con cáncer y son un recurso ideal para la detección de células tumorales diseminadas debido a la facilidad de acceso al material biológico para el análisis de la muestra. La presencia de células malignas en sangre fue descrita desde los años sesenta [3] y centenares de estudios en la última década han reportado sustancias metabólicas en sangre, producto del proceso de transformación maligna, la cual incluye aumento en la proliferación, pérdida de características morfológicas propias de un tejido o indiferenciación y pérdida de la adhesión, dando origen a la metástasis de muchos tipos de cáncer [4].
En concordancia con lo anterior, podría considerarse como marcadores tumorales no-séricos aquellos que proceden de fluidos corporales diferentes a sangre, como por ejemplo la orina o los que se estudian a partir de tejido neoplásico de donde se obtiene una gran diversidad de componentes celulares detectables.
En 1846, Bence-Jones, citado por Solomon [5], describe la precipitación de una proteína en orina de enfermos con melanoma. Esta proteína resulta ser una inmunoglobulina monoclonal de cadena ligera, identificada como el primer marcador de cáncer. Muchos años después del descubrimiento de Bence-Jones, entre 1928 y 1963, se identificaron numerosas hormonas, enzimas, isoenzimas y otras proteínas que en condiciones de malignidad alteran sus concentraciones en fluidos corporales [6]. La fosfatasa ácida, por ejemplo, ha servido como marcador de cáncer de próstata desde 1930. Entre 1963 y 1965 se descubrieron los dos marcadores tumorales más utilizados en la actualidad, para hepatoma y cáncer colorectal, éstos son la alfabeto proteína y el antígeno carcinoembrionario. Entre 1975 y la década de los ochenta, la tecnología de los anticuerpos monoclonales facilitó el descubrimiento de una nueva gama de marcadores tumorales como las glicoproteínas CA 125, CA 15.3 y CA19.9 y el antígeno PSA o prostato específico. A partir la década de los ochenta, se trabaja en la búsqueda de biomarcadores para establecer situaciones de susceptibilidad, precancerosas o de detección temprana de la enfermedad, que sirvan para identificar poblaciones con riesgo elevado de padecer algún tipo de cáncer que puedan beneficiarse de medidas preventivas. Lo anterior gracias al desarrollo del ADN recombinante y las técnicas de análisis de los ácidos nucleicos (reacción en cadena de la polimerasa PCR, secuenciación, microarreglos y espectrometría de masas) (ver figura 1) [6].
Figura 1. Recuento histórico del descubrimiento y utilización de los principales marcadores tumorales
CARACTERÍSTICAS DE UN MARCADOR TUMORAL SÉRICO
Un marcador tumoral sérico idealmente debe ser una sustancia producida por la célula neoplásica o cuya regulación esté bajo su control, que refleje su aumento en la actividad proliferativa y que permita determinar la presencia, evolución o respuesta terapéutica de un tumor maligno. Además, debe reunir las siguientes características [7]:
Sin embargo, hasta el momento no se han reportado marcadores tumorales con sensibilidad y especificidad suficientes para emplearse de forma general e infalible, en el diagnóstico precoz del cáncer por las siguientes razones [8-9]:
Finalmente, pueden existir casos en los cuales la detección del marcador está influenciada por patologías autoinmunes o desórdenes metabólicos y no por un proceso neoplásico.
CARACTERÍSTICAS DE LA CÉLULA CANCEROSA
El cáncer se origina por la acumulación de alteraciones que perturban el correcto funcionamiento celular, particularmente relacionadas con procesos de proliferación, reparación génica o muerte celular que conducen a la violación de las reglas básicas del comportamiento social de las células, es decir, se paga un precio muy alto por tener cuerpos que pueden renovarse y repararse así mismos. Los complejos mecanismos de regulación de estos procesos pueden dejar pasar errores y preservarlos hasta producir cambios catastróficos en la morfología, el metabolismo y el comportamiento celular que terminan afectando no sólo el tejido donde se inició la lesión sino que se invaden otros. Cuando estas alteraciones o sus productos pueden ser medidas, se consideran como marcadores tumorales [10]. Se dice que cuando una célula empieza a perder las características que la identifican como parte de un tejido y aumenta su tasa de proliferación, se transforma. Esta transformación puede tomar mucho tiempo, incluso años, hasta llegar a generarse una lesión cancerosa. Sólo aquellas células transformadas que logran escapar a los mecanismos regulatorios y de vigilancia de los organismos pueden dar origen a lesiones de tipo canceroso. Son muchos los factores que pueden inducir la acumulación de alteraciones y muchos los procesos celulares que se pueden alterar; por eso, el cáncer es una enfermedad multifactorial, cuyo diagnóstico temprano es difícil de lograr, así como la cura definitiva cuando la enfermedad está muy avanzada. Las características de las células cancerosas tienen que ver con los cambios que las células presentan durante el proceso de transformación, las cuales llegan a ser comunes entre las que integran el tumor. De manera resumida, se presentan a continuación las características más frecuentes de la célula cancerosa [7-10-11]:
Crecimiento y diseminación
Una de las características más típicas de las células tumorales es la pérdida de la regulación de la proliferación; generalmente, la tasa de proliferación aumenta y las células no responden a los mecanismos de control para detener la división celular. En células normales el crecimiento y la división celular están perfectamente regulados, se dan en el momento en que el organismo requiere aumentar el número de células, o cuando es necesario reemplazar células que han sido eliminadas por lesiones o por el recambio normal de un tejido. En las células normales la proliferación se activa en respuesta a señales que reciben y pueden procesar. Generalmente, las señales son factores de crecimiento, cuya información se capta a través de moléculas receptoras ubicadas en la membrana celular. La formación del complejo factor de crecimiento-receptor induce cambios en la estructura del receptor, el cual gana o pierde afinidad por elementos con los que puede interactuar en el interior de la célula. De esta manera se desencadena una serie de eventos, tales como fosforilación o defosforilación de proteínas, translocación de proteínas a diferentes compartimentos celulares, activación o represión de genes, síntesis o degradación de ciertos compuestos. Estos cambios, en conjunto, llevan a la célula a que dé inicio al ciclo celular, evento indispensable para lograr una división celular. Así mismo, se detiene la proliferación por mecanismos de respuesta al contacto físico entre células, fenómeno conocido como inhibición por contacto, bloqueándose principalmente el inicio del ciclo celular.
En las células tumorales desaparece la inhibición por contacto y disminuye el requerimiento de factores de crecimiento para producir un incremento en el número de divisiones celulares, posiblemente por la presencia de un mayor número de moléculas receptoras en la superficie celular, para estos factores de crecimiento o por alteraciones ya sea en moléculas claves para el bloqueo del ciclo celular o por la activación permanente de aquellas que favorecen el inicio y la continuidad del ciclo celular (ver figura 2) [7-11].
Figura 2. Principales cambios de la célula cancerosa. A (célula normal) comparada con B (célula tumoral), en la cual se observa un cambio en su forma, haciéndose más redondeada, con un aumento en el número de receptores para factores de crecimiento esencial, producción de factores de crecimiento que actúan de forma autocrina, cambio en los carbohidratos y antígenos de superficie, alteración en la expresión génica por mutación de genes supresores tumorales y de protoncogenes.
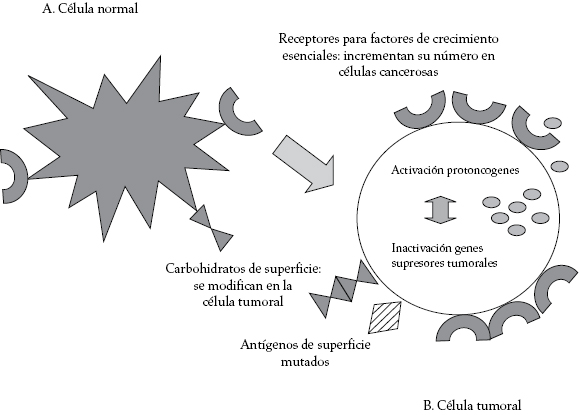
Cualquiera de las moléculas alteradas puede ser susceptible de ser usada como biomarcador del proceso de transformación; sin embargo, las mejores candidatas serán aquellas que puedan ser estudiadas más fácilmente. Un ejemplo de marcador tumoral de proliferación puede ser la lactato deshidrogenasa (LDH) que se encuentra prácticamente en todos los tejidos, pero en células tumorales su concentración está aumentada, posiblemente para mantener los mecanismos glucolíticos, como fuente de energía para su proliferación, debido a su rol en el proceso de glucólisis [8].
Diferenciación
La diferenciación es un proceso mediante el cual las células adquieren, en el caso de organismos complejos, en respuesta a señales, características y actividad metabólica propias de un tejido. Este proceso se entiende más fácilmente cuando se estudia el desarrollo embrionario de un individuo, porque se producen, en un momento y espacio determinado, una serie de señales que inducen la diferenciación celular, las señales presentes en estadíos tempranos de diferenciación, son diferentes a las de estadíos tardíos. Estas señales inducen la expresión de grupos de genes que dirigen cambios en la actividad y morfología celular, conduciendo a las células a tomar las características metabólicas y morfológicas de un linaje celular en particular, llegando, por esta vía, a la formación de tejidos. Las señales que inducen a la diferenciación celular se reconocen como factores de diferenciación, algunos son de tipo hormonal, otros de tipo físico, como por ejemplo el electromagnetismo. En las células tumorales se ha perdido la capacidad de responder a este tipo de señales, por lo que éstas no se diferencian, o las ya diferenciadas se diferencian, evidenciándose en la pérdida de características propias del tejido al que pertenecen y la adquisición de una morfología tumoral.
La actividad metabólica de las células transformadas de un tejido, también es diferente a la de las demás células normales del mismo tejido y, en fases avanzadas de la enfermedad, se puede hasta perder la funcionalidad tisular, afectando al individuo y poniendo en peligro su existencia. El grado de diferenciación de la neoplasia es indicativo de la agresividad del tumor; a mayor diferenciación, éste es menos agresivo [7-10]. Los antígenos de diferenciación específicos de tejidos también son importantes como dianas potenciales para la inmunoterapia y para la identificación del origen de los tumores. Por ejemplo, los linfomas pueden diagnosticarse mediante la detección de marcadores de superficie característicos de esta estirpe como el CD10 y el CD 20 [11].
Soporte y comunicación
En la célula cancerosa, la morfología se ve afectada por los cambios en la expresión o reorganización de moléculas del citoesqueleto, que también interfieren con la manera como se adhiere e interactúa con las células vecinas. Las interacciones célula-célula se dan principalmente a través del reconocimiento de señales, por lo general de tipo químico, que producen las mismas células. En un tejido normal, esta comunicación favorece el mantenimiento de la estructura tisular, por cuanto las células no sólo permanecen unidas, sino que además coordinan sus actividades metabólicas para el correcto funcionamiento del tejido. Las células cancerosas no responden de la misma manera que las células normales a las señales existentes, básicamente se vuelven insensibles a las señales que bloquean el ciclo celular, pero responden muy bien a las inductoras de la proliferación. De igual manera, pierden la capacidad de adhesión, por lo que fácilmente pueden desprenderse de la lesión inicial y movilizarse hacia otros tejidos, incluso viajar por los fluidos corporales y llegar a establecerse en sitios alejados.
Lo anterior determina la invasividad de una célula tumoral, considerada como la capacidad para establecer focos de crecimiento tumoral en sitios diferentes al de la lesión inicial y, en estadíos avanzados de la enfermedad .se describe como metástasis [7]. Entre las moléculas de adhesión, cuya expresión se ha detectado alterada en células tumorales, se encuentran las integrinas, las cadherinas y las CD44. Se ha señalado que la expresión reducida de la E-cadherina está relacionada con un crecimiento tumoral infiltrante, con la aparición de metástasis a distancia y con una menor supervivencia de los enfermos con cáncer gástrico [7].
Metabolismo
Al igual que los procesos anteriores, la transformación celular incluye el cambio de la actividad metabólica, que puede reflejarse en el aumento de la acción o pérdida de función de algunas proteínas, inducción o represión de algunos genes y bloqueo o estimulación de la actividad de algunas enzimas. Se tiene como ejemplo la reaparición de isoenzimas fetales (isoenzima fetal de fosfatasa alcalina), que habían sido sustituidas al término del desarrollo por las formas adultas; también puede haber incremento de la actividad de enzimas implicadas en los procesos de síntesis del ADN y sus componentes. Otro grupo de enzimas cuya síntesis y secreción suelen aumentar, lo constituyen las proteasas que son necesarias para la invasión de otros tejidos [7].
Cambios en la superficie celular
El caótico control interno del metabolismo en las células neoplásicas a menudo conduce a la presencia de estructuras anormales de los hidratos de carbono superficiales (síntesis anormal de mucina) que pueden relacionarse con el potencial de metástasis o tener consecuencias inmunitarias (ver figura 2) [11]. Estos cambios pueden facilitar a la célula tumoral escapar al reconocimiento y la eliminación por parte del sistema inmunitario. Otros cambios se relacionan con el cambio en el número de moléculas receptoras presentes en la membrana celular; por ejemplo, aumento en el número de receptores para factores de crecimiento y disminución de los receptores de factores de diferenciación.
Alteración de la muerte celular
Los organismos complejos generalmente poseen mecanismos a través de los cuales eliminan las células que dejan de ser funcionales, bien sea porque han sufrido un daño estructural irreparable o simplemente por el recambio celular. Durante el desarrollo embrionario, también es necesario eliminar células para alcanzar la morfología de los individuos adultos. Las células cancerosas no responden a las señales de muerte celular y continúan proliferando en condiciones anormales y si tienen, por ejemplo, alguna alteración genética, la transmiten a su descendencia. En algunas células tumorales se ha visto sobreexpresión de las proteínas antiapoptóticas bcl-2 y bcl-xL, que bloquean puntos clave para que se dé el proceso de apoptosis o muerte celular programada.
CLASIFICACIÓN DE LOS MARCADORES TUMORALES SÉRICOS DE USO FRECUENTE
Los marcadores tumorales séricos de uso frecuente pueden clasificarse de acuerdo con su función biológica y sus características bioquímicas (ver figura 3) en proteínas, enzimas, hormonas y ácidos nucleicos [12-13]:
Figura 3. Clasificación de los principales marcadores tumorales séricos.

Proteínas
Desde la década de los sesenta hasta la actualidad, son muchas las proteínas circulantes que han sido utilizadas como biomarcadores para la detección de tumores. Los antígenos oncofetales son proteínas que se expresan en niveles elevados en los tejidos en desarrollo (fetales) normales y en las células cancerigenas, pero no en los tejidos adultos. Se cree que los genes que codifican estas proteínas se silencian después de cumplir con su función durante el desarrollo y que experimentan una activación de su expresión durante la transformación maligna. Los dos antígenos oncofetales mejor caracterizados son el antígeno carcinoembrionario (CEA, del inglés carcinoembryonic antigen) y la alfa-fetoproteína [12-13].
El CEA es una proteína integral de membrana muy glicosilada que pertenece a la familia de las inmunoglobulinas [14], es detectada en el suero de pacientes con cáncer utilizando radioinmunoensayo. Los valores clínicos en la detección de CEA indicadores de enfermedad han sido difíciles de determinar debido no sólo a la alta tasa de falsos positivos en población normal [15] sino a una baja sensibilidad y especificidad de las técnicas usadas en su detección [16]. En condiciones normales, la expresión elevada de CEA está restringida al intestino, el páncreas y el hígado; durante los dos primeros trimestres de la gestación, se encuentra una expresión reducida en la mucosa colónica normal del adulto y en la mama durante el periodo de lactancia. El CEA se considera un marcador muy útil en el cáncer colorrectal, se acepta su uso como factor pronóstico ya que generalmente los niveles séricos están asociados con el estadío de la enfermedad y además existe una asociación entre el aumento de la expresión del CEA y el aumento en el grado de diferenciación de las células tumorales. En general, el valor clínico del CEA en el manejo del cáncer colorrectal puede evaluarse para conocimiento de la condición pre-opeoratoria del paciente y su monitorización postoperatoria de recurrencia [13].
La alfa-fetoproteína es una glucoproteína circulante sintetizada y secretada en condiciones normales durante la vida fetal por el hígado y el saco vitelino. Sus concentraciones séricas en el feto son elevadas, pero en la vida adulta esta proteína es substituida por la albúmina y se detecta en bajos niveles en el suero. Los niveles séricos de AFP pueden estar significativamente elevados en pacientes con carcinoma hepatocelular, tumores de células germinales y en algunos cánceres gástricos y pancreáticos [12-13].
La gonadotropina coriónica humana (HCG, del inglés human chorionic gonadotropin) es una glicoproteína constituida por dos subunidades, la alfa y la beta. Su detección es importante para el diagnóstico de enfermedades trofoblásticas gestacionales y su presencia simultánea con AFP es indicativo de la existencia de tumores en células germinales, los cuales pueden derivar de uno o varios tipos celulares [12].
Las mucinas constituyen una familia de glicoproteínas de peso molecular elevado que contienen numerosas cadenas laterales de carbohidratos. En condiciones tumorales, se ha encontrado alterada la expresión de las enzimas que sintetizan estas cadenas carbohidratadas, lo que da lugar a la aparición de epítopos distintos de un antígeno común [8]. Varias mucinas han sido objeto de estudio de diagnóstico y seguimiento terapéutico, incluyendo MUC1 (diferentes epítopes CA 15.3 y CA 27.29) y MUC 16 (CA 125) que son probablemente las más conocidas [17-18], expresadas en los carcinomas de ovario y de mama.
A diferencia de muchas mucinas, la MUC-1 es una proteína integral de la membrana que normalmente sólo se expresa en la superficie apical del epitelio ductal de la mama, un sitio que está relativamente vedado al sistema inmunitario. Sin embargo, en los carcinomas ductales de la mama, la molécula se expresa de una manera no polarizada y contiene nuevos hidratos de carbono específicos del tumor y epítopes peptídicos detectables con anticuerpos monoclonales de ratón [19-20].
Otros miembros de la familia de las mucinas (por ejemplo CA 19.9) son utilizados como biomarcadores en el diagnóstico de cáncer de páncreas, colon, esófago e hígado, debido a que reportan una alta sensibilidad y especificidad [8]. Considerando el papel que juegan estas moléculas en la adhesión intracelular y el desarrollo del cáncer, es posible que otros miembros de esta familia de mucinas puedan emerger en un futuro como biomarcadores útiles en el diagnóstico temprano de la enfermedad [21].
Las citoqueratinas de filamentos intermedios, en particular citoqueratinas 8, 18 y 19, también han sido utilizadas como biomarcadores en cáncer. Un ejemplo lo representa un fragmento soluble de la citoqueratina 19 conocido como Cyfra 21.1, el cual es medible en suero mediante el uso de anticuerpos monoclonales. El Cyfra 21.1 se ha estudiado principalmente para el diagnóstico de cáncer de pulmón; sin embargo, también ha sido evaluado para el diagnóstico y seguimiento de pacientes con carcinoma de cabeza y cuello. Aunque se ha observado sobreexpresión de la citoqueratina 19 en pacientes con cáncer de seno, existe una alta tasa de falsos positivos que no permite que sea utilizado como biomarcador de esta enfermedad [22].
Los anticuerpos séricos representan otra clase de biomarcadores potenciales en el diagnóstico temprano de algunos tipos de cáncer. Un anticuerpo monoclonal específico del producto oncogénico Her-2/Neu que se expresa en niveles elevados en algunos tumores ha demostrado tener éxito en pacientes con cáncer de mama [13-23], también se ha detectado en pacientes con cáncer de ovario [24] ya ha sido aprobado para uso clínico [13].
Otras proteínas como las de choque térmico HSP27 han emergido como biomarcadores útiles, gracias a la combinación de tecnologías, espectrometría de masas y cromatografía de separación, que han mejorado considerablemente la sensibilidad de detección en suero, en cáncer de mama [25-26], con respecto a otras técnicas usadas como las pruebas de ELISA.
Enzimas
Las características típicas de los procesos cancerígenos se reflejan en cambios en la síntesis y actividad de las enzimas respecto a las células normales, cada tipo de cáncer produce modificaciones enzimáticas comunes a las células tumorales, de manera independiente de su origen, lo que hace que sean buenos candidatos a ser biomarcadores de la enfermedad. La elevación de la lactato deshidrogenasa (LDH sérica) es un ejemplo de uno de los factores pronósticos más importantes en el cáncer de pulmón ya que las células cancerosas la utilizan para mantener elevados los niveles energéticos que contribuyen a su proliferación [8,27]. De igual forma, la fosfatasa alcalina tiene un valor pronóstico en cáncer de pulmón [27] y metástasis ósea [8]. La fosfatasa ácida se encuentra elevada en suero de pacientes con cáncer de próstata [12].
En las células normales, la producción de energía mediante la respiración aerobia inhibe la glicólisis, hecho conocido como efecto Pasteur. Por el contrario, en las células tumorales, en las que existe un aumento considerable de la glicólisis, el efecto Pasteur se reduce considerablemente y adquiere importancia el efecto Crabtree, que consiste en la supresión del consumo de oxígeno, lo cual trae como consecuencia el incremento en la fase anaerobia de la glicólisis, la cual es proporcional a la velocidad de crecimiento del tumor. Esto produce un cambio en la distribución de las enzimas de la glicólisis que se hacen similares a las existentes en los tejidos fetales con una mayor capacidad glicolítica y menor respuesta a las señales de regulación metabólica.
Se ha descrito la presencia en células tumorales de una forma fetal de la fosfofructoquinasa, enzima regulatoria de la glucolisis, la cual no es sensible a la inhibición por ATP o citrato que son indicadores de una célula rica en energía; por tanto, la glucolisis en células tumorales se encuentra permanentemente activa [13].
Hormonas
Las hormonas regulan muchos procesos celulares, por lo cual alteraciones detectables en la concentración sérica pueden ser usados como biomarcadores de la enfermedad. Un ejemplo es la hormona gonadotropina coriónica humana cuya concentración sérica aumenta cuando se han desarrollado tumores trofoblásticos gestacionales [12] o tumores testiculares no seminomatosos [20]. La calcitocina, hormona producida por la tiroides, se utiliza como marcador de los carcinomas medulares en los cuales se registra una hipersecreción [7-12] y su determinación posterior a estimulación ofrece la posibilidad de un diagnóstico precoz de cáncer medular de tiroides en familias de alto riesgo [12]. La catecolamina y sus metabolitos son indicadores de la presencia de feocromocitoma, neuroblastoma y tumores relacionados [20]. La hormona ACTH polipeptídica, adrenocorticotropa es producida por la hipófisis y que estimula las glándulas suprarrenales, el aumento en los valores clínicos de detección es útil en el diagnóstico de microadenomas y cáncer de pulmón [12- 20].
Ácidos nucleico
Desde 1950 se conoce la existencia de ácidos nucleicos (DNA y RNA), en fluidos biológicos desprovistos de células, los cuales, por la falta de avances en tecnología, no pudieron ser utilizados tanto en la investigación como en la clínica. Superadas estas limitaciones, y sabiendo que las concentraciones de DNA séricas son más altas en pacientes con cáncer que en sujetos normales, se ha propuesto la cuantificación de éste como un buen marcador tumoral y más recientemente, el RNA sérico circulante [28].
Con la tecnología moderna no sólo es posible cuantificar los ácidos nucleicos circulantes sino también medir alteraciones y eventos que modifican la estructura de éstos, conocidos como eventos epigéneticos y que han sido descritos en células neoplásicas, siendo la metilación del DNA una de las más comunes, la cual puede ser detectada en DNA derivado de tumores de pacientes con cáncer [29].
La cuantificación de la expresión génica en las células tumorales también adquiere una gran importancia en la investigación de marcadores tumorales ya que los patrones de expresión de algunos genes relacionados con el desarrollo del cáncer pueden dar indicios de la progresión de la enfermedad o de la respuesta del paciente al tratamiento. Para citar un ejemplo, el gen de la mamoglobina humana, también conocido como mamoglobina A, fue identificado en el año de 1996 por Watson y Fleming, es miembro de la familia de las secretoglobinas y mamoglobina constituida por 93 aminoácidos con un peso molecular de 8.48 KDa [30]. Aunque la función de la mamoglobina no es conocida aún, esta proteína presenta algunas características que sugieren que su expresión es de particular relevancia para la biología del cáncer de seno. Un estudio realizado con muestras de sangre periférica de pacientes con cáncer de seno encontró que al aislar las células tumorales diseminadas en circulación mediante inmunocaptura y al analizarlas mediante la técnica de RT-PCR en tiempo real, el 62% de las muestras presentaban niveles elevados de expresión de mamoglobina en comparación con el grupo control. En el mismo estudio se encontró que al estudiar varios biomarcadores al mismo tiempo, la detección de células tumorales diseminadas se incrementó a un 84% [26]. Estos hallazgos postulan a la mamoglobina como un buen candidato a ser evaluado como biomarcador celular para el diagnóstico de cáncer de seno [30-31].
CONCLUSIONES
Existe en la actualidad un gran interés por la identificación de nuevos marcadores moleculares y un reto en la cuantificación y verificación de los mismos en tejidos corporales de fácil acceso como lo es la sangre. Lo anterior podría facilitar enormemente, no sólo el diagnóstico e identificación más precisa de la enfermedad, sino orientar la toma de decisiones para el tratamiento a prescribir. La multiplicidad de factores que desencadenan la enfermedad, las características genéticas de los pacientes y el diverso número de procesos celulares alterados en los diferentes tipos de cáncer, explica que pacientes con un mismo diagnóstico respondan de manera diferente al mismo tratamiento. Además, los científicos están empeñados en encontrar biomarcadores de situaciones precancerosas o de etapas tempranas de la enfermedad que se puedan evaluar para la generación y el establecimiento de estrategias de prevención, diagnóstico preciso, seguimiento y orientación del tratamiento de la enfermedad. Así mismo, existen muchos estudios enfocados a la identificación de poblaciones con mayor riesgo genético o ambiental de desarrollar la enfermedad y que puedan beneficiarse de medidas preventivas que incluyan un seguimiento médico más frecuente que el resto de la población o la implementación de medidas profilácticas. Tal sería el caso del cáncer de seno de tipo hereditario, en el cual la mastectomía radical puede ser un tratamiento profiláctico de elección.
En la última década se ha incrementado enormemente el conocimiento sobre alteraciones de genes y proteínas responsables del cáncer como también el desarrollo de nuevas técnicas utilizadas para su análisis y detección. La reacción en cadena de la polimerasa (PCR) y la secuenciación, aunque no son conceptos nuevos, se han sistematizado de tal forma que permiten analizar secuencias de genes de las cuales se sospechan mutaciones y que pueden ser comparadas con las secuencias disponibles de esos mismos genes en las bases de datos de acceso público por Internet. A esto contribuyó enormemente la realización del Proyecto Genoma Humano, cuya terminación dio origen a la era post-genómica [32] en la que se mejoran las técnicas para el análisis del RNA. Lo anterior permite cuantificar la expresión génica en las células tumorales o en las normales, ya que la presencia de RNA mensajero indica que el gen correspondiente está activo en las células analizadas [33]. Los microarreglos y la PCR cuantitativa también son herramientas moleculares de gran utilidad para medir los niveles de RNA mensajero, expresados en un momento y en un sitio en particular y dada su sensibilidad también pueden ser utilizados para detectar anticuerpos en suero de pacientes con cáncer, que se producen como respuesta inmune de tipo humoral desde las primeras etapas de desarrollo de la enfermedad [34].
Es de resaltar que el fin último en la búsqueda de cualquier tipo de biomarcador apunta hacia la reducción de la mortalidad causada por el cáncer, en el entendido de que su valor dependerá de la utilidad clínica que se le pueda dar. Por tanto, en la investigación actual sobre técnicas de tamizaje en personas de alto riesgo, se trata de alcanzar una mayor sensibilidad lo cual determinará que la detección temprana de la enfermedad deje de ser un logro inalcanzable y se convierta en una realidad.
REFERENCIAS
1. Hayes DF, Bast RC, Desch CE, Fritsche H, Kemeny NE, Jessup JM, et al. Tumor marker utility gradingsystem: A framework to evaluate clinical utility of tumor markers. J Natl Cancer Inst 1996;88:1456-66. [ Links ]
2. Schrohl AA, Holten-Andersen M, Sweep F, Schmitt M, Harbeck N, Foekens, et al. Tumor markers: from laboratory to clinical utility. Mol Cell Proteomics 2003;2:378 -87. [ Links ]
3. Zidman I. The fate of circulating tumors cells. I. Passage of cells through capillaries. Cancer Res 1961;21:38-9. [ Links ]
4. Xi L, Nicastri DG, El-Hefnawy T, Hughes SJ, Luketich JD, Godfrey TE. Optimal markers for real-time quantitative reverse transcription PCR detection of circulating tumor cells from melanoma, breast, colon, esophageal, head and neck, and lung cancers. Clin Chem 2007;53:1206-15. [ Links ]
5. Solomon A, McLaughlin CL. Bence-Jones proteins and light chains of immunoglobulins. J Biol Chem 1969;244:3393-404. [ Links ]
6. Diamandis EP, Fritsche HA, Lilja H, Chan DW, Schwartz MK. Tumor markers: physiology, pathobiology, technology, and clinical applications. Washington D.C: AACC Press, 2002, p. 3-8. [ Links ]
7. Lozano JA, Galindo JD, García-Borrón JC, Martínez-Liarte JH, Peñafiel R, Solano F. Bioquímica y biología molecular en ciencias de la salud. (3ª ed). Madrid: McGraw-Hill Interamericana, 2005, p. 501-513. [ Links ]
8. Rivera P. Utilidad clínica de los marcadores tumorales. Rev Mex Pat Clin 1997;44:245-58. [ Links ]
9. Rubial A. Marcadores tumorales de secreción: situación actual. Med Clin (Barc) 2002;118:750-56. [ Links ]
10. Alberts B, Bray D, Hopkin K, Johnson A, Lewis J, Raff M, et al. Introducción a la biología celular. (2 a ed). Madrid: Editorial Médica Panamericana, 2006. p. 726. [ Links ]
11. Roitt IM, Delves PJ. Fundamentos en inmunología. (10ª ed). Buenos Aires: Editorial Panamericana: 2003. p. 429-31. [ Links ]
12. Contreras NA, Lugo G, Uriel J. Introducción a los marcadores tumorales séricos. Médica Sur (México) 2006;13(3):111-21. [ Links ]
13. Abbas AK, Lichtman AH, Pober JS. Inmunología celular y molecular. (5ª ed.). Madrid: Interamericana McGraw-Hill, 2003, p. 404-10. [ Links ]
14. Thompson JA. Molecular cloning and expression of carcinoembryonic antigen gene family members. Tumour Biol 1995;16:10-6. [ Links ]
15. Nagao K, Hisatomi H, Hirata H, Yamamoto S, Hikiji K, Yamamoto M, Kanamaru T. Expression of molecular marker genes in various types of normal tissue: implication for detection of micro metastases. Int J Mol Med 2002;10:307-10. [ Links ]
16. Clinton SR, Beason KL, Bryant S, Johnson JT, Jackson M, Wilson C, et al. A comparative study of four serological tumor markers for the detection of breast cancer. Biomed Sci Instrum 2003;39:408-14. [ Links ]
17. Gion M, Mione R, Leon AE, Dittadi R. Comparison of the diagnostic accuracy of CA27.29 and CA15.3 in primary breast cancer. Clin Chem 1999;45:630-37. [ Links ]
18. Klee GG, Schreiber WE. MUC1 gene-derived glycoprotein assays for monitoring breast cancer (CA 15-3, CA 27.29, BR): are they measuring the same antigen? Arch Pathol Lab Med 2004;128:1131-35. [ Links ]
19. Leonard GD, Low JA, Berman AW, Swain SM. CA 125 elevation in breast cancer: a case report and review of the literature. Breast J 2004;10: 146-9. [ Links ]
20. Kumar V, Cotran RS, Robins S. Robbins: Patología estructural y funcional. (7ª ed). Editorial Harcourt Brace-Elsevier, 2005, p. 317-43. [ Links ]
21. Rakha EA, Boyce RW, Abd El-Rehim D, Kurien T, Green AR, Paish EC, et al. Expression of mucins (MUC1, MUC2, MUC3, MUC4, MUC5AC and MUC6) and their prognostic significance in human breast cancer. Mod Pathol 2005;18:1295-304. [ Links ]
22. Giovanella L, Ceriani L, Giardina G, Bardelli D, Tanzi F, Garancini S. Serum cytokeratin fragment 21.1 (CYFRA 21.1) as tumour marker for breast cancer: comparison with carbohydrate antigen 15.3 (CA 15.3) and carcinoembryonic antigen (CEA). Clin Chem Lab Med 2002;40:298-303. [ Links ]
23. Disis ML, Pupa SM, Gralow JR, Dittadi R, Menard S, Cheever MA. High-titer HER-2neu protein-specific antibody can be detected in patients with early-stage breast cancer. J Clin Oncol 1997;15:3363-7. [ Links ]
24. Disis ML, Knutson KL, Schiffman K, Rinn K, McNeel DG. Preexistent immunity to the HER-2neu oncogenic protein in patients with HER-2neu overexpressing breast and ovarian cancer. Breast Cancer Res Treat 2000; 62:245-52. [ Links ]
25. Rui Z, Jian-Guo J, Yuan-Peng T, Hai P, Bing-Gen R. Use of serological proteomic methods to find biomarkers associated with breast cancer. Proteomics 2003;3:433-9. [ Links ]
26. Li J, Orlandi R, White CN, Rosenzweig J, Zhao J, Seregni E, et al. Independent validation of candidate breast cancer serum biomarkers identified by mass spectrometry. Clin Chem 2005;51:2229-35. [ Links ]
27. Albani K, Crowley JJ, LeBlanc M. Determinants of improved outcome in small cell lung cancer: an analysis of the 2580 patient Southwest Oncology Group data base. J Clin Oncol 1990; 8:2047-53. [ Links ]
28. Fleischhacker M. Part I. Biology of circulating nucleic acids: biology of circulating mRNA: still more questions than answers? Ann NY Acad Sci 2006;1075:40-9. [ Links ]
29. Laird PW. The power and the promise of DNA methylation markers. Nat Rev Cancer 2003;3:253-66. [ Links ]
30. Zehentner B, Carter D. Mammaglobin: a candidate diagnostic marker for breast cancer. Clin Biochem 2004;37:249-57. [ Links ]
31. Houghton RL, Dillon DC, Molesh DA, Zehentner BK, Xu J, Jiang J, et al. Transcriptional complementarity in breast cancer: application to detection of circulating tumor cells. Mol Diagn 2001;6:79-91. [ Links ]
32. Baak JPA, Janssen EAM, Soreide K, Heikkilæ R. Genomics and proteomics-the way forward. Ann Oncol 2005;16(S2):30-44. [ Links ]
33. Vumbaca F, Phoenix KN, Rodríguez-Pinto D, Han DK, Claffey KP. Double-stranded RNA-binding protein regulates vascular endothelial growth factor mRNA stability, translation, and breast cancer angiogenesis. Mol Cell Biol 2008;28:772-83. [ Links ]
34. Madoz-Gúrpide J, Kuick R, Wang H, Misek DE, Hanash SM. Integral protein microarrays for the identification of lung cancer antigens in sera that induce a humoral immune response. Mol Cell Proteomics 2008;7:268-81. [ Links ]














