Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Ciencias de la Salud
Print version ISSN 1692-7273On-line version ISSN 2145-4507
Rev. Cienc. Salud vol.6 no.3 Bogotá Sep./Dec. 2008
Artículos originales Cultivo primario de queratinocitos humanos sembrados en submucosa intestinal porcina
Primary culture of human keratinocytes planted on pigs intestine Submucosa
Ángela Ximena Amórtegui,1 Sandra Rocío Ramírez2
1. MD, MSc. Egresada maestría en Ciencias Biomédicas, Universidad de Los Andes, Bogotá.
2. MD, PhD. Decana (E) Facultad de Ciencias Naturales y Matemáticas, Universidad del Rosario, Bogotá. sramire@urosario.edu.co.
Recibido: 20 de septiembre de 2008 Aceptado: 25 de octubre de 2008
Resumen
En el campo de la regeneración de piel, la ingeniería de tejidos busca superar las limitaciones asociadas con el uso de autoinjertos inmediatos, dado que la elección de una región donante en el paciente, constituye un riesgo para el mismo, además de ser insuficiente cuando la lesión es extensa. Se ha comprobado que el empleo de la submucosa del intestino delgado de cerdo (SIS) (por la sigla en inglés small intestinal submucosa), por su especial composición, como biomaterial de relleno para tratar lesiones, disminuye el dolor y la inflamación desde su primera aplicación y favorece la movilidad temprana de la región lesionada. Con el fin de determinar la utilidad de SIS, como sustituto epidérmico, en el presente estudio se desarrolló un protocolo para el cultivo primario de queratinocitos humanos, provenientes de prepucios infantiles, sobre una matriz de SIS como soporte. Se evaluó el potencial de adherencia y la capacidad de proliferación de queratinocitos sobre este sustrato.
Palabras clave: ingeniería de tejidos, técnicas de cultivo de tejidos, regeneración guiada de tejidos, queratinocitos, SIS
Summary
Tissue engineering, in the fields of skin regeneration, seeks to overcome the limitations associated with the use of immediate auto-grafts, since choosing the donor region of the patient constitutes a risk for the patient himself and is insufficient if the injury that has to be repaired is very large. The use of the pigs small intestine submucosa (SIS) has being proved as a filling biomaterial to treat injuries, because of its special composition, it lowers pain and inflammation since its first application and it favours early mobility to the wounded area. The present study developed a protocol for the primary culture of human keratinocytes from infant foreskins, and used small intestinal submucosa (SIS) like culture substrate. Cellular adherence potential and proliferation capability of the keratinocytes over this substrate was evaluated.
Key words: tissue engineering, tissue culture techniques, guided tissue regeneration, kerationocytes, SIS
INTRODUCCIÓN
El primer método desarrollado para el cultivo de queratinocitos utilizó como substrato de adhesión una capa alimentadora de fibroblastos (3T3) de ratón, cuyo crecimiento y multiplicación se inhibieron mediante irradiación (1). Desde entonces, se han ensayado varias metodologías para el cultivo de queratinocitos humanos, utilizando diferentes medios de cultivo con suero bovino fetal o libres de suero, y con diversos suplementos (2). Estos avances han contribuido notablemente no sólo a la restauración de lesiones cutáneas superficiales sino, también, al desarrollo de la investigación dermatológica.
Actualmente existen algunos productos de reemplazo epidérmico disponibles comercialmente y otros en periodo de prueba. El principal inconveniente de estos sustitutos es la ausencia de un substrato adecuado, el cual, además de soportar los queratinocitos proliferantes, permita una buena interacción con los constituyentes dérmicos presentes en la lesión, de tal modo que exista una adherencia suficiente y estable para evitar que se produzca una contracción prematura de la herida, sin los resultados cosméticos y funcionales esperados (3).
La submucosa de intestino delgado porcina (SIS) ha sido usada exitosamente como medio para soportar los procesos de reparación, vascularización y remodelación de los tejidos (4,5). Ésta se encuentra entre la mucosa y la capa muscular del intestino, y constituye la matriz extracelular que no sólo le confiere resistencia, sino que también es reservorio de citoquinas y moléculas de adhesión celular, las cuales dirigen la reparación y el reemplazo de las células epiteliales intestinales. La SIS contiene colágeno tipo I, III, V y VI, glicosaminoglicanos, proteoglicanos, glicoproteínas y factores de crecimiento como el FGF-2, VEGF y TGF- â (6,7).
Estudios preliminares han reportado que células epidérmicas y fibroblastos pueden adherirse, migrar, proliferar y diferenciarse sobre la SIS, lo cual demuestra la utilidad del modelo para el estudio de las interacciones entre las células y la matriz extracelular, aspecto relevante para las investigaciones en el campo de los sustitutos de piel (8).
Dado que trabajos previos ya han cultivado exitosamente fibroblastos en SIS (9), en este estudio se obtuvieron queratinocitos a partir de prepucios infantiles y se cultivaron usando como soporte este biomaterial. Se describen, entonces, las condiciones óptimas para el aislamiento correcto y el cultivo selectivo de estas células epidérmicas, y los datos obtenidos de la evaluación de la capacidad de adherencia y proliferación de los queratinocitos sobre SIS.
MATERIALES Y MÉTODOS
A Continuación se detalla la fuente a partir de la cual se obtuvieron los queratinocitos, los materiales y técnicas empleados para la obtención de los cultivos primarios y la evaluación del crecimiento celular en sistemas libres de soporte y sobre submucosa intestinal porcina.
Fuente celular
La fuente celular de los queratinocitos fue restos de prepucios infantiles, obtenidos durante la circuncisión de menores en la Clínica Infantil Colsubsidio de Bogotá; previa autorización del Comité de Investigación y mediante aceptación y firma de un consentimiento informado. Se escogió este tejido porque se ha demostrado que los queratinocitos provenientes de piel de donantes jóvenes tienen un mayor potencial para formar colonias en cultivo que los obtenidos de tejido adulto (10). El tejido fue preservado durante el transporte desde la sala de cirugía hasta el laboratorio en PBS, suplementado con antibiótico penicilina/estreptomicina al 1% (Gibco Cat. No. 15140), conservado a 4° C. PBS (Dulbeccos phosphate buffer solution) sin Ca/Mg y con KCl 0,2 g, KH2PO40,2 g, NaCl 8 g, Na2HPO4anhidro 0,92 g.
Cultivos celulares
El tejido se extendió y lavó con PBS más antibiótico (penicilina/estreptomicina al 1%) en una caja de Petri. Allí fue cortado en trozos de 0,25 cm2, los cuales se lavaron en alcohol al 70% y PBS y se transfirieron a otra caja para someterlos a un proceso de disgregación enzimático (2). Los trozos de tejido fueron incubados en 5 ml de una solución que contenía dispasa al 0,5% a 4°C, durante 18 horas, o a 37°C durante 6 horas (Gibco Cat. No. 17105), para separar la hoja epidérmica y recuperarla intacta. Para disociar las células del epitelio se incubaron en una solución con tripsina/ EDTA 0,05% -1,02 mM- (Gibco Cat. No. 25300), dos veces durante 15 minutos, pipeteando cada 2-3 minutos, con el fin de facilitar la disgregación de las células. Las suspensiones celulares obtenidas después de cada tripsinización se resuspendieron en un tubo de 15 ml con el medio de cultivo suplementado con SBF al 10% para inactivar la tripsina. Esta mezcla se conservó en la incubadora, mientras el tejido con tripsina se trató por segunda vez. La suspensión obtenida se centrifugó a 1500 rpm durante 10 minutos, a temperatura ambiente; luego se descartó el sobrenadante y se recuperó el pellet de células, para resuspenderlas en 1 ó 2 ml de medio y enseguida se determinó la viabilidad celular mediante tinción con azul de tripán y conteo en cámara de Neubauer (ver ecuación 1).
Ecuación 1
Células/ml = Células/mm2 × Factor de dilución x 14
Las células fueron cultivadas en medio de crecimiento específico para queratinocitos (Gibco Cat. 10744-019), libre de suero, con insulina, factores de crecimiento EGF y FGF-2 como suplemento. Se utilizaron tres áreas diferentes de cultivo: cajas de 6 pozos para medir y teñir las colonias, cajas de 24 pozos para los cultivos de queratinocitos sobre submucosa y frascos 25 cm2 para la expansión celular. Las densidades celulares fueron: para las cajas de 6 pozos 1,5 x 106 células por pozo en 1,5 ml de medio de cultivo; y para las cajas de 24 pozos 1 x 105 células por pozo en 0,5 ml de medio para y 3 x 106 células en 2 ml de medio por frasco de cultivo de 25 cm2.
Los cultivos se mantuvieron a 37° C, en atmósfera húmeda y con 5% CO2. A los dos días, cuando las células se habían adherido a la superficie de cultivo, se realizó el primer cambio de medio para eliminar los restos de epitelio y las células muertas. Los siguientes cambios de medio se realizaron cada 3 días.
Cultivos sobre SIS
Láminas de SIS, deshidratadas y esterilizadas con óxido de etileno (9), que se utilizaron como soporte de crecimiento, fueron proporcionadas por el grupo de investigación en Ingeniería de Tejidos de la Universidad de los Andes. Para hidratar las láminas de SIS (18-24 horas) previamente a la siembra se utilizó suero fetal bovino (400ml), más antibiótico (penicilina/estreptomicina al 5%, Gibco Cat. No. 15140). Esta mezcla se aspira y se colocan 350ml de suspensión celular en agitación durante 1 hora, para luego adicionar medio de cultivo hasta completar 1,5 ml.
Análisis de viabilidad
Para realizar los análisis de viabilidad celular se usó azul de tripán (Sigma-Aldrich Cat. No. T8154); y para visualizar la colonias de queratinocitos se utilizó Rodamina B (Sigma-Aldrich Cat. No. R6626), en el cultivo primario. La viabilidad y el crecimiento celulares sobre la SIS se evaluaron con la ayuda de la técnica de MTT 3-(4,5-dimethylthiazolyl- 2)-2, 5-diphenyltetrazolium bromide, empleando isopropanol con HCl 0,04 M para romper las células y obtener extractos celulares, después de la tinción con MTT y solubilizar los precipitados violetas intercelulares.
Subcultivos o pases
Los subcultivos o pases se llevaron a cabo una vez los frascos alcanzaron un 75% de confluencia. Se aplicó 0,5ml de solución con tripsina-EDTA a los pozos y se incubó durante 5 minutos a 37°C. Cuando un 90% de las células adquirió la morfología redondeada y se despegaron de las placas de cultivo, se retiró la tripsina. Seguidamente, se golpeó suavemente la caja y se inactivó con medio de cultivo suplementado al 10% con SBF, pipeteando vigorosamente para facilitar el desprendimiento de las células, teniendo cuidado de no deteriorarlas. Se centrifugó a 1.500 rpm durante 10 minutos, se descartó el sobrenadante y se recuperó el pellet para realizar el conteo celular y ajuste del número de células, para continuar con el cultivo de pase 1:2.
Tinción con rodamina
El medio de cultivo se eliminó aspirando con la ayuda de una bomba de vacío y se agregó 0,5 ml de rodamina al 1% en agua destilada a cada pozo (10). Después de 30 minutos los cultivos se lavaron cuidadosamente con agua hasta que las colonias adquirieron un color rojizo brillante. Las placas de cultivo se dejaron destapadas para el secado y posterior conteo de las colonias. Para determinar la EFC, el conteo del número de colonias se realizó contando la cantidad de colonias presentes en un área de cultivo de 1 cm2, y haciendo la aproximación de acuerdo con el área calculada de la superficie de cultivo (10 cm2) para cada uno de los pozos de las cajas de cultivo.
Tinción con MTT
Para los cultivos sobre SIS, la coloración se hizo con MTT, ya que la rodamina era absorbida por este material y dificultaba la identificación de las células. Se agregaron 30-40 ml de MTT por cada pozo de las cajas de 24 pozos, se incubó durante 2 a 4 horas hasta observar el precipitado púrpura en las células y se agregó 300 ml del reactivo de lisis celular (isopropanol ácido). Después de 30 minutos, se midió la absorbancia a 570 nm, con la ayuda de un espectrofotómetro (GENIUS (TECAN)), incluido un blanco.
Evaluación de la capacidad de adhesión y proliferación celular sobre la superficie de cultivo
En las colonias se estimó y analizó tanto la eficiencia formadora de colonias (EFC) como la tasa de crecimiento (TC). Una vez se inició la formación de colonias de queratinocitos, a los 5-6 días de cultivo aproximadamente, se empezó a medir el incremento diario en mm/día del diámetro mayor de las colonias como un indicativo de la TC. Los datos se obtuvieron promediando los valores del crecimiento, mínimo en 3 colonias por día. Una colonia se define como un grupo de cuatro o más células contiguas cuya apariencia sugiere que han sido originadas a partir de una sola célula. La EFC definida en la ecuación 2, se mide antes de que el cultivo alcance un 60% de confluencia para distinguir claramente las diferentes colonias, haciendo tinción con rodamina B, colorante que presenta gran afinidad por las células epidérmicas. (ECUACIÓN 2: Eficiencia formadora de colonias)

Se ha reportado que la EFC de cultivos primarios de queratinocitos sin SIS fluctúa entre 0,1% y 1% y aumenta con los subcultivos hasta 30- 80%; y que la TC puede variar entre 0,18 mm/ día en ausencia de factores de crecimiento, hasta 1,42 mm/día en presencia del EFG (10).
Para los cultivos en SIS, se requirió de un método diferente para evaluar el crecimiento, ya que las células crecieron guiadas por las hendiduras del material y no formaron colonias. Se empleó la tinción con MTT y la medición del índice de absorbancia de los precipitados violetas solubilizados con isopropanol, producto de la reacción.
Inmunohistoquímica
Además de la morfología típica epitelial que muestran los queratinocitos en cultivo, se determinó la presencia de citoqueratinas propias del epitelio estratificado, mediante la técnica de inmunohistoquímica convencional peroxidasaantiperoxidasa (PAP), para lo cual se usó un coctel de dos anticuerpos monoclonales AE1/ AE2 que permite identificar varias citoqueratinas humanas como las ácidas K10 y K14, propias de las capas basales epidérmicas y las básicas K1 y K5, características del epitelio estratificado de la epidermis (11).
RESULTADOS
Se observó que el tiempo de digestión enzimática de la epidermis con dispasa no alteró la supervivencia de las células, ya que muestras sometidas al tratamiento con esta sustancia, durante 18 horas a 4° C, presentaron viabilidades muy similares (41%) a las obtenidas de muestras tratadas durante 6 horas a 37° C.
Teniendo en cuenta que las muestras fueron procesadas bajo un mismo método de aislamiento celular, no se presentó una relación directamente proporcional entre la edad de los donantes y el porcentaje de viabilidad celular; además, muestras de tejido de un mismo tamaño originaron diferentes cantidades de células viables, lo cual demuestra que probablemente otros factores relacionados con el estado o condición del paciente pueden intervenir.
Para conseguir las densidades celulares requeridas para cada caja o frasco de cultivo, las láminas epidérmicas se trataron dos veces con tripsina para recolectar una mayor cantidad de células, teniendo en cuenta que no todos los queratinocitos que conforman la epidermis tienen posibilidades de dividirse en cultivo. Esto debido, probablemente, a que muchos de ellos están en un estado de diferenciación avanzado o queratinizados y enucleados, siendo funcionales in vivo, a pesar de que conserven la capacidad de adherirse a la superficie de cultivo, no sean capaces de proliferar para formar colonias (figura 1). Esta clase de queratinocitos son de mayor tamaño y presentan una morfología más aplanada. La viabilidad celular promedio fue del 42,7%.
Al tercer día de cultivo, las células viables adheridas fueron refringentes y algo redondeadas al observarlas con la ayuda de un microscopio invertido. Las células empezaron a formar colonias a partir del día 4-5. Al tratar de migrar para agruparse, adquieren una forma algo alargada (figura 2).
Las colonias conformadas por 4 o más células se observaron a partir del día 5-6. Inicialmente estas colonias fueron redondeadas y al crecer se fueron alargando y deformando (figura 3); tendiendo a la confluencia (figura 4). Los queratinocitos confluentes adquirieron una forma poligonal y de tamaño regular, fácilmente reconocible (figura 5), aunque en las colonias separadas las células podían presentar diferentes tamaños.
Figura 1. Células queratinizadas no proliferantes, 10X
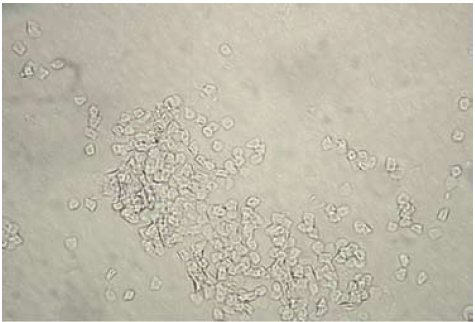
Figura 2. Aspecto de un cultivo primario de queratinocitos día 4-5
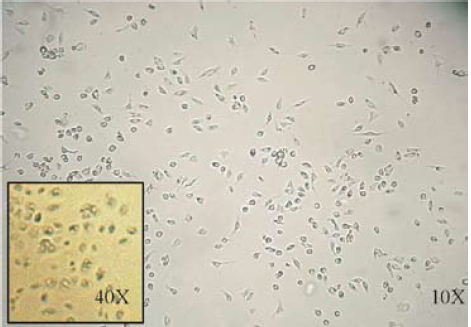
Figura 3. Imagen de un cultivo primario de queratinocitos en el día 9, 4X
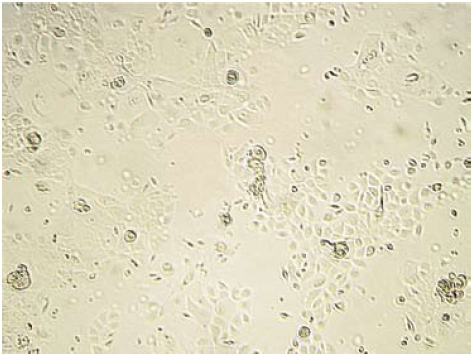
Figura 4. Imagen de una monocapa de queratinocitos, después de doce días de cultivo 10X
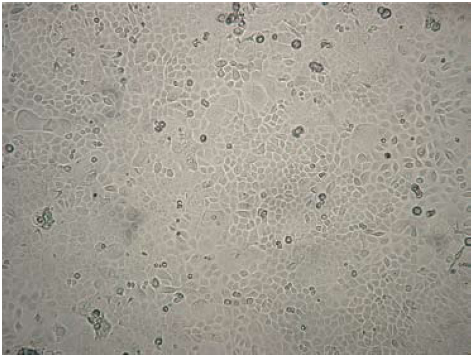
Figura 5. Aspecto de un cultivo primario de queratinocitos confluente día 12, 20X
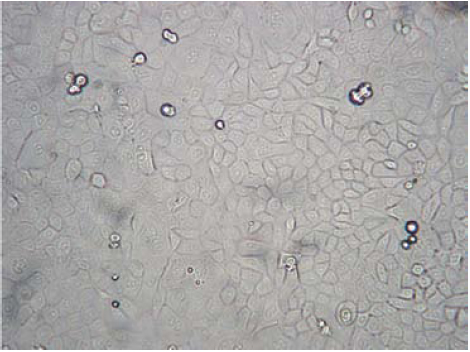
La tinción con el anticuerpo AE1/AE2 fue más fuerte en los cultivos más antiguos (figura 6).
No se realizó esta tinción en cultivos sobre submucosa.
Figura 6. Inmunotinción de cultivos primarios de queratinocitos con el anticuerpo AE1/AE2 específicos de citoqueratinas humanas K10, K1a, K1 y K5,100X
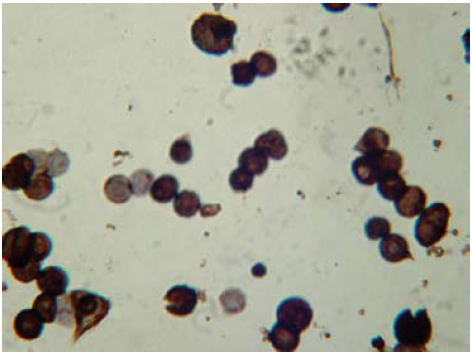
La mayoría de colonias de tamaño medio presentaron focos de diferenciación terminal de los queratinocitos (figura 7). Durante la diferenciación terminal in vivo, los queratinocitos se desplazan de la capa basal de la epidermis hacia arriba, perdiendo contacto con la membrana basal. En cultivo, se comportan similarmente, evidenciándose la pérdida de la adhesividad al substrato de cultivo.
La coloración con rodamina evidenció tanto las colonias de queratinocitos, como las células aisladas. Las células con mayor grado de diferenciación captaron el tinte con mayor intensidad (figura 8). La tinción con rodamina de los cultivos con SIS no permitió la identificación de las colonias de queratinocitos, debido a que el material absorbió gran cantidad de colorante, dificultando la observación; por esto, se recurrió a la tinción con MTT.
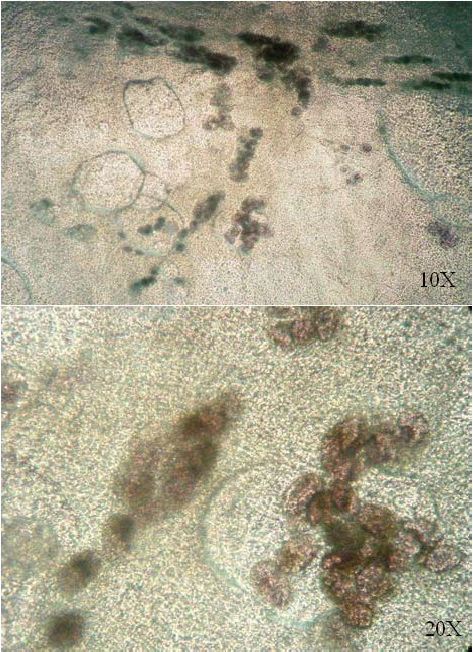
Figura 7. Identificación de los focos de diferenciación terminal, en los cultivos al día 10, 20X, 10X
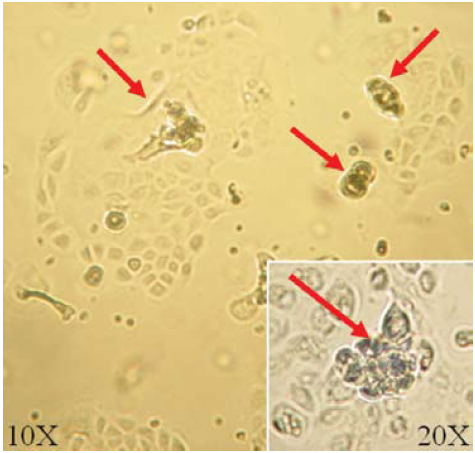
Figura 8. Aspecto de las colonias de queratinocitos teñidas con rodamina, día 9, 4X
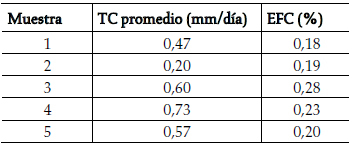
El seguimiento completo de los cultivos para determinar la TC y la EFC, se realizó en los cultivos procedentes de 5 muestras (tabla 1). Los valores resultantes se encuentran dentro de los rangos estimados para cultivos primarios.
Tabla 1. TC y EFC de cultivos primarios
Las colonias presentan un crecimiento exponencial (figura 9), alcanzando un tamaño máximo promedio de 4 mm de diámetro, momento en el cual se unen con las colonias adyacentes para formar una monocapa.
Los cultivos primarios presentaron contaminación inicial de melanocitos y fibroblastos (figura 10). Estas células mostraron tendencia a desaparecer con el tiempo.
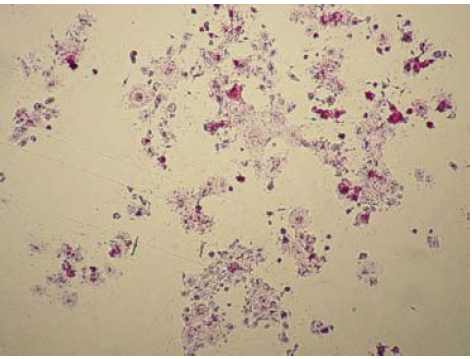
Los cultivos sobre submucosa mostraron un crecimiento muy pobre a los 12 días, cuando normalmente los cultivos sin ésta llegan a la confluencia; y la tinción con MTT de los cultivos reveló un crecimiento limitado de los queratinocitos, tanto de cultivo primario como de subcultivo. A medida que se dividieron, las células se fueron acumulando sobre las irregularidades del material (figura 11). Los índices de absorbancia medidos (tabla 2) no se encuentran dentro del rango de valores estimados cuando hay presencia de células en un pozo de cultivo.
Tabla 2. Índices de absorbancia de cultivos sobre submucosa
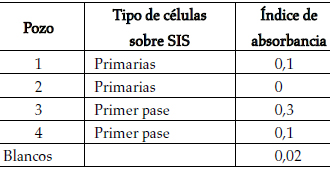
Figura 9. Curvas de crecimiento de las colonias de queratinocitos en un cultivo
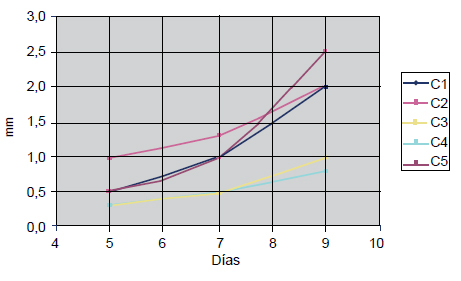
Figura 10. Melanocitos y fibroblastos observados en los primeros días de algunos cultivos 20X y 40X 3,0
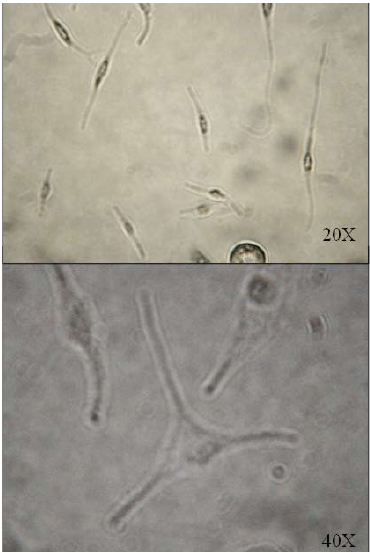
Figura 11. Tinción con MTT, cultivo primario de queratinocitos, día 9 10X y 20X
DISCUSIÓN
El protocolo estandarizado para llevar a cabo el aislamiento de células epidérmicas y su expansión in vitro, a partir de muestras de prepucio. En el presente estudio se hicieron las adaptaciones necesarias de acuerdo con las instalaciones y materiales disponibles en el laboratorio Las muestras de tejido provenientes de restos de prepucio, recolectados después de intervenciones quirúrgicas, fueron adecuadas para la realización del estudio; las cuales permitieron no sólo obtener un número suficiente de queratinocitos, sino en condiciones que permiten evaluar su crecimiento en diferentes sustratos. Sin embargo, dado que en muchos casos las muestras de tejido de prepucio están contaminados por los procesos infecciosos desarrollados in situ, se hace indispensable lavar exhaustivamente con PBS más antibiótico y desinfectar con alcohol, teniendo cuidado de no excederse en tiempo para no disminuir significativamente la viabilidad de las células. La selectividad del medio de cultivo utilizado (Gibco Cat. No. 10744), favoreció la obtención de monocapas de queratinocitos confluentes entre los 12 y 14 días de cultivo, además de suprimir la proliferación de fibroblastos y melanocitos, tipos celulares contaminantes en los primeros días de iniciado el cultivo. Durante el proceso de estandarización de la técnica de cultivo de queratinocitos, particularmente la digestión enzimática con dispasa, no afectó dramáticamente la viabilidad celular. Respecto a la densidad celular, se mostró que para iniciar un cultivo primario de queratinocitos, debe ser mucho mayor que la requerida para otros tipos celulares como por ejemplo fibroblastos, pudiéndose explicar, tal vez, porque no todos los queratinocitos recuperados del tejido son nucleados.
Las colonias de queratinocitos de mayor tiempo de cultivo presentaron focos de diferenciación terminal, en los cuales las células, a medida que se estratifican, pierden la capacidad de adhesión al sustrato sobre el cual están creciendo. Sin embargo, se obtuvieron mejores resultados cuando los queratinocitos de subcultivos en pases avanzados (tercer o cuarto pase) fueron colocados sobre la SIS. Probablemente en ese momento poseen una mayor capacidad de crecimiento además de presentar homogeneidad en la morfología. Los primeros pases suelen ser mucho más heterogéneos en cuanto a morfología, a pesar de la acción selectiva de la enzima dispasa, que permite obtener cultivos enriquecidos con células de tipo epidérmico. La capacidad de proliferar en los primeros pases puede verse disminuida por el estrés que causa el proceso de disgregación y por el tiempo que toma el proceso de adaptación a las nuevas condiciones de crecimiento in vitro. El crecimiento de queratinocitos primarios y de primer pase sobre submucosa intestinal porcina se dio sobre las hendiduras e irregularidades del material por lo cual, los cultivos sobre SIS en experimentos posteriores requerirán de otro método diferente a la medición de colonias para estimar el crecimiento celular. Además, se debe evaluar hasta qué pase es favorable la capacidad de proliferación sobre el biomaterial, antes de que las células alcancen estados senescentes.
Las TC de los cultivos analizados fluctuó entre 0,2 y 0,73 mm/día y la EFC entre 0,18% y 0,28%. Ambos parámetros coinciden con los valores reportados por otros autores para cultivos primarios de queratinocitos de 0,18-1,42 mm/día para la TC y 0,1-1% para la EFC.
Debido a que no es posible evaluar el crecimiento de los queratinocitos con rodamina sobre la submucosa, se usó la técnica del MTT. La SIS absorbe el colorante y no se pueden indentificar las células que crecen sobre ésta para seguir diariamente el crecimiento de las colonias que se van formando. El uso del MTT permitió obtener datos que hicieron posible correlacionar los índices de absorbancia obtenidos con un número aproximado de células en crecimiento. Sin embargo, se requiere hacer más pruebas de crecimiento de queratinocitos sobre otros sustratos, para determinar cuál es la mejor opción para obtener altas tasas de crecimiento de queratinocitos. El colágeno o la poli-lisina podrían se buenos candidatos por la propiedad que tienen para facilitar las interacciones celulares.
Además de la morfología típica epitelial que mostraron las células en cultivo, la expresión de las citoqueratinas propias del epitelio estratificado, evaluada por inmunohistoquímica, permitió corroborar que las células obtenidas corresponden a células epidermales con características de queratinocitos. Se usó el anticuerpo AE1 que permite identificar las citoqueratinas K10, K14, K15, K16 y K19 y el AE3 que identifica las 8 citoqueratinas básicas (K1-K8).
El estado actual de esta investigación confirma la factibilidad de un modelo de substituto epidérmico, basado en el cultivo de queratinocitos humanos sobre submucosa intestinal porcina. A futuro, los ensayos deben apuntar hacia la optimización de la técnica de cultivo sobre SIS para conseguir una adhesión y una tasa de crecimiento suficientes para alcanzar la confluencia y poder evaluar el sistema en modelos animales. Recientemente en modelos de ratón, el grupo de Zou aplicó la SIS sola y obtuvo una más rápida cicatrización de la herida en comparación con animales en los que no se aplicó la SIS; además se identificaron, por inmunohistoquímica, queratinocitos creciendo sobre las SIS (12). Por otro lado, el grupo de Fan también obtuvo queratinocitos en cultivo sobre submucosa, bajo condiciones diferentes a las del presente estudio (13).
AGRADECIMIENTOS
Al Fondo de Investigaciones de la Universidad del Rosario (FIUR) por la financiación para la compra de reactivos. A los miembros del Laboratorio de Biología Celular y Molecular de la Universidad del Rosario por su continuo apoyo técnico. Al grupo médico y auxiliar de la Clínica Infantil Colsubsidio, que facilitó la recolección de las muestras. Al Departamento de Patología del Instituto Nacional de Cancerología por su colaboración con el procedimiento de inmunotinción. Al grupo de Ingeniería Biomédica Línea de Tejidos de la Universidad de los Andes, el cual proporcionó las membranas usadas en este estudio.
REFERENCIAS
1. Rheinwald J, Green II. Serial cultivation of strains of human epidermal keratinocytes: formation of keratinizing colonies from single cells. Cell 1975;6:331-44. [ Links ]
2. Judd DA, Battista PJ, Behm DD. Culture of human keratinocytes in defined serum-free medium. Focus 1997;1:1-4. [ Links ]
3. Bello YM, Falabella AF, Eaglstein WH 2001. Tissue engineering skin: Current status in wound healing. Am J Clin Dermatol 2001;2:305-13. [ Links ]
4. Schmidt CE, Baier JM 2000. Acellular vascular tissues: natural biomaterials for tissue repair and tissue engineering. Biomaterials 2000;21:2215-31. [ Links ]
5. Olivares J, Delbouis A, Fernández J, Escalante J. Tratamiento de heridas con ulceración crónica, mediante submucosa de intestino delgado. Rev Mex Ortop Traum 2002;16:125-30. [ Links ]
6. Badylak S, Liang A, Record R, Tullius R, Hodde J. Endotellial cell adherence to small intestinal submucosa: an acellular bioscaffold. Biomaterials 1999;20:2257-63. [ Links ]
7. Cook Inc 2002. Brochure of small intestinal submucosa technology. www.cooksurgical.com, 2002, Acceso en: Agosto, 25 de 2004. [ Links ]
8. Lindberg K, Badylak S. Porcine small intestinal submucosa (SIS): a bioscaffold supporting in vitro primary human epidermal cell differentiation and synthesis of basement membrane proteins. Burns 2001;27:254-66. [ Links ]
9. Tabima DM. Desarrollo de una metodología para la preparación y evaluación de matrices biodegradables usadas para el crecimiento de fibroblastos. Tesis Maestría en Ingeniería Mecánica, Universidad de los Andes, Bogotá, 2003. [ Links ]
10. OConnor VV, Uhlemann H, Tilgen W. 1999. Análisis de los medios de transporte y cultivo de piel para auto o aloinjerto humano. Salud Revista de la Facultad de Ciencias de la Salud de la Universidad de Carabobo 1999;3:1-28. [ Links ]
11. Ebling F, Eady R. Anatomy and organization of human skin. Dermatology encyclopedia, cap 3, Oxford: Editado por Lowell A. Goldsmith, 1997. [ Links ]
12. Zou J, Liu Y y Zhu Y. An experimental study of using porcine small intestinal submucosa to repair rat full skin defect. PMID: 17882888 [PubMed - in process] 2007;21:872-6. [ Links ]
13. Fan WJ, Yang ZM, Li XQ, Wang Z, Zhi W, Qiu L. The experiment of porcine keratinocytes cultured on porcine small intestinal submucosa in vitro. PMID: 16883900 [PubMed - in process] 2006;22:220-2. [ Links ]














