Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Ciencias de la Salud
Print version ISSN 1692-7273On-line version ISSN 2145-4507
Rev. Cienc. Salud vol.6 no.3 Bogotá Sep./Dec. 2008
Presentación de cámara anestésica de bajo costo como herramienta didáctica para explicar los fundamentos de la anestesia general a estudiantes de medicina veterinaria
Using a low-cost anesthetic chamber as a didactic tool to explain the basics of general anesthesia to veterinary medicine students
Gerardo Alberto Isea Fernández,1 Ilsen Emérita Rodríguez Rodríguez,2 Ernesto Enrique Isea Morillo,3 Merilio Antonio Montero Urdaneta4
1. MV, PhD. Universidad del Zulia. Facultad de Ciencias Veterinarias. Departamento de Biología Animal. Cátedra de Farmacología y Toxicología. Maracaibo, Venezuela. Correo electrónico: gaisea3@gmail.com
2. MV. Instituto Socialista de la Pesca y Acuicultura (INSOPESCA).
3. MD. Sistema Regional de Salud. Estado Zulia, Venezuela.
4. MV. Universidad del Zulia. Facultad de Ciencias Veterinarias. Departamento de Biología Animal. Cátedra de Farmacología y Toxicología. Maracaibo, Venezuela.
Recibido: 14 de septiembre de 2008 Aceptado: 8 de octubre de 2008
Resumen
Se presenta el uso de una cámara anestésica de bajo costo, construida en vidrio, de fácil manejo y limpieza, como recurso didáctico, para explicar, en ratones de laboratorio, los fundamentos de la anestesia general inhalatoria a estudiantes de medicina veterinaria. La cámara permite adecuada dosificación del anestésico, garantiza la vida de los animales y disminuye la exposición de profesores y estudiantes a los gases anestésicos. Así, se pueden abordar didácticamente los aspectos básicos de la anestesia general inhalada, como el efecto de la concentración del anestésico en el aire inspirado y solubilidad.
Palabras clave: cámara anestésica, ratones, anestesia inhalatoria.
Summary
A low-cost glass-assembled and easy to handle anesthetic chamber is presented, easy handling and cleaning, as a didactic manner to explain, by using mice, the basis of the inhaled general anesthesia to veterinary medicine students. The chamber, allows adequate dose administration of anesthetic, preserves life of animals and decreases exposure of teachers and students to anesthetics gases. Thus, its possible to explain in a didactic fashion the basic concepts of inhaled anesthesia, such as anesthetic concentration and solubility.
Key words: Anesthetic chamber, mice, inhaled Anesthesia
INTRODUCCIÓN
La estrategia de enseñanza basada en la experimentación pretende relacionar al estudiante con hechos y datos para que construya conceptos, favoreciendo el aprendizaje de procedimientos y desarrollo de capacidades. Si el estudiante aprende a manejar variables a través de la observación y verificación, trasladará esta técnica al manejo de futuras situaciones [1].
Los ejercicios de laboratorio deben ofrecer adiestramiento, método y criterio, para que el estudiante aprenda a observar, investigar y discernir en torno a un problema. Sin embargo, implementar prácticas de laboratorio enfrenta una dificultad histórica, sobre todo en los países en vías de desarrollo y con fuertes limitaciones económicas: el número de experimentos es limitado, como consecuencia de la desproporción entre la enorme masa de estudiantes y los insuficientes recursos de enseñanza disponibles [2], además de la dificultad para adquirir modernos instrumentos de medición de variables.
Aunque los agentes volátiles inhalados (éter y cloroformo) están hoy en desuso por el hecho de existir anestésicos inhalados y fijos, con mejores propiedades farmacológicas, se considera válido utilizarlos para explicar los fundamentos de la anestesia general inhalada. Además, son base de estudios más completos en relación con periodos y fases de la anestesia y comprobación de efectos tóxicos [3].
La cámara anestésica para ratones que se presenta pretende ser un instrumento de enseñanza accesible a cualquier laboratorio de farmacología y toxicología, particularmente para países con escasos recursos económicos. Adicionalmente, una herramienta como ésta permite la correcta enseñanza de los principios de la anestesia general inhalada, utilizando un reducido número de animales de laboratorio (ratones) y mínima cantidad de anestésico, minimizando así la exposición de estudiantes y profesores a estos agentes químicos.
Objetivos docentes del trabajo práctico
El objetivo docente del presente trabajo práctico consiste en que el estudiante de Ciencias Veterinarias de la Universidad de Zulia conozca los conceptos fundamentales respecto a los anestésicos inhalados –presión de vapor, solubilidad y concentración alveolar mínima (CAM)–.
Presión parcial y presión de vapor
En su estado natural, los líquidos volátiles tienen parte como vapor, cuya acción terapéutica se obtiene por inhalación y su cinética se rige por los principios y leyes de los gases [4]. En contenedor cerrado, temperatura y presión constante, los anestésicos inhalados se evaporan hasta saturarse en fase gaseosa, ejerciendo una presión de vapor, característica para cada anestésico inhalado, relacionada con la concentración eficaz que puede alcanzarse. Aunque en la práctica se dosifican con base en su concentración en el aire inspirado, es más preciso utilizar el concepto de presión parcial ejercida por cada gas en el sistema. En equilibrio cinético, ésta se iguala entre los compartimientos orgánicos (alvéolo, sangre, cerebro), considerándose, entonces, un valor absoluto. La concentración, en cambio, es un valor relativo entre los compartimientos, ya que está influenciado por la solubilidad del agente anestésico [5].
La presión de vapor es una medida de la cantidad de líquido anestésico que se evapora a 20ºC. El vaporizador de una máquina anestésica permite una concentración máxima de 5%, nivel suficiente y seguro para todos los usos prácticos. El metoxifluorano tiene baja presión de vapor, alcanzando, a 20ºC, concentraciones máximas de 4%, en un circuito anestésico; no requiriere la precisión de un vaporizador para utilizarlo de forma segura [6], Halotano e isofluorano alcanzan hasta 30%.
Coeficiente de solubilidad
Los anestésicos inhalados se solubilizan en sangre y otros compartimientos orgánicos hasta alcanzar el equilibrio en función de esta propiedad, aunque también de la presión del anestésico y de la temperatura. En anestesiología, la solubilidad se expresa como un coeficiente de partición. Los coeficientes de partición (CP) que más influencian la farmacocinética de los anestésicos inhalados son el CP sangre/gas y el CP aceite/gas.
El CP sangre/gas determina la solubilidad del anestésico inhalado en la sangre, de la cual, a la vez, dependen las velocidades de inducción y recuperación anestésica [5]. Si es pequeño, se necesitará poco anestésico disuelto en sangre para alcanzar el equilibrio, lo cual facilita su paso desde la sangre hacia el sistema nervioso central. Así, a mayor potencia de un anestésico inhalado, menores serán su concentración alveolar mínima (CAM) y su CP sangre/gas.
Concentración alveolar mínima (CAM)
La concentración alveolar mínima (CAM) expresa la potencia de un anestésico inhalado, es decir, la profundidad anestésica que se alcanza con una dosis determinada. Se define como aquella concentración capaz de inhibir la respuesta motora a un estímulo doloroso determinado en el 50% de los casos. La CAM refleja la presión parcial del anestésico en el cerebro, ya que la acción anestésica es función de esta propiedad [7-8].
Factores fisiológicos como ventilación pulmonar y gasto cardíaco también influencian la velocidad de inducción y la recuperación anestésica. Si la velocidad de ventilación aumenta, más rápido será el proceso de equilibrio gaseoso entre los compartimientos, por tanto más cortos los periodos de inducción y recuperación [9]. Sin embargo, estas variables no son controladas en la cámara anestésica propuesta, por lo que serán abordadas sucintamente.
MATERIALES Y MÉTODOS
Descripción de la cámara anestésica
La cámara anestésica es una caja, generalmente transparente para ver lo que ocurre en su interior, con una entrada de gases frescos y una salida de gases residuales [10]. La propuesta de cámara anestésica de bajo costo para ratones guarda semejanza con cámaras de inducción anestésica empleadas en medicina veterinaria. En las últimas, se mezclan de manera controlada gas anestésico y oxígeno. Como elementos comunes a estos dos tipos de cámaras se encuentra la dificultad para monitorizar las frecuencias cardiaca y respiratoria, y el incremento del riesgo de exposición del personal al gas anestésico, particularmente cuando el paciente es retirado de la cámara [6].
La cámara propuesta está hecha exclusivamente con láminas de vidrio de 0,5 mm de espesor, adecuadamente cortadas y pegadas con silicón. La tabla 1 presenta los nombres, la cantidad y las medidas de las partes; la figura 1 señala las características más importantes y ofrece diferentes vistas.
Tabla 1. Partes de la cámara anestésica
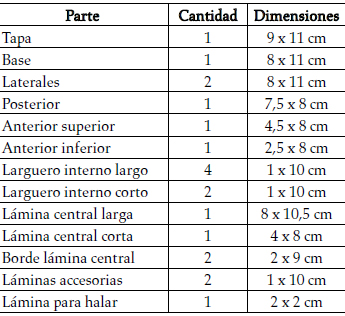
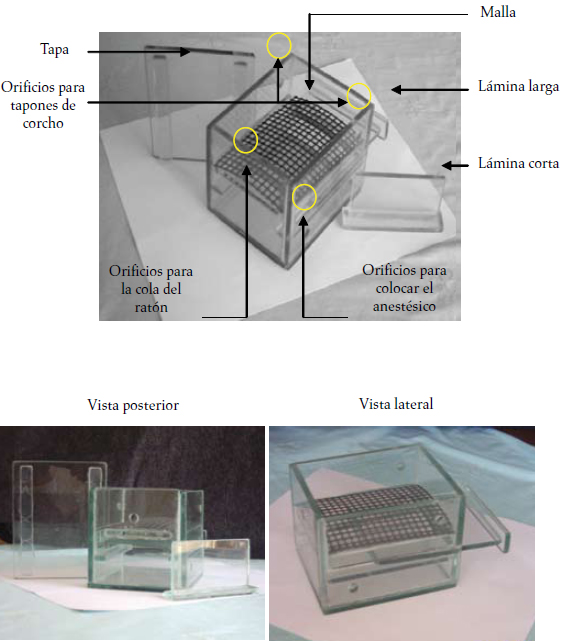
Figura 1. Cámara anestésica de bajo costo para ratones. Principales partes.
Desarrollo del trabajo práctico
Para alcanzar los objetivos docentes se siguió, con algunas modificaciones, la metodología propuesta en el experimento No. 1 de la Guía Práctica No. 5 de la Cátedra de Farmacología y Toxicología de la Facultad de Ciencias Veterinarias de la Universidad del Zulia [11]. El experimento titulado Efecto de la concentración de anestésicos en el aire inspirado se describe a continuación:
1. Coloque un ratón de 20-30 g de peso en la cámara anestésica, saque la cola por el orificio posterior, sosténgala suavemente y coloque la tapa.
2. Asegúrese de que la lámina larga que divide completamente la cámara en dos secciones (superior e inferior), esté bien colocada.
3. Vierta en la cámara, a través del orificio de inyección, el anestésico inhalado a la dosis de 0,15 mL /20 g de peso del ratón. Coloque el tapón de madera en el orificio de inyección. Mantenga sujeto el ratón suavemente pegado al orificio posterior.
4. Retire rápidamente la lámina larga y coloque la lámina corta para permitir el paso del anestésico. Ponga en marcha un cronómetro.
5. Intente colocar el ratón en decúbito dorsal, cada 20-30 segundos. De poder hacerlo, habrá comprobado la pérdida del reflejo de enderezamiento. Detenga el cronómetro y regístrelo como tiempo de inducción de la anestesia.
6. Destape la cámara, retire el ratón y colóquelo en lugar seguro para que se recupere. Quite las partes removibles de la cámara y seque todo con papel absorbente.
7. Repita los pasos 1-6 utilizando dosis de 0,30; 0,60; 1,2 mL por 20 g de peso.
8. Repita de los pasos 1-7 del experimento utilizando cloroformo.
9. Calcule la presión parcial de éter o cloroformo siguiendo los métodos primero, segundo y tercero del siguiente apartado.
10. Relacione el tiempo de inducción de la anestesia con la dosis de éter o cloroformo utilizada, estableciendo una relación dosisrespuesta, determinando el coeficiente de regresión.
11. Compruebe las diferencias de los resultados entre los grupos tratados mediante la aplicación de la prueba T de Student para muestras independientes. Explique los resultados con base en el coeficiente de solubilidad y presión de vapor.
Cálculo de la presión parcial del anestésico en el aire inspirado
Se propone que el estudiante aplique los métodos primero (Guía Práctica No. 5), segundo (www.uba.ar) [12] y tercero [5] para calcular, de acuerdo con la dosis, la presión parcial del anestésico empleado en el aire inspirado. El ejercicio le ayudará a una mejor comprensión de los elementos físicos y químicos que determinan la acción anestésica de un agente inhalado. Por razones de espacio se presenta sólo el procedimiento para la primera dosis de éter.
1. Método primero
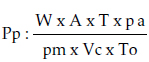
Pp: Presión parcial del anestésico en el aire inspirado
W: Peso del éter o cloroformo de acuerdo con la dosis utilizada pm: Peso molecular del éter (74, 12) o del cloroformo (119,39)
A: Volumen que ocupa el peso molecular del éter o el cloroformo (22,412 L)
T: Temperatura ambiental, en grados centígrados, transformada a Kelvin (20ºC = 273ºK)
To: Temperatura absoluta de congelación del agua (273ºK)
Vc: Volumen de la cámara anestésica en litros (0,448 L)
Pa: Presión atmosférica (1 atm = 760 mm Hg)
El peso del éter o del cloroformo se calcula con la siguiente fórmula:
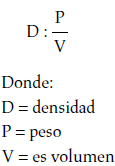
Procedimiento
Primero debe determinarse el peso de acuerdo con la dosis utilizada, así:
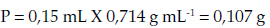
Seguidamente, sustituimos los valores en la fórmula principal:
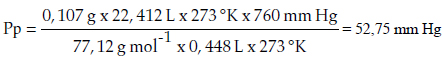
2) Método segundo
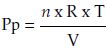
Donde:
N = número de moles del anestésico
R = constante de proporcionalidad de los gases
T = temperatura ambiental en grados Kelvin
Vc = volumen de la cámara anestésica en litros.
Procedimiento
Debe calcularse el número de moles:
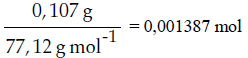
La constante de proporcionalidad de los gases expresa el diferente volumen que ocupa una mezcla de gases en atención a la presión atmosférica y temperatura a la que se encuentran. Si utilizamos la presión expresada en atmósferas, su valor proviene de la siguiente relación:
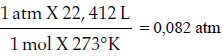
Sin embargo, se calculará la constante considerando la presión atmosférica en mm Hg:
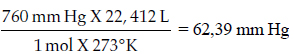
Así, podemos aplicar la formula principal:
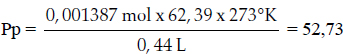
3) Método tercero
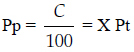
Donde: C = concentración del anestésico expresada en porcentaje respecto de la presión total
Pt = presión total de la cámara
El método tercero, generalmente utilizado en la práctica y relativamente más sencillo, requiere calcular la concentración del anestésico. Para ello se asume que la concentración de oxígeno y nitrógeno en el aire es de 21 y 79%, equivalente a 0,21 y 0,79 L, respectivamente. Se calcula el número de moles de oxigeno y nitrógeno:
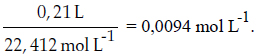
En 0,448 L hay 0,0042 moles de oxígeno
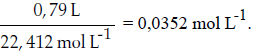
En 0,448 L hay 0,05158 moles de nitrógeno
La presión que ejercen estos 2 gases debe ser aproximadamente de 760 mm Hg.

Para el caso, la presión ejercida por los gases oxígeno y nitrógeno corresponde, aproximadamente, a la presión atmosférica (760 mm Hg). Al introducir éter, la presión total del sistema se incrementaría a 813 mm Hg (760 mm Hg + 52,75 mm Hg). Ésta debe asumirse como 100% o presión total, valor utilizado para calcular la presión parcial de éter:
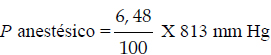
Aunque debe obtenerse un valor similar al obtenido con los anteriores métodos, esto no sucede en la práctica. La presión total no se incrementa ya que a un incremento de la presión parcial del anestésico, corresponde una disminución de la presión parcial del gas portador, sea oxígeno o la mezcla oxigeno-óxido nitroso.
RESULTADOS Y DISCUSIÓN
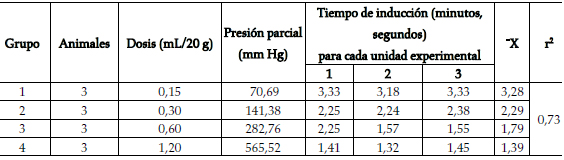
En las tablas 2 y 3 se presentan los resultados. El coeficiente de regresión (> 0,70) indica la relación dosis-respuesta. A medida que se incrementa el volumen del anestésico depositado en la cámara, aumenta la presión parcial del anestésico en el aire inspirado. Así, con un reducido número de unidades experimentales, es posible construir curvas dosis-respuesta de los anestésicos empleados. Existe diferencia entre grupos tratados (p < 0,05). La diferente presión parcial con un mismo volumen de éter o cloroformo es, en este caso, hipotéticamente consecuencia sólo de la diferente presión de vapor de estas sustancias. Otros factores que la modifican, como temperatura y presión atmosférica, se asumen como constantes.
Tabla 2. Tiempo de inducción de la anestesia con éter
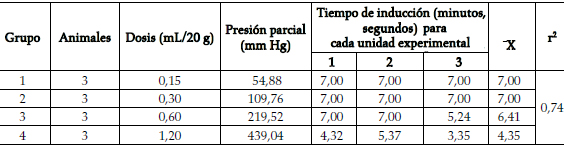
Tabla 3. Tiempo de inducción de la anestesia con cloroformo
El estudiante debe realizar los cálculos correspondientes a cada dosis empleada para obtener la presión parcial del anestésico en el aire inspirado, tanto de éter como de cloroformo. La realización de los procedimientos matemáticos propuestos debe permitir valorar factores como temperatura, presión atmosférica y propiedades físico-químicas del agente, respecto de su efecto terapéutico [13].
Es útil comprobar que las presiones parciales de oxígeno y nitrógeno no disminuyen por el aumento de la presión parcial del anestésico; por tanto, se incrementa la presión total. Esto no ocurre en una máquina anestésica, en la cual las cantidades de gas anestésico y gas portador son reguladas por el operador y sus presiones parciales monitoreadas a través de manómetros. Según las necesidades clínicas, a un incremento de la presión del gas anestésico corresponde una disminución proporcional del gas portador.
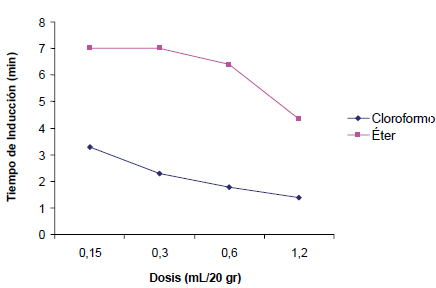
La diferencia entre los periodos de inducción señala la diferencia de potencia anestésica entre éter y cloroformo (figura 2), atribuible al cloroformo por su mayor presión de vapor y menor solubilidad (p < 0,05).
Figura 2. Tiempo de inducción de anestesia en ratones
CONCLUSIONES Y RECOMENDACIONES
La cámara anestésica propuesta en este trabajo permite, utilizando un pequeño número de animales y minimizando la exposición de sus operadores a los gases anestésicos, explicar matemáticamente y de manera gráfica, conceptos fundamentales de la anestesia general inhalada, garantizando la vida de las unidades experimentales.
La realización de los procedimientos matemáticos aquí descritos, permite comprender la relación entre propiedades físicas y químicas y las bases de la anestesia general inhalada.
Se propone que este procedimiento se implemente como recurso de enseñanza en pregrado para las ciencias médicas, en las cuales se dicte la unidad curricular farmacología y realizar estudios sobre grupos de estudiantes, para evaluar la adquisición del conocimiento y confirmar o no su utilidad pedagógica.
REFERENCIAS BIBLIOGRÁFICAS
1. Criado A, del Cid R y García-Carmona A. La cámara oscura en la clase de ciencias: fundamento y utilidades didácticas. Revista Eureka sobre Enseñanza y Divulgación de las Ciencias 2007;4:123-40. [ Links ]
2. Universidad de Buenos Aires. Guía de trabajos prácticos de fisiología. Buenos Aires: Instituto de Fisiología. Facultad de Ciencias Médicas de la Universidad de Buenos Aires: El Ateneo, 1957. [ Links ]
3. Alexander A. Técnica quirúrgica en animales y temas de terapéutica quirúrgica. México: Interamericana, McGraw-Hill, 1986. [ Links ]
4. Restrepo J. Farmacología de los anestésicos por inhalación en fisiología. Rev Ven Anest 2002;7:184-90. [ Links ]
5. Laredo F, Gómez- Villamandos F, Redondo I, Cruz JI, y Burzaco O. Anestesia inhalatoria: bases, drogas y equipamiento. Consulta de Difusión Veterinaria 2001;9:69-83. [ Links ]
6. McKelvey D y Hollingshead KW. Small animal anesthesia and analgesia. Estados Unidos: Ediciones Mosby, 2000. [ Links ]
7. Hurlé MA. Fármacos anestésicos generales. En Flores J. (Ed) Farmacología humana. España: Editorial Masson, 2004, p. 477-88. [ Links ]
8. Ritter JM, Lewis LD y Mant TGK. Anaesthetics and muscle relaxants. En A textbook of Clinical Pharmacology. (4ª ed). Ediciones Arnold, 1999, p 194-95. [ Links ]
9. Rang HP, Dale MM y Ritter JM (2000). Anestésicos generales. En Rang HP, Dale MM y Ritter JM, Flores J. (Ed) Farmacología (4ª ed.). Madrid: Ediciones Harcourt, 2000, p. 553-60. [ Links ]
10. Palacios C y Benítez A. Anestesia inhalatoria en pequeños animales. Revista de Información Veterinaria 2005;diciembre,16-19. [ Links ]
11. Universidad de Zulia. Cátedra de Farmacología y Toxicología. Experimento No. 1. Efecto de la concentración del anestésico en el aire inspirado. En Guía Práctica No. 5. Depresores del sistema nervioso central. Anestésicos generales. Zulia: Universidad del Zulia, 1986. [ Links ]
12. Universidad de Buenos Aires. Átomos y moléculas. Estado gaseoso. www.uba.ar/academicos/uba21/download/materias/qui_atomosmoleculas-gas.pdf. Acceso en: Abr. 04, 2008. [ Links ]
13. Guzmán M. (2007). Enseñanza de las ciencias y la matemática. Rev Iber de Edu 2007;43:15-58. [ Links ]














