Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Ciencias de la Salud
versión impresa ISSN 1692-7273versión On-line ISSN 2145-4507
Rev. Cienc. Salud v.7 n.1 Bogotá ene./abr. 2009
Alteración en la regulación de la apoptosis vía Fas/FasL en cáncer gástrico*
Alteration of Regulation of Fas/FasL Mediated Apoptosis in Gastric Cancer
Reggie García Robles,1 Paola Ayala Ramírez,2 Natalia Acosta Vega3
* Agradecemos al Dr. Germán Darío Díaz por su ayuda y orientación en la revisión del tema.
1. Bióloga. Estudiante de maestría de la Facultad de Ciencias de la Pontificia Universidad Javeriana.
2. Bacterióloga. Profesora del Instituto de Genética Humana, Facultad de Medicina, Pontificia Universidad Javeriana. Correo Electrónico: payala@javeriana.edu.co.
3. Bióloga. Estudiante de maestría, Facultad de Ciencias, Pontificia Universidad Javeriana. Correo electrónico: natalializ@yahoo.com.
Recibido: febrero 9 de 2009 Aceptado: marzo 16 de 2009
Resumen
El cáncer gástrico es una de las enfermedades neoplásicas de más alta incidencia y mortalidad a nivel mundial: es el segundo tipo de cáncer más frecuente en el mundo y la primera causa mundial de mortalidad por esta enfermedad. Por su parte, la apoptosis es un proceso importante de muerte celular programada que se presenta durante la embriogénesis, la regulación del sistema inmune y el mantenimiento de la homeostasis tisular. La evasión de la apoptosis por diferentes mecanismos es uno de los aspectos moleculares más importantes en el desarrollo de cáncer. En este artículo se presenta una revisión exhaustiva de la evidencia del papel de la apoptosis vía Fas/FasL en el desarrollo de la carcinogénesis gástrica, inclusive desde etapas tempranas, como la aparición de lesiones preneoplásicas. Finalmente, se evidencia que el desarrollo de más estudios permitiría esclarecer mejor el papel de la vía Fas/FasL en la carcinogénesis gástrica, en sus diferentes estadios.
Palabras clave: cáncer gástrico, apoptosis, receptor Fas, proteína ligando Fas.
Abstract
Gastric cancer is an important neoplastic disease in all around the world because its high incidence and mortality. Otherwise, apoptosis is a key process of programmed cell death during embryogenesis, regulation of immune system, and holding the tissue homeostasis. Besides, the escape of apoptosis by different ways is an essential molecular aspect for the development of cancer. In this article we present an exhaustive review of the current evidence of the role of apoptosis through Fas/FasL pathway in the development of gastric carcinogenesis, including since early stages like in appearance of preneoplastic lesions. Finally, we think that a better comprehension of the signaling pathway Fas/ FasL role in the different stages of gastric carcinogenesis could let us know more about the implicated molecular ways and the physiopathological changes in the appearance of this disease.
Key words: Gastric cancer, apoptosis, Fas receptor, Fas ligand protein.
CÁNCER GÁSTRICO
El cáncer gástrico es una de las enfermedades neoplásicas de mayor incidencia y mortalidad. Este tipo de cáncer guarda un patrón geográfico, delimitado en áreas con grados variables de incidencia y mortalidad y, en general, es el segundo cáncer más frecuente en el mundo y la primera causa de mortalidad por esta enfermedad a nivel mundial (1). Existen diferentes tipos de tumores neoplásicos de origen gástrico; el adenocarcinoma es el más común y cuenta para el 90-95% de las neoplasias derivadas de tejido gástrico (2). De acuerdo con la clasificación histopatológica de Lauren, se describen dos tipos de adenocarcinoma gástrico, el difuso y el intestinal, los cuales aparentemente tienen un comportamiento biológico y presentan alteraciones moleculares diferentes (3). En esta revisión nos enfocaremos en el adenocarcinoma gástrico de tipo intestinal, ya que de las dos variantes histopatológicas esta es la más común y, además, los mecanismos fisiopatológicos y moleculares involucrados en su aparición y desarrollo son parcialmente conocidos y comprendidos.
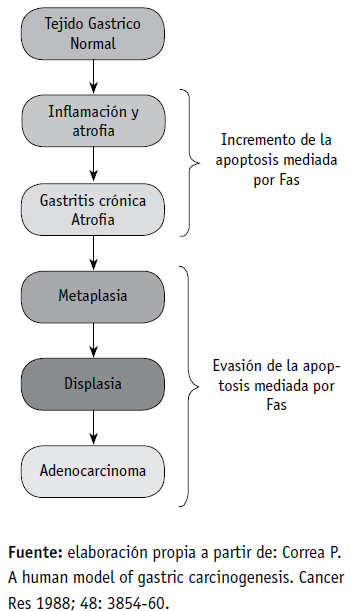
El adenocarcinoma gástrico de tipo intestinal se considera una enfermedad de origen multifactorial, donde se ha descrito un proceso carcinogénico lento y complejo, con múltiples factores ambientales y genéticos, asociados a la aparición y progresión de la enfermedad. De tal manera que, de acuerdo con el modelo postulado por Pelayo Correa, se inicia con una mucosa gástrica normal con hiperproliferación epitelial y se transforma en gastritis crónica con varios gados de atrofia, metaplasia intestinal, displasia y, finalmente, carcinoma (4) (ver figura 1). Varios factores medioambientales y genéticos se han asociado a la etiología y fisiopatología de este tipo de cáncer: en la literatura se encuentran reportes de asociación con factores como hábitos alimentarios, estilo de vida e infecciones, así como genes involucrados en procesos de proliferación, apoptosis, diferenciación y ciclo celular.
Figura 1. Modelo para la carcinogénesis gástrica correlacionado con la desregulación de la vía Fas/FasL, postulado por Pelayo Correa
Algunos genes involucrados en la fisiopatología molecular del cáncer gástrico son: proto-oncogenes, como c-met y c-erb B2; genes supresores tumorales, como p53 y APC; genes de moléculas de adhesión celular, como la E-Cadherina; genes reguladores del ciclo celular, como el de la ciclina E y p27, y genes reparadores del DNA, como los que tienen incidencia en factores de crecimiento y citoquinas (2, 5). Otros genes que se han encontrado alterados durante la carcinogénesis gástrica son aquellos de diferenciación celular, como el Sonic Hedgehog, y los reguladores de la apoptosis, como el Bcl-2, y de la vía de señalización Fas/FasL (6-10). Adicionalmente, ya que se ha identificado que los microRNA juegan un papel muy importante en la regulación génica, es posible afirmar que estos podrían funcionar como supresores de tumores, lo que causa deleciones, silenciamiento epigenético o pérdida de la expresión de uno o más factores de transcripción (11).
APOPTOSIS
La muerte celular programada, o apoptosis, es un mecanismo importante para mantener un balance entre proliferación y pérdida celular, lo que permite regular fisiológicamente, bajo un estricto control genético, el número de células a nivel tisular. Este proceso es importante durante la embriogénesis, la regulación del sistema inmune y el mantenimiento de la homeostasis tisular.
Durante la apoptosis ocurren cambios morfológicos y moleculares típicos, tales como condensación celular, fragmentación del núcleo y DNA nuclear, disrupción del esqueleto y alteración de la superficie celular; lo que genera un despliegue de señales para que la célula sea fagocitada por un macrófago o célula vecina y, por último, la muerte de la célula, sin afectar a las células vecinas. La maquinaria intracelular responsable del proceso de apoptosis depende de una familia de proteasas, llamadas caspasas, las cuales son producidas en la célula como precursores inactivos o procaspasas. Una vez activadas las caspasas iniciadoras, estas clivan a otras procaspasas para activarlas y producir una cascada proteolítica.
Finalmente, las caspasas efectoras clivan proteínas indispensables para la célula, como por ejemplo la laminina, lo que produce una degradación de la membrana nuclear o una influencia sobre una enzima degradante del DNA (DNAsa) que se activa y fragmenta el DNA nuclear. La cascada de proteasas no es sólo destructiva, sino autoamplificada e irreversible; por lo tanto, el proceso de apoptosis al alcanzar un punto crítico ya no puede ser revertido. La activación de la apoptosis puede darse por un estimulo interno o externo a la célula, lo que determina dos vías de inducción de este proceso: la intrínseca y la extrínseca, respectivamente (12-14).
La muerte celular por apoptosis es el principal mecanismo de pérdida celular en el tracto gastrointestinal, de tal manera que una masa tisular constante es mantenida por el balance entre la tasa de producción de nuevas células por proliferación y la tasa de pérdida celular por apoptosis. Alteraciones en el balance entre apoptosis y proliferación están asociadas con estados patológicos; así, por ejemplo, se presenta atrofia cuando la pérdida celular es excesiva, comparada con la proliferación, y se presenta neoplasia, cuando ocurre lo contrario (15, 16).
El daño genético activa programas apoptóticos, lo que convierte la apoptosis en la mayor fuente de disminución de la celularidad en un tumor. Por eso, la apoptosis necesita ser superada para asegurar la expansión clonal continua y la supervivencia de la masa tumoral, lo que genera un desbalance entre la proliferación y la muerte celular. En consecuencia, evitar la apoptosis debe ser un evento relativamente temprano en la transformación que asegure la acumulación de las mutaciones, necesarias para el crecimiento maligno exitoso. La falla en la apoptosis podría permitir la sobrevivencia de células transformadas que son susceptibles de sufrir posterior daño genético y jugar un papel importante en la patogénesis tumoral. Durante el desarrollo tumoral, la resistencia a la apoptosis puede ser adquirida por las células cancerosas a través de diferentes estrategias; de acuerdo al tipo histológico hay un mecanismo predominante. Cualquier inactivación de vías proapoptóticas o activación de vías antiapoptóticas, ya sea por mutaciones somáticas o alteraciones en la expresión, genera falla en la apoptosis y, por lo tanto, promueve la supervivencia de células tumorales (17,18).
La muerte celular es una variable cada vez más estudiada para la mejor comprensión del desarrollo del cáncer y el establecimiento de nuevas y mejores estrategias para la prevención y tratamiento de esta enfermedad (14). Por ejemplo, durante el proceso de carcinogénesis gástrica inducida por Helicobacter Pylori, la evidencia acumulada sugiere que en el momento de la infección se aumenta la proliferación celular y durante la inflamación crónica temprana de la mucosa gástrica, la apoptosis; mientras que, posteriormente, en la transformación maligna tisular se inhibe la apoptosis y se altera la adhesión de las células epiteliales (7).
En estadios tempranos del cáncer gástrico se pierde el balance entre proliferación celular y apoptosis. Por ello, durante el desarrollo de este tipo de cáncer se han encontrado alteraciones en genes que regulan la apoptosis, como el Fas, el Factor de Necrosis Tumoral (TNF, por sus siglas en inglés) y el Bcl-2 (7). El mecanismo preciso por el cual las células de la mucosa gástrica evitan la apoptosis durante la transformación a células malignas no ha sido completamente dilucidado, pero al parecer la vía de señalización de Fas/FasL cumple un papel importante (17).
VÍA DE SEÑALIZACIÓN FAS/FASL
El gen Fas, o también llamado receptor APO-1 o CD95, pertenece a la superfamilia de receptores TNF (Factor de Necrosis Tumoral). Este gen está ubicado en el brazo largo del cromosoma 10, en la región 24.1, el cual produce una proteína de 314aa. El receptor es una glicoproteína transmembranal tipo I, que se activa con la unión de su ligando extracelular y genera apoptosis.
Por otro lado, el gen de FasL, o también llamado CD95L, está ubicado en el brazo largo del cromosoma 1, en la región 2, y produce una proteína de 281aa, miembro de la familia TNF y factor de crecimiento neuronal. Este gen codifica para una proteína de membrana tipo II, en la cual el extremo N terminal se encuentra en el espacio citoplasmático y el C terminal, en el extracelular.
La solubilidad de esta proteína se logra gracias a la actividad de metaloproteinasas; su fracción soluble es funcional, circula por el torrente en forma de trímero y se ha encontrado incrementada en pacientes con cáncer gástrico. El gen FasL se encuentra principalmente en los linfocitos T activados y en los linfocitos natural killer; aunque también se encuentra en diversos tejidos como los testículos y el ojo (7,13).
Los miembros de la familia TNF se caracterizan por presentar 5 copias de un dominio extracelular rico en cisteína y un dominio de muerte intracelular. Cuando la proteína transmembranal Fas se une con su ligando FasL, esta se trimeriza y se une a una proteína con un Dominio de Muerte Asociado a Fas (FADD, por sus siglas en inglés) o Mort 1. Además, la FADD también presenta otro dominio, denominado Dominio Efector de Muerte (DED, por sus siglas en inglés), y por interacciones homologas activa la procaspasa-8, la cual contiene un DED, se libera del Complejo de Señalización Inductor de Muerte (DISC; unión de Fas, FasL, FADD y procaspasa-8) y en el citoplasma ejerce su actividad proteolítica sobre la caspasa-3, que es finalmente la molécula efectora (12-14,19) (ver figura 2).
Figura 2. Vía extrínseca de la apoptosis mediada por Fas/FasL
La prevalencia elevada de la expresión de FasL en numerosos y diversos tipos de cáncer humano (como cáncer de colon, seno, hígado, pulmón y cerebro) sugeriría que la expresión tumoral de FasL es de vital importancia para el crecimiento tumoral. Particularmente, son contundentes los hallazgos de varios estudios donde el nivel de Linfocitos T Infiltrantes (TILs) en el tumor puede variar en relación con la expresión tumoral de FasL. En cáncer esofágico, por ejemplo, se encontró que hay cuatro veces menos TILs en sitios del tumor que expresan FasL, que en aquellos en los que no lo expresan. Esta diferencia en el nivel de TILs se correlacionó con una diferencia en la tasa de apoptosis de los mismos, y se evidenció que son dos veces mayores en los sitios del tumor que expresan FasL. Estos hallazgos implican que la expresión de FasL tumoral es el principal determinante de la apoptosis de los TILs y disminuye de forma local la respuesta inmune antitumoral (20). Adicionalmente, Aguilar-Lemarroy et ál. (21) demostraron en un estudio que la vía Fas media el proceso de apoptosis en células Jurkat, en pacientes con cáncer cervical. Además, en carcinoma intestinal grande la gastrina y la somatostatina juegan un papel muy importante en la regulación y el control de apoptosis celular, el cual está directamente relacionado con una expresión aberrante de Fas/FasL (22). Hallazgos semejantes se han presentado en otros tipos de cáncer, como el ovárico, el gástrico, el de colon y el angiosarcoma.
Existe evidencia, tanto in vivo como in Vitro, que sugiere que la evasión de la apoptosis mediada por Fas es un evento importante en la carcinogénesis gástrica. Ciertamente, el programa de muerte celular apoptótica puede ser activado por sobre-expresión de oncogenes o programas de crecimiento alterado y la eliminación de estas células anormales vía apoptosis parece ser la manera principal mediante la cual las células mutadas son removidas. Debido a que la apoptosis remueve células en un estadio temprano de la alteración genética, la superación de este proceso es un requisito temprano en la iniciación de cáncer y, probablemente, necesita ser mantenido para la supervivencia de una célula que acumula expresión anormal de genes. Una de las estrategias para adquirir resistencia a la apoptosis es la desregulación de la vía Fas/FasL.
Mutaciones germinales en el gen Fas están asociadas con un incremento de varios tipos de cáncer, incluyendo el gástrico y el colorectal. Otros tumores epiteliales y mutaciones somáticas en Fas han sido encontrados en melanomas, aunque la relación de causalidad no ha sido establecida (17). Se han descrito procesos de muerte celular por apoptosis en células de adenoma y carcinoma gástrico y el mayor índice apóptotico se presentó en células de adenoma tubular, luego en células de adenocarcinoma gástrico tipo intestinal bien diferenciado y, finalmente, en células de adenocarcinoma gástrico tipo intestinal pobremente diferenciado. Se ha encontrado expresión Fas/ FasL en adenoma y carcinoma gástrico; el aumento en la expresión de FasL puede ser correlacionado con la progresión de carcinoma gástrico, por un mecanismo que involucra la evasión de la respuesta por los Linfocitos T Infiltrantes, lo que induce a su apoptosis. Por otro lado, la expresión de Fas claramente generó el incremento de la apoptosis de las células de adenoma y carcinoma gástrico. Por lo tanto, el sistema Fas/FasL parecer ser relevante para la proliferación de las células durante el proceso adenoma-carcinoma (23).
Se ha encontrado, también, un incremento estadísticamente significativo en la expresión de FasL tumoral concomitante, con un aumento en los niveles séricos de FasL en adenocarcinoma gástrico, independiente del estadio tumoral y subtipo histológico (24). La coexpresión de FasL y Fas que ocurre en grandes áreas del adenocarcinoma gástrico no genera un incremento de la tasa de apoptosis de células tumorales, pero sí se demostró una reducción estadísticamente significativa de Linfocitos T Infiltrantes, concomitante con el incremento significativo de la apoptosis de los mismos, adyacente a regiones del tumor que expresan FasL. Este hallazgo sugiere que la disminución observada en cáncer gástrico de Linfocitos T Infiltrantes se debe a un proceso de apoptosis mediado por Fas, en respuesta a la expresión de FasL en las células tumorales. También, brinda evidencia sobre la teoría de contra-ataque por Fas como un mecanismo de escape del sistema inmune, tanto en el cáncer gástrico de tipo intestinal como difuso (ver figura 3). Esta capacidad de los Linfocitos T Infiltrantes para evadir la respuesta del sistema inmune es adquirida desde estadios tempranos del cáncer y continúa a través de la progresión tumoral; así, esta es dependiente de la capacidad de la producción de FasL por las células tumorales (24, 25).
Además, se ha encontrado mayor expresión, de manera estadísticamente significativa, de FasL en las células displásicas del foco primario, en comparación con las del foco metastásico; mientras que la expresión de caspasa 3 es menor en el foco primario, que en el foco metastásico, con una diferencia también estadísticamente significativa. Lo anterior demuestra la capacidad disminuida de las células metastásicas cancerosas para inducir apoptosis en linfocitos y la mayor susceptibilidad de ellas para sufrir apoptosis, lo cual podría ser influenciado por el microambiente tumoral. Estos hallazgos sugieren que el aumento en la expresión de FasL y la disminución de la expresión de la caspasa 3 en las células del carcinoma primario están involucrados en la carcinogénesis gástrica (7).
Figura 3. Mecanismo de contra-ataque
Los pacientes con carcinoma gástrico con expresión de Fas parecen tener una mejor sobrevida que los que tienen masas tumorales negativas para la expresión de Fas. Se ha encontrado mayor expresión de Fas en tumores en estadios iniciales y bien diferenciados, que en los más avanzados y pobremente diferenciados. La alta expresión de Fas y apoptosis frecuente en carcinomas gástricos en estadios tempranos indica que la apoptosis mediada por Fas puede ser uno de los mecanismos de defensa para restringir el crecimiento tumoral en fases iniciales de desarrollo (26). Por otro lado, el pobre pronóstico del carcinoma gástrico de tipo difuso, comparado con el carcinoma gástrico de tipo intestinal, podría ser en parte explicado por la carencia de expresión de Fas en las células del carcinoma gástrico de tipo difuso, lo que genera menos vulnerabilidad en la apoptosis inducida por las células que expresan FasL (27).
Alteración de la vía Fas/FasL durante la infección por H. Pylori
La infección por Helicobacter Pylori es una de las principales causas de la aparición de cáncer gástrico. Los eventos moleculares iniciadores de la carcinogénesis gástrica inducida por Helicobacter Pylori son desconocidos, aunque varios estudios indican que en la infección temprana hay un incremento de la muerte celular mediado por apoptosis, lo que aumenta la expresión de su receptor Fas, probablemente por el aumento de INF- ã, y de citosina, producida por las células inflamatorias, en respuesta a la infección. El aumento de la apoptosis acaba con la población de las células principales y parietales, mediada por la expresión de FasL por los Linfocitos T y a medida que la infección progresa aparecen células metaplásicas y displásicas, resistentes a la apoptosis inducida por el FasL de los Linfocitos T Infiltrantes, como se evidencia por la expresión del receptor Fas y la baja incidencia de apoptosis, a pesar de la amplia presencia de FasL.
No está claro, todavía, si la pérdida de estas células facilita la aparición de metaplasia y displasia o si su pérdida promueve el desarrollo de lesiones neoplásicas. La adquisición de un fenotipo antiapoptótico antes de la transformación celular sugiere que la pérdida de sensibilidad Fas puede ser un evento temprano requerido para el desarrollo de cáncer gástrico (17, 28). Bajo una constante exposición al ligando de las células del sistema inmune hay una probable selección para las células resistentes a Fas. No es claro si las células metaplásicas y displásicas son inherentemente resistentes a Fas o si las células con mayor resistencia sobreviven selectivamente.
Tampoco es claro el mecanismo por el cual estas células evitan la apoptosis medida por Fas, pero algunos mecanismos podrían ser alteración en la expresión de caspasas, expresión incrementada de survivina y/o mutaciones en el dominio de muerte del receptor Fas. Aunque las alteraciones genéticas son posibles, es probable que la evasión temprana de la apoptosis involucre mecanismos reversibles. También es posible afirmar, basándose en datos de estudios en humanos, que la metaplasia y la displasia temprana son lesiones reversibles y que la arquitectura normal puede, al menos, ser parcialmente restaurada con la erradicación bacteriana exitosa (17).
IMPLICACIONES CLÍNICAS Y PERSPECTIVAS DE LA UTILIDAD DE LA REGULACIÓN DE LA VÍA FAS/FASL EN LA PREVENCIÓN, DIAGNÓSTICO Y TRATAMIENTO DEL CÁNCER GÁSTRICO
La expresión de FasL potencialmente capacita a las células tumorales gástricas para contraatacar y matar las células efectoras inmunes antitumorales y contribuye a la evasión inmune del cáncer gástrico. Se ha encontrado variabilidad en la expresión de FasL intra e intertumoral, sin importar el estadio tumoral o subtipo histológico, lo que sugiere que FasL puede ser expresado a través de la progresión del cáncer gástrico.
Se ha encontrado, además, un incremento de Fas ligando sérico (sFasL) en los casos donde hay expresión de FasL tumoral; por su parte, donde no hay expresión de FasL tumoral no se observa el incremento en sFasL. Esto sugiere que el sFasL deriva del FasL tumoral. Esta elevación de sFasL disminuye después de que los pacientes son sometidos a manejo quirúrgico, lo que hace que la molécula se convierta en candidata a marcador de seguimiento postoperatorio (24).
Por otro lado, la apoptosis espontánea en el carcinoma gástrico puede ser un indicador pronóstico para la sobrevida y está significativamente influenciado por la expresión tumoral de Fas y el número de Linfocitos T Infiltrantes, aunque la importancia pronóstica de la expresión de Fas/FasL en el cáncer gástrico todavía no ha sido evaluada (26). Por consiguiente, la desregulación temprana de la vía Fas/FasL en el proceso de carcinogénesis gástrica y la posterior evasión de la apoptosis mediada por Fas parecen ser alteraciones moleculares tempranas importantes en el desarrollo de lesiones premalignas, posterior crecimiento tumoral y expansión clonal de las células transformadas. Además, el FasL producido por las células tumorales produce una evasión del tumor a la respuesta inmune del huésped, lo que induce a apoptosis de TILs en el área que rodea al tumor, durante la progresión del carcinoma gástrico.
Este fenómeno de contraataque depende, de manera directamente proporcional, de la habilidad de las células tumorales para expresar FasL y de la apoptosis de las células TILs. Sin embargo, el FasL de las células tumorales es expresado en el carcinoma gástrico temprano, sin importar el estadio clínico, como un método para evadir la vigilancia inmune en estadios iniciales. Es posible que el balance entre la reacción linfocitaria y el mecanismo de contraataque sea una variable que se pueda correlacionar con el estadio clínico del tumor y con la progresión de la enfermedad, sin importar el tipo histológico de adenocarcinoma gástrico (24).
Los niveles de sFasL en pacientes con gastritis aguda o en pacientes sanos no alcanzan los niveles que se presentan en la mayoría de pacientes con cáncer gástrico, por lo cual se podría proponer que el incremento de sFasL es un hallazgo serológico sensible en pacientes con este tipo de cáncer. Sin embargo, la especificidad de la elevación de los niveles de sFasL debe ser mejor evaluada, ya que múltiples condiciones pueden afectar el resultado. A pesar de ello, el sFasL no debe ser considerado un factor principal determinante de la agresividad biológica de la célula tumoral, debido a que no se han encontrado diferencias estadísticamente significativas entre el estadio clínico y el subtipo histológico (24).
Por su parte, la sensibilización a Fas de las células tumorales o la protección a FasL de los linfocitos infiltrantes podrían ser blancos útiles para estrategias terapéuticas futuras. Anticuerpos neutralizantes anti-FasL o inhibidores de las metaloproteinasas podrían ser utilizados en la modulación del daño tisular; además, la presencia de sFasL quizás esté asociada al daño sistémico tisular presente en los pacientes con cáncer, lo que convierte a esta molécula en otro objetivo terapéutico interesante.
El hallazgo de la disminución de Linfocitos T Infiltrantes como consecuencia de apoptosis mediada por Fas y asociada a un aumento en la expresión de FasL por las células tumorales, nos da evidencia que soporta el mecanismo de contraataque por Fas e indica que el nivel de sFasL puede ser un indicador útil en diagnósticos preoperatorios y seguimiento postoperatorio del adenocarcinoma gástrico, sin variación de acuerdo al estadio clínico o tipo histológico (24). Por otro lado, los últimos avances en terapia génica han demostrado que genes suicidas, genes supresores de tumores y genes anti-angiogénicos, entre otros, pueden ser introducidos en células cancerígenas por medio de vectores como los adenovirus (29); más específicamente, se han realizado estudios en donde se han infectado células de carcinoma gástrico humano (SGC- 7901) con Ad-FasL, se observó un incremento de la expresión de FasL y, en consecuencia, de apoptosis (7).
Finalmente, si se pudieran encontrar factores predictores de las características biológicas de los tumores, determinando la relación entre la presencia-ausencia o el grado de expresión de las proteínas y los factores relacionados con la progresión y pronóstico del tumor, se podrían tratar los tumores regulando estas proteínas.
Es así como el FasL surge como una molécula interesante para evaluar el comportamiento biológico en el cáncer gástrico (24) y como cobra importancia la evasión de la apoptosis mediada por Fas como un evento temprano en el cáncer gástrico, que contribuye a un fenotipo agresivo, y las estrategias que apuntan a la restauración de la apoptosis mediada por Fas, como aproximaciones terapéuticas para el cáncer gástrico, que sigue siendo resistente a la terapia convencional (17).
CONCLUSIÓN
La apoptosis mediada por la vía de señalización Fas/FasL es un mecanismo importante para la homeostasis tisular del epitelio gástrico humano. La desregulación de esta vía durante el proceso de carcinogénesis gástrica es un evento temprano, relacionado con la aparición de las lesiones precursoras, con el desarrollo tumoral y la generación de células neoplásicas. Aunque se evidencian diferencias en los resultados de los diferentes estudios, los hallazgos indican que la vía Fas/FasL es de vital importancia en la aparición de cáncer gástrico y que su regulación es un objetivo terapéutico interesante para esta enfermedad, además de plantear su posible utilidad como marcador diagnóstico, pronóstico y terapéutico de FasL y sFasL.
A pesar del diagnóstico temprano y la mejoría del pronóstico posterior a la resección curativa, un número significativo de pacientes con carcinoma gástrico todavía muere por fallas en el tratamiento primario o diagnóstico tardío de la enfermedad.
Nuevos marcadores moleculares y estrategias terapéuticas son necesarios para diseñar una aproximación efectiva que permita tratar a estos pacientes apropiadamente (26). Por esto, se deben realizar más estudios que logren esclarecer mejor el papel de la vía Fas/FasL en la carcinogénesis gástrica en sus diferentes estadios, lo cual derivará en una mejor comprensión de los mecanismos fisiopatológicos y moleculares de la enfermedad, y en la generación de procedimientos para evitar la aparición de cáncer gástrico y generar mejores aproximaciones diagnósticas, pronósticas y terapéuticas. Por otro lado, los niveles de sFasL podrían convertirse en un parámetro valorable en el seguimiento postoperatorio, aunque existen limitaciones, debido a la baja especificidad de la prueba; sin embargo, se deberían realizar más estudios en busca de este objetivo.
REFERENCIAS
1. Ángel LA, Giraldo A, Pardo CE. Mortalidad por cánceres del aparato digestivo en Colombia entre 1980 y 1998. Análisis de tendencias y comparación regional. Rev Fac Medicina (Universidad Nacional de Colombia) 2004; 52: 19-37. [ Links ]
2. Gao HJ, Yu LZ, Bai JF, Peng YS, Sun G, Zhao HL, et al. Multiple genetic alterations and behaviour of cellular biology in gastric cancer and other gastric mucosal lesions: H. pylori infection, histological types and staging. World J Gastroentero 2000; 6(6): 848-54. [ Links ]
3. Lauren P. The two histological main types of gastric carcinoma: diffuse and so-called intestinal type carcinoma. Acta Pathol Microbiol Immunol Scand 1965; 64: 31-49. [ Links ]
4. Correa P. A human model of gastric carcinogenesis. Cancer Res 1988; 48: 3854-60. [ Links ]
5. Smith MG, Hold GL, Tahara E, El-Omar EM. Cellular and molecular aspects of gastric cancer. World J Gastroenterol 2006; 12(19): 2979-90. [ Links ]
6. Peter S, Beglinger C. Helicobacter pylori and gastric cancer: the causal relationship. Digestion 2007; 75: 25-35. [ Links ]
7. Zheng SY, Li DC, Zhang ZD, Zhao J, Ge JF. Adenovirusmediated FasL gene transfer into human gastric carcinoma. World J Gastroenterol 2005; 11: 3446-50. [ Links ]
8. Faller G, Kirchner T. Immunological and morphogenic basis of gastric mucosa atrophy and metaplasia. Virchows Arch 2005; 446:1-9. [ Links ]
9. Wang L, Choi Y, Hua X, Shin Y, Song Y, Youn S, Yun, et al. Increased expression of sonic hedgehog and altered methylation of its promoter region in gastric cancer and its related lesions. Modern Pathology 2006; 19: 675-83. [ Links ]
10. Ma X, Chen K, Huang S, Zhang X, Adegboyega PA, Evers BM, et al. Frequent activation of the hedgehog pathway in advanced gastric adenocarcinomas. Carcinogenesis 2005; 26 (10):1698-705. [ Links ]
11. Croce CM. Oncogenes and cancer. N Engl J Med 2008; 358(5): 502-11. [ Links ]
12. Alberts B. Molecular biology of the cell. 3ª ed. New York: Garland Science Publishers; 2004. [ Links ]
13. Nagata S. Apoptosis by death factor. Cell 1997; 88: 355-65. [ Links ]
14. Kanduc D, Mittelman A, Serpico R, Sinigaglia E, Sinha AA, Natale C, et al. Cell death: apoptosis versus necrosis. International Journal of Oncology 2002; 21:165-70. [ Links ]
15. Shirin H and Moss SF. Helicobacter pylori induced apoptosis. Gut 1998; 43: 592-4. [ Links ]
16. Maeda S, Yoshida H, Mitsuno Y, Hirata Y, Ogura K, Shiratori Y, et al. Analysis of apoptotic and antiapoptotic signalling pathways induced by helicobacter pylori. J Clin Pathol: Mol Pathol 2002; 55: 286-93. [ Links ]
17. Cai X, Stoicov C, Li H, Carlson J, Whary M, Fox JG, et al. Overcoming Fas-mediated apoptosis accelerates helicobacter-induced gastric cancer in mice. Cancer Res 2005; 65(23): 10912-20. [ Links ]
18. Soung H, Lee JW, Kim SY, Jang J, Park YG, Park WS, et al. Caspase-8 gene is inactivated by somatic mutations in gastric carcinomas. Cancer Res 2005; 65: 815-21. [ Links ]
19. Muzio M, Stockwell B, Stennicke H, Salvesen G, Dixit V. An induced proximity model for caspase-8 activation. J Biol Chem 1998; 273(5): 2926-30. [ Links ]
20. O´Connell J. Fas ligand and the fate of antitumor cytotoxic T lymphocytes. Immunology 2002; 105: 263-6. [ Links ]
21. Aguilar-Lemarroy A, Romero-Ramos JE, Olimon-Andalon V, Hernández-Flores G, Lerma-Diaz JM, Ortiz-Lazareno PC, et al. Apoptosis induction in Jurkat cells and sCD95 levels in womens sera are related with the risk of developing cervical cancer. BMC Cancer 2008; 8: 99. Disponible en: http://www.biomedcentral.com/1471-2407/8/99. [ Links ]
22. Mao JD, Wu P, Yang YL, Wu J, Huang H. Relationship between expression of gastrin, somatostatin, Fas/ FasL and caspases in large intestinal carcinoma. World J Gastroenterol 2008; 14(18): 2802-9. [ Links ]
23. Osaki M, Kase S, Kodani I, Watanabe M, Adachi H, Ito H. Expression of Fas and Fas ligand in human gastric adenomas and intestinal-type carcinomas: correlation with proliferation and apoptosis. Gastric Cancer 2001; 4: 198-205. [ Links ]
24. Sung-Chul Lim. Expression of Fas ligand and sFas ligandin human gastric adenocarcinomas. Oncology Reports 2002; 9:103-7. [ Links ]
25.Bennett MW, OConnell J, OSullivan GC, et al. Fas ligand and Fas receptor are coexpressed in normal human esophageal epithelium: a potential mechanism of apoptotic epithelial turnover. Dis Esophagus 1999; (12): 90-8. [ Links ]
26. Ohno S, Tachibana M, Shibakita M, Dhar DK, Yoshimura H, Kinugasa S, et. al. Prognostic significance of Fas and Fas ligand system-associated apoptosis in gastric cancer. Ann Surg Oncol 2000; 7: 750-7. [ Links ]
27. Van der Woude CJ, Kleibeuker JH, Tiebosch ATGM, Homan M, Beuving A, Jansen PLM, et al. Diffuse and intestinal type gastric carcinomas differ in their expression of apoptosis related proteins. J Clin. Pathol 2003; 56: 699-702. [ Links ]
28. Jones NL, Day AS, Jennings HA, Sherman PM. Helicobacter pylori induces gastric epithelial cell apoptosis in association with increased Fas receptor expression. Infection and Immunity 1999; 67(8): 4237-42. [ Links ]
29. Khalighinejad N, Hariri H, Behnamfar O, Yousefi A, Momeni A. Adenoviral gene therapy in gastric cancer: A review. World J Gastroenterol 2008; 14(2): 180-4. [ Links ]














