Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Ciencias de la Salud
Print version ISSN 1692-7273On-line version ISSN 2145-4507
Rev. Cienc. Salud vol.7 no.3 Bogotá Sept./Dec. 2009
Estrategias de prevención primaria y tamización para cáncer colorrectal: ¿cuál estrategia debemos tomar?
Primary Prevention and Screening Strategies for Colorectal Cancer: Which Strategy Should Take?
Carlos Eduardo Pinzón Flórez M.D. MSc.1, Felipe Vargas Barato M.D.2, Juan Carlos Barriga M.D.3
1. Grupo de Investigación a la Oferta, Fundación Universitaria Sanitas, Bogotá, Colombia.
2. Departamento de Cirugía, Universidad del Rosario, Bogotá, Colombia.
3. Departamento de Urgencias, Clínica Universitaria Colombia, Bogotá, Colombia. Correspondencia: Carlos Eduardo Pinzón Flórez, Instituto de Investigaciones, Av. Calle 68 No. 22 A - 30, segundo piso, Bogotá, Colombia. Teléfono: (57)1 - 2220015, ext. 0023. Fax: (57)1 - 3341360. Correo electrónico: cepinzon@gmail.com.
Agradecimientos: agradecemos al Instituto Nacional de Cancerología por permitirnos acceder a los textos fuente de los estudios realizados en el país sobre cáncer colorrectal. Conflictos de interés: conflictos de interés no declarados.
Recibido: 20 de enero de 2009 Aceptado: 21 de septiembre de 2009
Resumen
Objetivo: explorar y definir la utilidad de las diferentes estrategias de prevención primaria (ASA, dieta, actividad física) y las estrategias de tamización (test de sangre oculta en heces, sigmoidoscopia, colonoscopia, etc.) para cáncer colorrectal.
Fuente de datos: las bases de datos consultadas fueron MEDLINE (1966 a 2006), DARE (1980 a 2006), Cochrane Central Register of Controlled Trials, Cochrane Collaborations Registry of Clinical Trials, Cochrane Database of Systematic Reviews y LILACS.
Selección de los estudios: estudios tipo ensayo clínico, cohorte y casos y controles de la efectividad de las pruebas de tamización y prevención primaria para adenoma y cáncer colorrectal; fueron identificados por dos revisores.
Extracción de los datos: la extracción de los datos y su evaluación se realizo en la mayoría del proceso de manera pareada.
Limitaciones: no cumple rigurosamente con la metodología de una revisión sistemática, por lo cual su reproducibilidad es cuestionable. Las conclusiones de este estudio deben extrapolarse con precaución.
Conclusiones: la mejor estrategia de tamización en cuanto a la efectividad de detección temprana de lesiones preneoplasicas o cáncer es la colonoscopia cada 5 anos; sin embargo, es necesario evaluar esta medida con estudios de costo-efectividad. En cuanto a prevención primaria, la aspirina y los inhibidores de la ciclooxigenasa 2 reducen la incidencia de adenoma colonico. La aspirina puede reducir la incidencia de cáncer colorectal. Sin embargo, estos medicamentos pueden estar asociados a un importante riesgo de eventos cardiovasculares y sangrado gastrointestinal. El balance entre riesgos y beneficios debe ser evaluado en próximos estudios.
Palabras clave: cáncer colorrectal, adenoma, programa de tamizaje organizado, test de tamizaje.
Abstract
Objective: To explore and define the utility of different strategies for primary prevention (ASA, diet, physical activity) and strategies of screening test (FOBT, sigmoidoscopy, colonoscopy, etc.) for colorectal cancer.
Data source: Databases consulted were MEDLINE (1966 to 2006), DARE (1980 to 2006), Cochrane Central Register of Controlled Trials, Cochrane Collaborations Registry of Clinical Trials, Cochrane Database of Systematic Reviews and LILACS.
Study selection: Studies such clinical trial, cohort and case-control studies of the effectiveness of tests for screening and primary prevention adenoma and colorectal cancer were identified by two reviewers.
Data Extraction: The extraction of data and its evaluation is done in most of the process so paired.
Limitations: Not strictly complies with the methodology of a systematic review and therefore reproducibility is questionable, the conclusions of this study should be extrapolated with caution.
Conclusions: The major strategy of screening on the effectiveness of early detection of premalignant lesions or cancer is colonoscopy every 5 years, however it is necessary to evaluate this measure cost-effectiveness studies. For primary prevention, aspirin and cyclooxygenase-2 inhibitors reduce the incidence of colorectal adenomas. Aspirin can reduce colorectal cancer incidence. However, these medications may be associated with a significant risk of cardiovascular events and gastrointestinal bleeding. The balance between risks and benefits must be evaluated in future studies.
Key words: colorectal neoplasms (MeSH), adenoma (MeSH), organized screening program (All Fields), screening test (All Fields).
Introducción
El Carcinoma Colorrectal (CCR) es un problema de salud publica importante en países desarrollados, pues ocupa el segundo puesto en incidencia por patologías oncológicas (1). En Colombia, el CCR ocupa el cuarto puesto para ambos sexos en incidencia entre todos los canceres y muestra una tendencia ligeramente mayor en las mujeres (6), con un aumento constante en la incidencia desde el inicio de la década de los 80 (2, 7, 8). Al igual que a nivel mundial, la mayor incidencia en nuestro país es en poblaciones mayores de 50 anos. En el Instituto Nacional de Cancerología se muestra el incremento en mortalidad en los últimos cuatro anos: de 177 casos nuevos en 1999, se paso a 324 en 2003 (9).
El problema colombiano puede entenderse en el estudio de Ángel y colaboradores, quienes, en el ano 2004, publicaron proyecciones no ajustadas sobre mortalidad de enfermedades gastrointestinales oncológicas. En su investigación, los autores estiman que para el ano 2045 la incidencia del CCR se igualara al cáncer gástrico en el país.
La carga de la enfermedad del CCR en Colombia tiene, además, una segunda consideración, independiente de su incidencia o mortalidad: la primera consulta de estos pacientes se realiza en estadios tardíos de la enfermedad, escenario que nos impone una medicina intervencionista y rehabilitadora, mas no preventiva.
Existe evidencia de Ensayos Clínicos Aleatorizados (ECA) que muestran que la tamización y la prevención primaria reducen la mortalidad por CCR (4). Las condiciones epidemiológicas del CCR en Colombia difieren a lo observado en países desarrollados, debido a que nuestros indicadores de incidencia y mortalidad son evidentemente inferiores. Sin embargo, demostrada la eficacia de las estrategias de prevención (primaria y secundaria) para CCR, es necesario evaluar estas estrategias en el contexto colombiano; a esto se suma que la población colombiana se encuentra inmersa en condiciones culturales de occidentalización, debido a un importante proceso de transición demográfica y epidemiológica, hecho reflejado en la tendencia ascendente de la incidencia y mortalidad por esta enfermedad.
Las estrategias para la tamización y prevención primaria del CCR pueden generar escenarios potencialmente serios de gran repercusión humana, asistencial y económica para el país, lo que afecta a los pacientes, los gestores y los profesionales de la salud en su ejercicio diario. Dado que los recursos son limitados, los tomadores de decisión necesitan información que les permita asignar recursos a aquellas intervenciones que muestren mejores razones de costo-efectividad. En Colombia, no se han realizado análisis económicos que evalúen este aspecto de las diferentes estrategias de prevención de CCR.
En el caso de Estados Unidos, el CCR es la tercera causa de muerte por cáncer en hombres y mujeres; se calcula que cada ano se gastan 8,4 billones de dólares en su tratamiento (3). También se sabe que el 6% de la población estadounidense desarrolla CCR en algún momento de su vida; la carga de la enfermedad es tal, que en el 2004 se diagnosticaron 150.000 nuevos casos y se produjeron 56.700 muertes por esta enfermedad (4).
En Gran Bretaña, el CCR es la segunda causa de mortalidad por cáncer y se diagnostican 30.000 casos nuevos cada ano. Dado que el 80% de los casos se diagnostica en estadios avanzados (compromiso de toda la pared o compromiso ganglionar), la supervivencia global a cinco anos no supera el 40%. El diagnostico tardío se debe a que los síntomas dentro de la historia natural de la enfermedad se expresan también tardíamente (5). Por el contrario, cuando la lesión se diagnostica en sus fases iniciales la supervivencia a cinco anos es mayor al 80%.
Metodología
Fuente de los datos
Para la selección de los artículos a revisar se desarrollo una estrategia de búsqueda para MEDLINE, la cual fue modificada para cada una de las bases de datos propuestas en el estudio. La búsqueda fue limitada por lenguaje: ingles, español y portugués.
Las siguientes bases de datos fueron consultadas: MEDLINE (1966 a diciembre de 2008), DARE (1991 a 2008), Registro Central de Ensayos Clínicos Cochrane y la librería Cochrane (de 1999 a 2008). Se realizo una búsqueda en LILACS, por medico, de términos DeCS; los términos relacionados con cáncer fueron tomados del glosario de términos del Instituto Nacional de Cáncer de Estados Unidos, entre los que estuvieron "colorectal cáncer" y "adenomatous polyps". Se realizo la adaptación de los términos para las diferentes bases de datos y se evaluó la posibilidad de artículos relacionados con cada termino (ver Anexo 1).
Selección de los estudios
Se revisaron todas las citas, resultado de las estrategias de búsqueda en cada base de datos; se identificaron estudios tipo ensayo clínico, estudios analíticos observacionales tipo cohorte y/o casos y controles; se evaluaron de manera preliminar los estudios por titulo y por resumen, teniendo en cuenta los criterios de selección (evaluación de estrategias de tamización y/o prevención primaria, población general, tipo de estudio), y finalmente, se seleccionaron los articulo, proceso que no se realizo de manera sistemática o pareada. Se excluyeron estudios que evaluaran dichas estrategias en población de alto riesgo, con poliposis adenomatosa familiar o síndrome de Lynch I o II
Extracción de los datos y evaluación de la calidad
Los miembros del grupo de trabajo extrajeron los datos importantes de cada uno de los estudios seleccionados para esta revisión, de acuerdo a la estrategia PICO. Los datos extraídos fueron aquellos relacionados con efectividad de quimioprevención y características operativas de pruebas diagnosticas para tamización.
Pruebas de tamización
Esta metodología consiste en la aplicación de una o mas pruebas a personas asintomáticas o en riesgo, para identificar aquellas que tienen la enfermedad o un precursor de la misma (10). La medida critica para definir la efectividad de una prueba de tamización en cáncer es la reducción en la mortalidad por esta enfermedad.
El CCR es una enfermedad susceptible de tamización, pues es un problema importante de salud publica, se conoce su historia natural, se cuenta con pruebas diagnosticas que permiten detectar la enfermedad en fases tempranas y existen tratamientos efectivos de las lesiones precancerosas. Los objetivos de la aplicación de esta metodología a este tipo de cáncer son: detección de la enfermedad en fases tempranas, lo que lleva a disminución de la mortalidad, y la detección de lesiones precancerosas, que deriva en una reducción en la incidencia y la mortalidad.
En la actualidad existen múltiples pruebas para la tamización del CCR, estas son: sangre oculta (prueba de guayaco o la inmunohistoquimica), sigmoidoscopia flexible, colonoscopia total y colonoscopia virtual. También hay otras en desarrollo, como el ADN en materia fecal para detectar mutaciones y la video-capsula (mas utilizada en enfermedades del tracto digestivo superior). El colon por enema, utilizado durante varias décadas, ya perdió su vigencia, ya que la colonoscopia tiene una mayor sensibilidad y especificidad y, además, tiene potencial terapéutico (11). A continuación se desarrolla cada una de estas pruebas.
Sangre oculta
Es un ensayo colorimétrico de una reacción sobre guayaco, catalizado por la pseudoperoxidasa presente en la sangre. Como prueba de tamización tiene las siguientes ventajas: bajo costo; es una prueba simple, no invasiva y segura. Sin embargo, su desventaja es la baja sensibilidad (12), la cual, para el caso de detección de CCR, es de 30 a 40%, con una especificidad de 96 a 98% en muestras no rehidratadas (13, 14, 15). La sensibilidad aumenta al 60% tomando tres muestras, cada una en momentos diferentes, y rehidratando el espécimen (14, 15).
Un estudio de la Universidad de Minnesota, en el cual participaron 46.551 personas entre los 50 y 80 anos, asignadas en forma aleatoria a uno de tres grupos (tamización cada dos años, tamización cada ano y no tamización) (16), logro que en un seguimiento de trece anos la mortalidad se redujera significativamente: en un 33%. En una actualización de este estudio, para un seguimiento de 18 anos, el grupo bianual tuvo una reducción de la mortalidad del 21% (17); iguales reducciones se reportaron en los estudios europeos (18,19) (ver tabla 1).
Tabla 1. Efecto de la tamización con sangre oculta en materia fecal sobre la mortalidad e incidencia por CCR
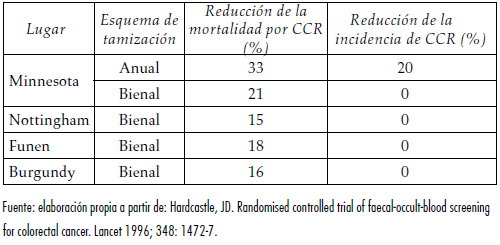
El estudio de Goteborg dividió aleatoriamente a 68.308 personas en dos grupos (18), uno recibió la prueba de tamización y el otro fue el grupo control; los participantes se tamizaron cada 16 a 24 meses con hemoccult (sangre oculta) rehidratados. Los resultados finales aun no se han reportado, pero los preliminares, después de 8 anos de seguimiento, indican que la mortalidad por CCR se redujo en un 12% (19), lo cual es consistente con los otros estudios.
La sangre oculta ha demostrado, además, que reduce la incidencia de CCR; en el estudio de Minnesota, por ejemplo, esta reducción fue de 20% en el grupo anual (IC 95%: 0,7-0,9; p= 0,01) y de 17% en el bianual (IC 95%: 0,73- 0,94; p=0,02) (22).
Estudios de caso y control han dado resultados similares a los ensayos clínicos controlados, en estos se ha observado que los casos tienen porcentajes menores de tamización, lo que demuestra un beneficio de la sangre oculta como prueba de tamización en la reducción de la mortalidad por cáncer de colon (23, 24).
Las pruebas inmunoquimicas tienen ventajas sobre el guayaco, ya que detectan únicamente hemoglobina humana; por esta razón, no requieren restricción dietaria antes de su realización. Un estudio de caso y control realizado en Japón mostro que el uso de esta prueba se asocia con una disminución en la mortalidad por cáncer de colon, con un OR de 0,4 (IC 95%: 0,17-0,92; p = menor de 0,001); 0,41 (IC 95%: 0,2-0,82; p = menor de 0,001) y 0,48 (IC 95%: 0,2-0,82; p = menor de 0,001), dependiendo de si la tamización se realizo en el primero, segundo o tercer ano del caso diagnosticado (25).
Sigmoidoscopia flexible
La evidencia del beneficio de la sigmoidoscopia proviene de estudios de caso y control. Uno de estos estudios encontró que el uso de sigmoidoscopia esta asociado a la disminución de la mortalidad por cáncer de colon, con un OR de 0,41 (IC 95%: 0,25-0,69; p = 0,002) (26).
La mejor evidencia de esta técnica de tamización se obtendrá de un estudio aleatorizado controlado en curso, a cargo de Philip C. Prorok, del grupo de PLCO en Estados Unidos (el estudio es de tamización para cáncer de próstata, pulmón, ovario y colorrectal). En este se evalúa la efectividad de dos sigmoidoscopias flexibles con intervalos de 3 y 5 anos; los resultados definitivos estarán disponibles en 3 anos (27).
Colonoscopia
A pesar de la ausencia de estudios clínicos aleatorizados controlados, parece que la colonoscopia puede reducir la incidencia y mortalidad por CCR. Esto se deduce de los siguientes estudios: el Estudio Nacional de Polipos y el Estudio Multicentrico Italiano (28).
La erradicación de los pólipos con colonoscopia es la base de los dos estudios mencionados anteriormente, en los cuales se demostró una disminución en la incidencia de CCR entre los pacientes a los cuales se les resecaron los pólipos adenomatosos.
Colonoscopia virtual
Con esta técnica se crean imágenes bidimensionales o tridimensionales del colon, mediante escáneres helicoidales de multicorte, cuyas imágenes son reconstruidas por computador (29). El mayor estudio en el que se han usado imágenes tridimensionales muestra que para identificar pólipos de 10mm la sensibilidad es de 93,8%, con una especificidad de 96% (30). A pesar de estos resultados, un estudio posterior mostro que esta técnica no es la mas adecuada para tamización, ya que la sensibilidad para lesiones de 6mm es de 39% y para las de 10mm, de 55% (31). En consecuencia, para un uso mas efectivo de la prueba los problemas técnicos tendrán que ser resueltos.
Colon por enema de doble contraste
El enema de bario con doble contraste es una prueba radiológica que consiste en la administración de bario y aire a presión en el colon. Esta exploración se realiza previo lavado del colon con un enema o mediante la administración de laxantes, y sin necesidad de sedación (32). Ante un resultado positivo se requiere un examen completo del colon mediante colonoscopia.
No se dispone de estudios aleatorizados que evalúen la eficacia del enema opaco en la tamización del CCR en términos de incidencia o mortalidad (14,33). Por su parte, un estudio de caso y control demuestra una reducción importante, pero no significativa, de la mortalidad (OR: 0,67; IC del 95%: 0,31-1,48,, p = 0,001), probablemente debido al reducido tamaño de la muestra (34).
La sensibilidad del enema opaco es menor que la de la colonoscopia y, además, no permite la toma de biopsias, ni la resección de los pólipos. Resultados del Estudio Nacional de Polipos muestran que el índice de detección del enema opaco para adenomas de tamaño <5mm, 6-10mm y >10mm es de 21, 53 y 48%, respectivamente (11).
Prevención primaria
La evidencia disponible indica que las intervenciones de prevención primaria en el CCR (modificación de la dieta, administración de antioxidantes, cambios del estilo de vida y quimioprevención) pueden incidir en las diversas etapas del desarrollo de esta neoplasia: previamente a la aparición de los adenomas, durante el crecimiento de estos y en el proceso de transformación a carcinoma. A continuación se desarrolla la influencia de cada una de estas intervenciones.
Dieta
Las primeras evidencias sobre el efecto de la dieta en el desarrollo del CCR derivan de la observación de importantes diferencias en la incidencia de esta neoplasia en diversas aéreas geográficas (aumento en los países occidentales y en relación con el desarrollo económico), así como del incremento de riesgo de la población inmigrante en zonas de alto riesgo, procedente de zonas de baja incidencia. Sin embargo, a pesar de la constatación de estos hechos desde hace décadas, aun no ha sido posible determinar de manera precisa que alimentos o nutrientes son los principales responsables de ello.
Algunos nutrientes como la fibra se han propuesto como mecanismos protectores de cáncer colorrectal, pues diluyen los caricinogenos en el intestino y mejoran el transito intestinal; sin embargo, los resultados de un metanalisis de estudios observacionales no evidencian asociación alguna (38). El consumo de carne también se ha asociado a riesgo de cáncer colorrectal, por los efectos carcinogenos de las aminas heterocíclicas durante la cocción de la carne, pero la evidencia epidemiológica no es concluyente al respecto (35). La asociación con frutas y verduras también ha sido inconsistente (35), aunque en un estudio de cohorte se vio protección asociada al consumo de leguminosas y de una dieta rica en fibra y verdura (39, 40). El riesgo asociado al consumo de tabaco ha sido marginal, aunque se ha planteado su interacción con polimorfismos genéticos, y el consumo de alcohol ha mostrado un leve aumento del riesgo (33).
Macronutrientes
La ingesta excesiva de los diferentes macronutrientes que componen la dieta puede contribuir a un incremento del riesgo de CCR. No obstante, los estudios sobre el papel de la dieta presentan limitaciones, dado que es difícil aislar sus componentes. Además, se desconoce si el tipo de alimento contribuye de manera independiente al riesgo de CCR o si este guarda relación con la ingesta excesiva de macronutrientes presentes en la comida (34).
Grasas
La mayoría de estudios observacionales no muestran que el contenido total de grasas incremente el riesgo de CCR (35, 36), aunque algunos tipos de grasa específicos podrían estar asociados a un mayor riesgo (33). En estudios de caso y control que mostraron una asociación positiva entre la ingesta de grasas y el riesgo de cáncer de colon, la relación fue normalmente atribuible a grasas de origen animal o fuentes de grasa saturada, mientras que rara vez fue asociada a grasas poliinsaturadas (36).
Como se señaló anteriormente, estos resultados deben interpretarse con cautela, porque un efecto de confusión de la energía total puede haber ocurrido en algunos de los estudios. Entre los cuatro posibles estudios de cohortes de cáncer de colon con una evaluación completa de la dieta, tres no encontraron una asociación entre grasas totales, animales, vegetales o grasas poliinsaturadas con el riesgo de cáncer colorectal (27, 29). En The Nurses Health Study, en el que se empleo una cohorte de >100,000 mujeres, se encontró el doble de riesgo de cáncer de colon en mujeres en el quintil mas alto, en comparación con las que estaban en el quintil mas bajo de la ingesta de grasa animal (26). En consecuencia, el consumo de grasa de carne roja aparece como factor de riesgo a tener en cuenta, con el mayor riesgo de influir en el desarrollo de cáncer de colon.
Carne
Las diferentes revisiones disponibles (37, 39) muestran que la ingesta total de carne no se asocia a un mayor riesgo de padecer CCR, pero si el consumo de carne roja (ternera, cerdo, cordero, etc.) (RR: 1,35; IC del 95%: 1,21-1,51; p = 0,04) (38); y de carne procesada (embutidos, tocineta, salchichas, etc.) (RR: 1,31; IC del 95%: 1,13-1,51; p = 0.03) (38). La relación entre consumo y riesgo es mayor para la carne procesada, que para la carne roja (39).
Fibra, vegetales y frutas
Aunque los estudios de caso y control muestran una asociación inversa entre el consumo de fibra, vegetales y fruta y el riesgo de CCR, los 34/Rev. Cienc. Salud. Bogotá (Colombia) 7 (3): 17-31, septiembre-diciembre de 2009 Pinzón, C.E.; Vargas, F.; Barriga, J.C. estudios prospectivos no la confirman (41). Sin embargo, recientemente, el estudio del European Prospective Investigation into Cáncer and Nutrition (42) ha demostrado un efecto protector. Estas inconsistencias podrían deberse a la existencia de variables de confusión: realización de ejercicio físico, consumo de suplementos vitamínicos y folatos, y bajo consumo de alcohol, entre otras (41, 43). No existen Ensayos Clínicos Aleatorizados (ECA) que evalúen si la dieta rica en fibra previene el desarrollo del CCR, aunque si se han realizado diversos ECA que evalúan el efecto de los suplementos de fibra y la dieta rica en fibra en relación con la recurrencia de adenomas colorrectales. Los resultados combinados de estos ECA no muestran que la dieta rica en fibra reduzca la recurrencia de adenomas colorrectales (RR: 1,04; IC del 95%: 0,95-1,13) (44). Un estudio anidado dentro del ECA, titulado Prostate Lung Colorectal and Ovarian Cáncer Screening Trial, muestra que en los pacientes con adenomas colorrectales una dieta rica en fibra reduce el riesgo de desarrollar estas lesiones (45).
Leche y otros productos lácteos
Resultados de una reciente revisión sistemática (36) indican que los estudios de caso y control no muestran un efecto protector de la leche u otros productos lácteos en relación con el riesgo de CCR, mientras que este efecto si se ha observado en los pocos estudios de cohortes disponibles.
Micronutrientes
Diversos estudios han evaluado el efecto de la administración de suplementos de folato, calcio y vitamina D, entre otros, en la prevención primaria del CCR.
Folato
Diferentes estudios epidemiológicos sugieren que los folatos, a través de su participación en la síntesis, reparación y metilación del ADN, pueden modular el desarrollo de CCR (34). Estudios observacionales, tanto en población general, como en pacientes con adenomas o historia familiar de CCR, muestran que los suplementos de folato disminuyen el riesgo de CCR (34).
Calcio
Una revisión de estudios observacionales, tanto de caso y control, como de cohorte, sugiere que la administración de calcio no se asocia a una reducción del riesgo de CCR (46). Por el contrario, estudios de cohorte mas recientes demuestran que la ingesta de calcio se asocia a una reducción del desarrollo de neoplasias en el colon distal (36, 47). Información indirecta, procedente de ECA en pacientes con adenomas colorrectales (48, 50), demuestra que los suplementos de calcio reducen, aunque de forma moderada, la recurrencia de estas lesiones tras la polipectomia.
Vitamina D
Se dispone de pocos estudios epidemiológicos que evalúen el efecto del consumo de vitamina D en la prevención del CCR (36). Una revisión sugiere que la vitamina D es un factor protector del CCR (46). No obstante, los estudios de caso y control mas recientes presentan resultados contradictorios (36) y no se dispone de ningún estudio prospectivo.
Antioxidantes
En los últimos años ha crecido el interés por evaluar la utilidad de los antioxidantes, sustancias con capacidad para inhibir el efecto oxidante de los radicales libres, en la prevención del CCR. Sin embargo, no hay hasta ahora un estudio que compruebe su eficacia para este propósito.
Carotenos
Los resultados de los ECA Womens Health Study (51), Physicians Health Study (52) y Alpha Tocopherol Beta Caroteno Cancer Prevention Study (53) no muestran asociación entre la administración de betacarotenos y la incidencia de CCR (54). Dos ECA en pacientes con adenomas colorrectales (Antioxidant Polyp Prevention Study (55) y Australian Polyp Prevention Project (56)) muestran un incremento no significativo del riesgo de recurrencia. Resultados mas recientes del Antioxidant Polyp Prevention Study (57) muestran que los betacarotenos se asocian a una reducción de este riesgo (RR: 0,56; IC del 95%: 0,35-0,89; p = 0.02) en pacientes que nunca han fumado ni consumido alcohol, mientras que confieren un incremento de este entre los fumadores o aquellos que consumen alcohol (57).
Vitamina E
A pesar del elevado numero de estudios observacionales y ECA que evalúan la relación entre el consumo de vitamina E y el riesgo de CCR, la baja calidad de estos conlleva a que el informe de la US Prevention Services Task Force (54) base sus recomendaciones únicamente en los resultados del ECA Alpha Tocopherol Beta Caroteno Cancer Prevention Study. Los resultados actualizados de este estudio (53) muestran que los suplementos de vitamina E no reducen de forma significativa el desarrollo de CCR (RR: 0,94; IC del 95%: 0,57-1,57).
Selenio
El Nutritional Prevention Cáncer Trial, disenado para evaluar la eficacia del selenio (200µg/ día) en la prevención de la recurrencia del cáncer de piel no asociado a melanoma (58), muestra una disminución no significativa de la incidencia de CCR (RR: 0,46; IC del 95%: 0,21- 1,02), causada por el consumo de este mineral.
Vitamina A
Dos estudios de cohortes que se están llevando a cabo en EE. UU. (Leisure World Study y Iowa Womens Health Study) muestran que la vitamina A reduce en las mujeres el riesgo de padecer CCR (54).
Vitamina B
Los estudios de cohortes que se están llevando a cabo muestran que el consumo de vitamina B reduce el riesgo de padecer CCR (54).
Vitamina C
Dos estudios de cohortes que se están llevando a cabo en EE. UU. (Leisure World Study y Iowa Womens Health Study) no demuestran que la vitamina C posea un papel protector en relación con el desarrollo de CCR en mujeres (54).
Actividad física, obesidad y balance energético
A partir de mas de 50 estudios observacionales disponibles, se estima que el ejercicio físico regular reduce el riesgo de padecer CCR en aproximadamente 40%, independientemente del Índice de Masa Corporal (59) del paciente. El nivel de actividad, intensidad, frecuencia y duración del ejercicio físico, así como la actividad mantenida en el tiempo, parecen estar asociados a una mayor reducción del riesgo.
Tanto los estudios de caso y control, como los de cohorte han mostrado una asociación entre el Índice de Grasa Corporal y el riesgo de padecer CCR (59). Esta asociación es menos evidente en el cáncer de recto, que en el de colon (59). Asimismo, los estudios epidemiológicos muestran que la reducción de peso tiene un efecto beneficioso en la prevención de esta neoplasia (59). Evidencias mas recientes sugieren que la obesidad central (acumulación de grasa en el abdomen) incrementa el riesgo de CCR, independientemente del Índice de Masa Corporal (34).
Consumo de alcohol
Un meta análisis muestra una asociación positiva entre la ingesta de alcohol y el desarrollo de CCR (60). Esta asociación se incrementa con mayor consumo de la bebida: una ingesta de 25g/día muestra un riesgo de 1,08 (IC del 95%: 1,06-1,10; menor de 0,05) y una ingesta de 100g/día, de 1,38 (IC del 95%: 1,29-1,49; menor de 0,05). La consideración del habito del tabaquismo como covariante no reduce el efecto observado. Sin embargo, es importante señalar que los resultados de los estudios son inconsistentes, debido a diferencias en su diseño y a posibles factores de confusión (dieta, sexo).
Consumo de tabaco
Las diferentes revisiones disponibles (61, 62) muestran que los estudios realizados antes de la década de 1970 no encontraron asociación entre el consumo de tabaco y el desarrollo de CCR. Sin embargo, el seguimiento de algunos de estos estudios a mas largo plazo (30 y 40 anos) muestran un aumento en el riesgo de padecer CCR. Esta asociación guarda relación con el numero de cigarrillos consumidos al día, tiempo de exposición al tabaco, intensidad y edad en que se empezó a fumar. Los diferentes factores de confusión estudiados (actividad física, alcohol, dieta) no reducen el efecto observado (61). Este riesgo podría ser mas elevado para el cáncer de recto que para el de colon (62).
Quimioprevención Antiinflamatorios no esteroides
La mayoría de estudios observacionales muestran que el uso regular de Acido Acetil Salicilico (AAS) reduce a la mitad, aproximadamente, el riesgo de padecer CCR. Estudios con otros AINE muestran también una reducción del riesgo. Sin embargo, los resultados del único ECA disponible, dirigido a evaluar la utilidad del AAS (325mg/día) en la prevención del infarto de miocardio, no ha demostrado una reducción de la incidencia de CCR, tras 5 anos de seguimiento. Una revisión sistemática, publicada en 2007 en "Annals of Internal Medicine", reporta que el consumo de Aspirina es una medida efectiva, pues reduce la incidencia de adenoma colonico y de CCR, especialmente si es consumida en altas dosis por mas de 10 anos; sin embargo, los posibles danos derivados de esta practica requieren de cuidadosas consideraciones (68, 69, 70).
Tratamiento hormonal posmenopáusico
Diversos meta análisis de estudios observacionales muestran una asociación inversa entre el tratamiento hormonal posmenopáusico y el riesgo de padecer CCR (71-74). Sin embargo, los resultados de ECA recientes, que evalúan la incidencia de cáncer como variable secundaria, muestran resultados inconsistentes. El Women Health Iniciative (WHI) muestra un efecto protector (RR: 0,63; IC del 95%: 0,43-0,92) que no alcanza la significación estadística tras el ajuste (RR: 0,63; IC del 95%: 0,32-1,24) (75).
Asimismo, los resultados del Heart and Estrogen/ Progestin Replacement Study (HERS II) muestran un efecto protector no significativo (RR: 0,81; IC del 95%: 0,46-1,45) (75). Además, el WHI muestra un incremento del riesgo de cardiopatía isquémica, accidentes cerebrovasculares agudos y cáncer de mama (75).
Costo-efectividad
Los resultados de una revisión sistemática (13) que incluye siete estudios demuestran que la tamización del CCR es costo-efectiva, en relación con la no tamización. En EE. UU., la relación de costo-efectividad de las diferentes estrategias de tamizaje disponibles oscila entre 10.000 y 25.000 dólares por año de vida ganado (76).
La tamización del cáncer colorrectal parece ser costo-efectiva comparada con las situaciones en las que no se implementa ninguna estrategia, pero una única estrategia optima no se puede determinar a partir de los datos actualmente disponibles. Datos adicionales en relación con la adherencia de tamizaje en el tiempo, las tasas de complicaciones en escenarios del mundo real y la biología del cáncer colorrectal son necesarios.
Es necesario también realizar análisis adicionales para determinar mejor las edades de inicio y cese del proceso de implementación de estrategias de tamizaje para esta enfermedad. También se debe visualizar la utilidad de las estrategias de prevención primaria como herramientas para reducción de la mortalidad por dicha enfermedad y proponer estrategias de tamizaje y prevención primaria juntas, con el fin de optimizar la eficacia y, en un futuro, la efectividad para la reducción de la mortalidad por cáncer colorrectal.
No existe evidencia disponible que compare las estrategias de prevención primaria con estrategias de tamizaje para la reducción de la mortalidad por cáncer colorrectal; asimismo, se debe tener en cuenta el contexto social y económico donde se integren dichas estrategias, ya que de ello dependerá la cobertura y adherencia a cualquiera de las estrategias implementadas, sugerencia que también se debe tener presente en los países latinoamericanos, en especial en Colombia, a la hora de tomar una decisión. Sin embargo, también es necesario realizar estudios de costos y costo-efectividad, combinados y por separado de las diferentes estrategias enunciadas en este articulo, para poder tomar una decisión acertada y ecuánime.
Anexo 1. Estrategia de búsqueda
La estrategia de búsqueda de bibliografía empleada fue la siguiente: ("ulcerative colitis" [Title/Abstract]); o ("Crohns disease" [Title/Abstract]); o (Inflammatory Bowel Diseases[MeSH]); o (adenoma*) y (Colorect*); o ("colorectal neoplasms"[MeSH Terms]) y (Adenoma[MeSH]); o ("neoplasms" [All Fields]); o ("carcinoma" [All Fields]); o ("adenocarcinoma" [All Fields]); o (tumour*); o (malignan*); o (cancer*) y (Colorect*); o ("colorectal neoplasms" [MeSH Terms]) y (Occult Blood [MeSH]); o (fecal occult blood testing [Title/Abstract]); o (Sigmoidoscopy [MeSH]); o (Colonoscopy [MeSH]); o ("Barium sulfate" [MeSH]) y ("organized screening" [All Fields]); u ("organized screening program" [All Fields]); u ("organized screening programmes" [All Fields]); u ("opportunistic screening"[All Fields]); o ("mass screening" [All Fields]); o ("mass screening tests" [All Fields]); o ("mass screenings" [All Fields]); o ("screening" [All Fields]); o ("screenings" [All Fields]); o ("screening test" [All Fields]); o ("screening tests" [All Fields]) y (search* [Title/Abstract]); o (meta analysis [Publication Type]); o (meta analysis [Title/Abstract]); o (meta analysis [MeSH Terms]); o (review [Publication Type]) para MEDLINE y (colorectal neoplasms); o (colorectal cancer) y (mass screenings); o (screening) para COCHRANE.
Referencias
1. Ferlay J, Bray F, Pisani P, Parkin. DM. GLOBOCAN 2002: Cancer incidence, mortality and prevalence worldwide. IARC Cáncer Base No. 5, version 2.0. Lyon: IARC Press, 2004. [ Links ]
2. Pineros M, Hernandez G, Bray F. Increasing mortality rates of common malignancies in Colombia: an emerging problem. Cancer 2004; 101(10): 2285-92. [ Links ]
3. Brown ML, Riley GF, Schussler N, Etzioni RD. Estimating health care costs related to cancer treatment from SEER-Medicare data. Medical Care 2002; 40(8 Supl IV): 104-17. [ Links ]
4. Parkin DM, Whelan S, Ferlay J, TeppoL, Thomas DB, Editores. Cancer incidence in five continents, vol. 8. Lyon, France: International Agency for Research on Cancer; 2002. [ Links ]
5. National Cancer Institute. Surveillance. Epidemiology and end results. Estados Unidos: El Autor. Disponible en http://seer.cancer.gov/. [ Links ]
6. Cendales R. Estimacion de los casos nuevos de cancer en Colombia en el ano 2005 [Trabajo de Grado]. Bogota: Facultad de Ciencias, Departamento de Estadistica, Universidad Nacional de Colombia; 2005. [ Links ]
7. Angel LA, Giraldo A, Pardo CE. Mortalidad por canceres del aparato digestivo en Colombia entre 1980 y 1998, analisis de tendencias y comparacion regional. Rev Fac Med Univ Nac Colomb 2004; 52(1): 19-37. [ Links ]
8. Instituto Nacional de Cancerologia. Anuario Estadistico. Bogota 2004: 1-12. [ Links ]
9. Anderson BO, Braun S. Early detection of breast cancer in countries with limited resources. Breast J 2003; 9(Supl 2): 51-59. [ Links ]
10. Winawer SJ, Stewart ET, Zauber AG, Bond JH, Ansel H, Waye JD, et al. A comparison of colonoscopy and double-contrast barium enema for surveillance after polypectomy. National Polyp Study Work Group. N Engl J Med 2000; 342: 1766-72. [ Links ]
11. Mandel JS, Bond JH, Bradley M, Snover DC, Church TR, Williams S, et al. Sensitivity, specificity and positive predictivity of the Hemoccult test in screening for colorectal cancers. Gastroenterology 1989; 97: 597-600. [ Links ]
12. US Preventive Services Task Force. Screening for colorectal cancer: recommendation and rationale. Ann Intern Med 2002; 137: 129-131. [ Links ]
13. Pignone M, Rich M, Teutsch SM, Berg AO, Lohr KN. Screening for colorectal cancer in adults at average risk: a summary of the evidence for the U.S. Preventive Services Task Force. Ann Intern Med 2002; 137: 132-141. [ Links ]
14. Research Triangle Institute, University of North Carolina. Screening for colorectal cancer in adults. Systematic evidence review. Carolina del Norte: Agency for Healthcare Research and Quality; 2002. Disponible en: http://www.ahcpr.gov/clinic/uspstf/uspscolo.htm. [ Links ]
15. Mandel JS, Bond JH, Church TR, Snover DC, Bradley GM, Schuman LM, et al. Reducing mortality from colorectal cancer by screening for faecal occult blood. Minnesota Colon Cancer Control Study. N Engl J Med 1993; 328: 1365-71. [ Links ]
16. Mandel JS, Church TR, Ederer F, Bond JH. Colorectal cancer mortality: effectiveness of biennial screening for faecal occult blood. J Natl Cancer Inst 1999; 91: 434-7. [ Links ]
17. Jorgensen OD, Kronborg O, Fenger C. A randomised study of screening for colorectal cancer using faecal occult blood testing: results alter 13 years and seven biennial screening rounds. Gut 2002; 50: 29-32. [ Links ]
18. Scholefield JH, Moss S, Sufi F, Mangham CM, Hardcastle JD. Effect of faecal occult blood screening on mortality from colorectal cancer: results from a randomized controlled trial. Gut 2002; 50: 840-4. [ Links ]
19. Kewenter J, Brevinge H, Engaras B, Haglind E, Ahen C. Results of screening, rescreening, and follow up in a prospective randomized study for detection of colorectal cancer by faecal occult blood testing. Scand J Gastroenterol 1994; 29: 468-73. [ Links ]
20. Towler B, Irwig L, Gasziou P, Kewenter J, Weller D, Silagy C. A systematic review of the effects of screening for colorectal cancer using the faecal occult blood test Hemoccult. BMJ 1998; 317: 559-65. [ Links ]
21. Mandel JS, Church TR, Bond JH, Ederer F, Geisser MS, Mongin SJ, et al. The effect of fecal occultblood screening on the incidence of colorectal cancer. N Engl J Med 2000; 343: 1603-7. [ Links ]
22. Bertario L, Russo A, Crosignani P, Sala P, Berrino F, et al. Reducing colorectal cancer mortality by repeated faecal occult blood test: a nested case-control study. Eur J Cancer 1999; 35(6): 973-7. 23. Faivre J, Tazi MA, El Mrini T, Lejeune C, Benhamiche AM, Dassonville F. Faecal occult blood screening and reduction of colorectal cancer mortality: a case-control study. Br J Cancer 1999; 79(3-4): 680-3. [ Links ] [ Links ]
24. Saito H, Soma Y, Koeda J, Wada T, Kawaguchi H, Sobue T, et al. Reduction in risk of mortality from colorectal cancer by faecal occult blood screening with immunochemical hemagglutination test: a case-control study. Int J Cancer 1995; 61: 465-9. [ Links ]
25. Selby JV, Friedman GD, Quesenberry CP Jr, Weiss NS. A case-control study of screening sigmoidoscopy and mortality from colorectal cancer. N Engl J Med 1992; 326: 653-7. [ Links ]
26. Prorok PC, Andriole GL, Bresalier RS, Buys SS, Chia D, Crawford ED, et al. Design of the Prostate, Lung, Colorectal and Ovarian (PLCO) cancer screening trial. Control Clin Trials 2000; 21: 273S-309S. [ Links ]
27. Citarda F, Tomaselli G, Capocaccia R, Barcherini S, Crespi M. Efficacy in standard clinical practice of colonoscopic polypectomy in reducing colorectal cancer incidence. Gut 2001; 48: 812-5. [ Links ]
28. Gottlieb LS, Winawer SG, Stemberg SS, et al. National Polyp Study (NPS): the diminutive colonic polyp. Gastrointest Endosc 1984; 28: 143. [ Links ]
29. Levin B, Brooks D, Smith RA, Stone A. Emerging technologies in screening for colorectal cancer: CT colonography, immunochemical faecal occult blood tests and stool screening using molecular markers. CA Cancer J Clin 2003; 53: 44-55. [ Links ]
30. Prickhardt PJ, Choi JR, Hwang I, Butler JA, Puckett ML, Hildebrandt HA, et al. Computed tomographic virtual colonoscopy to screen for colorectal neoplasia in asymptomatic adults. N Engl J Med 2003; 349: 2191-200. [ Links ]
31. Cotton PB, Durkalski VL, Pineau BC, Palesch YY, Mauldin PD, Hoffman B, et al. Computed tomographic colonography (virtual colonoscopy): a multicenter comparison with standard colonoscopy for detection of colorectal neoplasia. JAMA 2004; 291: 1713-8. [ Links ]
32. Winawer SJ, Fletcher RH, Miller L, Godlee F, Stolar MH, Mulrow CD, et al. Colorectal cancer screening: clinical guidelines and rationale. Gastroenterology 1997; 112: 594-642. [ Links ]
33. Walsh JM, Terdiman JP. Colorectal cancer screening: clinical applications. JAMA 2003; 289: 1297-302. [ Links ]
34. Giovannucci E. Modifiable risk factors for colon cancer. Gastroenterol Clin North Am 2002; 31: 925-43. [ Links ]
35. Giovannucci E, Goldin B. The role of fat, fatty acids and total energy intake in the etiology of human colon cancer. Am J Clin Nutr 1997; 66: 1564S-71S. [ Links ]
36. Norat T, Riboli E. Dairy products and colorectal cancer. A review of possible mechanisms and epidemiological evidence. Eur J Clin Nutr 2003; 57: 1-17. [ Links ]
37. Sandhu MS, White IR, McPherson K. Systematic review of the prospective cohort studies on meat consumption and colorectal cancer risk: a meta-analytical approach. Cancer Epidemiol Biomarkers Prev 2001; 10: 439-46. [ Links ]
38. Norat T, Lukanova A, Ferrari P, Riboli E. Meat consumption and colorectal cancer risk: dose-response meta-analysis of epidemiological studies. Int J Cancer 2002; 98: 241-56. [ Links ]
39. Norat T, Lukanova A, Ferrari P, Riboli E. Meat consumption and colorectal cancer risk: an estimate of attributable and preventable fractions. IARC Sci Publ 2002; 156: 223-5. [ Links ]
40. Le Marchand L. Meat intake, metabolic genes and colorectal cancer. IARC Sci Publ 2002; 156: 481-5. 41. Riboli E, Norat T. Epidemiologic evidence of the protective effect of fruit and vegetables on cancer risk. Am J Clin Nutr 2003; 78: 559S-69S. [ Links ] [ Links ]
42. Bingham SA, Day NE, Luben R, Ferrari P, Slimani N, Norat T, et al. Dietary fiber in food and protection against colorectal cancer in the European Prospective Investigation into Cancer and Nutrition (EPIC): an observational study. Lancet 2003; 361: 1496-501. [ Links ]
43. Michels KB, Edward G, Joshipura KJ, Rosner BA, Stampfer MJ, Fuchs CS, et al. Prospective study of fruit and vegetable consumption and incidence of colon and rectal cancers. J Natl Cancer Inst 2000; 92: 1740-52. [ Links ]
44. Asano T, McLeod R. Dietary fiber for the prevention of colorectal adenomas and carcinomas (Cochrane Review). En: The Cochrane Library. Chichester, UK: John Wiley & Sons Ltd., 2003. [ Links ]
45. Peters U, Sinha R, Chatterjee N, Subar AF, Ziegler RG, Kulldorff M, et al. Dietary fiber and colorectal adenoma in a colorectal cancer early detection program. Lancet 2003; 361: 1491-5. [ Links ]
46. Martinez ME, Willett WC. Calcium, vitamin D and colorectal cancer: a review of the epidemiologic evidence. Cancer Epidemiol Biomarkers Prev 1998; 7: 163-168. [ Links ]
47. Wu K, Willett WC, Fuchs CS, Colditz GA, Giovannucci EL. Calcium intake and risk of colon cancer in women and men. J Natl Cancer Inst 2002; 94: 437-46. [ Links ]
48. Hofstad B, Almendingen K, Vatn M, Andersen SN, Owen RW, Larsen S, et al. Growth and recurrence of colorectal polyps: a double-blind 3-year intervention with calcium and antioxidants. Digestion 1998; 59: 148-56. [ Links ]
49. Baron JA, Beach M, Mandel JS, van Stolk RU, Haile RW, Sandler RS, et al. Calcium supplements for the prevention of colorectal adenomas. Calcium Polyp Prevention Study Group. N Engl J Med 1999; 340: 101-7. [ Links ]
50. Bonithon-Kopp C, Kronborg O, Giacosa A, Rath U, Faivre J. Calcium and fiber supplementation in prevention of colorectal adenoma recurrence: a randomized intervention trial. European Cancer Prevention Organization Study Group. Lancet 2000; 356: 1300-6. [ Links ]
51. Lee IM, Cook NR, Manson JE, Buring JE, Hennekens CH. Beta-carotene supplementation and incidence of cancer and cardiovascular disease: the Womens Health Study. J Natl Cancer Inst 1999; 91: 2102-6. [ Links ]
52. Cook NR, Le IM, Manson JE, Buring JE, Hennekens CH. Effects of beta-carotene supplementation on cancer incidence by baseline characteristics in the Physicians Health Study (United States). Cancer Causes Control 2000; 11: 617-26. [ Links ]
53. Malila N, Virtamo J, Virtanen M, Pietinen P, Albanes D, Teppo L. Dietary and serum alphatocopherol, beta-carotene and retinol, and risk for colorectal cancer in male smokers. Eur J Clin Nutr 2002; 56: 615-21. [ Links ]
54. Ritenbaugh C, Streit K, Helfand M. Routine vitamin supplementation to prevent cancer: a summary of the evidence from randomized controlled trials for the U.S. Preventive Task Force. Disponible en: http://www.ahcpr.gov/clinic/3rduspstf/vitamins/vitasum.htm. [ Links ]
55. Greenberg ER, Baron JA, Tosteson TD, Freeman DH Jr., Beck GJ, Bond JH, et al. A clinical trial of antioxidant vitamins to prevent colorectal adenoma. Polyp Prevention Study Group. N Engl J Med 1994; 331: 141-7. [ Links ]
56. MacLennan R, Macrae F, Bain C, Battistutta D, Chapuis P, Gratten H, et al. Randomized trial of intake of fat, fiber and beta carotene to prevent colorectal adenomas. The Australian Polyp Prevention Project. J Natl Cancer Inst 1995; 87: 1760-6. [ Links ]
57. Baron JA, Cole BF, Mott L, Haile R, Grau M, Church TR, et al. Neoplastic and antineoplastic effects of beta-carotene on colorectal adenoma recurrence: results of a randomized trial. J Natl Cancer Inst 2003; 95: 717-22. [ Links ]
58. Duffield-Lillico AJ, Reid ME, Turnbull BW, Combs GF Jr., Slate EH, Fischbach LA, et al. Baseline characteristics and the effect of selenium supplementation on cancer incidence in a randomized clinical trial: a summary report of the Nutritional Prevention of Cancer Trial. Cancer Epidemiol Biomarkers Prev 2002; 11: 630-9. [ Links ]
59. IARC Working Group on the Evaluation of Cancer-Preventive Agents. Weight control and physical activity. Handbooks of Cancer Prevention, vol. 6. Lyon: IARC Press, 2002. [ Links ]
60. Bagnardi V, Blangiardo M, La Vecchia C, Corrao G. A meta-analysis of alcohol drinking and cancer risk. Br J Cancer 2001; 85: 1700-5. [ Links ]
61. Giovannucci E. An updated review of the epidemiological evidence that cigarette smoking increases risk of colorectal cancer. Cancer Epidemiol Biomarkers Prev 2001; 10: 725-31. [ Links ]
62. Kuper H, Boffetta P, Adami HO. Tobacco use and cancer causation: association by tumor type. J Intern Med 2002; 252: 206-24. [ Links ]
63. ODonnell MJ, Kearon C, Johnson J, Robinson M, Zondag M, Turpie I, et al. Brief communication: preoperative anticoagulant activity after bridging low-molecular weight heparin for temporary interruption of warfarin. Ann Intern Med. 2007; 146: 184-7. [ Links ]
64. Garcia-Rodriguez LA, Huerta-Alvarez C. Reduced risk of colorectal cancer among longterm users of aspirin and nonaspirin nonsteroidal anti-inflammatory drugs. Epidemiology 2001; 12: 88-93. [ Links ]
65. IARC Working Group on the Evaluation of Cancer Preventive Agents. Non-steroidal anti-inflammatory drugs. Lyon: IARC Press, 1997. [ Links ]
66. Gatof D, Ahnen D. Primary prevention of colorectal cancer: diet and drugs. Gastroenterol Clin North Am 2002; 31: 587-623. [ Links ]
67. Vaisman N, Arber N. The role of nutrition and chemoprevention in colorectal cancer: from observations to expectations. Best Pract Res Clin Gastroenterol 2002; 16: 201-17. [ Links ]
68. Gann PH, Manson JE, Glynn RJ, Buring JE, Hennekens CH. Low-dose aspirin and incidence of colorectal tumors in a randomized trial. J Natl Cancer Inst 1993; 85: 1220-4. [ Links ]
69. Sturmer T, Glynn RJ, Lee IM, Manson JE, Buring JE, Hennekens CH. Aspirin use and colorectal cancer: post-trial follow-up data from the Physicians Health Study. Ann Intern Med 1998; 128: 713-20. [ Links ]
70. Baron JA, Cole BF, Sandler RS, Haile RW, Ahnen D, Bresalier R, et al. A randomized trial of aspirin to prevent colorectal adenomas. N Engl J Med 2003; 348: 891-9. [ Links ]
71. Hebert-Croteau N. A meta-analysis of hormone replacement therapy and colon cancer in women. Cancer Epidemiol Biomarkers Prev 1998; 7: 653-9. [ Links ]
72. Nanda K, Bastian LA, Hasselblad V, Simel DL. Hormone replacement therapy and the risk of colorectal cancer: a meta-analysis. Obstet Gynecol 1999; 93: 880-8. [ Links ]
73. Beral V, Banks E, Reeves G, Appleby P. Use of HRT and the subsequent risk of cancer. J Epidemiol Biostat 1999; 4: 191-210. [ Links ]
74. Grodstein F, Newcomb PA, Stampfer MJ. Postmenopausal hormone therapy and the risk of colorectal cancer: a review and meta-analysis. Am J Med 1999; 106: 574-82. [ Links ]
75. Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Womens Health Initiative randomized controlled trial. JAMA 2002; 288: 321-33. [ Links ]
76. Pignone M, Saha S, Hoerger T, Mandelblatt J. Cost-effectiveness analyses of colorectal cancer screening: a systematic review for the U.S. Preventive Services Task Force. Ann Intern Med 2002; 137: 96-104. [ Links ]














