Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Ciencias de la Salud
Print version ISSN 1692-7273On-line version ISSN 2145-4507
Rev. Cienc. Salud vol.9 no.2 Bogotá May/Aug. 2011
Caracterización citogenética de lucilia sericata (Meigen,
1826) (Diptera: calliphoridae), Cepa Bogotá, Colombia
Cytogenetic characterization of lucilia sericata (Meigen, 1826) (diptera: calliphoridae), Bogotá-Colombia strain
Caracterização citogenética de lucilia sericata (Meigen, 1826) (diptera: calliphoridae), cepa Bogotá, Colômbia
Yisethe Acuña Morera1, Diana Cortés Bernal2, Margarita Vargas3, Nidya Alexandra Segura4, Felio Bello García5
1 Licenciada en Biología; Laboratorio de Entomología Médica y Forense, Universidad del Rosario. eyam10@gmail.com.
2 Licenciada en Biología; Laboratorio de Entomología Médica y Forense, Universidad del Rosario. didicor@gmail.com.
3 Magíster; Profesora Universidad Distrital Francisco José de Caldas. mvargasromero@gmail.com.
4 Magíster; estudiante doctorado, Laboratorio de Entomología Médica y Forense, Universidad del Rosario. alexandrasegura@yahoo.es.
5 PhD; Profesor Principal, Laboratorio de Entomología Médica y Forense, Universidad del Rosario. felio.bello@urosario.edu.co.
Recibido: 11 de marzo de 2011 • Aceptado: 19 de junio de 2011
Para citar este artículo: Acuña-Morera Y, Cortés-Bernal D, Vargas M, Segura NA, Bello-García F. Caracterización citogenética de lucilia Seiicata (Meigen, 1826) (Diptera: Calliphoridae), CEPA Bogotá, Colombia. Rev. Cienc. Salud 2011; 9 (2): 111-124.
Resumen
Introducción: Lucilia sericata es una especie de importancia médica y forense, utilizada en terapia larval para curar heridas crónicas y en estudios médico-legales empleada en la estimación del intervalo post mórtem y el traslado de cadáveres. No existen registros de las características citogenéticas de esta mosca en el neotrópico. El objetivo principal de este trabajo fue identificar las características morfométricas cromosómicas y las estructuras primarias del cariotipo, a partir de especímenes de L. sericata de la cepa Bogotá, Colombia. Materiales y métodos: Se tomaron huevos embrionados, que fueron previamente esterilizados en su superficie, se maceraron y luego fueron sembrados en el medio de cultivo L-15, suplementado con 20% de SFB, e incubados a una temperatura de 28 °C, sin atmosfera de C02. La preparación de los cromosomas se obtuvo de monocapas celulares semiconfluentes, empleando diversas soluciones: antimitótica (Colchicina), hipotónica (KCl 0,075 M) y fijadora (Carnoy: metanol y ácido acético; 3:1). Se llevó a cabo la técnica de bandeo C para la identificación de regiones cromosómicas de heterocromatina constitutiva. Resultados: Se obtuvieron parámetros morfométricos de cada par cromosómico. El número diploide del cariotipo obtenido de los cultivos celulares fue 2n = 12; éstos se clasificaron morfológicamente, de acuerdo con patrones previamente establecidos, así: los pares I, II, IV y V fueron metacéntricos, y el par III fue submetacéntrico. A su vez, el par sexual fue heteromórfico, siendo el cromosoma X metacéntrico y el cromosoma Y submetacéntrico. El bandeo C fue positivo para todos los pares cromosómicos. Conclusiones: Se establecieron las características citogenéticas de L. sericata, cepa Bogotá, Colombia, relacionadas con número, forma, tamaño, posición del centrómero y regiones heterocromáticas de los cromosomas.
Palabras clave: Lucilia sericata, cariotipo, bandeo C, cultivo celular, citotaxonomía.
Abstract
Objective: Lucilia sericata is an important species for medical and forensic purposes, it is used in maggot therapy in the treatment of chronic wounds and in medical-legal studies for establishing the post-mortem interval and the transfer of corpses. Currently there are no records of the cytogenetic characteristics of this fly in Neotropical region. The main objective of this study was to identify morphometric characteristics and primary structures from karyotype of L. sericata strain Bogota, Colombia. Methods and materials: Embryonated eggs were taken, which were previously surface sterilized, macerated and then seeded in L-15 medium culture, supplemented with 20% FBS and incubated at 28 °C, without C02 atmosphere. The preparation of chromosomes was obtained from semiconfluent monolayers, pretreated with various solutions: antimitotic (Colchicine), hypotonic (KCl 0.075 M) and fixative (Carnoy, methanol and acetic acid, 3:1). C-banding technique was carried out to identify chromosomal regions of constitutive heterochromatin. Results: Morphometric parameters were obtained from each pair of chromosomes. The diploid karyotype number obtained from cell cultures was 2n = 12; they were classified morphologically, according to patterns established previously, as follows: pairs I, II, IV and V were metacentric and pair III was submetacentric. On the other hand, the sexual pair was heteromorphic, being X chromosome metacentric and Y chromosome submetacentric. C banding was positive for all chromosome pairs. Conclusions: The cytogenetic characteristics of L. sericata, strain Bogotá, were established according to number, shape, centromer position and heterochromatic regions.
Key words: Lucilia sericata, karyotype, C banding, cell culture, cytotaxonomy.
Resumo
Introdução: Lucilia sericata é uma espécie de importência médica e forense, utilizada em terapia larval para curar feridas crônicas e em estudos médico-legais empregada na estimação do intervalo post morteme o traslado de cadáveres. Não existem registros das características citogéneticas desta mosca no neotrópico. O objetivo principal deste trabalho foi identificar as características morfométricas cromossômicas e as estruturas primárias do cariótipo, a partir de especímenes de L. sericata da cepa Bogotá, Colômbia. Materiais e métodos: Tomaram-se ovos embrionados, que foram previamente esterilizados em sua superfície, se maceraram e depois foram semeados no médio de cultivo L-15, suplementado com 20% de SFB, e incubados a uma temperatura de 28 °C, sem atmosfera de C02. A preparação dos cromossomas obteve-se de monocamadas celulares semiconfluentes, utilizando diversas soluções: antimitótica (Colchicina), hipotônica (KCl 0,075 M) e fixadora (Carnoy: metanol y ácido acético; 3:1). Levou-se a cabo a técnica de bandas C para a identificação de regiões cromossômicas de heterocromatina constitutiva. Resultados: Se obtiveram parâmetros morfométricos de cada par cromossômico. O número diplóide do cariótipo obtido dos cultivos celulares foi 2n = 12; estes se classificaram morfologicamente, de acordo com patrões previamente estabelecidos, assim: os pares I, II, IV e V foram metacêntricos, e o par III foi submetacéntrico. Por sua vez, o par sexual foi heteromórfico, sendo o cromossoma X me-tacêntrico e o cromossoma Y submetacêntrico. As bandas C foram positivas para todos os pares cromossômicos. Conclusões: Se estabeleceram as características citogenéticas de L. sericata, cepa Bogotá, Colômbia, relacionadas com número, forma, tamanho, posição do centrômero e regiões heterocromáticas dos cromossomas.
Palavras chave: Lucilia sericata, cariótipo, bandas C, cultivo celular, citotaxonomia.
Introducción
Lucilia sericata (Diptera: Calliphoridae), Meigen 1826, tiene una amplia distribución mundial: se encuentra en Europa, África y parte de Asia, y se ha reportado en el continente americano (1). En el neotrópico existen registros de su presencia en Colombia Argentina, Brasil y Perú. En Colombia, se ha encontrado en los departamentos de Antioquia, Cundinamarca, Santander y Sucre (1). Esta especie se caracteriza por ser sinantrópica, debido a su estrecha relación con los asentamientos humanos (2-4).
L. sericata es una mosca necrófaga de importancia en entomología forense debido a que a través de la duración de su ciclo biológico y/o algunas fases de éste se puede determinar el intervalo post mórtem (5). Por otro lado, las larvas de esta especie son eficaces en tratamientos de heridas crónicas de difícil cicatrización, en razón a que actúan como parásitos facultativos que se alimentan sólo del tejido necrótico. La acción de las larvas sobre las heridas está científicamente comprobada a través de tres funciones primordiales: desbridamiento, actividad antimicrobiana y estimulación del tejido de granulación (6, 7). En la actualidad, la terapia larval es considerada una tecnología natural, simple, segura y altamente exitosa para la curación de úlceras o lesiones crónicas en humanos y animales (8-10).
Los estudios citogenéticos son importantes debido a que pueden aportar información para la diferenciación citotaxonómica de las especies. También, tienen aplicación en filogenia y en análisis de estructura poblacional (11). Particularmente, en L. sericata la diferenciación citotaxonómica cobra singular relevancia debido a la aplicación médica que tienen sus larvas, pues una confusión de especies, aun del mismo género, podría tener consecuencias impredecibles en el uso de la terapia larval, ya que algunas especies, como Lucilia cuprina, podrían causar miasis obligatoria al alimentarse de tejido sano.
Los análisis genéticos y citogenéticos de dípteros se han facilitado en gran medida por la existencia de mapas y por el patrón de bandas reproducibles de cromosomas dentro de cada especie (12). Existen algunos trabajos citogenéticos aplicados a moscas necrófagas, como el reportado por Parise y Avancini, quienes efectuaron un estudio cromosómico comparativo con especímenes de la familia Muscidae (13). Los resultados obtenidos se compararon con especies de las familias Calliphoridae y Sarcophagidae, las cuales revelaron una considerable variación entre sus cromosomas sexuales. Por otro lado, Üllerich et al. realizaron un estudio para la identificación de cariotipos, heterocromatina constitutiva y valor genómico del ADN en las moscas del género Crhysomya, Lucilia y Protophormia (Diptera: Calliphoridae), en el que encontraron números cromosómicos similares (2n = 12), incluyendo un par heteromórfico sexual XY-XX, pero éstos a su vez varían en tamaño y morfología entre especies. (14)
Aunque existe una considerable variación morfológica encontrada en los cariotipos de las especies de la familia Calliphoridae, el número diploide de los cromosomas 2n = 12 es muy estable, para las especies que tienen cinco pares de autosomas y los cromosomas heteromórficos sexuales XX y XY (15).
Los estudios citogenéticos en dípteros, utilizando cromosomas mitóticos, son en general escasos y se han realizado principalmente para la diferenciación de especies de diversas familias (16). Aunque se han reportado pocos trabajos citogenéticos de L. sericata, no existen estudios de esta especie a partir de muestras originarias del neotrópico (14, 17). En el presente trabajo de caracterización citogenética de L. sericata se utilizó por primera vez una cepa del Nuevo Mundo, particularmente de Bogotá, Colombia (18).
El objetivo de este estudio fue identificar parámetros morfométricos de los cromosomas y estructuras primarias del cariotipo de L. sericata a partir de cultivos celulares primarios derivados de especímenes de la cepa Bogotá, Colombia.
Materiales y métodos
Material biológico
Se utilizaron huevos embrionados, tomados de una colonia de L. sericata, previamente establecida en el Laboratorio de Entomología Médica y Forense de la Universidad del Rosario (18). La colonia se mantuvo a 27 °C +/- 2, con una humedad relativa del 70% y periodos de luz y oscuridad de 12:12. Los huevos, ovipositados sobre un medio sintético, se recolectaron luego de 12 a 15 horas de incubación. La investigación se realizó en el Laboratorio de Biología Celular y Molecular de la Universidad del Rosario, en Bogotá, desde julio de 2008 hasta agosto de 2010.
Desinfección del material biológico y obtención de cultivos celulares primarios
Una masa aproximada de 150 huevos embrionados se puso en un tubo estéril cónico Falcón de 15 ml, el cual contenía previamente 10 ml de hipoclorito de sodio al 0,05%. Luego, se agitó vigorosamente durante diez minutos. Se dejaron decantar los huevos y se retiró la solución de hipoclorito. Seguidamente, se adicionó etanol al 70% por 15 minutos, agitando suavemente. Al finalizar el tiempo de exposición, se dejaron precipitar los huevos al fondo del tubo y se retiró el alcohol; los huevos se lavaron con agua destilada estéril dos veces y por último se adicionó 1,5 ml del medio de cultivo L-15, suplementado con suero fetal bovino al 20% y antibiótico (penicilina y estreptomicina al 1%). Luego, con una pipeta de vidrio estéril se realizó la maceración de los huevos embrionados y se llevó la suspensión a un frasco de cultivo celular estéril de 25 cm2 que de inmediato se incubó a 28 oC. Los cultivos celulares se observaron diariamente con un microscopio invertido (Leica DMIL) para identificar el crecimiento y desarrollo celular hasta la formación de una monocapa semiconfluente (19).
Preparación de cromosomas
Muestras de cultivos primarios se utilizaron para la obtención de cromosomas metafásicos. Una concentración de 0,016% de colchicina fue adicionada a los cultivos, durante un periodo de tres horas; las células fueron removidas y la solución resultante fue centrifugada a 1000 g durante diez minutos. El sobrenadante fue descartado y al precipitado se le adicionó una solución de KCl al 0,56%, se agitó con la ayuda de una pipeta de Pasteur y se dejó actuar por 30 minutos; al cabo de este tiempo, se volvió a centrifugar y, siguiendo el procedimiento anterior, se agregó Carnoy (metanol y ácido acético 3:1) durante 15 minutos. Se hicieron tres lavados seguidos con la misma sustancia; finalmente, en una cantidad de 1 ml de Carnoy se goteó la suspensión celular sobre láminas limpias y desengrasadas. La coloración se efectuó con Giemsa al 2% (20, 21).
Morfometría cromosómica
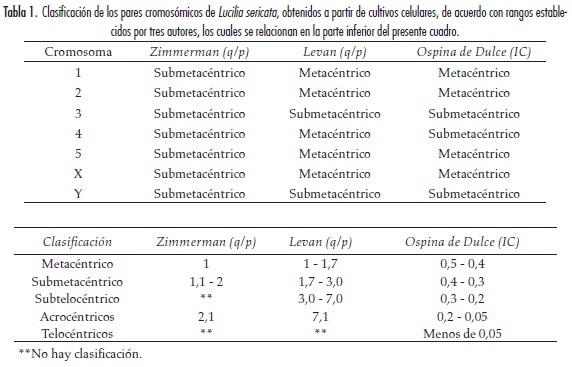
Se seleccionaron 20 metafases obtenidas a partir de los cultivos celulares y se fotografiaron las imágenes con ayuda de un fotomicroscopio Axiophot (Zeiss). Las mediciones estándar para cada uno de los cromosomas se realizaron directamente sobre las láminas con ocular micrométrico hasta alcanzar aumentos de 1000X. Los pares de cromosomas fueron numerados de I a V en orden decreciente de tamaño y el par sexual (XX/XY) siguiendo el procedimiento de estudios anteriores para especies de la familia Calliphoridae (22). Se efectuaron las siguientes mediciones directas: brazo corto (p), brazo largo (q) y longitud total (LT). Luego se calcularon las indirectas: longitud relativa (LR), índice centromérico (IC), el cual se encontró midiendo la relación del brazo corto de cada cromosoma sobre la longitud total del mismo y, finalmente, la longitud relativa promedio de los cromosomas (LRPC), que se registró al relacionar la longitud total de cada cromosoma sobre la longitud del cromosoma más pequeño del genoma, relación de brazos (q/p y p/q) y valor absoluto promedio de longitud de los cromosomas (VAPL), utilizando el Software LUCIA Citogentics Imaging Software 1.56. La clasificación de los cromosomas se realizó a partir de patrones y valores establecidos por Zimmerman y Sihvonen, Levan et al. y Ospina de Dulce (tabla 1). (23-25)
Bandeamiento C
Siguiendo el protocolo de Summer con algunas modificaciones, las láminas sin tinción, obtenidas a partir de la técnica de cultivo celular y sometidas a un tiempo de maduración o envejecimiento de diez días, fueron sumergidas en una solución ácido clorhídrico 0.2 N durante una hora a temperatura ambiente. Luego de previos lavados con agua destilada, se trataron con hidróxido de bario al 5% a 50 °C entre 5-15 minutos y, antes de ser coloreadas con Giemsa al 2%, se pusieron durante una hora en solución salina doblemente citratada a una temperatura de 60 °C.
Resultados
Cultivos celulares primarios de Lucilia sericata
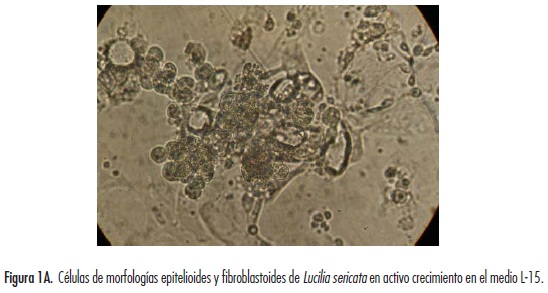
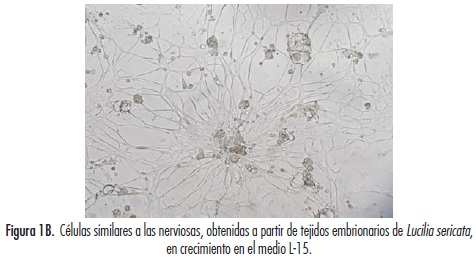
Los cultivos celulares primarios registraron un crecimiento relativamente rápido donde se observó la formación de una monocapa semiconfluente desde el día 3, presentando un patrón de crecimiento firmemente adherido a la superficie del frasco con formación de vesículas a partir del día 7. De igual manera, se pudieron observar movimientos pulsátiles en el cultivo, semejantes a los realizados por células musculares, destacándose formas celulares epitelioides y fibroblastoides (figura 1A). Estas últimas formas, al avanzar el cultivo, tomaron configuraciones parecidas a células nerviosas (figura 1B).
Número cromosómico
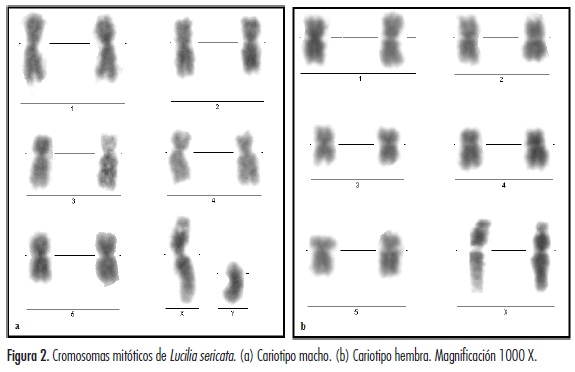
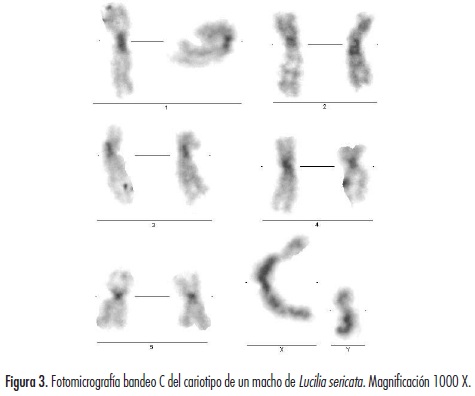
El complemento cariotípico de la especie exhibió un número diploide 2n = 12, el cual consta de cinco (5) pares de autosomas y un (1) par sexual (XX hembra, XY machos). Las metafases de L. sericata diferenciadas en cariotipo macho y hembra se muestran en la figura 2.
Longitudes cromosómicas
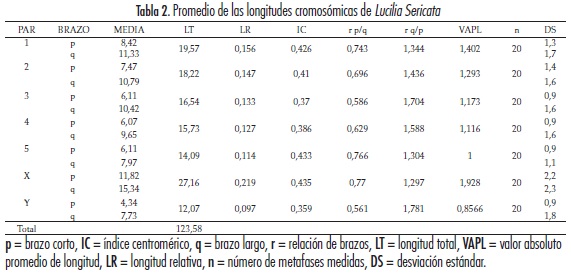
La tabla 2 muestra los promedios de las longitudes cromosómicas de L. sericata. Teniendo en cuenta la longitud total (LT) y longitud relativa (LR), en los autosomas el mayor tamaño se presentó en el par I (LT = 19,757; LR = 0,156), y el de menor tamaño en el par V (LT = 14,092; LR = 0,114). Sin embargo, en todo el complemento cariotípico el que presentó una mayor longitud fue el cromosoma sexual X (LT = 27,167; LR = 0,219), y el de menor longitud fue el cromosoma sexual Y (LT = 12,071; LR = 0,097), destacándose un par sexual heteromórfico (tabla 2).
Clasificación de los cromosomas
Con los datos directos y teniendo en cuenta la posición del centrómero, los cromosomas del cariotipo para L. sericata se clasificaron así: los pares I, II, IV y V y el cromosoma sexual X fueron metacéntricos y el par III y el cromosoma sexual Y se registraron como submetacéntricos. La clasificación de los cromosomas del cariotipo de la especie, siguiendo los parámetros establecidos por Zimmerman y Shivonnen (23), Levan et al. (24) y Ospina de Dulce (25), se muestran en la tabla 1.
Bandeamiento C
A partir de esta técnica se pudo identificar correctamente la región centromérica y pericentromérica presente en cada uno de los cromosomas de la especie. Se observó una pequeña banda intersticial en el par cromosómico II que posiblemente se relaciona con una constricción secundaria, una banda de doble punteo, en el cromosoma I. El par cromosómico sexual (X, Y) es heterocromático, excepto por una región en la parte final del brazo corto de cada cromosoma, y exhibe también un satélite, una constricción secundaria y una región organizadora nucleolar (NOR) en la parte final de este brazo (figura 3). La medición de la región heterocromática para cada uno de los cromosomas se muestra, en porcentajes, en la tabla 3.
Discusión
Los cultivos celulares primarios, bajo las condiciones ambientales, físico-químicas y nutricionales establecidas en el medio L-15, presentaron migración celular en las primeras horas después de haberse realizado los explantes de tejidos embrionarios, observándose crecimiento y proliferación celular al igual que movimientos pulsátiles y vesículas adheridas a los fragmentos de tejidos o en suspensión, de forma semejante a lo registrado por Echeverry et al. Estas vesículas posibilitaron el suministro de células en activo crecimiento y el posterior establecimiento de nuevas colonias celulares sobre la superficie de los frascos como paso previo a la formación de la monocapa semiconfluente (19,27).
Los cultivos celulares derivados de moscas necrófagas usados para la obtención de cromosomas, tal como ocurrió en el presente trabajo, no corresponden a una metodología corrientemente empleada para estudios citogenéticos de insectos, como ocurre en el caso de los vertebrados, precisamente debido a las difíciles condiciones que previamente se deben establecer para lograr un exitoso crecimiento de las células en los cultivos (28). Sin embargo, cuando están disponibles, como en el caso particular aquí descrito, los cultivos celulares posibilitan una mejor manipulación durante el desarrollo de la técnica, si se compara con la metodología de obtención de cromosomas in vivo, a partir de larvas de último estadio. La acción directa de los pretratamientos sobre las células en cultivos posibilita alcanzar una capacidad máxima en los extendidos cromosómicos, situación que pocas veces se obtiene con la técnica de aplastamiento del tejido o de secado al aire (29).
El número cromosómico diploide 2n = 12, en la cepa estudiada, coincidió con el señalado para L. sericata por El-Bassiony, con un total de cinco pares de autosomas y un par sexual heteromórfico XX, XY (figura 3) (17). Este número cromosómico, tanto para L. sericata como para otras especies de la familia Calliphoridae, también ha sido reportado por Üllerich y Üllerich y Schöttke (14,22).
Con base en las mediciones directas y la posición del centrómero en los pares cromosómicos del cariotipo (tabla 1), se pudo establecer que los pares I, II, IV y V y el cromosoma X fueron metacéntricos, mientras que los pares III y el cromosoma Y fueron submetacéntricos, lo que coincide con el estudio reportado por El-Bassiony (17). No obstante, con los criterios utilizados por los tres autores para clasificar los cromosomas, observamos que sólo Levan coincidió con la anterior clasificación y que Ospina de Dulce estableció, a través de sus parámetros, igual clasificación con la diferencia en el par cromosómico IV, que es submetacéntrico (24, 25). El patrón de Zimmerman y Shivonen permitió clasificar todos los autosomas y el par sexual de L. sericata como submetacéntricos, similar a lo descrito por Üllerich y Schöttke, a excepción del cromosoma Y, al que estos últimos autores clasifican como telocéntrico (14, 23). No se puede esperar que haya una coincidencia entre los tres autores ya que los parámetros establecidos por cada uno de ellos para clasificar los cromosomas son distintos. Sin embargo, el par III y el cromosoma Y son submetacéntricos en la clasificación establecida por los tres autores.
Los valores promedio de las longitudes cromosómicas de L. sericata revelan que el cromosoma con mayor tamaño en el cariotipo es el X, coincidiendo en este resultado con Üllerich y Schöttke, siendo este cromosoma 7,41 veces más largo que el par I, el cual a su vez se registra como el de mayor tamaño entre los autosomas (14). Por otro lado, la menor longitud cromosómica la presenta el Y, permitiendo una fácil diferenciación morfológica con el cromosoma X, tal como lo demuestran los estudios preliminares de Üllerich y Schöttke y Üllerich para las especies L. sericata y L. cuprina respectivamente (14,30). No obstante, para esta última especie se reporta una constricción secundaria en el brazo corto del cromosoma Y que no se encontró en el presente estudio para L. sericata. El mayor tamaño del cromosoma X se conserva en varias especies de la familia Calliphoridae (13, 14, 22, 31).
En el cromosoma X, tanto en el cariotipo de hembras como de machos, obtenido del presente trabajo, se registró un satélite en la parte final del brazo corto, también una constricción secundaria y una región organizadora nucleolar (NOR). Estos resultados también se han observado en otras especies del orden Diptera (13). Así, por ejemplo, Üllerich describió el cariotipo de L. cuprina (Wiedemann) y observó que los nucléolos estaban asociados con las constricciones secundarias presentes en los cromosomas X y Y, coincidiendo en esta caracterización con lo observado por Bedo (30-32).
El patrón de bandas C del cariotipo de L. sericata muestra una gran uniformidad, con una distribución de heterocromatina constitutiva con mayor abundancia en la región centromérica y pericentromérica, lo cual coincide con los resultados identificados con este marcador en la mayoría de las especies de califóridos (31, 32). Sin embargo, en el brazo largo del par cromosómico II de L. sericata se observaron bandas C intersticiales positivas que no se han registrado en otras especies de califóridos, lo que constituye\ un factor citogenético diferenciador para esta especie, que por primera vez ha sido caracterizado con esta técnica. No obstante, en Chrysomya putoria hay registros de una banda C intersticial pero circunscrita al brazo corto del cromosoma III (13, 31).
Por otro lado, el cromosoma Y, mediante la técnica de bandas C, fue reconocido como heterocromático, excepto por una pequeña región eucromática localizada en su brazo corto, lo que coincide con el estudio realizado en la especie L. cuprina por Bedo y Foster (33). Este resultado difiere de los hallazgos descritos por Üllerich y Schöttke, quienes identificaron un cromosoma Y totalmente heterocromático para L. sericata (14). Bedo, empleando también bandas C en la especie L. cuprina, observó una constricción secundaria en el brazo corto del cromosoma Y que difiere de los resultados obtenidos en L. sericata (32).
En el brazo corto del cromosoma X del cariotipo de L. sericata se registró una constricción secundaria, un satélite y un NOR, al igual que una banda clara en los extremos terminales de ambos brazos de dicho cromosoma, estructuras que coinciden con las reportadas por Üllerich y Schöttke en la misma especie (14). En esta misma tendencia, aunque no con idénticas estructuras, Bedo observó en L. cuprina una constricción secundaria y un satélite en el brazo corto de este cromosoma (32).
Aunque en el presente trabajo se registraron importantes similitudes entre las características morfológicas del cariotipo de L. sericata con los reportes previos de la misma especie, también hubo notables diferencias, las cuales probablemente puedan deberse a respuestas adaptativas de la mosca a las condiciones medioambientales de Bogotá que hayan incidido, a través del tiempo, en rearreglos cromosómicos específicos. Eventualmente, esta hipótesis sobre presiones selectivas de la especie estará sujeta a investigaciones puntuales y exhaustivas sobre la temática, por ejemplo, estudios genético-comparativos entre poblaciones del Viejo Mundo y de muestras representativa de la Sabana de Bogotá.
Este estudio representa un aporte importante en el proceso de la definición de las características citogenéticas de L. sericata, que por primera vez se hace con muestras de una cepa del neotrópico y utilizando la metodología de cultivos celulares, lo cual posibilitó la comparación y diferenciación intra- e interespecífica; en este último caso correlacionándolas con individuos del mismo género y con otros especímenes pertenecientes a la familia Calliphoridae, usando para todos los efectos marcadores citotaxónomicos.
Conclusiones
Se lograron establecer cultivos celulares primarios, a partir de huevos embrionados de L. sericata, con un óptimo crecimiento celular, posibilitando la obtención de cromosomas metafísicos, la tipificación del número diploide de la especie (2n = 12) y la composición del cariotipo (cinco pares de autosomas y un par sexual heteromórfico, siendo los pares I, II, IV y V metacéntricos y el par III submetacéntrico). El par sexual presentó un cromosoma X de mayor longitud y metacéntrico, en tanto que el cromosoma Y fue de menor longitud y se clasificó como submetacéntrico.
Todos los cromosomas se caracterizaron por presentar un patrón de bandas C positivo en la región centroamérica y el par sexual se diferenció por ser heterocromático, excepto por una región clara en el brazo corto del cromosoma X y en el cromosoma Y. Se observó en el cariotipo de L. sericata un NOR, una constricción secundaria y un satélite únicamente en el brazo corto de los cromosomas X y una banda intersticial en el par autosómico II. Estas características, en su conjunto, posibilitaron discutir la diferenciación de esta especie originaria del neotrópico con otras del Viejo Mundo y con especímenes de diferentes géneros de la familia Calliphoridae.
Agradecimientos
A La Universidad del Rosario por la financiación del presente trabajo. A la doctora Martha L. Bueno, del Laboratorio de Citogenética, Departamento de Biología de la Universidad Nacional de Colombia, por el apoyo en el procesamiento de la información a partir de las láminas originales con las metafases y por la asesoría en la toma de datos y las gráficas correspondientes.
Descargos de responsabilidad
El manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe ningún conflicto de intereses que ponga en riesgo la validez de los resultados presentados.
Referencias
1. Pape T, Wolff M, Amat E. Los califóridos, éstridos, rinofóridos y sarcofágidos (Diptera: Calliphoridae, Oestridae, Rinophoridae, Sarcophagidae) de Colombia. Biota Colombiana 2004; 5:201-08. [ Links ]
2. Figueroa L, Linhares A. Sinantropia de los calliphoridae (Diptera) de Valdivia, Chile. Neotrop Entomol 2002; 31:233-9. [ Links ]
3. Clark K, Evans L, Wall R. Growth rates of the blowfly, Lucilia sericata, on different body tissues. Forensic Sci Int 2006; 156:145-9. [ Links ]
4. Saigusa K, Matsumasa M, Yashima Y, Takamiya M, Aoki Y. Practical applications of molecular biological species identification of forensically important flies. Legal Med 2009; 11:344-7. [ Links ]
5. Ames C, Turner B. Low temperature episodes in development of blowflies: implications for postmortem interval estimation. Med Vet Entomol 2003; 17:178-86. [ Links ]
6. Horobin A, Shakesheff K, Pritchard D. Maggots and wound healing: an investigation of the effets of secretions from Lucilia sericata larvae upon the migration on human dermal fibroblasts over a fibronectin-coated surface. Wound Rep Regen 2005; 13:422-33. [ Links ]
7. Parnés A, Lagan K. Larval therapy in wound management: a review. Int J Clin Pract 2007; 61:488-93. [ Links ]
8. Sherman R. Maggot therapy for foot and leg wounds. Int J Low Extrem Wounds 2002; 1: 135-42. [ Links ]
9. Orkiszewski M. Maggots of Lucilia sericata in treatment of intractablewounds. Wiad Lek 2007; 60:381-5. [ Links ]
10. Davydov L. Therapy in wound management in modern era and a review of published literature. J Pharm Pract 2011; 24: 89-93. [ Links ]
11. Córdova J, Lamas G. Citogenética, filogenia, clasificaciones naturales y evolución de las especies. Alma Mater 1997; 13:95-111. [ Links ]
12. Munstermann L, Marchi A. Cytogenetic and isozyme profile of Sabethes cyaneus: a mosquito of the neotropical canopy. J Hered 1986; 77: 241-8. [ Links ]
13. Parise M, Avancini R. C-Banding and fish in chromosomes of the blow flies Chrysomya megacephala and Chrysomya putoria (Diptera, Calliphoriade). Mem Inst Oswaldo Cruz 2001; 96:371-7. [ Links ]
14. Üllerich F, Schöttke M. Karyotypes, constitutive heterochromatin, and genomic dna values in the blowfly genera Chrysomya, Lucilia, and Protophormia (Diptera: Calliphoridae). Genome 2006; 49:584-97. [ Links ]
15. Stevens J, Wall R. Classification of the genus Lucilia (Diptera: Calliphoridae): a preliminary parsimonyanalysis. J Natural Hist 1996; 30:1087-94. [ Links ]
16. Baimai V. Heterochromatin accumulation and karyotypic evolution in some dipteran insects. Zoo Biol 1998; 37: 75-88. [ Links ]
17. El-Bassiony G. Cytogenetic studies of Calliphoravicina and Lucilia sericata (Diptera: Calliphoridae) from northwestern Egypt. J Egypt Soc Parasitol 2006; 36:23-32. [ Links ]
18. Rueda L, Ortega L, Segura N, Acero V, Bello F. Lucilia sericata strain from Colombia: Experimental colonization, life tables and evaluation of two artificial diets of the blowfy Lucilia sericata (Meigen) (Diptera: Calliphoridae), Bogotá, Colombia Strain. Biol Res 2010; 43:197-203. [ Links ]
19. Echeverry L, Zapata A, Segura N, Bello F. Estudio de cultivos celulares primarios derivados de Lucilia sericata (Diptera: Calliphoridae). Rev Cienc Salud 2009; 7:17-28. [ Links ]
20. Schneider I. Preparation and maintenance of arthropod cell cultures: Diptera, with emphasis on mosquitoes. En: Yunker CE. Arboviruses in arthropod cells in vitro, Vol 1. Boca Raton Florida; CRC 1969, p. 25. [ Links ]
21. Lee S, Hou R. Establishment of a cell line derived from embryos of the Diamodback moth, Plutella xylostella (L). J Invertebr Pathol 1992; 59:174-77. [ Links ]
22. Üllerich, F. Identifizierung der genetischen Geschlechtschromosomen bei der monogenen Schmeifliege Chrysomya rififacies (Calliphoridae, Diptera). Chromosoma 1975; 50:393-419. [ Links ]
23. Zimmerman E, Sihvonen D. Chromosomal banding pattern and idiogram of the cotton rat, Sigmodon arizonae (Rodentia, Muridae). Chromosoma 1973; 41:85-91. [ Links ]
24. Levan A, Fredga K, Avery S. Nomenclature for centromeric position on chromosomes. Hereditas 1964; 52:201-20. [ Links ]
25. Ospina de Dulce D. Parámetros utilizados en la clasificación de los cromosomas. En: García BE. Estudio citotaxonómico de los peces Nematobrycon palmeri y Nematobrycon lacotei. Bogotá: Pontificia Universidad Javeriana; 1980, p. 125. [ Links ]
26. Summer A. A simple technique for demonstrating centromeric heterochromatin. Exp Cell Res 1972; 75:304-6. [ Links ]
27. Ardila A, Escovar J, Bello F. Características de nuevos cultivos celulares derivados de tejidos embrionarios de Aedes aegypti (Diptera: Culicidae). Biomédica 2005; 25:65-75. [ Links ]
28. Hieber L, Huber R, Bauer V, Scháffner Q, Braselmann H, Thomas G, et al. Chromosomal rearrangements in post-Chernobyl papillary thyroid carcinomas: Evaluation by spectral karyotyping and automated interphase FISH. J. Biomed Biotechnol 2011; 2011:693-1. [ Links ]
29. Bello F, Olano V, Morales A, Boshell J, Rey G, Durán F. Evaluación de tres técnicas citogenéticas diferentes en los estudios morfométricos del cariotipo de Aedes taeniorhynchus (Diptera: culicidae). Biomédica 1995; 15: 109-15. [ Links ]
30. Üllerich F. Geschleschtschromosomen und Geschlechtsbestimmung bei einigen (Calliphoridae, Diptera). Chromosoma 1963; 14: 45-110. [ Links ]
31. Üllerich F. Chromosomenverháltnisse, konstitutives hetrochromatin und geschlechtsbestimmung bei einigen Arten der Gattung Chrysomya (Calliphoridae, Diptera). Chromosoma 1976; 58: 113-36. [ Links ]
32. Bedo D. C, Q and H-Banding in the analysis of y chromosome rearrangements in Lucilia cuprina (Wiedemann) (Diptera: Calliphoridae). Chromosoma 1980; 77: 299-308. [ Links ]
33. Bedo D, Foster G. Cytogenetic mapping of the male-determining region of Lucilia cuprina (Diptera: Calliphoridae). Chromosoma 1985; 92: 344-50. [ Links ]