Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Ciencias de la Salud
versión impresa ISSN 1692-7273
Rev. Cienc. Salud vol.10 no.2 Bogotá mayo/ago. 2012
Caracterización de la resistencia in vitro a diferentes antimicrobianos en cepas de Staphylococcus spp. en una institución hospitalaria de la ciudad de Valledupar entre enero y julio de 2009
Characterization of resistance in vitro to different antimicrobial in strains of Staphylococcus spp. in a hospital of the city of Valledupar between January and July 2009
Caracterização da resistência in vitro a diferentes antimicrobianos em cepas de Staphylococcus spp. em uma instituição hospitalaria da cidade de Valledupar entre janeiro e julho de 2009
Gloria Inés Morales, Esp1, María Cecilia Yaneth, Esp1, Katiuska Milena Chávez, Esp1
1 Universidad de Santander. Correspondencia: gloriaudes7@hotmail.com
Recibido: mayo 18 de 2011 • Aprobado: mayo 5 de 2012
Para citar este artículo: Morales GI, Yaneth MC, Chávez KM. Caracterización de la resistencia in vitro a diferentes antimicrobianos en cepas de Staphylococcus spp. en una institución hospitalaria de la ciudad de Valledupar entre enero y julio de 2009. Rev. Cienc. Salud 2012; 10 (2): 169-177.
Resumen
Los Staphylococcus spp. causan un amplio rango de infecciones sistémicas y localizadas en pacientes hospitalizados y comunitarios. Su alta patogenicidad y su creciente resistencia a múltiples antimicrobianos, entre ellos la meticilina, provocan elevadas tasas de morbimortalidad ocasionando un alto impacto epidemiológico. Objetivo: determinar el perfil fenotípico de resistencia a diferentes antimicrobianos en cepas del género Staphylococcus spp. Materiales y métodos: se recolectaron setenta y cinco cepas y se determinó susceptibilidad a diferentes antibióticos por el método de Kirby Bauer. La producción de beta-lactamasa se verificó mediante la prueba del nitrocefin. La resistencia a la meticilina en S. aureus se realizó usando Mueller Hinton con 4% de NaCl y oxacilina 6 µg/mL. La resistencia inducible a clindamicina se tamizó mediante la prueba del D-Test. Resultados: se aisló un 38% de estafilococos coagulasa negativa (SCN) y un 62% de S. aureus. Un 53% de los estafilococos fueron resistentes a penicilina: S. aureus con 58% y SCN 42%; un 47% de las cepas presentaron resistencia a meticilina: S. aureus con un 61% y SCN con un 39%; una cepa de S. aureus mostró resistencia inducible a la clindamicina (1,33%). En su mayoría, los estafilococos coagulasa negativa fueron aislados a partir de muestras de hemocultivos (31%) y los estafilococos meticilino-resistentes predominaron en muestras de heridas (46%), hemocultivo (29%) y punta de catéter (5%); gran parte de ellos procedía de UCI neonatal (25%), médica (21%) y cirugía (16%). Conclusiones:S. aureus y SCN se aislaron con mayor frecuencia en hemocultivos y heridas procedentes de UCI neonatal y cirugía. Los fenotipos de resistencia predominantes fueron para penicilina y oxacilina.
Palabras clave: resistencia bacteriana, MRS, Staphylococcus aureus.
Abstract
The Staphylococcusspp. they can cause a wide range of infections systemic and located in community and hospital patients. Its high pathogenicity and growing resistance to multiple antimicrobials including methicillin, causes high morbiditymortality rates, causing a high epidemiological impact. Objective: to determine the phenotypic profile of resistance to different antimicrobials in strains of the genus Staphylococcus spp. Materials and methods: collected 75 strains and determined them susceptibility to different antibiotics by the Kirby-Bauer method. The production of betalactamase check using the nitrocefin test. (Resistance to Methicillin in S. aureus was conducted using Mueller Hinton with 4% NaCl and oxacillin 6 µg/mL). Inducible clindamycin resistance tamizo by D-Test test. Results: they were isolated by 38% of staphylococcus coagulase negative (SNA) and 62% of S. aureus. 53% were penicillin resistant staphylococci: S. aureus with 58% and 42% SNA. 47% of the strains showed resistance to methicillin: S. aureus with 61% and SNA with 39%. A strain of S. aureus showed inducible resistance to clindamycin (1.33%). Coagulase negative staphylococci were isolated mostly from blood samples (31%), blood (29%), tip of catheter (5%) and came mostly from neonatal ICU (25%), medical (21%) and surgery (16%). Conclusions: S. aureus and SNA were isolated with greater frequency in blood and wounds from surgery and neonatal ICU. The predominant resistance phenotypes were penicillin and oxacillin.
Keywords: bacterial resistance, MRS, Staphylococcus aureus.
Resumo
Os Staphylococcus spp. causam uma ampla série de infecções sistemáticas e localizadas em pacientes hospitalizados e comunitários. Sua alta patogenicidade e sua crescente resistência a múltiplos antimicrobianos, entre eles a meticilina, causam taxas elevadas de morbimortalidade ocasionando um alto impacto epidemiológico. Objetivo: determinar o perfil fenotípico de resistência a diferentes antimicrobianos em cepas do gênero Staphylococcus spp. Materiais e métodos: se recoletaram setenta e cinco cepas, e determinou-se suscetibilidade aos diferentes antibióticos pelo método de Kirby Bauer. A produção de beta-lactamase verificou-se mediante a prova do nitrocefin. A resistência à meticilina en S. aureus realizou-se usando Mueller Hinton com 4% de NaCl e oxacilina 6 µg/mL. A resistência induzível a clindamicina se tamisou mediante a prova do D-Test. Resultados: se isolo um 38% de estafilococos coagulase negativa (SCN) e um 62% de S. aureus. Um 53% dos estafilococos foram resistentes à penicilina: S. aureus com 58% e SCN 42%; um 47% das cepas apresentaram resistência à meticilina: S. aureus com um 61% e SCN com um 39%; uma cepa de S. aureus mostrou resistência induzível á clindamicina (1,33%). Em sua maioria, os estafilococos coagulase negativa foram isolados a partir de amostras de hemoculturas (31%) e os estafilococos meticilino-resistentes predominaram em amostras de feridas (46%), hemocultura (29%) e ponta de cateter (5%); grande parte deles procedia de UCI neonatal (25%), médica (21%) e cirurgia (16%). Conclusões: S. aureus y SCN se isolaram com maior frequência em hemoculturas e feridas procedentes de UCI neonatal e cirurgia. Os fenótipos de resistência predominantes foram para penicilina e oxacilina.
Palavras chave: resistência bacteriana, MRS, Staphylococcus aureus.
El aumento de las infecciones por patógenos Gram positivos, en especial del género estafilococos, se ha incrementado en los últimos años. Estos microorganismos son considerados patógenos oportunistas y ocasionan graves infecciones en heridas, osteomielitis, endocarditis, bacteriemias, forúnculos, infecciones postoperatorias, enterocolitis, bronconeumonía, choque séptico, artritis y abscesos, pericarditis, abscesos musculares y cerebrales en el ámbito nosocomial (1). La emergencia de Staphylococcus aureus resistente a meticilina, MRSA, hace que las infecciones causadas por estos agentes sean más difíciles de tratar, aumentando la morbimortalidad de los pacientes afectados (2). También se ha demostrado que los índices de mortalidad son 2,5 veces mayores en los casos de infecciones por MRSA (21%) que por Staphylococcus aureus meticilino-sensibles (MSSA) con un 8% (3).
El problema de las infecciones intrahospitalarias por estafilococos meticilino-resistentes radica en que estas cepas generan resistencia a todos los antibióticos betalactámicos y en general portan un perfil de resistencia múltiple a antibióticos no betalactámicos (macrólidos, sulfas, quinolonas y lincosamidas), dejando a los glucopéptidos como única opción terapéutica (4-5).
Estudios realizados por el Centro para el Control y la Prevención de Enfermedades (CDC por su nombre en inglés), revelaron que los MRSA provocaron más de 94.000 infecciones potencialmente mortales y casi 19.000 muertes en Estados Unidos durante 2005, en su mayoría vinculadas con entornos médicos (6); son considerados, entonces, como los patógenos aislados con mayor frecuencia en las instituciones hospitalarias, constituyendo un grave problema de salud pública. Teniendo en cuenta la problemática de la creciente resistencia a meticilina y a otros antibióticos betalactámicos y no betalactámicos, se determinó el perfil fenotípico de resistencia a diferentes antimicrobianos en cepas del género Staphylococcus spp. para conocer su prevalencia en la institución objeto de estudio e implementar medidas de control que prevengan la aparición de brotes.
Materiales y métodos
Se llevó a cabo un estudio descriptivo transversal. Se recolectaron setenta y cinco cepas identificadas mediante pruebas bioquímicas convencionales realizadas en el Laboratorio de Microbiología de la Universidad de Santander. Se realizó el antibiograma por difusión (Kirby Bauer) y se evaluaron los siguientes antibióticos: penicilina, vancomicina, eritromicina, tetraciclina, trimetropin/sulfa, cloranfenicol, ciprofloxacina, gentamicina y clindamicina. La producción de beta-lactamasa se verificó por el test basado en nitrocefin. La resistencia a meticilina se realizó tamizando con el antibiótico cefoxitin, el cual detecta mejor los clones heterorresistentes y la resistencia a oxacilina codificada por el gen MecA. Esta resistencia en los S. aureus fue confirmada con el método de dilución en agar usando Mueller Hinton suplementado con 4% de cloruro de sodio (NaCl) y 6 µg/ml de oxacilina. El fenotipo de resistencia inducible a clindamicina se tamizó a todos los estafilococos que mostraron resistencia in vitro a eritromicina y sensibilidada clindamicina mediante el método de difusión del doble disco (D-Test). Se utilizaron todos los criterios incluyendo los del control de calidad del Clinical and Laboratory Standard Institute (CLSI) de 2009 (7).
Resultados
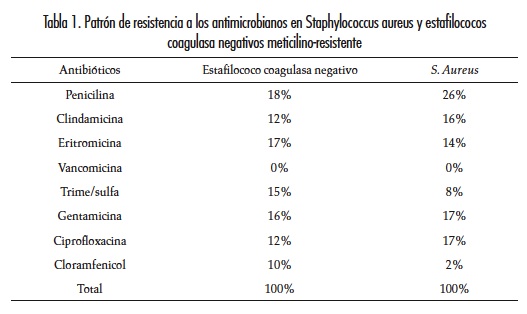
Se analizaron setenta y cinco muestras de estafilococos: 38% fueron estafilococos coagulasa negativos (SCN) y un 62% S. aureus. Al analizar el patrón de susceptibilidad antimicrobiana in vitro se pudo observar que el fenotipo de resistencia encontrado con mayor frecuencia fue la resistencia a penicilina con un 53%. Este se halló en 58% de cepas de S. aureus y en 42% de SCN. El segundo fenotipo sobresaliente fue la resistencia a meticilina, con una frecuencia>de 47%: 61% en cepas de S. aureus y 39% en SCN. A excepción de la vancomicina, que no mostró resistencia in vitro, todos los estafilococos presentaron un menor perfil de resistencia para el resto de antibióticos probados (tabla 1). Pese a que los estafilococos mostraron resistencia constitutiva a clindamicina con frecuencia inferior a 16%, solo una cepa presentó el perfil fenotípico de resistencia inducible a clindamicina (1,33%). Los estafilococos meticilino-resistentes predominaron en muestras de heridas con 46%, hemocultivo con 29% y punta de catéter con 5%. El porcentaje restante de MRSA provenía de diferentes secreciones (ocular, traqueal, faríngea), orina y líquido pleural (20%) y en su mayoría de la UCI neonatal (25%), UCI médica (21%) y cirugía (16%).
Discusión
El género estafilococos, en especial el S. aureus, es uno de los patógenos que se aísla con mayor frecuencia en el ámbito nosocomial. Debido a la patogenicidad variable que presenta puede causar infecciones de todo tipo. En este estudio el S. aureus se aisló en una mayor proporción (62%), seguido de los estafilococos coagulasanegativos (38%). Resultados similares a los reportados por hospitales de Cuba y España documentaron una frecuencia de 60,2% y 53% para S. aureus y de 39,7% y 46% para SCN respectivamente (8-9). En contraste con los estudios ya referenciados, Estados Unidos reporta una prevalencia para SCN de 32% y para S. aureus de 16%, cifras muy inferioresa las reportadas en esta investigación (10). Se puede analizar que la frecuencia de aislamietos de los estafilococos no es la misma para todos los hospitales, pues está determinada por las condiciones higiénico-sanitarias de cada institución que, cuando no son adecuadas, contribuyen a la aparición de los estafilococos en sus instalaciones.
Un 31% de los Staphylococcus spp. fue obtenido a partir de hemocultivos, guardando relación con los estudios realizados en Argentina, Venezuela y el Consorcio Internacional de Control de Infecciones (Inicc), quienes aislaron la mayor parte de los estafilococos del torrente sanguíneo (11-13). La alta frecuencia de estafilococos en muestras de sangre está asociada con el uso de catéteres vasculares centrales (CVC), factor que predispone a la colonización y proliferación de estos patógenos y ocasiona una infección local o generalizada.
El fenotipo de resistencia a la penicilina para S. aureus fue de 58%, porcentaje ligeramente superior al de los SCN (42%). Estos resultados son inferiores al compararlos con estudios realizados en Paraguay y Venezuela, que documentan una resistencia a penicilina aproximada de 95% para ambos estafilococos (14-15). Múltiples estudios realizados por la CLSI en Colombia y en otros países demuestran que la resistencia actual de los estafilococos a la penicilina es alrededor de 90% (16-17). Para el año 2005, Cuba reportó una resistencia a penicilina de 100% en varias instituciones hospitalarias (8). El Hospital de Navarra, España, realizó un estudio de varios años y logró documentar una resistencia a penicilina de 88,8% en SCN y de 100% para MRSA (18).
En contraste con los SCN (39%), S. aureus tuvo una mayor resistencia in vitro a la meticilina (61%). Los porcentajes de los SCN son inferiores a trabajos que reportan un alto porcentaje de resistencia a oxacilina: Asunción,87%; Estados Unidos, 57%; Canadá, 51%; Europa, 59% y América Latina, 68% (19-20). Vale la pena resaltar que los factores propiciadores de la aparición y alta frecuencia de estos estafilococos en el ámbito hospitalario tienen que ver con el nicho ecológico, el uso de dispositivos invasivos como catéteres y la colonización en pacientes dializados o que reciben repetidos y prolongados tratamientos (8). Por otro lado, la frecuencia de 61% para MRSA obtenida en esta investigación es proporcional a los resultados reportados por hospitales de Asunción, 64%; Cuba, 60,2% y Lima, 57,4% siendo superiores a los datos arrojados por el Grupo para el control de la resistencia en Bogotá (Grebo), el cual recogió varios estudios realizados en diferentes ciudades colombianas que documentaron una resistencia del S. aureus a la meticilina entre 40 y 50%. (8, 19, 21-22). Otros estudios realizados por hospitales de Bogotá y Cali reportan una frecuencia de SMRA de 48 y 45% (23).
Los casos con mayor número de cepas resistentes a la meticilina fueron obtenidos dmuestras de heridas (46%) y en menor proporción de hemocultivos (29%). Estos resultados concuerdan con estudios realizados en España, Colombia, Uruguay y Estados Unidos, los cuales reportan que los MRSA estudiados provenían en mayor proporción de piel, tejidos blandos y heridas quirúrgicas (3, 13-24). Quizá esto se debe a que los estafilococos forman parte de la biota normal del cuerpo humano y, aprovechando las condiciones críticas de los pacientes hospitalizados, ocasionan infecciones en estos sitios.
Los MRSA provenían en su gran mayoría de UCI neonatal con un 25% (14). Estos resultados coinciden con un estudio realizado en Asunción (19), en contraste con investigaciones realizadas en España y México, las cuales señalan una baja frecuencia de aislamientos provenientes de esta área hospitalaria (26-27). En Colombia, el estudio de Olarte en la Universidad del Bosque de Bogotá reporta un 26% de MRSA (24), cifra similar a la obtenida en nuestra investigación; Londoño, en la Clínica Universitaria Bolivariana de Medellín y Morales, en el Hospital Rosario Pumarejo de López de Valledupar, documentaron frecuencias de 15% y 17%, cifras ligeramente inferiores a las encontradas en este trabajo (28,29). Dado que el área de la UCI y en especial UCI neonatal albergan a los pacientes con compromiso inmunológico, se deberían maximizar las medidas preventivas para evitar que estos pacientes adquieran infecciones por SMR.
La resistencia a clindamicina fue de 12% para SCN y de 16% para S. aureus. Al realizar la prueba del D-Test para detectar la resistencia de tipo inducible, solo una cepa de S. aureus presentó este fenotipo de resistencia (1,33%). La presencia leve pero significativa de resistencia inducible a la clindamicina en la cepas de estafilococos aisladas en la institución objeto de estudio es muy baja al compararlo con otros estudios reportados por diferentes instituciones hospitalarias de Caracas, 4,05%; Chile, 48,3%; Lima, 48,2%; Estados Unidos 9,7% y Mede-llín, 25% (15, 28, 30-32). Se debería tamizar de manera obligatoria esta resistencia a todos los estafilococos que presenten el fenotipo de resistencia a eritromicina y sensibilidad a clindamicina in vitro para evitar fracasos terapéuticos, teniendo en cuenta que la clindamicina es un antibiótico de bajo costo y una excelente alternativa de tratamiento en infecciones cutáneas y osteoarticulares.
En cuanto al impacto económico que generan los estafilococos, estudios recientes coinciden en afirmar que la resistencia a la oxacilina es un factor relacionado con una mayor estancia hospitalaria y, en consecuencia, con mayores costos directos de atención a estos pacientes. La resistencia a la meticilina se asocia con un aumento estadísticamente significativo de 1,3 veces la estancia hospitalaria y un incremento en los costos hasta de 40% (33). Evaluar las implicaciones de la resistencia a los antimicrobianos tanto en los pacientes como en las instituciones de salud es un paso necesario para generar estrategias de contención de esta problemática y justifica la creación de programas de control de infecciones y de uso prudente de antibióticos (34).
Se puede concluir que S. aureus fue el patógeno aislado en mayor proporción. Los antibióticos que mostraron mayor resistencia in vitro fueron penicilina y oxacilina. La resistencia inducible a la clindamicina fue baja al compararla con otras investigaciones. Todos los laboratorios deberían implementar las técnicas para detectar mejor los estafilococos meticilinoresistentes y el fenotipo de resistencia inducible a la clindamicina. Es imprescindible mantener una adecuada vigilancia epidemiológica, reportar con periodicidad los perfiles de resistencia y hacer un uso adecuado de los antibióticos y de las normas de contención para evitar la propagación de estos patógenos en el ámbito nosocomial y comunitario, ya que el impacto de la resistencia a la meticilina de este microorganismo es evidente.
Descargos de responsabilidad
Ningún conflicto de interés.
Agradecimientos
Los autores agradecen a las personas que participaron en el estudio, al Hospital Rosario Pumarejo de López por su colaboración en la obtención de las muestras y a la Universidad de Santander (UDES) por financiar parcialmente esta investigación.
Bibliografía
1. Barnett ED, Klein JO. The problem of resistant bacteria for the management of acute otitis media. Pediatr. Clin. North. Am. 1995; 42: 509-17. [ Links ]
2. Austrian R, Gold J. Pneumococcal bacteremia with especial reference to bacteremic pneumoccal pneumonia. Ann. Intern. Med. 1964; 60: 759-76. [ Links ]
3. Solís del Baño S. Prevalencia y evolución de la resistencia de Staphylococcus aureus resistente a meticilina en pacientes hospitalizados durante el período 2003-2007 en el Hospital Universitario de Guadalajara. Memorias de IV Reunión Científica de la Sociedad de Microbiología Clínica de Castilla 2007. [Consultado el 15 de mayo de 2012]. Disponible en http://www.somiccam.com/archivos/albacete_08.pdf [ Links ]
4. Cuevas O, Cercenado E, Goyanes MJ, Vindel A, Trincado P, Boquete T et al. Staphylococcus spp en situación actual y evolución de la resistencia a antimicrobianos. Servicio de Microbiología. Hospital General Universitario Gregorio Marañón. Madrid. Centro Nacional de Microbiología. Instituto de Salud Carlos III. Majadahonda España 2006; 3. [ Links ]
5. Céspedes C, Miller M, Quagliarello B, Vavagiakis P, Klein RS, Lowy FD. Differences between Staphylococccus aureus isolates from medical and nonmedical hospital personnel. J. Clin. Microbiol. 2002;40 (7): 2594-7. [ Links ]
6. CDC Centro para el Control y Prevención de enfermedades. CDC calcula que en EE. UU. ocurrieron 94,000 infecciones por estafilococos resistentes a los medicamentos en 2005. [Consultado el 15 de mayo de 2012]. Disponible en http://www.cdc.gov/spanish/esmedia/2007/16oct2007.html [ Links ]
7. CLSI Clinical and Laboratory Standards Institute. Performance standards for antimicrobial disk susceptibility tests; M02-A10 2009; 29 (1): 52-9. [ Links ]
8. González L, Morffi J, Nadal L, Vallin C, Contreras R, Roura G. Frecuencia de aislamiento de Staphylococcus spp meticilina resistentes y Enterococcus spp vancomicina resistentes en hospitales de Cuba. Rev. Cubana Farm. 2005; 39 (3): 1-2. [ Links ]
9. Rodríguez-Baño J, Bischofberger C, Álvarez-Lerma F, Asensio Á, Delgado T, García-Arcal D, et al. Vigilancia y control de Staphylococcus aureus resistente a meticilina en hospitales españoles. Documento de consenso GEIH-SEIMC y SEMPSPH. Enferm. Infecc. Microbiol, Clin. 2008; 26 (5): 285-98. [ Links ]
10. Srinivasan A, Dick JD, Perl TM. Vancomycin resistance in staphylococci. Clin. Microbiol. Rev. 2002;15 (3): 430-8. [ Links ]
11. Cabrera M. Estafilococo aureus meticillino resistente. Un reto en la terapia antimicrobiana. Revista electrónica Portales Médicos 2006; 193 (2): 172-9. [ Links ]
12. Álvarez M, Velazco E, Nieves B, Álvarez E, Araque M, Salazar E, Gutiérrez B. Caracterización fenotípica de cepas de Staphylococcus coagulasa negativa aisladas de una unidad de alto riesgo neonatal. Rev. Kasmera 2008; 36 (1): 7-16. [ Links ]
13. Kuehnert MJ, Kruszon-Moran D, Hill HA, McQuillan G, McAllister SK, Fosheim G, et al. Prevalence of Staphylococcus aureus nasal colonization in the United States, 2001 2002. J. Infec. Dis. 2006; 193(2): 172-9. [ Links ]
14. Savio E, Medina J. Consideraciones clínicas y directivas terapéuticas en las enfermedades producidas por SAMR-com. Paraguay: Dirección General de la Salud Ministerio de Salud Pública. Cátedra de Enfermedades Infecciosas Facultad de Medicina; 2004. [ Links ]
15. Fernández S, et al. Incidencia de resistencia constitutiva e inducible a clindamicina en Staphylococcus spp. aislados en un centro ambulatorio. INHRR 2004; 35 (2): 10-3. [ Links ]
16. Fluit A, Wielders C, Verhoef J, Schmitz F. Epidemiology and susceptibility of 3051 Staphylococcus aureus isolates from 25 university hospitals participating in the European SENTRY study. J. Clin. Microbiol. 2001; 39 (10): 3727-32. [ Links ]
17. Gobernado M. Resistencia en Staphylococcus aureus. Ahora a la vancomicina. Rev. Esp. Quimioter. 2002; 15 (3): 211-21. [ Links ]
18. Navascués A, García-Irure J, Guillén F. Situación de Staphylococcus aureus resistente a meticilina en el Hospital de Navarra (2000-2002). Anales Sis. San Navarra; 27 (1): 21-5. [ Links ]
19. Laspina F, Samudio M, Sosa S, Centurión MG, Apud E, Espinola C, et al. Mem. Inst. Investig. Cienc. Salud 2008; 6 (2) Mem. Inst. Investig. Cienc. Salud 6 (2): 18-24. [ Links ]
20. Melzer1 M, Eykyn S, Gransden W, Chinn S. Is methicillin-resistant Staphylococcus aureus more virulent than methicillin-susceptible S. aureus? A comparative cohort study of British patients with nosocomial infection and bacteremia. Clinic. Infect. Dis. 2003; 37 (11): 60. [ Links ]
21. Mamani E, Luján D, Pajuelo G. Perfil de sensibilidad y resistencia de Staphylococcus aureus. Experiencia en el Hospital Nacional Hipólito Unanue. An. Fac. Med. 2006; 67 (2): 120-4. [ Links ]
22. Leal AL, Álvarez C, Cortés J, Sánchez R, Castillo J, Buitrago G, et al. Impacto clínico y económico de la resistencia bacteriana en hospitales del Distrito. Boletín Grebo 2010; S1: 3-13. [ Links ]
23. Jiménez JN, Correa MM. Staphylococcus aureus resistente a meticilina: bases moleculares de la resistencia, epidemiología y tipificación. Iatreia 2009; 22 (2): 147-58. [ Links ]
24. Vanegas G, Alberto V, Karlo R, Quintana O, Garzón M, Castro B, et al. Infectio 2008; 12 (1): 115. [ Links ]
25. Parodi V, Aldao J, Bustos R. Estafilococo meticilino-resistente en la maternidad del Centro Hospitalario Pereira Rossell. Arch. Pediatr. Urug. 2007; 78 (1): 5-10. [ Links ]
26. Escribano E. Prevalencia y evolución de la resistencia de Staphylococcus aureus resistente a meticilina en pacientes hospitalizados en el Complejo Hospitalario Universitario de Albacete: 2003-2007. Memorias de IV Reunión Científica de la Sociedad de Microbiología Clínica de Castilla 2007. [Consultado el 15 de mayo de 2012]. Disponible en http://www.somiccam.com/archivos/albacete_08.pdf [ Links ]
27. Rolon Al, Reyes Mar J, Hernandez M, Portillo E, Bobadilla JM, Ponce de Leon A, et al. Características Epidemiológicas de Staphylococus Aureus Resistente a Oxacilina (SARO) en México, 2004: Red Nacional de Resistencia Bacteriana en México. Rev Enf Infecc Microbiol 2005; 25 (S1): S74. [ Links ]
28. Londoño J, Ortiz G, Gaviria Á. Prevalencia de Staphylococcus aureus resistente a meticilina en personal de la unidad de terapia intensiva de la Clínica Universitaria Bolivariana, Medellín 2004. Infect. 2006; 10 (3): 160-6. [ Links ]
29. Morales GI, Yaneth MC, Arango C, Hinojosa B. Patrones de resistencia en cepas de Staphylococcus aislados en un centro hospitalario de la ciudad de Valledupar. RCMT 2010; 1 (2): 37-40. [ Links ]
30. Montoya I, Mira M, Álvarez I, Cofré J, Cohen J, Donoso G, et al. Resistencia inducible a clindamicina en Staphylococcus aureus meticilino-resistente. Rev. Chil. Pediatr. 2009; 80 (1): 48-53. [ Links ]
31. Tamariz H, Cruz J, Atencia A, Jaime Figueroa J, Horna G, Guerra H. Resistencia a clindamicina inducida por eritromicina en Staphylococcus aureus aislados de tres hospitales de Lima, Perú. Acta Med. Per. 2009; 26 (1): 14-6. [ Links ]
32. Schreckenberger PC, Ilendo E, Ristow KL. Incidence of constitutive and inducible clindamycin resistance in Staphylococcus aureus and coagulase-negative Staphylococci in a community and a tertiary care hospital. J. Clin. Microbiol. 2004; 42 (6): 2777-9. [ Links ]
33. Cosgrove SE, Qi Y, Kaye KS, Harbarth S, Karchmer AW, Carmeli Y. The impact of methicillin resistance in Staphylococcus aureus bacteremia on patient outcomes: mortality, length of stay, and hospital charges. Infect. Control Hosp. Epidemiol. 2005; 26 (2): 166-74. [ Links ]
34. Cosgrove SE. The relationship between antimicrobial resistance and patient outcomes: mortality, length of hospital stay, and health care costs. Clin. Infect. Dis. 2006; 42 (Suppl 2): S82-9. [ Links ]