Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Ciencias de la Salud
versión impresa ISSN 1692-7273versión On-line ISSN 2145-4507
Rev. Cienc. Salud v.10 supl.1 Bogotá mar. 2012
Asociación entre las concentraciones de malondialdehído (MDA) y las alteraciones neurológicas en personas expuestas ocupacionalmente a mercurio
Association between Concentrations of Malondialdehyde (MDA) and Neurological Abnormalities in People Occupationally Exposed to Mercury
Associação entre concentração de malondialdeído (MDA) e anormalidades neurológicas em pessoas ocupacionalmente expostoa ao mercúrio
Claudia Lucía Arroyave Hoyos MD, MsC1, Fanny Cuesta González, Ing Q, MsC1, Nicolás Wilches, MD1,Diana Marcela Álvarez MD1, José William Cornejo, MD, MsC1
1 Departamento de Farmacología y Toxicología, Facultad de Medicina, Universidad de Antioquia. Facultad de Medicina, Universidad CES. Hospital Pablo Tobón Uribe. Correspondencia: clarroyave@gmail.com
Recibido: junio 30 de 2011 • Aprobado: octubre 2 de 2011.
Para citar este artículo: Arroyave CL, Cuesta F, Wilches N, Álvarez, DM, Cornejo JW. Asociación entre las concentraciones de malondialdehído (MDA) y las alteraciones neurológicas en personas expuestas ocupacionalmente a mercurio. Rev. Cienc. Salud 2012; 10 (Especial): 17-28.
Resumen
Se cree que la neurotoxicidad por mercurio metálico se debe a la inducción del estrés oxidativo (determinado por aumento de las concentraciones de malondialdehído, MDA), pero se desconoce si la mayor concentración de MDA implica mayor cantidad de alteraciones neurológicas. Objetivo: establecer la asociación entre las concentraciones urinarias de MDA y la gravedad de la neurotoxicidad en individuos expuestos a mercurio. Materiales y métodos: se recurrió a un estudio transversal. Se incluyeron hombres entre 18 y 60 años laboralmente expuestos a mercurio. Se tomaron 110 unidades de análisis de una base de datos. Se obtuvo información de historias clínicas con énfasis en la evolución neurológica, de la concentración de mercurio en orina de 24 horas y de análisis de MDA en orina. Se compararon concentraciones de MDA entre quienes tenían alteraciones neurológicas contra quienes no las tenían y se evaluaron las diferencias de las concentraciones de esta sustancia de acuerdo con la gravedad neurológica; se realizó un análisis de correlación entre concentraciones urinarias de MDA con las concentraciones urinarias de mercurio. Resultados: como resultado se obtuvo que las concentraciones de MDA en los individuos expuestos a mercurio y que presentaron alteraciones neurológicas no fueron diferentes de las concentraciones de los individuos expuestos pero sin alteraciones neurológicas. Sus concentraciones tampoco estuvieron asociadas con la gravedad. No hubo correlación entre las concentraciones urinarias de MDA y mercurio. Conclusión: será necesario buscar otras muestras biológicas diferentes a la orina que reflejen lo que ocurre en el sistema nervioso central (SNC), o buscar otras razones fisiopatológicas que expliquen la presencia de las manifestaciones clínicas en estos individuos.
Palabras clave: malondialdehído, MDA, mercurio, neurotoxicidad, minería, radicales libres.
Abstract
It is believed that mercury neurotoxicity is due to induction of oxidative stress [as determined by increased concentrations of malondialdehyde (MDA)], but we don't know if to have higher concentrations of MDA involves to have more neurological disorders. Objective: To establish association between urinary concentrations of MDA and the severity of neurological abnormalities in people exposed to mercury. Materials and methods: A cross-sectional study was done. Inclusion criteria: men between 18 and 60 years with occupational exposure to metallic mercury. The sample was taken from a database of 110 patients exposed to mercury. Information was gathered from medical records with emphasis on neurologic outcome, from the mercury concentration in urine of 24 hours and from urinary MDA analysis. For statistical analysis, nonparametric tests were used for comparisons between concentrations of MDA among those with neurological disorders vs. those without disorders and to evaluate differences in the concentrations of this substance according to the severity of these alterations; it was performed correlation analysis between urinary concentrations of MDA and urinary concentrations of mercury. Results: The concentrations of MDA in patients exposed to mercury with neurological abnormalities were not different from those without abnormalities. MDA concentrations neither were associated with the severity of clinical findings. There was no correlation between MDA and urinary mercury concentrations. Conclusion: It will be necessary to search biological samples other than urine that could reflect what occurs in CNS or look for other pathophysiological causes to explain the presence of clinical findings in these patients.
Keywords: malondialdehyde, MDA, mercury, neurotoxicity, mining, free radicals.
Resumo
Acredita-se que a neurotoxicidade do mercúrio metálico devido à indução de estresse oxidativo [conforme determinado pelo aumento das concentrações de malondialdeído (MDA)], mas não sabe se quer ter maiores concentrações de MDA envolve mais alterações neurológicas. Objetivo: estabelecer a associação entre a concentração urinária do MDA e da gravidade da neurotoxicidade em expostos ao mercúrio. Materiais e métodos: Estudo transversal. Ele incluiu homens entre 18 e 60 expostos ao mercúrio. Levou 110 unidades de análise de um banco de dados. As informações foram coletadas dos prontuários médicos, com ênfase na evolução neurológica, a concentração de mercúrio na urina de 24 horas e MDA na análise da urina. Testes não paramétricos foram utilizados para comparar as concentrações de MDA em pacientes com distúrbios neurológicos vs aqueles que não tê-los e avaliar as diferenças na concentração desta substância em função da gravidade dos distúrbios, foi feita uma análise de correlação entre as concentrações urinárias MDA com concentrações urinárias de mercúrio. Resultados: As concentrações de MDA no exposto a alterações de mercúrio e neurológico não foram diferentes daquelas expostas, mas sem distúrbios neurológicos. Seus níveis não foram associados com a gravidade. Não houve correlação entre o MDA e concentrações urinárias de mercúrio. Conclusão: Será necessário procurar outras amostras biológicas de urina que não reflectem o que ocorre no SNC ou procurar outras razões fisiopatológicas explicar a presença das manifestações clínicas nesses indivíduos.
Palavras chave: malondialdeído, MDA, mercúrio, neurotoxicidade, mineração, radicais livres.
Introducción
La minería del oro es una actividad económica común en América Latina (1-5). En Colombia, Antioquia es una de las principales regiones de producción de oro, en particular los municipios del nordeste y del bajo Cauca como Segovia, Remedios, El Bagre, Zaragoza, Caucasia y Amalfi, entre otros (6). La extracción artesanal del oro se realiza con mercurio en forma metálica (7) y una forma de valorar la exposición al metal es mediante la medición de mercurio en orina. La American Conference of Governmental Industrial Hygienists (Acgih), ha recomendado que, al final de la jornada laboral, las máximas concentraciones urinarias permisibles en individuos expuestos ocupacionalmente deben ser de 35μg Hg/gr creatinina (8). El Sistema Nervioso Central (SNC), es su blanco de toxicidad (9-13, 54) y se cree que se debe a la capacidad que tiene el mercurio de aumentar la concentración de radicales libres, reflejando un acrecentamiento del estrés oxidativo (14, 53). Estos radicales libres interactúan con macromoléculas como la membrana celular produciendo una reacción conocida como peroxidación lipídica; de esta interacción membrana-radical se producen metabolitos como el malondialdehído (MDA), el cual puede ser detectado en muestras biológicas (15). En investigaciones in vitro y en animales expuestos a dicho metal se ha encontrado mayor estrés oxidativo al compararlos con controles (16-17).
En humanos se ha encontrado que las concentraciones de MDA se hallan significativamente más elevadas en mineros expuestos de manera crónica al mercurio que en controles (18). A pesar de que se sabe que hay un aumento en la producción de radicales libres en individuos expuestos, no se sabe si esta elevación tiene impacto clínico, es decir, si se relaciona o no con la presencia de alteraciones clínicas, en particular las neurológicas. Por tanto, el objetivo principal de este estudio fue explorar si las concentraciones urinarias de MDA se asocian con la gravedad de las alteraciones neurológicas en los individuos expuestos laboralmente a mercurio metálico y con las de mercurio.
Materiales y métodos
Se realizó un estudio transversal. Se evaluaron adultos que, por su ocupación, estaban expuestos a mercurio metálico en Amalfi y Segovia entre junio de 2006 y junio de 2009. Los criterios de inclusión fueron: hombres entre 18 y 60 años de edad, con exposición ocupacional a mercurio por la minería del oro o compraventa de oro durante un tiempo mayor a seis meses. Se excluyeron aquellos que tenían antecedentes de hipertiroidismo, cáncer, cardiopatía, artritis reumatoidea, enfermedad pulmonar obstructiva crónica (EPOC) u hospitalización en los últimos tres meses, así como a quienes tenían creatinina sérica mayor de 1,5 mg% y a quienes, en el momento de la evaluación, estuvieran tomando vitaminas, inhibidores de la Enzima Convertidora de Angiotensina (ECA), antagonistas de canales de calcio, agonistas β2-adrenérgicos o β-bloqueadores. El estudio se hizo con datos ya existentes en una base del grupo de Toxicología de la Facultad de Medicina de la Universidad de Antioquia. De las historias clínicas se tomó información correspondiente a edad, años de exposición a mercurio, consumo actual de cigarrillo, frecuencia de consumo de alcohol y si tenía o no alguno de los siguientes hallazgos neurológicos: temblor, alteraciones de la memoria verbal, trastornos del estado de ánimo con síntomas depresivos, irritabilidad, insomnio, apatía sexual o parestesias. También se tomó la información de las concentraciones séricas de creatinina y las urinarias de mercurio y de MDA en 24 horas procesadas en el laboratorio de Toxicología de la Facultad de Medicina de la Universidad de Antioquia. La base de datos tuvo 147 historias disponibles. Asumiendo un 25% de pérdidas de estas, por no cumplir criterios de elegibilidad o por pérdida de información, se esperaba contar con la información de 108 historias. Se calculó una mínima diferencia de medias de 0,15 μmol/L de MDA detectable entre sujetos con alteraciones neurológicas contra asintomáticos, considerando un poder de 80% y un error α de 0,05 de una cola. Este cálculo se hizo con base en la diferencia de medias encontrada en el estudio de Kobal y otros autores (18). Se definió como alteración o hallazgo neurológico la presencia de alguna de las siguientes manifestaciones: temblor, alteraciones de la memoria verbal, trastornos del estado de ánimo con síntomas depresivos, irritabilidad, insomnio, apatía sexual o parestesias. Para evaluar el temblor, se indicó a la persona que extendiera los miembros superiores en ángulo de 90° respecto al tronco, con los dedos separados y los ojos cerrados. Se puso una hoja de papel sobre el dorso de sus manos y se observaron los movimientos rítmicos alternativos de ascenso y descenso del papel. Se definió como presencia de temblor cuando la amplitud de dicho movimiento fue ≥0,5 cm (19). También se pidió que escribiera su nombre o que hiciera figuras geométricas en un papel sin apoyar la mano y, si el temblor era evidente, también se consideró como positivo (20-21). La alteración en la memoria verbal se definió como un puntaje ≤5 en las preguntas del Mini-Mental State Examination (22) correspondientes a memoria de fijación y memoria de evocación. Para diagnosticar el trastorno del estado de ánimo con síntomas depresivos se usaron los criterios del DSM IV para el "trastorno del estado de ánimo con síntomas depresivos debido a enfermedad médica" (23). Se definió irritabilidad como la manifestación de la personalidad que se expresa en reacciones exageradas ante las influencias externas y se consideró como respuesta positiva cuando el sujeto respondía sí a la siguiente pregunta: ¿se torna agresivo verbal o físicamente de manera no controlable y por situaciones sin importancia? Se precisó insomnio como un puntaje >8 en la Escala de Atenas de Insomnio (24). La apatía sexual se consideró como respuesta positiva a la siguiente pregunta: ¿Tiene usted falta de interés por los aspectos relacionados con el sexo y por llevar a cabo conductas sexuales? Se consideró presencia de parestesias a la respuesta positiva a la siguiente pregunta: ¿Tiene usted una sensación de hormigueo o adormecimiento en sus manos o en sus pies? Se delimitó la gravedad de las manifestaciones neurológicas de la siguiente forma: a) sin alteraciones o sin hallazgos, cuando no tenían alteraciones neurológicas; b) alteraciones leves, cuando tenían entre una y dos alteraciones neurológicas; c) alteraciones moderadas, cuando tenían entre tres y cuatro alteraciones; y d) alteraciones graves, cuando tenían cinco o más alteraciones. Se realizaron los análisis de mercurio en orina de 24 horas mediante la técnica de absorción atómica de vapor frío (25-26), la creatinina sérica mediante espectrofotometría y el MDA en orina de 24 horas con cromatografía líquida (HPLC) con la técnica de adición de estándares (27-28). El análisis estadístico se realizó con SPSS versión 17. Las variables categóricas se expresaron como frecuencias absolutas o relativas y las variables continuas con la mediana y el rango intercuartil (por distribución no normal). Se realizaron comparaciones de las características cuantitativas de los individuos de acuerdo con la gravedad (sin alteraciones, leves, moderadas y graves) con la prueba Kruskal Wallis y se aplicó Chi2 para la comparación de las características categóricas. Se utilizó U de Mann-Withney para hacer comparaciones de las concentraciones de mercurio y MDA con la presencia o no de cada uno de los hallazgos neurológicos de los individuos. Se realizó un análisis de correlación entre las variables continuas (número de alteraciones neurológicas por paciente con concentraciones urinarias de MDA y estas últimas con concentraciones urinarias de mercurio) con el coeficiente de correlación de Spearman. Se hizo un análisis multivariado con regresión logística teniendo en cuenta como variable dependiente el hallazgo neurológico y como independiente a las concentraciones de MDA y se consideró realizar ajustes en caso necesario por edad, años de exposición, procedencia, concentración de mercur io, consumo de alcohol (38-39) y consumo de cigarrillo (40). Este trabajo fue aprobado por el Comité de Ética de la Facultad de Medicina de la Universidad de Antioquia el 22 de julio de 2010 y cumplió con la Resolución 8430 de 1993 del Ministerio de la Protección Social y con la Declaración de Helsinki.
Resultados
Para el estudio se tenían 147 historias clínicas disponibles, de las cuales 110 cumplieron con los criterios de elegibilidad y fueron utilizadas para realizar el análisis. Un 53,6% de la muestra correspondía a Amalfi y el resto a Segovia. La edad de los individuos estuvo entre 18 y 59 años, con una mediana de 37,7 años, y 50% tenía un tiempo de exposición al metal mayor o igual a 12 años (Tabla 1). La mediana de las concentraciones urinarias de mercurio fue de 61 mcg/L y el rango estuvo entre 0,1 hasta 1.400 mcg/L; 62% de las personas estudiadas tenía concentraciones por encima de los valores máximos permitidos (>35 mcg/L). La mediana de la concentración de MDA fue de 2,06 µmol/L (mínimo 0,1; máximo 5,61). Un 79% de los sujetos no fumaba; entre quienes lo hacían, el consumo varió de 1 a 30 cigarrillos por día. Un 70% de la población era consumidora de alcohol, con un rango entre 0 hasta 1.200 gr semanales y una mediana de 120 gr semanales. En relación con los hallazgos clínicos, 90% de los participantes tenía, al menos, una alteración neurológica. El hallazgo más frecuente fue el temblor (69%), seguidos en orden decreciente de los trastornos de memoria (60,9%), irritabilidad (46,4%), insomnio (40,9%), apatía sexual (31,8%), síntomas depresivos (24,5%) y por último parestesias (6,4%). Las características generales de los participantes como tiempo de exposición ocupacional, consumo de cigarrillo, consumo de alcohol, presión arterial sistólica y diastólica y frecuencia cardíaca fueron similares entre las personas expuestas sin hallazgos comparadas con las de quienes sí tenían hallazgos neurológicos leves moderados o graves (Tabla 1). Se evidenció que la edad de quienes presentaban alteraciones neurológicas era mayor aproximadamente en diez años comparada con quienes no las tenían, aunque no alcanzó a ser un dato estadísticamente significativo. La proporción de sujetos con alteraciones neurológicas fue similar en ambos municipios, pero su gravedad sí mostró diferencia por lugar en cada categoría (leve, moderada, grave); por ejemplo, se encontró con mayor frecuencia que las manifestaciones en la muestra de Amalfi eran más leves que en la de Segovia. En relación con las muestras biológicas se encontró que, a pesar de la alta variabilidad, las concentraciones de mercurio se incrementaban a medida que aumentaba la cantidad de alteraciones neurológicas mostrando medianas de 33,7 en los que no tenían alteraciones, así como de 54,1, 83,7 y 102,7 en quienes las tenían de forma leve, moderada o grave respectivamente, aunque no hubo diferencias de significancia estadística (p= 0,20).
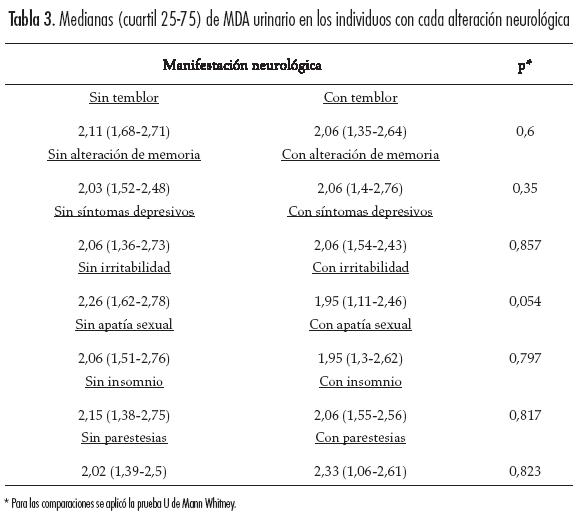
En relación con la concentración de MDA, no hubo diferencias estadísticamente significativas de acuerdo con la gravedad de las alteraciones neurológicas (Tabla 2). Cuando se hizo el análisis bivariado, no se encontró que las concentraciones urinarias de MDA fueran diferentes en las personas con la presencia o ausencia de cada uno de los hallazgos neurológicos (Tabla 3). En el análisis multivariado no se encontró que las covariables modificaran los resultados obtenidos en el análisis bivariado (Tabla 4).
La correlación existente entre el número de alteraciones neurológicas por individuo y la concentración de MDA fue muy baja (r= -0,088) y estadísticamente no significativa (p: 0,361), así como es baja la correlación existente entre las concentraciones de mercurio con MDA (r= 0,158) y estadísticamente no significativa(p: 0,099).
Discusión
El objetivo del presente estudio fue explorar si las concentraciones urinarias de MDA se asociaban con las alteraciones neurológicas en los individuos expuestos laboralmente a mercurio metálico y con las de mercurio. Lo hallado en este trabajo no pudo demostrar que hubiese mayor concentración de esta sustancia en aquellos que tuviesen alteraciones neurológicas comparado con los que no las tenían, o que fuese mayor en los individuos más graves; tampoco se encontró buena correlación entre la concentración urinaria de MDA y mercurio. Aunque se sabe que las personas con exposición ocupacional a mercurio tienden a presentar mayores concentraciones de MDA en orina de acuerdo con lo reportado por Kobal y otros autores (18), no se había estudiado si este aumento del metabolito, resultante de la producción de radicales libres, pudiera estar relacionado con las alteraciones clínicas presentadas por los individuos (en este caso las neurológicas). Aunque se aprecia que en nuestros resultados la mediana de la edad y de las concentraciones de mercurio de los individuos se incrementa a medida que aumenta la gravedad de las alteraciones neurológicas y que los individuos de Segovia tenían manifestaciones más graves que los individuos de Amalfi, cuando se hizo el análisis multivariable se encontró que, independientemente del lugar de procedencia, de la edad o de la intensidad de exposición a mercurio, las concentraciones de MDA no se comportaron como un factor de riesgo para presentar las alteraciones neurológicas.
Una posible explicación para estos resultados podría ser que, aunque la orina es un marcador aceptado para determinar las concentraciones de mercurio, esta muestra biológica no sea adecuada para reflejar lo que realmente está sucediendo en el SNC en relación con la producción de radicales libres, es decir, puede haber un importante estrés oxidativo en el SNC que esté generando daño local y que no pueda verse reflejado en la orina. Esto lo encontraron Arguelles y otros autores con muestras de sangre (41), quienes compararon las concentraciones séricas del ácido tiobarbitúrico (marcador de estrés oxidativo) con las de diferentes tejidos (hígado, bazo, corazón y riñón) en ratas, encontrando una pobre correlación entre estos con la muestra sanguínea. Otra posibilidad es que el estudio no haya podido encontrar las diferencias por un problema de potencia, es decir, por un error tipo II, ya que se encontró una frecuencia muy baja de individuos libres de alteraciones neurológicas; sin embargo, los autores no creen que el aumento en el tamaño de la muestra vaya a mostrar diferencias entre los grupos, pues ni siquiera se aprecia una tendencia a verse mayores concentraciones de MDA en aquellos con alteraciones neurológicas contra quienes están libres de ellas. Otra situación a considerar es que aunque los radicales libres pueden estar aumentados, esto no explica necesariamente las alteraciones neurológicas presentadas en los individuos evaluados, es decir, que esta no sea la razón fisiopatológica. Es posible, entonces, que sea necesario considerar otras pruebas de laboratorio que reflejen mejor lo que ocurre en el SNC o continuar en la búsqueda de otros factores que expliquen la susceptibilidad individual a tener o no alteraciones neurológicas, como factores genéticos (42), autoinmunes (43) o ambientales (44). Otros consideran que los efectos neurológicos secundarios a la exposición del metal pueden estar más relacionados con el tiempo de exposición, ya que se han encontrado concentraciones altas de mercurio en el cerebro, glándulas endocrinas, riñón y otros tejidos en autopsias de personas que se dedicaron largo tiempo a la minería y que dejaron esta actividad durante varios años antes de morir, lo que sugiere la capacidad de acumulación que tiene este metal (45); sin embargo, la literatura al respecto es controvertida y otros estudios clínicos no han encontrado ninguna relación (46-47). Nuestro trabajo no encontró que el tiempo de exposición influyera sobre las manifestaciones neurológicas de los evaluados.
El estudio tiene varias limitaciones. Una de ellas es que no se pudo controlar una serie de factores que aumentaría la capacidad antioxidante (29-37), como la hipercolesterolemia (48), la diabetes mellitus (49-50) o la exposición a otros metales como el aluminio (56), el plomo (51, 55), el cobre (51, 55), el arsénico (55) y el cadmio (52, 55) porque no se tenía información en las historias clínicas consultadas. Otra limitación es que no se pudo determinar la concordancia inter-observador en la evaluación clínica debido a la característica retrospectiva del estudio; de todas maneras, en caso de presentarse algún error por esta causa, sería de tipo no diferencial, ya que la forma como se obtuvieron los datos fue igual para los individuos con alteraciones y sin alteraciones neurológicas y no se conocían las concentraciones de mercurio ni de MDA previo a la evaluación clínica.
Conclusión
En conclusión, nuestra investigación no pudo demostrar que las concentraciones de MDA fueran mayores en los individuos expuestos ocupacionalmente al mercurio con alteraciones neurológicas comparados con quienes no tienen estas alteraciones. Será necesario buscar otras muestras biológicas que reflejen lo que ocurre en el SNC o buscar otras explicaciones fisiopatológicas que expliquen la presencia de las manifestaciones clínicas en estos individuos.
Descargos de responsabilidad
El apoyo económico recibido para esta investigación fue brindado por el Departamento de Farmacología y Toxicología de la Facultad de Medicina de la Universidad de Antioquia. Los autores niegan tener conflictos de intereses.
Agradecimientos
Se agradece al grupo docente de la Maestría en Ciencias Clínicas de la Facultad de Medicina de la Universidad de Antioquia por sus valiosos aportes.
Bibliografía
1. Cock J, López W. Conflicto y colaboración en la minería de Segovia y Remedios. En: Buitelaar R. (comp). Aglomeraciones mineras y desarrollo local en América Latina. Bogotá: Alfaomega; 2002. p. 300-15. [ Links ]
2. Rojas M, Drake P, Roberts S. Assessing mercury health effects in gold workers near El Callao, Venezuela. J Occup Environ Med. 2001; 43(2):158-65. [ Links ]
3. Malm O. Gold mining as a source of mercury exposure in the brazilian Amazon. Environmental Research 1998; 77(2):73-8. [ Links ]
4. Palheta D, Taylor A. Mercury in environmental and biological samples from a gold mining area in the Amazon region of Brazil. The Science of the Total Environment 1995; 168:63-9. [ Links ]
5. Kom JF, Van Der Voet GB, Wolff F. A mercury exposure of maroon workers in the small scale gold mining in Suriname. Environ. Res. 1998; 77(2):91-7. [ Links ]
6. Tabares Z. Intoxicación por mercurio en el departamento de Antioquia 1998-2001. Revista Epidemiológica de Antioquia 2002; 27:25-37. [ Links ]
7. Programa de las Naciones Unidas para el Medio Ambiente. Evaluación mundial sobre el mercurio. Ginebra: Pnuma; 2002. p. 35-49. [ Links ]
8. ACGIH (American Conference of Governmental Industrial Hygienists). TLVs and BEIs Based on the Documentation of the Threshold Limit Values for Chemical Substances and Physical Agents & Biological Exposure Indices. Cincinati: ACGIH Worldwide Signature Publications; 2005. p. 93. [ Links ]
9. Kishi R, Doi R, Fukuchi Y, Satoh H, Satoh T, Ono A, Moriwaka F, Tashiro K, Takahata N, Sasatani H, Shirakashi H, Kamada T, Nakagawa K. Residual neurobehavioural effects associated with chronic exposure to mercury vapour. Occup.Environ. Med. 1994; 51:35-41. [ Links ]
10. Young-Jin Sue. Mercury. En: Flomenbaum NE, Goldfrank LR, Hoffman RS, Howland MA, Lewin NA, Nelson LS. En: Goldfrank's Toxicologic Emergencies. 8th Edition. New York: McGraw-Hill; 2006. p.1334-44. [ Links ]
11. Albers W, Kallenbach LR, Fine L, Langolf GD, Wolfe RA, Donofrio PD, Alessi AG, Stolp-Smith KA, and Bromberg MB. The mercury workers study group. Neurological abnormalities associated with remote occupational elemental mercury exposure. Ann Neurol. 1988; 24: 651-9. [ Links ]
12. Ellingsen DG, Morland T, Andersen A, and Kjuus H. Relation between exposure related indices and neurological and neurophysiological effects in workers previously exposed to mercury vapour. Br Ind Med. 1993; 50:736-44. [ Links ]
13. Echeverría D, Heyer NJ, Martin MD, Naleway CA, Woods JS, Bittner AC. Behavioral effects of lowlevel exposure to Hg ° among dentists. Neurotoxicol. Teratol. 1995; 17:161-8. [ Links ]
14. Megha F, Mehta A. Heavy metal induced oxidative stress and its possible reversal by chelation therapy. Indian J Med Res. 2008; 128:501-23. [ Links ]
15. Janero D. Malondialdehyde and thiobarbituric acid reactivity as diagnostic indices of lipid peroxidation and peroxidative tissue injury. Free Rad Biol Med. 1990; 9:515-40. [ Links ]
16. Lund BO, Miller DM, Wods JS. Studies on Hg (II)-induced H2O2 formation and oxidative stress in vivo and in vitro in rat kidney mitochondria. Biochem Pharmacol. 1993; 45:2017-24. [ Links ]
17. Mahboob M, Shireen KF, Atkinson A, Khan AT. Lipid peroxidation and antioxidant enzyme activity in different organs of mice exposed to low level of mercury. J Environ Sci Health B. 2001; 36:687-97. [ Links ]
18. Kobal A, Horvat M, Prezelj M, Sesek A, Krsnik M, Dizdarevic T, Mazej D, Falnoga I, StibiLj V, Arneric N, KobaL D Osredkar J. The impact of long-term past exposure to elemental mercury on antioxidative capacity and lipid peroxidation in mercury miners. Trace Elem Med Biol. 2004; 17 (4):261-74. [ Links ]
19. Villanueva VJ. Diagnóstico de los temblores. Revista de Posgrado de la Cátedra Vía de Medicina. 2001; 10:20-3. [ Links ]
20. Bain PG, Findley LJ, Atchison P, Behari M, Vidailhet M, Gresty M, Rothwell JC, Thompson PD, CD Marsden. Assessing tremor severity. J Neurol. Neurosurg. Psychiatry 1993; 56:858-73. [ Links ]
21. Louis ED, Wendt KJ, Albert SM, Pullman SL, Yu Q, Andrews H. Validity of a Performance-Based Test of Function in Essential Tremor. Arch Neurol. 1999; 56:841-46. [ Links ]
22. Folstein MF, Folstein SE, McHugh PR. Mini-Mental State: A practical method for grading the cognitive state of patients for the Clinician. J Psychiatr Res. 1975; 12:189-98. [ Links ]
23. López-Ibor Aliño JJ, y Valdés Miyar M. Trastornos del estado de ánimo. En: Miyar M Editores de la Edición Española de American Psychiatric Association. DSM IV TR. Manual Diagnóstico y Estadístico de los Trastornos Mentales Texto Revisado. Barcelona: Masson; 2002. p. 387-476. [ Links ]
24. Nanclares A, Jiménez A. Estudio de validación de la traducción al español de la Escala Atenas de Insomnio. Salud Mental. 2005; 28 (5):34-9. [ Links ]
25. Robbins D. Mercury in urine. En: Kneip TJ, Crable JV, edit. Methods for biological monitoring. A Manual for assessing human exposure to hazardous substances. Washington DC: APHA; 1988. p. 213-8. [ Links ]
26. Cianciola M, Echeverría D, Martin M, Aposian HV, Woods JS. Epidemiologic assessment of measures used to indicate low level exposure to mercury vapor (Hg°). Journal of Toxicology and Environmental Health. 1997; 52:19-33. [ Links ]
27. Estepa V, Ródenas S, Martin MC. Optimización de un método para la determinación de la peroxidación lipídica en suero humano. Anal Real Acad. Farm. 2001; 3:447-62. [ Links ]
28. Nina H, Cos P, Vanden Berghe D, Vietlinck, De Bruyne T. A method development and validation for monitoring in vivo oxidative stress: Evaluation of lipid peroxidation and fat-soluble vitamins status by HPLC in rat plasma. J Chromatogr B Analyt. Technol. Biomed. Life Sci. 2005; 822 (1-2):33-9. [ Links ]
29. Vahter M, Berglund M, Akesson A, Liden C. Environmental Research, Section A. 2002; 88:145-55. [ Links ]
30. Barregard L. Svalander C, Schütz A, Westberg G, Sállsten G, Blohmé I et al. Cadmium, mercury, and lead in kidney cortex of the general swedish population: a study of biopsies from living kidney donors. Environ Health Perspect. 1999; 107 (11):867-71. [ Links ]
31. Bates M. Mercury amalgam dental fillings: An epidemiologic assessment. Int. J Hyg. Environ. Health 2006; 209 (4):309-16. [ Links ]
32. Spiteller G. Lipid peroxidation in aging and age-dependent diseases. Exp. Gerontol. 2001; 36:1425-57. [ Links ]
33. Andryskowski G, Owczarek T. The evaluation of selected oxidative stress parameters in patients with hyperthyroidism. Pol. Arch. Med. Wewn. 2007; 117 (7):1-4. [ Links ]
34. Rajneesh CP, Manimaran A, Sasikala KR, Adaikappan P. Lipid peroxidation and antioxidant status in patients with breast cancer. Singapore Med J. 2008; 49 (8):640-3. [ Links ]
35. Bartsch H. Studies on biomarkers in cancer etiology and prevention: a summary and challenge of 20 years of interdisciplinary research. Mutat Res. 2000; 462:255-79. [ Links ]
36. Humad S, Zarling E, Clapper M, Skosey JL. Breath pentane excretion as a marker of disease activity in rheumatoid arthritis. Free Radic. Res. Commun. 1988; 5:101-6. [ Links ]
37. Andresen M, Regueira T, Bruhn A, Perez D, Strobel P, Dougnac A, Marshall G, Leighton F. Lipoperoxidation and protein oxidative damage exhibit different kinetics during septic shock. Mediators Inflamm. 2008; ID 168652:1-8. [ Links ]
38. Vendemiale G, Altomare E, Grattagliano I, Albano O. Journal of Hepatology 1989; 9 (3): 359-65. [ Links ]
39. Roig R, Cascón E, Arola L, Bladé C, Salvadó MJ. Effects of chronic wine and alcohol intake on glutathione and malondialdehyde levels in rats. Nutrition Research. 2000; 20 (11):1547-55. [ Links ]
40. Chia T, Hsu ChY, Chen HL. Oxidative damage of workers in secondary metal recovery plants affected by smoking status and joining the smelting work. Ind. Health. 2008; 46:174-82. [ Links ]
41. Arguelles S, García S, Maldonado M, Machado A, Ayala A. Do the serum oxidative stress biomarkers provide a reasonable index of the general oxidative stress status? Biochim. Biophys. Acta 2004; 1674:251-9. [ Links ]
42. Schláwicke Engstrõm K, Strõmberg U, Lundh T, Johansson I, Vessby B, Hallmans G, Skerfving S, Broberg K. Genetic variation in glutathione-related genes and body burden of methylmercury. Environ. Health Perspect. 2008; 116 (6):734-9. [ Links ]
43. Nielsen JB, Hultman P. Mercury-induced autoimmunity in mice. Environ. Health Perspect. 2008; 110 (5):877-81. [ Links ]
44. Abdelouahab N, Vanier C, Baldwin M, Garceau S, Lucotte M, Mergler D. Ecosystem matters: fish consumption, mercury intake and exposure among fluvial lake fish-eaters. Sci. Total Environ. 2008; 407 (1):154-64. [ Links ]
45. Fannoga I, Kregar I, Tusek-Znidaric M, Horvat M, Stegnar P. Mercury, selenium and cadmium in human autopsy samples from Idrija residents and Mercury Mine workers. Environ. Res. 2000; A84:211-8. [ Links ]
46. Rohling M and Demakis G. A meta-analysis of the neuropsychological effects of occupational exposure to mercury. Clin. Neuropsychol. 2006; 20:108-32. [ Links ]
47. Meyer-Baron M, Schaeper M, Seeher A. A meta-analysis for neurobehavioural results due to occupational mercury exposure. Arch Toxicol. 2002; 76:127-36. [ Links ]
48. Holvoet P, Collen D. Oxidation of low density lipoproteins in the pathogenesis of atherosclerosis. therosclerosis. 1998; 137 (Suppl 1):S33-S38. [ Links ]
49. Soliman GZA. Blood lipid peroxidation (superoxide dismutase, malondialdehyde, glutathione) levels in Egyptian type 2 diabetic patients. Singapore Med. J. 2008; 49 (2):129-36. [ Links ]
50. Kumar A, Kaundal RK, Iyer S, Sharma, SS. Effects of resveratrol on nerve functions, oxidative stress and DNA fragmentation in experimental diabetic neuropathy. Life Sci. 2007; 80:1236-44. [ Links ]
51. Aboul-Ela HM, Saad AA, El-Sikaily AMA, Zaghloul TI. Oxidative stress and DNA damage in relation to transition metals overload in Abu-Qir Bay, Egypt. Journal of Genetic Engineering and Biotechnology 2011; 9 (1):51-8. [ Links ]
52. Flora S, Mittal M, Mehta A. Heavy metal induced oxidative stress & its possible reversal by chelation therapy. Indian J Med. Res. 2008; 128:501-23. [ Links ]
53. Chatziargyriou V, Dailianis S. The role of selenium-dependent glutathione peroxidase (Se-GPx) against oxidative and genotoxic effects of mercury in haemocytes of mussel Mytilus galloprovincialis (Lmk). Toxicology in Vitro. 2010; 24:1363-72. [ Links ]
54. Zieminska E, Toczylowska B, Stafiej A, Lazarewicz JW. Low molecular weight thiols reduce thimerosal neurotoxicity in vitro: Modulation by proteins. Toxicology 2010; 276:154-63. [ Links ]
55. Jomova K, Valko M. Advances in metal-induced oxidative stress and human disease. Toxicology 2011; 283:65-87. [ Links ]
56. Belmonte Pereira L et al. Aluminum-induced oxidative stress in cucumber. Plant Physiol. Biochem. 2010; 48:683-9. [ Links ]