Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Ciencias de la Salud
versión impresa ISSN 1692-7273versión On-line ISSN 2145-4507
Rev. Cienc. Salud v.10 supl.1 Bogotá mar. 2012
Establecimiento de un sistema para el monitoreo y control de la contaminación cruzada en el laboratorio de análisis microbiológico de alimentos durante 2009
Establishment of a System for Monitoring and Control of Cross Contamination in the Laboratory of Microbiological Analysis of Food during 2009
Estabelecimento de um sistema para a monitoração e controle da contaminação cruzada no laboratório de análise microbiológico de alimentos durante 2009
Eduardo Javid Corpas Iguarán, Bac, Esp1
1 Grupo de Investigación y Desarrollo Tecnológico para el Sector Agroindustrial y Agroalimentario de la Universidad Católica de Manizales. Correspondencia: eduardocorpas@hotmail.com
Recibido: mayo 2 de 2011 • Aprobado: agosto 10 de 2011.
Para citar este artículo: Corpas EJ. Establecimiento de un sistema para el monitoreo y control de la contaminación cruzada en el laboratorio de análisis microbiológico de alimentos durante 2009. Rev. Cienc. Salud 2012; 10 (Especial): 53-67.
Resumen
Dentro de las actividades para el control de calidad en el laboratorio, los resultados finales de un analito en particular son considerados productos intermedios, dada la pertinencia otorgada al aseguramiento de la calidad como fin último de los programas de gestión de la calidad. Esta concepción precisa el establecimiento de instrumentos integrales para la detección de eventos como la contaminación cruzada y la adopción de medidas para evitar que se afecte la marcha analítica. Objetivo: el objetivo principal fue establecer un sistema para el monitoreo y control de la contaminación cruzada en el laboratorio de análisis microbiológico de alimentos. Materiales y métodos: la metodología empleada consistió en desarrollar diagramas de flujo para los procedimientos sobre el control de las poblaciones de mesófilos aerobios y mohos provenientes de la contaminación en los ambientes, superficies, material estéril y medios de cultivos. Dichos diagramas incluyeron un árbol de decisiones, diseñado para efectuar acciones de control con base en los intervalos de tolerancia, establecidos como herramienta objetiva hacia la toma de decisiones que normalicen los recuentos de las poblaciones microbianas en cuestión. Resultados: los límites de alerta más estrictos se obtuvieron para las poblaciones de mesófilos aerobios y mohos en los diferentes controles, excepto para el ambiente del área de preparación de medios y los correspondientes al material estéril. Conclusión: el proceso desarrollado permitió complementar el sistema de control de calidad interno en el laboratorio, al disponer de un medio objetivo para el cierre de no conformidades por contaminación cruzada.
Palabras clave: control de calidad, contaminación cruzada, mesófilos aerobios, mohos, análisis microbiológico de alimentos.
Abstract
Within the activities for quality control in the laboratory, the final results of a particular analyte are now recognized as intermediates, due to the relevance given to quality assurance, as the ultimate goal of programs for quality management. This concept makes it necessary to establishment of integral tools, to detect events such as cross-contamination, and measures to avoid affecting the analysis method. Objective: to established a system for monitoring and control of cross-contamination in the laboratory of microbiological analysis of food. Materials and methods: Flowcharts were developed to control the proceedings on the populations of aerobe mesophilics and molds originated from pollution in the environment, surfaces, sterile material and culture media, which included a decision tree designed to perform control actions based on tolerance intervals, which were established as objective tool to decision-making leading to normalize counts of microbial populations in question. Results: Warning limits stricter were obtained for aerobic mesophilic and mold populations in the different controls, except for environment of media preparation and the corresponding for sterile material. Conclusion: The process developed allowed to complement the system of internal quality control in the laboratory, to provide of an objective tool for closing nonconformities because of cross-contamination.
Keywords: quality control, cross contamination, aerobic mesophilics, molds, microbiological analysis of foods.
Resumo
Introdução: dentro das atividades para o controle de qualidade no laboratório, os resultados finais de um analito em particular são considerados produtos intermédios, dada a pertinência outorgada à asseguração da qualidade como fim último dos programas de gestão de qualidade. Esta concepção precisa o estabelecimento de instrumentos integrais para a detecção de eventos como a contaminação cruzada e a adoção de medidas para evitar que se afete a marcha analítica. Objetivo: o objetivo principal foi estabelecer um sistema para a monitoração e controle da contaminação cruzada no laboratório de análise microbiológico de alimentos. Metodologia: a metodologia empregada consistiu em desenvolver diagramas de fluxo para os procedimentos sobre o controle das populações de mesófilos aeróbios e mofos provenientes da contaminação nos ambientes, superfícies, material estéril e meios de cultivos. Estes diagramas incluíram uma árvore de decisões, criado para efetuar ações de controle com base nos intervalos de tolerância, estabelecidos como ferramenta objetiva para a tomada de decisões que normalizem os recontos das populações microbianas em questão. Resultados: os limites de alerta mais estritos se obtiveram para as populações de mesófilos aeróbios e mofos nos diferentes controles, exceto para o ambiente da área de preparação de meios e os correspondentes ao material estéril. Conclusão: o processo desenvolvido permitiu complementar o sistema de controle de qualidade interno no laboratório, ao dispor de um meio objetivo para o fecho de não conformidades por contaminação cruzada.
Palavras chave: controle de qualidade, contaminação cruzada, mesófilos aeróbios, mofos, análise microbiológico de alimentos.
Introducción
El control de calidad en el laboratorio de análisis microbiológico de alimentos constituye un instrumento primordial dentro de los programas que pretenden asegurar la calidad de los ensayos efectuados para lograr resultados cercanos al valor real (el valor verdadero de un analito no existe como realidad absoluta debido a la existencia de error alguno en la medición misma), que a su vez soporten de manera confiable el control de calidad microbiológico en las empresas productoras de alimentos. En Colombia existe una legislación que reglamenta los requisitos de funcionamiento para los laboratorios de control de calidad en alimentos (1) con especificaciones mínimas, descontextualizadas de la actual concepción, en la cual los resultados finales de un analito en particular son considerados productos intermedios, dada la pertinencia otorgada al aseguramiento de la calidad como fin último de los programas de gestión de la calidad, arista de competitividad que finalmente habrá de convertirse en una política de supervivencia en la transición desde la antigua premisa que privilegió el volumen productivo en función del tiempo hacia la confiabilidad dentro de un proceso analítico en particular.
Desde el surgimiento de las Buenas Prácticas de Laboratorio (BPL) en la década del setenta, instituidas como un conjunto de requisitos científicos y técnicos de soporte al aseguramiento de los procesos (2), la calidad se ha convertido en una política de empresa y representa uno de los factores estratégicos de éxito (3) frente al reto que implican las exigencias en legislaciones como la norma ISO/IEC 17025, como base técnico-metodológica para la acreditación de los laboratorios que realizan análisis microbiológicos (4). Este contexto ha favorecido la común aplicación de Procedimientos Normalizados de Operación (PNO), en especial para el uso de medios de cultivo, limpieza y esterilización de cristalería, uso y control del agua para análisis, entre otros (5), así como el establecimiento de procedimientos para estimar la incertidumbre de las mediciones generadas en los ensayos (6) y brindar garantías a las empresas productoras de alimentos, para quienes los laboratorios de análisis de alimentos constituyen una herramienta esencial dentro de los programas de control de la inocuidad (7).
El control de calidad en el laboratorio de microbiología se relaciona con el monitoreo de los medios de cultivo, de los reactivos, de los instrumentos, de los procedimientos y del personal (8) y su tarea primordial es garantizar el suministro de información reproducible y segura que soporte la confiabilidad de los resultados analíticos (9-10), de manera que en el control interno se detecten desviaciones en las temperaturas de incubación y problemas con la calidad en la elaboración de los medios de cultivos, entre otras (11). Esta tarea se complementa con programas de evaluación externa de la calidad que permiten esencialmente evaluar la reproducibilidad analítica del laboratorio (12). Además, las actividades de control de calidad interno en el laboratorio de análisis microbiológico deben enfocarse tanto hacia el soslaye de variaciones relacionadas con el funcionamiento de equipos o con descuidos humanos, como hacia la generación de estrategias de seguimiento y control frente a las desviaciones de origen microbiológico relacionadas con procesos de contaminación cruzada, teniendo en cuenta que estos eventos pueden afectar la confiabilidad de los resultados analíticos.
La veracidad del resultado analítico puede declararse con un alto grado de confianza cuando se utilizan mecanismos eficaces de control (13); por eso, un aspecto importante dentro del control de calidad interno y externo es la trazabilidad o conocimiento histórico dentro de los procesos para ejercer control, seguimiento y toma de medidas preventivas y correctivas (14). De esta manera, se pueden establecer orígenes y consecuencias por medio del seguimiento de una cadena ininterrumpida de comparaciones reales (15). Hilado a lo anterior, el control sobre la contaminación de origen microbiológico en el laboratorio trasciende su concepción como medio de detección de anormalidades incidentes en el proceso, hasta convertirse en un soporte de la trazabilidad como garante de la inexistencia de condiciones anormales, factor principal en los casos donde el cliente efectúa solicitudes denominadas "no conformidades" en torno a un resultado en particular.
En el presente estudio se estableció un sistema para el monitoreo y control de la contaminación cruzada en el laboratorio de análisis microbiológico de alimentos, por medio del desarrollo de diagramas de flujo para los procedimientos sobre el control de las poblaciones de mesófilos aerobios y mohos provenientes de la contaminación en los ambientes, superficies, material estéril (cajas y pipetas) y medios de cultivos. Dichos diagramas incluyeron un árbol de decisiones, diseñado para efectuar acciones de control con base en los intervalos de tolerancia establecidos como herramienta objetiva hacia la toma de decisiones que normalicen los recuentos de las poblaciones microbianas en cuestión.
El material estéril incluido dentro del estudio está representado por cajas de Petri y pipetas. Es importante aclarar que actualmente ese tipo de materiales fabricados en vidrio ha caído en desuso, así como el empleo de hornos de esterilización, que ha sido reemplazado por ciclos autoclavado, fundamentados en la aplicación de calor húmedo a determinadas presiones, por lo cual los procedimientos aquí tipificados pueden ser aplicados a pipetas y a cajas de Petri de otro tipo de material, siempre y cuando sean autoclavables. Cabe anotar que la confiabilidad de los resultados también depende de aspectos como el monitoreo ejercido mediante la detección de fallas sistemáticas por medio del control externo (las cuales no son susceptibles de identificar por el control interno), de la aplicación correcta de los procedimientos y de la calibración de los instrumentos de medición, por lo cual la estrategia planteada asume el carácter de complementariedad dentro del control y aseguramiento de la calidad en el laboratorio de análisis microbiológico de alimentos.
Materiales y métodos
Tipo de estudio: fue un estudio descriptivo, de modelo procedimental, realizado durante 2009. Se diseñó y aplicó una metodología para delinear los procedimientos de control de calidad en el laboratorio y establecer intervalos de tolerancia que constituyan un criterio objetivo para detectar el desvío de condiciones normales y así activar el árbol de decisiones que permita cerrar la no conformidad microbiológica.Población y muestra: la población correspondió a los análisis microbiológicos para el recuento de mesófilos aerobios (RMA) y recuento de mohos (RM) dentro del control sobre la desinfección de ambientes, superficies, control sobre esterilidad de medios de cultivo y control sobre la esterilidad del material estéril. La muestra correspondió a la toma de veinte datos para cada una de las poblaciones dentro de los respectivos controles ( Ver Figura 1).
Fundamento de la utilización de los intervalos de tolerancia para el control microbiológico: la mayoría de los estadísticos muestrales proporciona estimaciones de los parámetros poblacionales, aunque tales estimaciones no son necesariamente correctas (16). En algunos casos, existe menos interés por las estimaciones poblacionales y más preocupación por las mediciones individuales para la toma de decisiones, lo que amerita determinar los límites que en sentido probabilístico cubren los valores individuales de la población mediante un intervalo de confianza sobre una proporción fija de las mediciones (17). A esto se denomina intervalo de tolerancia y se considera exacta la cobertura de 95% de las observaciones medidas. Considerando que en la práctica µ; y σ rara vez se conocen, se debe aplicar X +/- ks, donde k es determinada de modo que se pueda asegurar con una confianza de 100 (1- δ)% que los límites dados contienen al menos la proporción 1-α de las mediciones (18). Se debe tener en cuenta que si un intervalo tiene un coeficiente igual a 0,95, decimos que su coeficiente es de 95%. Si el coeficiente es 0,99, decimos que el intervalo corresponde a 99% (19).
La utilización de intervalos de tolerancia se propugna bajo el criterio de considerar el tamaño de la muestra, la confiabilidad y la variabilidad de los datos, lo que implica una ventaja frente a los límites establecidos a partir de la desviación estándar, en cuyo proceso únicamente se considera la variabilidad de los datos (17). El número de muestras utilizado (veinte unidades de muestra para cada ambiente, superficie, esterilidad del material y medios de cultivo) obedece a que en los intervalos de tolerancia se establecen límites para observaciones individuales futuras, en cuyo caso no se requiere un número específico de mediciones, puesto que para cada n existe un factor de tolerancia dentro de la distribución normal, a un nivel de confiabilidad definido (en este caso de 95%) que, al multiplicarse por la desviación estándar, da como resultado el límite de tolerancia de su respectiva población. No obstante, el establecimiento de límites de tolerancia para una población determinada, tiene como requisito inapelable que las distribuciones muestrales sean normales (17).
En el análisis de los resultados se demostró la normalidad de la muestra y se pudo comprobar la existencia de condiciones de representatividad, ya que las desviaciones estándar en los ensayos realizados fueron menores a 1,5, demostrando la homogeneidad de los datos. Esta condición fue favorecida, además, por el sometimiento de los datos a la herramienta de eliminación de datos atípicos basada en el cálculo de la mediana. La condición de representatividad, ligada a la homogeneidad de la muestra, no solo es requerida como criterio de confiabilidad, sino que se considera determinante en el proceso concreto de establecimiento de intervalos de tolerancia, puesto que, cuando existen datos heterogéneos, los límites tienden a ser significativamente laxos y por consiguiente decrece su rigurosidad.
Eliminación de datos atípicos basado en el cálculo de la mediana: la aplicación de intervalos de tolerancia implicó la aplicación de procedimientos estadísticos para la eliminación de datos atípicos, cuya inclusión podría derivar en la desviación de los valores de tendencia central y dispersión, como las medias y desviaciones estándar (20). Una regla para la detección de valores atípicos está dada por señalar como datos atípicos aquellos que cumplan la siguiente condición:
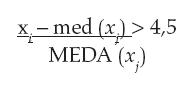
Donde med ( xi ) es la mediana de las observaciones y MEDA ( xj ) es la mediana de las desviaciones absolutas con respecto a la mediana (20).
Procedimiento utilizado en el establecimiento del sistema para el monitoreo y control de la contaminación cruzada en el laboratorio de análisis microbiológico de alimentos: el establecimiento de un sistema de control fue concebido mediante la articulación de dos etapas. En principio se desarrollaron diagramas de procedimiento en los cuales se incluían el análisis de datos y un árbol de decisiones diseñado para efectuar acciones de control con base en los intervalos de tolerancia establecidos. Este sistema se aplicaría a partir de las actividades de control microbiológico interno que forman parte del diario vivir del laboratorio de análisis microbiológico de alimentos, es decir, cada vez que se realicen análisis de los ambientes, superficies, esterilidad del material y esterilidad de los medios de cultivo (Plate Count y YGC), los resultados serán comparados con los intervalos de tolerancia establecidos y su sobrepaso implicará el aborde del árbol de decisiones con el propósito de cerrar la no conformidad microbiológica y garantizar la minimización del riesgo de aparición de eventos de contaminación cruzada durante la marcha analítica.
Desarrollo de diagramas de flujo y árbol de decisiones: con base en los procedimientos del control de la contaminación microbiológica se desarrollaron diagramas de flujo para sintetizar tales actividades, con el fin de que pudiesen constituir una guía práctica de trabajo. Hilado a ello, se desarrolló un árbol de decisiones activable desde el sobrepaso de los intervalos de tolerancia establecidos para las poblaciones de mesófilos aerobios y mohos en cada control microbiológico (ambientes, superficies, material estéril y medios de cultivo). El árbol de decisiones ha sido desarrollado a partir de la detección, análisis, toma de acciones correctivas y documentación de los eventos durante los cuales las poblaciones estudiadas estuvieron significativamente por encima del nivel acostumbrado (variaciones apreciables no comprobadas, pues en este momento no se habían establecido los intervalos) en el laboratorio de análisis microbiológico de alimentos durante el período 2008-2009. Es importante aclarar que, en la medida de desarrollarse variaciones de orden físico, procedimentales o de flujo de procesos en el laboratorio de microbiología, se deberán efectuar los ajustes al diagrama de síntesis y al árbol de decisiones, sin olvidar que estas variaciones implicarían eventos de desviación de los intervalos diferentes a los establecidos y, debido a su origen sui géneris a las causas tradicionales, podrían no haber sido considerados en el diagrama actual.
El establecimiento de un diagrama de flujo y de un árbol de decisiones instaurado en el laboratorio de microbiología pretende ser una guía de trabajo dentro del control de calidad microbiológico, al contemplar una estructura objetiva para la toma de decisiones provenientes del seguimiento a las desviaciones previas; sin embargo, este sistema puede considerarse dinámico en la medida en que se contemplen otras posibles causas, denominadas atípicas por la condición inaudita de su aparición como raíz del desvío, en los casos subsecuentes de desviación de los intervalos.
Establecimiento de intervalos de tolerancia: los intervalos de tolerancia se instauraron con el fin de determinar los límites para la adopción de medidas que pudiesen mantener el control sobre los eventos subsecuentes de contaminación microbiológica. Para el establecimiento de intervalos de tolerancia:
-
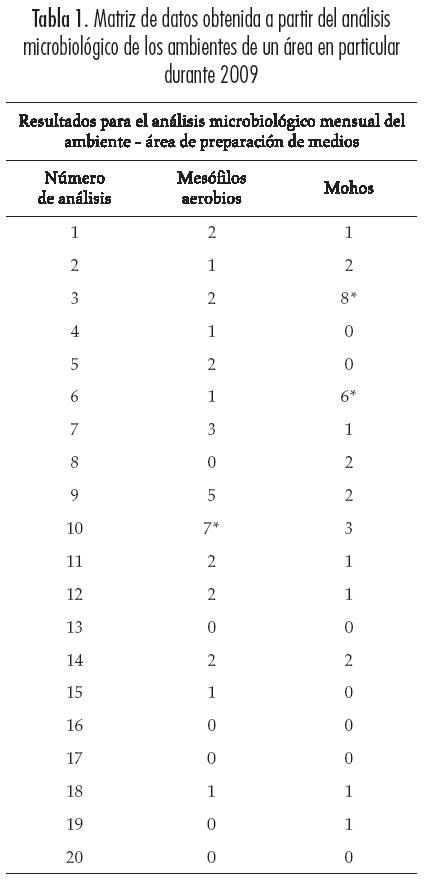
Se realizaron veinte análisis microbiológicos para el recuento de las poblaciones de mesófilos aerobios y mohos en los controles establecidos ver (Tabla 1).
-
Se organizaron los datos en un cuadro y se convirtieron en la matriz que alimentó el procesamiento estadístico de los datos.
-
Se efectuó la prueba estadística de eliminación de datos atípicos basado en el cálculo de la mediana a los veinte datos analíticos de cada control para que no se afectara la variabilidad de los datos, eliminando todos aquellos que, al aplicar la respectiva fórmula, arrojaron un valor mayor a 4,5.
-
Se establecieron las medidas de tendencia central y dispersión: promedio y desviación estándar, indispensables para establecer los límites de alerta (cuyo sobrepaso implique la activación de acciones de control).
-
Con ayuda de las medidas de tendencia central y dispersión se establecieron los límites de alerta para ambientes, superficies y manos de operarios, mediante la fórmula:
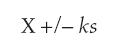
Donde
X = media muestral.
k = constante que tiene en cuenta el número de muestra y el nivel de confiabilidad. s = desviación estándar corregida (21).
-
Para hallar la constante k, se utilizaron los valores de la tabla estadística de factores de tolerancia para distribuciones normales, considerando el número de muestras y el nivel de confianza (18). La constante seleccionada en la tabla de factores de tolerancia para distribuciones normales concierne al número de datos (veinte) con un nivel de confianza de 95%, correspondiente a un valor de 2.752 utilizado para el límite de alerta.
-
Para finalizar, se organizaron los datos de límites de alerta y acción en una tabla, como soporte guía del laboratorio para la interpretación de los futuros resultados analíticos microbiológicos en los controles analizados.
Resultados
Diagramas de flujo y árboles de decisiones: las (Figuras 2, 3, 4, 5) muestran los diagramas de flujo para el control de la contaminación de origen microbiológico en ambientes, superficies, material estéril y medios de cultivo respectivamente. Para su elaboración se empleó el sistema internacional de símbolos y se asignaron los números 1-4 para indicar de manera consecutiva el nuevo recorrido a seguir, es decir, si dentro de la ruta se llega al número 1 en el diagrama de flujo correspondiente a la Figuras 2, la indicación a seguir es el inicio del proceso de control microbiológico del ambiente.
El desarrollo de los diagramas de flujo implicó el análisis del historial de seguimientos en torno a eventos de contaminación reconocidos en el laboratorio y consignados en los respectivos registros de control microbiológico, razón por la cual las rutas privilegiadas en cada diagrama de flujo correspondieron a las causas de eventos de contaminación de mayor prevalencia, demostradas por dicho historial.
Intervalos de tolerancia microbiológicos
Establecimiento de la matriz de datos: la Tabla 1 muestra los análisis microbiológicos del ambiente del área para preparación de medios con respecto a los parámetros de recuento de mesófilos aerobios y de mohos.
Se realizaron controles para tres ambientes, tres superficies, dos tipos de vidriería (cajas y pipetas) y dos tipos de medios de cultivo; sin embargo, a manera de ilustración, en el presente artículo solo se muestra una matriz de los datos obtenidos a partir del análisis microbiológico de un ambiente en particular (ver Tabla 1). Se pueden apreciar los datos atípicos (números seguidos de asterisco) detectados con base en la respectiva fórmula y reemplazados con análisis subsecuentes.
Establecimiento de medidas de tendencia central y dispersión: en general se pudo apreciar homogeneidad en los datos obtenidos. En los análisis de ambiente hubo recuentos similares, entre 1 y 2 UFC para los mesófilos aerobios y entre 1 y 3 UFC para los mohos y la mayor desviación estándar fue de 1,4 para el recuento de mohos en el área de lectura. Por otra parte, los promedios obtenidos en el recuento de mesófilos para todas las superficies fueron de 0,9; para el recuento de mohos, los promedios fluctuaron entre 0,7 y 1,0 y las desviaciones estándar fueron mayores en las poblaciones de mohos provenientes de las superficies monitoreadas. En cuanto a los análisis de esterilidad del material estéril, se obtuvieron menores promedios y menores desviaciones estándar en las poblaciones de mohos, tanto en los análisis realizados a pipetas como en los efectuados a las cajas de Petri. Además, al analizar la esterilidad de los medios de cultivo destinados al monitoreo de mesófilos aerobios y mohos en alimentos, se obtuvieron promedios y desviaciones similares para ambos, producto de recuentos que en general no superaron 1 UFC en ambas poblaciones microbianas. A partir de los controles de esterilidad del material estéril y de medios de cultivo se obtuvieron menores desviaciones estándar.
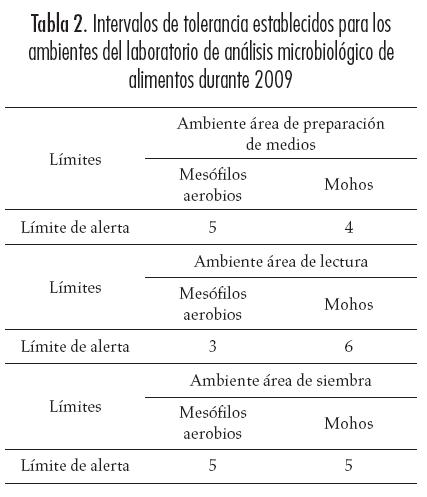
Establecimiento de medidas de establecimiento de los intervalos de tolerancia: las Tablas 2, 3, 4 y 5 muestran los límites de alerta desarrollados con base en el procesamiento estadístico de los datos obtenidos del análisis de veinte controles para las poblaciones de mesófilos aerobios y mohos en ambientes, superficies, material estéril y medios de cultivo. Se obtuvieron límites estrictos para las poblaciones de mesófilos aerobios y mohos en todos los controles realizados, sobre todo en los correspondientes al material estéril y a los medios de cultivo, condición que deriva en tener rangos significativamente susceptibles a las desviaciones de las poblaciones de interés y, por consiguiente, un apoyo más eficaz sobre el control de los eventos de contaminación cruzada de origen microbiológico.
Los tres ambientes analizados presentaron menos de 15% de datos atípicos, tanto para la población de mesófilos aerobios como para las poblaciones de mohos, destacándose el área de siembra, que no tuvo desvíos. Este hallazgo es razonable, si se tiene en cuenta que es un área de mayor nivel de esterilidad y, por su disposición y hermeticidad, la posibilidad de ingreso de microorganismos de manera cruzada mediante corrientes de aire es limitada, lo que la hace menos susceptible a desviaciones en ambas poblaciones. A pesar de esto, los intervalos establecidos en los ambientes fueron similares para cada una de las poblaciones monitoreadas (Ver Tabla 2); el laboratorio maneja intervalos homogéneos para las poblaciones de microorganismos, que se afectan en ocasiones por causa de eventos puntuales y poco comunes de contaminación. En cuanto a las superficies, no se presentaron datos atípicos en el proceso, por lo cual se plantea la correcta ejecución de las actividades de limpieza y desinfección; así que para las superficies monitoreadas el intervalo correspondió a un recuento idéntico de 3 UFC para la población de mesófilos y entre 3 y 5 UFC para la población de mohos (ver Tabla 3). Esta condición implica la posibilidad de considerar una menor periodicidad en los controles correspondientes, dada la limitada frecuencia de aparición de eventos de desvío de las poblaciones monitoreadas.
Tal como ocurrió con los análisis de superficie establecidos, para el caso del material estéril tampoco se generaron datos atípicos producto de eventos de contaminación; además, las cajas y pipetas tuvieron menores recuentos de mesófilos aerobios y mohos, por lo que se generó un recuento máximo de 3 UFC para los mesófilos aerobios y de 2 UFC para los mohos (ver Tabla 4). Esto sucedió también para el caso de la esterilidad de medios, cuyo máximo recuento fue de 2 UFC para los mesófilos desarrollados en Plate Count como para los mohos desarrollados en YGC (ver Tabla 5). Estos hallazgos indican la aplicación correcta de los procesos de esterilización respectivos y, al igual que para las superficies, los controles del material estéril y de medios de cultivo pueden tener una periodicidad limitada fundamentada en que no se generaron datos atípicos durante el proceso.
Una de las derivaciones principales producto del estudio es la necesidad imperante de ejercer mayor control sobre las condiciones ambientales, puesto que solo se encontraron datos atípicos para el recuento de mohos en los ambientes sometidos al proceso en cuestión. Si se sabe que los microorganismos utilizan el ambiente como un vehículo de diseminación, es pertinente que se generen estrategias en el laboratorio tendientes a minimizar la ocurrencia de dicho evento; entre las más importantes está el uso de sistemas de filtrado que toman el aire del ambiente y lo devuelven a este después de pasarlo por filtros que retienen bacterias, cuyo diámetro de porosidad es menor a 0,45 mm. Además, es importante revalidar el procedimiento de nebulización de ambientes, poniendo especial atención a la periodicidad, rotación y choque desinfectante, así como al uso de un nebulizador apropiado que genere microgotas de baja densidad que puedan estar en el ambiente durante el tiempo pertinente para hacer contacto letal con el microorganismo. Estas estrategias deben ser complementadas con la verificación de las prácticas mínimas requeridas inherentes al ambiente, como el mantenimiento de condiciones de hermeticidad en las áreas; el uso de sistemas extractores para evitar la generación de humedad en el ambiente; el monitoreo de la humedad relativa del laboratorio; el uso de deshumidificadores, entre otras. La integración de dichas estrategias redundará en la reducción de controles microbiológicos de mohos en ambientes con recuentos superiores a los límites establecidos.
Por otra parte, en los análisis de ambientes y superficies se evidenció una tendencia de recuento mayor para las poblaciones de mohos en comparación con los mesófilos aerobios, lo cual puede obedecer a que las poblaciones de mohos, en su mayoría, suelen sobrevivir en circunstancias limitadas en cuanto a nutrientes y a condiciones ambientales, de manera que cuando estas condiciones mejoran, tienden a aflorar en mayor medida que algunos mesófilos del ambiente; además, la mayoría de agentes de desinfección disponibles en el mercado para la desinfección de ambientes y superficies ejercen un efecto bactericida, aunque su accionar frente a mohos es limitado. En ambos casos (ambientes y superficies) los análisis fueron efectuados después de los procesos de limpieza y desinfección con un desinfectante cuyo principio activo corresponde a una biguanidina polimérica, por lo cual sería pertinente validar el tipo y concentración del desinfectante utilizado, para verificar si su accionar antifúngico es el apropiado o, en caso contrario, utilizar otro desinfectante de acción letal para mohos disponible en el mercado, como los basados en amonios cuaternarios.
Los procesos de soporte a los programas de calidad en el laboratorio de análisis microbiológico de alimento han contemplado la aplicación e interacción de los conceptos de gestión, control, mejoramiento y aseguramiento de la calidad para la generación del criterio de calidad total, consideración locuaz y, si se quiere, efímera, por cuanto la adopción misma del modelo analítico implica la coexistencia con el paradigma "incertidumbre"; pero este mismo concepto soporta la necesidad reduccionista hacia el factor error, so pretexto del establecimiento de sistemas confluentes e interdependientes que deriven en la confiabilidad de los resultados analíticos. El establecimiento de un sistema para el monitoreo y control de la contaminación cruzada implica la complementariedad entre controles de diferente tipo; en este caso, se estableció como directriz el control sobre la contaminación cruzada de origen microbiológico por medio de ambientes, superficies, material estéril y medios de cultivo, aunque el sistema requiere de la complementariedad con otros dedicados al control sobre la correcta ejecución de los procesos analíticos; de la verificación y control sobre el funcionamiento de equipos; de la validación de las diferentes técnicas; del establecimiento de la incertidumbre del método; de la detección y control de fallas sistemáticas mediante control externo, entre otras.
Conclusiones
El desarrollo de diagramas de flujo de los procedimientos de control de calidad permitió establecer un mecanismo para la toma de decisiones a partir de los intervalos de tolerancia establecidos, así como complementar el sistema de control de calidad interno en el laboratorio, direccionado inicialmente hacia la verificación del funcionamiento de equipos.
La instauración de intervalos de tolerancia en el laboratorio de análisis microbiológico de alimentos fue establecido en los controles planteados, obteniéndose los límites más estrictos para los correspondientes a material estéril y medios de cultivo en las poblaciones de mesófilos aerobios y mohos.
Se obtuvieron límites de alerta más estrictos para las poblaciones de mesófilos aerobios en los diferentes controles, excepto para el ambiente del área de preparación de medios y los correspondientes a la esterilidad del material estéril.
El árbol de decisiones desarrollado permitió que el laboratorio dispusiera de un instrumento objetivo para la interpretación de los resultados de cada análisis puntual de las poblaciones de RMA y RM, que se realiza de manera periódica en el laboratorio de análisis microbiológico.
Descargos de responsabilidad
No hubo conflicto de intereses en la elaboración de este artículo.
Bibliografía
1. Instituto Nacional de Vigilancia de Medicamentos y Alimentos INVIMA. Resolución número 16078. Por la cual se reglamentan los requisitos de funcionamiento de los Laboratorios de Control de Calidad de Alimentos. Instituto Nacional de Vigilancia de Medicamentos y Alimentos; 1985. [Consultado el 24 de agosto de 2009]. Disponible en: http://web.invima.gov.co/portal/documents/portal/documents/root//resolucion_16078_1985.pdf [ Links ]
2. Dybkaer R. Quality assurance, accreditation and certification needs and possibilities. Clinical and Chemical 1994; 40 (7):1416-20. [ Links ]
3. Valdés O, Luna M, Aramillo J, García C, Cisneros E. Gestión de la calidad en los servicios especializados en nutrición e higiene de los alimentos. RCAN 1998; 12 (1):64-70. [Consultado el 24 de agosto de 2009]. Disponible en: http://www.bvs.sld.cu/revistas/ali/vol12_1_98/ali14198.pdf [ Links ]
4. Instituto Nacional de Salud. Guía para la acreditación de laboratorios que realizan análisis microbiológicos. G-ENAC-04; 1998(2). [Consultado el 26 de agosto de 2009]. Disponible en: http://www.insgob.pe/insvirtual/images/normatividad/norref/g-enac-04rev.pdf. [ Links ]
5. Soto I, Cobo M, Perdigón O, Reyes D, Hunt M. Control de la calidad de los medios de cultivos en microbiología sanitaria. Facultad de Ciencias Médicas. Centro Provincial de Higiene y Epidemiologia; 1992. [Consultado el 29 de septiembre de 2009]. Disponible en: http://www.bvs.sld.cu/revistas/mciego/vol7_01_01/articulos/a4_v7_0101.html. [ Links ]
6. Sardinas O, Hernández M. Aseguramiento de la calidad en un laboratorio acreditado del Instituto Nacional de Higiene, Epidemiología y Microbiología. RCHE 2002. 40 (1):16-9. [ Links ]
7. Leotta G. Métodos rápidos: una herramienta útil y práctica para el análisis microbiológico de los alimentos. RAM; 2009. 41 (2):63-4. [ Links ]
8. Herrera M, Campos M. Control de la calidad para un laboratorio de microbiología. Rev. Méd. Hosp. Nac. Niños 2005. 40 (1):9-15. [ Links ]
9. Gutiérrez J, Fernández F, Soto M, Maroto M. Control de calidad interno del inmunodiagnóstico microbiano para conseguir la calidad global. Departamento de Microbiología del Hospital Universitario San Cecilio; 2001. Universidad de Granada (España). [Consultado el 29 de septiembre de 2009]. Disponible en: http://www.ugr.es/~cts521/documentos/Gutier-Enf.Inf.MicrClin19.pdf [ Links ]
10. Vargas M, Schosinsky K. Aplicación del método gráfico de levey-jenning a los datos de un control de calidad externo en química clínica. RCCM 1986. 7 (4):315-321. [ Links ]
11. Peterz M. Quality assurance and quality control in food microbiology laboratories. Swedish University of Agricultural Sciences. Sweden: Uppsala; 1992. [ Links ]
12. Zárate M, Dadamio J, Giordanelli A, Smayevsky J, Torres M. Desarrollo y evaluación de una muestra para control de calidad en Microbiología. Acta bioquím. clín. Latinoam 2007. 41 (1):57-61. [ Links ]
13. Pullés M, Mayarí R, Martínez V. Criterios para la acreditación de laboratorios que realizan ensayos microbiológicos según NC-ISO/IEC 17025. CENIC Ciencias Biológicas 2006. 37 (1):9-12. [ Links ]
14. Costa E, Llorens V, Planes M, Usall J. Implementación de un Sistema HACCP en una central frutícola. Revista Horticultura Internacional 2009. [Consultado el 26 de agosto de 2009]. Disponible en: www.horticom.com/pd/imagenes/55/446/55446.pdf [ Links ]
15. Ciencia y Tecnología para el Desarrollo CYTED. Aspectos prácticos de la validación e incertidumbre en medidas químicas. Red Iberoamericana de Laboratorios de Calidad de Aguas Área Desarrollo Sostenible; 2009. [Consultado el 6 de octubre de 2009]. Disponible en: http://kerwa.ucr.ac.cr/handle/10669/330 [ Links ]
16. Freeman L. Elementos de estadística aplicada. España: Euroamérica; 1971. [ Links ]
17. Corpas E. Procedimiento para el establecimiento de intervalos de tolerancia a partir del análisis microbiológico de ambientes, superficies y manos de operarios en empresas del sector agroalimentario. Revista de Investigaciones U.C.M 2009; 13 (1):157-63. [ Links ]
18. Walpole R, Myers R, Myers S. Probabilidad y estadística para ingenieros. 6ta ed. México: Prentice-Hall Hispanoamericana; 1998. [ Links ]
19. Mendenhall W, Sincich T. Probabilidad y estadística para ingenierías y ciencias. 4ta ed. México: Prentice Hall Hispanoamérica; 1997. [ Links ]
20. Daza G, Suárez J, Castellanos G. Preproceso de datos en bioseñales: una aplicación en detección de patologías de voz. Revista ingeniería e investigación 2009. [Consultado el 25 de febrero de 2010]. Disponible en: http://www.revistaingenieria.unal.edu.co/Resumenes/29_3/15_861.pdf [ Links ]
21. Montgomery D, Runger G. Probabilidad y estadística. 2da ed. México: Mc Graw Hill; 1997. [ Links ]