Introducción
Durante el embarazo, normalmente se experimenta una disminución de la sensibilidad a la insulina, que, de manera progresiva, se acrecienta y se hace más evidente en el segundo trimestre de embarazo. En mujeres que no logran compensar este aumento de la resistencia a la insulina propia del embarazo, aparece la Diabetes Mellitus Gestacional (DMG) 1,3.
La DMG es una alteración del metabolismo de los Hidratos de Carbono (HC), de severidad variable, que se inicia o se reconoce por primera vez durante la gestación, independientemente que requiera insulina para su control o que persista después de la terminación del embarazo 3,5.
Para el diagnóstico se realiza una prueba oral de tolerancia a la glucosa (POTG) entre las 24-28 semanas de gestación, con 50 g de glucosa oral. En caso de detección de DMG, se debe intervenir con tratamiento adecuado a cada caso, con el objetivo de lograr y mantener los valores normales de glucosa y de HbA1c 6,7. Se debe tener en cuenta que las mujeres con DMG tienen mayor riesgo de desarrollar diabetes (DM) en el futuro 8,9.
Actualmente, entre un 4 % y 8 % de embarazadas se encuentran afectadas con DMG en países desarrollados 10,11. Cambios en los patrones de alimentación, el sobrepeso, la obesidad y el aumento del sedentarismo han hecho que aumente la incidencia de la DMG 12,13.
El principal objetivo del tratamiento en DMG es el control de la glucemia materna, ya que el control glucémico reduce la morbilidad y mortalidad materno-fetal a concentraciones cercanas a embarazos sin DMG 14,15.
Se debe evitar un tratamiento intenso que cause hipoglucemia, lo que ocurre hasta en el 60 % de las pacientes, en muchos casos asintomática para la madre, pero con diversas repercusiones para el feto. Las bases del tratamiento continúan siendo la dieta controlada en HC, de preferencia con índice glucémico bajo; la actividad física adaptada a la fisiología materna de acuerdo con la edad gestacional y la administración de insulina en los casos en que sea necesario para lograr los objetivos. Las metas del plan de alimentación son: mantener glucemia plasmática en ayunas < 100 mg/dl, glucemia prandial en 120 y valores de HbAc<6% 16,17.
El objetivo de esta revisión es identificar y analizar estudios sobre distintos tipos de intervenciones nutricionales para el tratamiento de DMG, principalmente en cuanto a la composición en macronutrimentos (HC, proteínas y grasas), además de analizar la metodología y características de cada investigación.
Materiales y métodos
Teniendo como objetivo analizar por medio de ensayos clínicos, realizados a nivel mundial, el efecto de diversos tipos de dietas en mujeres con DMG y el efecto sobre sus niveles de glucosa en sangre, se buscó responder a la siguiente pregunta: ¿cuál es la intervención nutricional más favorable para el tratamiento de la DMG?
Para ello, se inició la búsqueda de artículos originales, mediante la base de datos de PUBMED con base en las siguientes palabras clave: gestational diabetes, nutrition, diet, freeding, diabetes, pregnancy (para idioma ingles). Diabetes gestacional, nutrición, dieta, alimentación y embarazo (para idioma español).
Se realizaron los siguientes límites:
Tipo de diseño: artículos empíricos.
Idioma: inglés y español.
Tipo de estudio: diabetes gestacional y Nutrición.
Temporalidad: publicaciones desde 1980 a 2017.
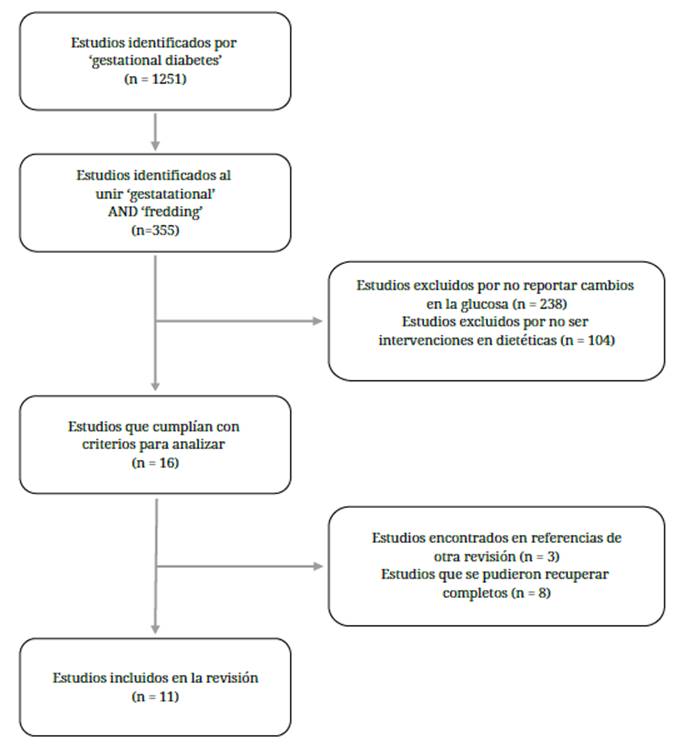
De la primera búsqueda, se obtuvieron 1251 artículos con las palabras 'gestational diabetes'. Para especificar que el estudio trata sobre la alimentación, se escribieron las palabras 'gestational' y feeding' unidas con la conjunción 'and', lo que dio un total de 355 artículos (figura 1).
Se eliminaron aquellos trabajos que no reflejaban cambios en el control de la glucosa, quedaron un total de 117 artículos. También se descartaron aquellos trabajos que no se enfocaran en la dieta (como de medicamentos, cirugía, entre otros), lo que redujo la muestra a un total de 16 artículos en inglés.
Para la segunda selección, se buscaron los artículos completos utilizando PUBMED y Google Académico como bases de datos, se recuperaron un total de 8 artículos. Además, se realizó una búsqueda complementaria a partir de las referencias de los artículos ya elegidos, se encontraron solo 3. Lo que da un total de 11 artículos.
Se seleccionaron 11 artículos para la revisión. Todos eran ensayos clínicos aleatorizados (tabla 1).
Para la etapa siguiente, se realizaron 3 matrices, divididas según la intervención: hidratos de carbono (HC), proteínas (PS) o grasas (LP), y se colocaron los datos más relevantes de cada investigación (autor, tipo de intervención, tipo de estudio, población, resultados).
En la primera matriz se pusieron los estudios relacionados con intervención en cuanto a los HC, lo que dio un total de 7 artículos. Para la segunda matriz que corresponde a PS, solo se halló 1 artículo; mientras que para las intervenciones en LP se encontraron 3 artículos, todos ellos con el mismo objetivo de lograr cambios en la glucosa.
Intervención basada en Hidratos de Carbono
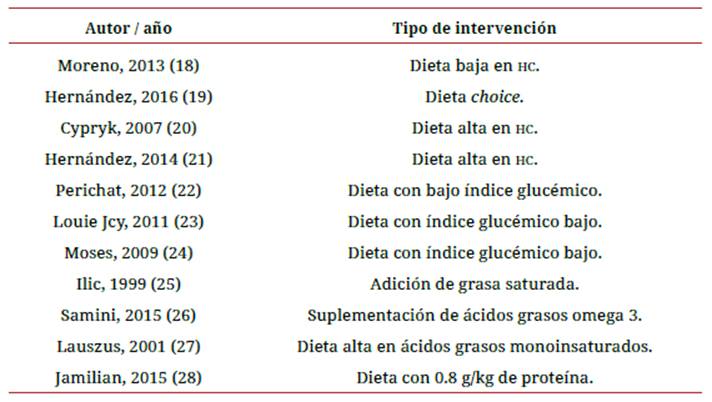
En este grupo se incluyeron 7 de los 11 artículos encontrados, cuya intervención se basa en realizar una modificación de la cantidad y tipo de HC en la dieta de mujeres con DMG (tabla 2).
Antiguamente, el enfoque de la terapia nutricional en DMG consistía en la restricción de HC (30 %-40 % de las calorías totales), con el objetivo de reducir la glucemia posprandial 29,30.
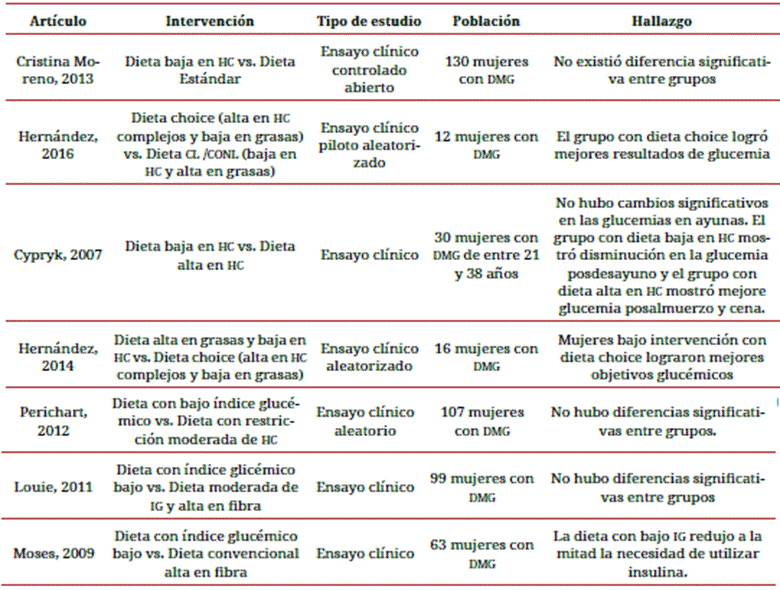
En dos de los 7 artículos que intervienen en los HC (Moreno, 2013 y Cypryk, 2007) se realizó una dieta baja en HC en 130 y 30 mujeres con DMG, respectivamente 18,20. Ninguno obtuvo resultados beneficiosos en los niveles de glucosa materna.
Los estudios de Hernández en 2016 y Hernández en 2014 compararon una dieta LC/ CONV, baja en HC y alta en grasas (40 % HC, 45 % LP, y 15 % PS), con la dieta choice (Choosing Healthy Options in Carbohydrate Energy), alta en HC complejos y baja en grasa (60 % HC complejos, 25 % LP, 15 % PS) 19,21. Se hallaron mejores niveles de glucemia en la dieta choice, además de reflejar implicancias importantes en la prevención de macrosomía fetal.
Otros autores analizaron la intervención por medio de dietas con bajo índice glucémico (IG). En las intervenciones de Perichart en 2012 y Louie en 2011 no se hallaron diferencias significativas en las glucemias maternas con dietas de bajo IG, en comparación con intervención por medio de una restricción moderada de HC (40 %-45 %) y dieta alta en fibras 22,23. El estudio de Moses en 2009 encontró que la dieta de bajo IG redujo a la mitad el número de embarazadas que requirieron insulina, en comparación con la dieta convencional alta en fibra 24.
Intervenciones nutricias basadas en lípidos
Para este tipo de intervención, se incluyeron 3 artículos en los que se buscó determinar si con la modificación en la cantidad de grasa de la dieta se logran mejores resultados glucémicos (tabla 3).
El objetivo del estudio de Ilic en 1999 fue determinar si el tipo de grasa desempeña un papel en la respuesta glucémica luego de las comidas, independientemente del contenido de HC, se halló que el consumo de grasa saturada daba una menor glucosa posprandial en comparación a la grasa monoinsaturada 25.
El ensayo clínico de Samini en 2015 realizó intervención por medio de suplementación con ácidos grasos omega 3, sin encontrar cambios significativos en las glucemias al compararlas con embarazos sin suplementar 26.
Por último, el estudio de Lauszus en 2001 comparó mujeres con dieta alta en ácidos grasos monoinsaturados con mujeres con dieta alta en HC, sin encontrar diferencias entre grupos 27.
Intervenciones basadas en Proteínas
Para este tipo de intervención, se analizó solo un ensayo clínico en 68 mujeres con DMG que tuvo como objetivo determinar los efectos de la ingestión de proteína de soja en el estado metabólico de mujeres con DMG (tabla 4) 28. Se comparó el metabolismo de mujeres con DMG que tenían un consumo durante 6 semanas de 0.8 gr/Kg de proteínas (70 % eran animales y 30 % vegetales - grupo control) frente al metabolismo de mujeres que consumían 0.8 gr/ Kg de proteínas (35 % animales, 35 % proteínas de soja y 30 % de otras proteínas vegetales). El grupo control tuvo glucemias en ayunas significativamente más altas que el grupo con mayor consumo de proteínas de soja. Además, la intervención con proteínas de soja mostró también mejores resultados de triglicéridos y complicaciones en el recién nacido.
Resultados
Según los artículos analizados en la presente revisión, se demostró que la intervención nutricional por medio de la calidad y cantidad de HC, PS y LP consumidas en el transcurso del embarazo influirá en la glucemia materna de mujeres con DMG.
Las intervenciones que obtuvieron resultados favorables en los niveles de glucosa de las mujeres con DMG fue la utilización de dieta choice (60 % HC complejos, 25 % LP, 15 % PS), la dieta con bajo índice IG, ingesta mayor de grasas saturadas, así como el consumo de proteína de soja. Sin embargo, aún faltan estudios que corroboren su efectividad.
Discusión
En 1998, Major Carol y colegas hallaron que una restricción de HC (<42 % de las calorías diarias) en mujeres con DMG logró mejores resultados glucémicos en comparación con mujeres con consumo de HC >45 % 31. Nolan en 1984 analizó 5 mujeres con DMG que llevaban a cabo distintas dietas, alta en HC no refinados y baja en grasas frente a una dieta baja en HC y los resultados sugirieron que las dietas bajas en grasa y altas en contenido de HC sin refinar son beneficiosas para el tratamiento de DMG 32.
Desde hace muchos años se busca determinar cuál es el efecto de la intervención en los HC para el tratamiento de DMG. Sin embargo, el análisis y los resultados de la presente revisión y de otros trabajos de hace años atrás, que incluyeron en la revisión, ponen de manifiesto la baja calidad de evidencia que existe actualmente en relación con los HC en el tratamiento de DMG, ya que los formatos y resultados de estas son diversos y no permiten obtener fuertes conclusiones al respecto. Además, en los trabajos analizados se han incluido muestras con un número de mujeres reducido, lo que impide que sus resultados sean concluyentes. Si bien, el presente análisis sugiere que se logran mejoras con la intervención por medio de la cantidad y calidad (índice glucémico) de los HC, no son claros los beneficios que se logran con las distintas intervenciones y cuál ofrece mejores resultados que otras.
Además de las intervenciones por medio de HC, las dietas en las que se controla el tipo de grasa han mostrado efectos beneficiosos en la madre y el recién nacido. En el estudio de Hernández y colegas, una dieta alta en HC complejos y baja en grasa (choice) logró mejores resultados que aquellas donde las mujeres que llevaron a cabo una dieta más alta en grasas 19. Con respecto al consumo de proteínas, la adición de proteínas de soja parecería traer efectos favorables en embarazadas con DMG, pero hacen falta estudios que comprueben su eficacia en el tratamiento.
En conclusión, en la presente revisión, donde se analizaron los resultados de 11 investigaciones en las que se han estudiado distintas intervenciones nutricionales en el tratamiento de DMG, se encontró que aún faltan estudios que determinen cual es el tratamiento nutricional más adecuado. Dada la heterogeneidad de los estudios, en cuanto a metodología y resultados, no se ha podido determinar qué tipo de intervención logra mejores beneficios que otras.
La terapia nutricional sigue siendo el tratamiento de primera línea de la DMG y se han encontrado beneficios gracias a ella. Sin embargo, existe poca evidencia y hace falta avanzar y generar mejor evidencia sobre el verdadero potencial de la terapéutica nutricional y evaluar los efectos a corto y largo plazo sobre los diferentes tipos de dietas en mujeres con DMG.