Introducción
Los concentrados plaquetarios (CPQ) se han utilizado con fines terapéuticos y profilácticos, en pacientes con variaciones plaquetarias cuantitativas y cualitativas 1. A pesar de su utilidad en medicina transfusional, los CPQ tienen una vida útil limitada, tanto que la Asociación Americana de Bancos de Sangre (AABB) recomienda cinco días; mientras que la Food and Drug Administration (FDA) recomienda el uso de los CPQ hasta los siete días de almacenamiento, previo cultivo microbiológico 2,3. La demanda por el uso de esos hemocomponentes supera la producción y ello se ha convertido en una limitante en los bancos de sangre, debido a la preocupación por la posible contaminación bacteriana y lesiones durante el tiempo de almacenamiento que acorta su vida útil 2 y afecta su funcionalidad y propósito terapéutico.
Los CPQ sufren lesiones durante el almacenamiento que afectan tanto su morfología como su función biológica 4. Algunos estudios han determinado que los CPQ obtenidos dentro de 24-48 horas tienen una buena recuperación, supervivencia y función plaquetaria, de tal manera que proporcionan una mejora en la condición del paciente 5. Las indicaciones de uso están relacionadas con hemorragias masivas con coagulopatías, y en caso de profilaxis, se asocian con el recuento plaquetario o tratamientos que producen aplasia plaquetaria 5. En contraste, en los pacientes con diagnóstico de COVID-19 no se informaron requerimientos de CPQ en cantidades mayores en cuanto a otras patologías, lo que no ha afectado significativamente al stock de estos hemocomponentes 6.
Las buenas prácticas transfusionales establecen que los CPQ obtenidos a través de la separación de la capa leucocitaria (buffy coat) o aféresis deben evaluarse durante y al final de la etapa de almacenamiento permitido, con el fin de determinar la calidad y viabilidad del producto 7; también se recomienda medir la activación de las plaquetas mediante la liberación de P-selectina (CD62). La CD62 es una glucoproteína presente en la membrana de los gránulos a de las plaquetas, que se expresa en la superficie de estas al ser activadas, lo que constituye un buen indicador de la función plaquetaria 8. Durante la etapa de almacenamiento existe una mayor expresión de CD62, aunque se desconoce la importancia de este aumento durante la transfusión 9.
La recuperación funcional y la cantidad de plaquetas en el paciente depende no solo de la dosis utilizada, sino de la viabilidad y funcionalidad de los CPQ 10,11. Sin embargo, y de acuerdo con el estudio de Bashir et al., se ha demostrado que la función plaquetaria se mantiene dentro de los índices óptimos hasta el día catorce de almacenamiento, pero los parámetros in vitro se preservan mejor en CPQ almacenados en solución aditiva que en el plasma 12. Por lo tanto, en la calidad de los CPQ influyen factores, como método de preparación, plaquetas derivadas de sangre total-bufy coat o aféresis, medio de almacenamiento, aditivos añadidos, control y monitoreo de los parámetros de calidad 13,14.
Es por esta razón por la que en este estudio se evaluó la viabilidad de los CPQ desde el día de su producción hasta el séptimo día de almacenamiento, para establecer el tiempo de viabilidad y contribuir de esta manera con información relevante.
Materiales y métodos
Este fue un estudio descriptivo transversal, llevado a cabo en 4 meses, tiempo en el que se monitorearon los parámetros de calidad a través de un muestreo aleatorio simple, que evaluó un total de 64 CPQ, fraccionados en 3 alícuotas (192 muestras) al tercer, quinto y séptimo día de su obtención. El tamaño muestral se calculó siguiendo los lineamientos de la AABB, la cual establece que para un control de calidad efectivo se debe elegir el 1 % del total de hemocomponentes producidos mensualmente; por lo que se tomó en cuenta el tamaño de la población de los CPQ obtenidos en los últimos 4 meses previos a la investigación.
Luego de la firma del consentimiento informado predonación, el personal del banco de sangre extrajo un tubo con ácido edético para determinar el contaje plaquetario; seguidamente, se fraccionó la unidad de sangre total dentro de las 6 horas posteriores a la extracción. Los CPQ obtenidos por capa leucocitaria se ubicaron en la cámara de almacenamiento (serie: 977358), en constante agitación, a una temperatura controlada de 20-24°C durante 7 días. Una vez determinado el contaje plaquetario, se verificó que este sea menor o igual a 107 células.
Alícuotas de CPQ para monitoreo: los 64 CPQ elegidos para el estudio se fraccionaron en 2 bolsas de transferencia TERUFLEX, mediante el equipo de conexión estéril GENESIS-TCD B40, que recolectaron un volumen de 15 mL en cada bolsa utilizada para el análisis al tercer y quinto día, respectivamente, y la bolsa matriz del CPQ, de aproximadamente 15 mL, para la medición al séptimo día de almacenamiento. Todas las bolsas permanecieron en agitación constante, a una temperatura de 22 °C y bajo las mismas condiciones de almacenamiento.
Análisis microbiológicos: se realizó cultivo en agar sangre, eosin methylene blue agar, y tioglicolato incubado a 37 °C durante 3 días para determinar los contaminantes aerobios y anaerobios.
Medición de la activación plaquetaria: se midió la CD62 P-selectina, mediante FITC anti-Human CD41/CD61/Lot 5160916025 y PE anti-Human CD62/Lot 5160916023. Con ayuda del citómetro de flujo FACS canto II y siguiendo las indicaciones del inserto proporcionado por la casa comercial. El complejo CD41/CD61 se utilizó para medir la agregación plaquetaria.
Contaje de células: se utilizó el analizador automatizado de hematología SYSMEX XT1800Í y se aplicó la fórmula: células / bolsa = células/μl x 1000 x volumen del hemocomponente. El valor del estándar por cada CPQ estableció un recuento de leucocitos <0.12 x 109/unidad y eritrocitos <1.2 x 109/unidad.
Medición de parámetros morfológicos: se evaluó el efecto swirling o torbellino plaquetario al agitar los CPQ, y por la difracción del haz de luz, se observó que la alineación de las plaquetas en forma de discoides normales formaban un torbellino. Para calificarlo se utilizaron los criterios 0 = indica que no hay remolino y 3 (+++) = un gran remolino.
Existencia de grumos: indicativo de agregación plaquetaria calificándolo: ausencia (0) y tres cruces (+++) grumos visibles.
pH: debe mantenerse entre 6.4 y 7.2. Su variación es indicativo de glucólisis o contaminación bacteriana. Se utilizó pH-metro 213 marca: HANNA.
Color y aspecto: observación a contraluz del color para determinar un cambio de amarillo transparente a turbio verdoso, indicativo de contaminación bacteriana.
Control de calidad: se constató que todos los equipos utilizados en el estudio tuvieran su certificado de calibración y verificación por empresas certificadas y se utilizaron controles internos en las pruebas automatizadas. Las pruebas de P-selectina se estandarizaron utilizando células sin marcaje, marcadas con CD41-CD61 y CD62 (P-selectina) y plaquetas marcadas con CD41-CD61/CD62 para determinar el porcentaje de plaquetas activadas. Como control interno negativo se utilizó plasma citratado de un paciente con administración de ácido acetil salicilico, y una muestra de plasma activado (figuras 1a y 1b).
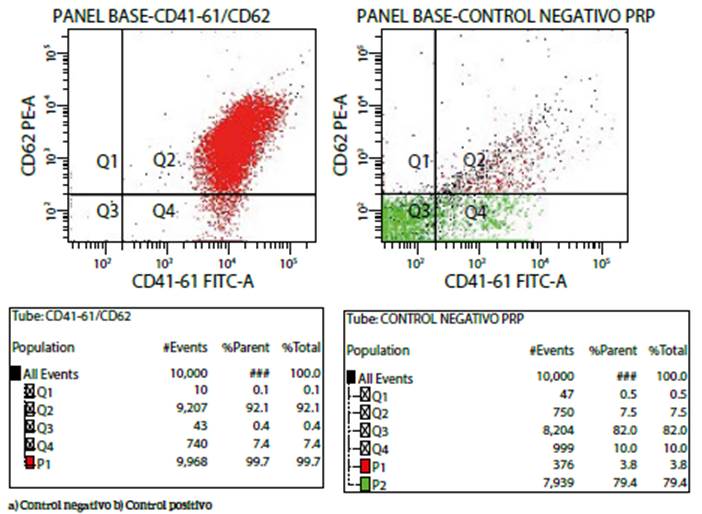
Figura 1 Control interno de calidad. a) Control negativo: se observa únicamente el 3.8 % de plaquetas activas pertenecientes al porcentaje basal del paciente. b) Control positivo: se utilizó una muestra de plasma activado con 1 μL de adp, el cual se incubó por 15 min. En esta muestra se encontró que el 99.7 % de las plaquetas se encontraban activadas
Análisis estadístico: mediante estadística descriptiva, con el programa IBM SPSS Statistics v. 20. Para la relación entre las variables nominales se usaron la prueba chi cuadrado de asociación e independencia, el análisis de varianza (Anova) unidireccional y la prueba no paramétrica de Kruskall-Wallis; entre tanto, para las variables cuantitativas, el estadístico de correlación de Pearson. Además, se analizó la relación entre las diferentes variables de estudio con la activación plaquetaria, a efectos de determinar qué variable medida visualmente es la que mejor predice la activación plaquetaria. Para ello se utilizó la regresión lineal. Se definió que no existe una correlación con un r2 ≤ 0.1; con un 0.1 < r2 < 0.5 existe una débil correlación; con un 0.5 > r2 <0.8 indica una buena relación, y con un r2 > 0.8 representa una alta correlación 15.
Resultados
Parámetro de aspecto físico: el 100 % de CPQ mantuvieron el aspecto transparente y color amarillo durante los días de almacenamiento.
Contaje de células: el 100 % de CPQ cumple con un contaje óptimo de leucocitos residuales (<0.12 x 109 cél./bolsa); por el contrario, el 7.3 % de CPQ sobrepasa el límite de eritrocitos residuales (<1.2 x 109 cél./bolsa).
Cultivo microbiano: el 100 % de los CPQ no presentó contaminación bacteriana durante los siete días de almacenamiento.
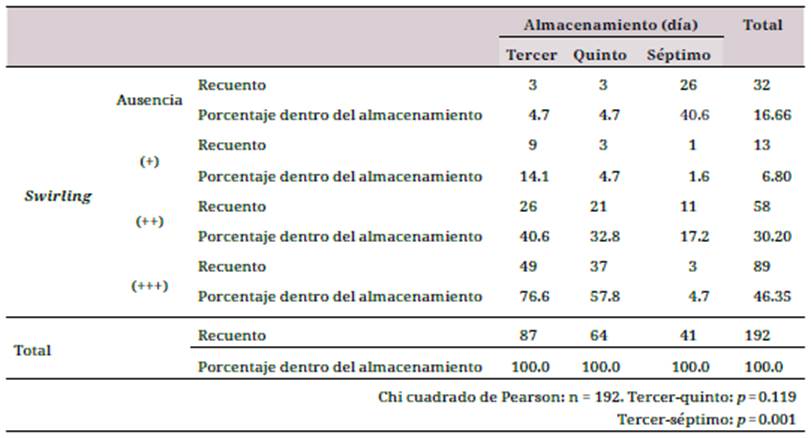
Formación de swirling (torbellino plaquetario): disminuye con el tiempo de almacenamiento, 112 (58.3 %) presentaron una formación de 3 cruces (+++) de swirling en el primer día de almacenamiento; mientras que al tercer día solo en 49 CPQ se podía apreciar (+++) de swirling. Así se observó una disminución paulatina entre los días 3 y 7 (p = 0.001) (tabla 1).
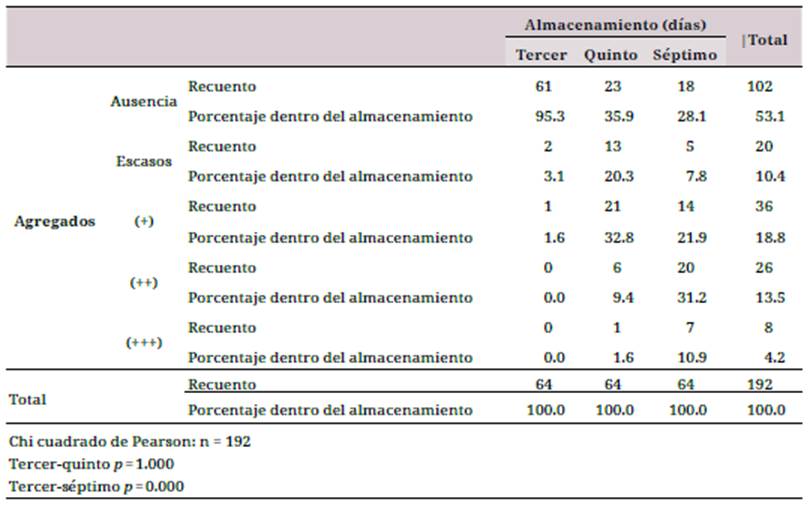
Agregados plaquetarios: se observó que mientras más días de almacenamiento, existe mayor cantidad de agregados plaquetarios. Hay una diferencia significativa en el día siete de conservación (p = 0.001) con respecto a los días 3 y 5 (tabla 2).
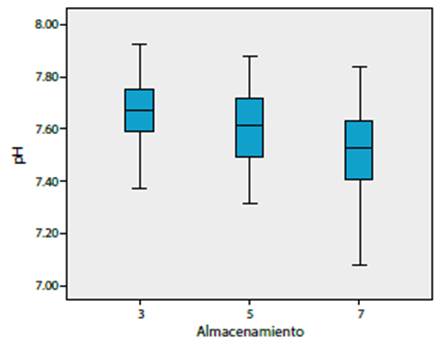
Medición del pH: el valor inicial del pH se encontró dentro de los rangos 6.20-6.40 en el 100 % de lo CPQ; sin embargo, aumenta su valor con los días de almacenamiento. Así, se identificó una relación estadísticamente significativa entre los días 5 y 7 (p = 0.001) (figura 2).
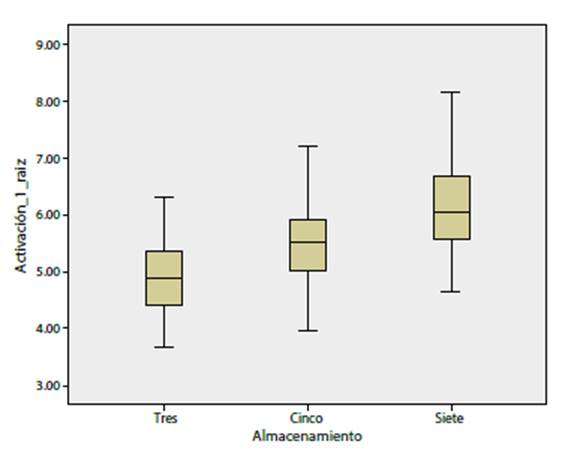
Activación de plaquetas: se obtuvo dependencia entre los días de almacenamiento y la activación plaquetaria, p = 0.001, es decir, la expresión de CD62 se incrementaba a través del tiempo de almacenamiento (figura 3). La prueba de Tukey mostró diferencias significativas entre los días tres y el cinco (p = 0.001) y entre los días cinco y siete (p = 0.001), así como los días tres y siete de almacenamiento (p = 0.001).
Relación entre las variables de estudio: se aplicó la prueba estadística Anova de un factor para determinar la relación entre torbellino o swirling y la activación plaquetaria. Se halló una relación dependiente (p = 0.001). La prueba de Kruskal-Wallis se utilizó para determinar la relación entre la formación de agregados plaquetarios y la activación, y con ella se obtuvo una relación estadísticamente significativa (p = 0.004) que determinó su dependencia. Por último, se identificó una correlación fuerte r2 = 0.848 entre el incremento de la liberación de CD62 y la disminución del swirling. El análisis estadístico entre la variable pH y activación plaquetaria demostró una relación inversa entre las dos variables cuantitativas (r = -0.154).
Discusión
Los CPQ se utilizan como terapia transfusional en pacientes con enfermedades hematológicas. Su eficacia depende de la calidad funcional de las plaquetas, por lo que es de suma importancia controlar todos los parámetros que determinen la viabilidad de cada concentrado. El presente estudio determinó que lo recomendable es que los CPQ se empleen 5 días después de su extracción para garantizar su efectividad 16. Sin embargo, el estudio realizado por Chandra et al. estableció que la función plaquetaria puede mantenerse añadiendo una solución aditiva hasta el séptimo día luego de su extracción 17. El presente estudio no incluyó la adición de soluciones aditivas, por no ser una práctica común en los bancos de sangre ni estar disponible en Ecuador.
De igual forma, Castrillo et al. evaluaron, además de todos los parámetros de calidad de los CPQ, la medición del CD62 P-selectina 18. Los resultados mostraron una buena calidad in vitro de los concentrados almacenados durante 9 días, pero suspendidas en solución aditiva. La presencia de swirling o torbellino plaquetario está relacionado con la morfología discoidea de la plaqueta, y su ausencia es indicativa de la activación plaquetaria. En este estudio se determinó que el torbellino plaquetario iba disminuyendo mientras aumentaban los días de almacenamiento (p = 0.001). Datos similares corresponden al estudio de Singh et al., donde identificaron que después de 5 días de almacenamiento, el torbellino disminuyó notablemente, debido a las lesiones ocurridas durante la conservación de CPQ 19.
Otros estudios han demostrado que el índice de torbellino o swirling en concentrados derivados de capa leucocitaria disminuyó después del séptimo día, y que en concentrados obtenidos de plasma rico en plaquetas empezó a decrecer significativamente a partir del quinto día 20. Los CPQ pueden presentar agregados inmediatamente después de la separación de sangre total, independiente del método usado; la producción de agregados normalmente se disipa con el reposo, la agitación y la temperatura de almacenamiento. Los resultados obtenidos en esta investigación mostraron que los CPQ presentaron un aumento de agregados plaquetarios mientras aumentaba el tiempo de almacenamiento. No se establecieron causas exactas de la formación de agregados, pero en el estudio de Ringwald et al. se sugiere que bajas temperaturas, bajo pH, periodos de reposo corto, presencia de burbujas y variables dependientes del donador podrían ser las causantes 21,22.
Actualmente, no existe un consenso sobre una estrategia general de descarte de los CPQ con agregados plaquetarios y los criterios dependen de cada servicio de medicina transfusional 18. El pH es un parámetro importante porque determina la viabilidad de las plaquetas, y a pesar de que el 100 % de CPQ analizados cumplieron con un pH mayor a 6.2, este valor aumenta con respecto a los días de almacenamiento (p = 0.001). Estos resultados son similares al estudio de Dijkstra-Tiekstra et al., en el cual se obtuvo una diferencia significativa (p = 0.001), pues al relacionar durante 12 días de almacenamiento, el pH no disminuyó del rango normal hasta el séptimo día 15.
El estudio de Costa et al. corroboró estos hallazgos, donde el pH se encuentra estable hasta el séptimo día (6.93-7.34) 20,23. Otro parámetro evaluado fue la expresión de CD62 P-selectina. Esta es una de las proteínas más abundantes de los gránulos a de las plaquetas y se secreta durante la activación; muchos autores sugieren que esta se incrementa durante el almacenamiento 15. En este estudio, los resultados mostraron que la liberación de este marcador se incrementa progresivamente y que hay una diferencia significativa, al quinto día (p = 0.001) y séptimo día de almacenamiento (p = 0.001) con relación al tercer día. El estudio de Quinteros Quintana et al. encontró un incremento de la secreción de CD62 a través del tiempo, con una diferencia significativa a partir del tercer hasta el noveno día de almacenamiento 24; además, evidenció que el método de obtención también es un parámetro que influye en el nivel de activación plaquetaria.
El análisis de la relación existente entre la activación plaquetaria y los parámetros medidos visualmente determinó que la expresión del marcador P-selectina (CD62), indicativo de activación plaquetaria, tuvo una correlación fuerte con el torbellino plaquetario, al encontrar que mientras más activación plaquetaria, existe menos swirling; relación hallada también por Dijkstra-Tiekstra et al. 15. Otro de los parámetros medidos visualmente fue la cantidad de agregados plaquetarios que tuvieron una relación significativa (p = 0.004) con la cantidad de plaquetas activadas, medidas con el marcador CD62, que así mismo se menciona en el foro la Revista Internacional de Transfusión Sanguínea. Entonces, mientras más agregados plaquetarios se observan, más activación plaquetaria se encuentra en el CPQ 23.
Por último, en esta investigación se identificó una correlación débil entre el pH y la activación plaquetaria. Dijkstra-Tiekstra et al. obtuvieron una correlación alta (r2 = 0.85) y determinaron que cuando el pH permanecía >6.5, la expresión de CD62 se encontraba por debajo del 30 % 15. En cambio, con un pH < 6.2, la expresión de CD62 subía al 60 %. Este aumento puede deberse a la disminución de glucosa en el medio y la consecuente producción de lactato, lo que se traduce en cambios morfológicos de las plaquetas 24,25.
Con estos resultados se recomienda que el personal encargado de la terapia transfusional realice una inspección visual previa a una transfusión de CPQ, sobre todo la medición del torbellino o swirling, parámetro que mejor predice la cantidad de plaquetas presentes y su activación. Sin embargo, al ser un parámetro medido visualmente, es necesario realizar capacitaciones y estudios de concordancia intra e interobservador al personal que se encargue de este procedimiento, para asegurar así la correcta medición de un parámetro de gran beneficio y que no requiere un presupuesto elevado, que suele ser una limitante en la mayoría de las instituciones públicas del país. Al medir estos parámetros se estaría contribuyendo a que los CPQ cumplan con la función de restablecer los trastornos de la función plaquetaria y trombocitopenia, así como de mejorar la hemostasia en varias patologías.