Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Prospectiva
Print version ISSN 1692-8261
Prospect. vol.12 no.2 Barranquilla July/Dec. 2014
https://doi.org/10.15665/rp.v12i2.265
http://dx.doi.org/10.15665/rp.v12i2.265.
Remoción de Pb (II), Ni (II) y Cr (VI) en soluciones acuosas usando matrices modificadas químicamente
Study for removal of Pb (II), Ni (II) and Cr (VI) in solutions using support chemically modified
Candelaria Tejada Tovar1, Angel Villabona Ortiz2, Erika Ruiz Paternina3
1 M.Sc. en Educación, M.Sc.(c) en Ingeniería Ambiental,
2 M.Sc.(c) en Ingeniería Ambiental,
1,2 Docente asociado. Universidad de Cartagena, Cartagena, Colombia; Grupo IDAB.
3 Ingeniera Química; Joven investigador; Universidad de Cartagena; Grupo IDAB. Cartagena, Colombia.
Email:ctejadatt@gmail.com.
Recibido 1/06/13, Aceptado 30/06/2014
Citar como: C. Tejada, A. Villabona, E.Ruiz, "Study for removal of Pb (II), Ni (II) and Cr (VI) in solutions using support chemically modified", Prospect, Vol 12, N° 2, 7-17, 2014.
Resumen
En este artículo se realiza una descripción general de la aplicación de materiales de bajo costo obtenidos de residuos vegetales y matrices orgánicas modificadas para reemplazar el uso de métodos convencionales en la remoción de metales, evitando problemas subsecuentes como la generación de lodos químicos, y proponiendo un uso alternativo a materiales considerados como desechos. Se sabe que la presencia de ciertos grupos funcionales, hace aplicables estos residuos en la captura eficiente de iones metálicos, sin embargo, se encuentra que factores como el pH de la solución y la concentración del metal influyen en el proceso. En general, se establece que el tratamiento con ácidos y la posterior transformación de las matrices a carbón activo aumentan la capacidad de adsorción, además es el modelo pseudo segundo orden y la isoterma de Langmuir, las ecuaciones más usadas para describir la cinética y el comportamiento de adsorción.
Palabras Clave: Adsorción, Cinética, Fibra, Metales pesados y Residuos.
Abstract
In this paper was studied the use of low-cost materials obtained from plants remains and modified organic matrices to replace the use of conventional methods for removal of heavy metals. So avoiding subsequent problems such as the generation of chemical sludge, and creates an alternative use for materials considered as waste. It is well known that the presence of some of the active components in these materials allow them to efficiently capture metal ions, however, it was found that other factors like pH of solution and concentration of metals also influence this process. In general, acid treatment and a subsequent transformation of materials to active carbon increases sorption capacity. Also, it is the pseudo second order model and the Langmuir isotherm that are the equations most used to describe kinetics and the adsorption behavior.
Key words: Adsorption, Kinetics, Fibre, Heavy metals and Waste.
1. Introducción
La presencia de metales pesados en recursos hídricos y suelos se convierte en uno de los problemas ambientales más graves del presente siglo, puesto que cada vez es más creciente el número de actividades industriales que involucran a estos elementos en sus procesos [1-3].
Los metales pesados se caracterizan por ser estables y persistentes en el ambiente, ya que no pueden ser degradados ni destruidos, además son altamente tóxicos para diversas formas acuáticas de vida, incluso pueden llegar a ser un serio problema para la salud de los seres humanos [4-6].
El contenido de metales pesados de efluentes industriales que van dirigidos a cuerpos naturales de agua es un problema a resolver, tradicionalmente se han usado tecnologías como: precipitación química, oxidación, reducción, intercambio iónico, filtración, membranas y recuperación por evaporación, sin embargo estas a menudo resultan ineficientes a bajas concentraciones del metal, costosas por el alto uso de energía, o contaminantes por el uso de químicos y posterior generación de lodos [7-11]. Por lo cual, nuevas tecnologías como la biosorción para el tratamiento de aguas y suelos ha centrado la atención de diversos sectores interesados en la remoción de metales pesados a bajo costo y alta efectividad, siendo el carbón activado el adsorbente más usado, caracterizándose por su alto costo [12]. En aras de mejorar esta situación se han estudiado materiales lignocelulósicos, tales como desechos agrícolas, que aparte de ser económicos y abundantes, permiten la regeneración del biosorbente, la recuperación del metal e inclusive la obtención de carbón activado [13-15].
Los productos agrícolas están compuestos principalmente de lignina, hemicelulosa y celulosa, los cuales podrían incluir grupos funcionales como hidroxilos, carboxilos, aldehídos, cetonas, fenoles y éteres, que tienen la capacidad de secuestrar iones metálicos por donación de un par de electrones para la formación de complejos en solución [16], además actualmente se han trabajado modificaciones a los materiales lignocelulósicos con ácido cítrico, hidróxido de sodio, cloruro de calcio, transformación a carbón activado, entre otras, dando lugar a la generación de nuevos centros activos, a fin de incrementar la efectividad de estos para la remoción de metales y otros contaminantes en solución [17-19].
2. Mecanismos de biosorción metálica
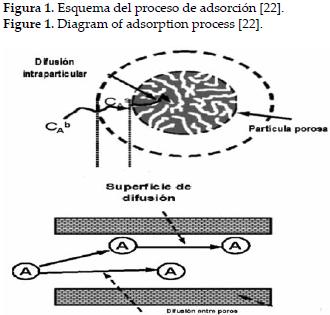
La biosorción de metales es un proceso complejo, que involucra diversos mecanismos, y que además se ve seriamente afectado por muchos factores; entre los mecanismos que incluye se encuentra la quimisorción, complejación, adsorción, intercambio iónico, y distribución en la superficie de adsorción [20], pero en general el proceso de adsorción sea cual sea la naturaleza del adsorbente se puede explicar cinéticamente en cuatro pasos, tal como se muestra en la figura 1; primero una transferencia del metal desde la fase liquida hasta la película que rodea al adsorbente mediante un proceso de difusión, donde Ca es la concentración del contaminante en fase liquida, luego una transferencia a través de la película líquida hacia el adsorbente, donde es importante tener en cuenta el coeficiente de transferencia de masa global y la resistencia ejercida por la película al fenómeno ocurrido. Posteriormente, se da la difusión del metal en el adsorbente, ya sea en el líquido intraparticular o de un sitio del adsorbente a otro, para que finalmente se dé el proceso de adsorción, químico o físico, donde se dan como tal las interacciones del metal en los sitios activos del adsorbente [21].
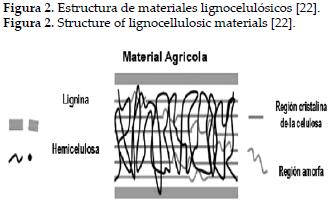
Igualmente, es esencial para comprender como se da la unión metal-biomasa identificar la estructura principal de los adsorbentes de origen vegetal, siendo trascendental la función de la pared celular, la cual está constituida principalmente por celulosa, hemicelulosa y lignina (ver figura 2).
La celulosa ha sido la principal estructura asociada al proceso de adsorción, esta tiene una estructura lineal y fibrosa en la que se establecen múltiples puentes de hidrógeno entre los grupos hidroxilo de distintas cadenas de glucosa, haciéndola resistente e insoluble en agua, originando fibras compactas que le confieren alta capacidad de sorción, principalmente de cationes divalentes [22-23].
Otra consideración a tener en cuenta en el proceso de adsorción, es la alta afinidad de estos materiales por el agua. El agua puede entonces extenderse por la parte no cristalina de la celulosa, y por toda la lignina y hemicelulosa. A través de la absorción y la adsorción, la solución acuosa entra en contacto con los diferentes componentes de la pared celular, así la celulosa puede sorber los iones metálicos en solución. Aunque también, interviene el tipo de estructura molecular y supramolecular de la biomasa, ya que la adsorción de agua en la fibra causa hinchazón, entre más agua más hinchazón, lo cual afectaría la adsorción metálica por los sitios disponibles [24-25].
3. Modelos cinéticos
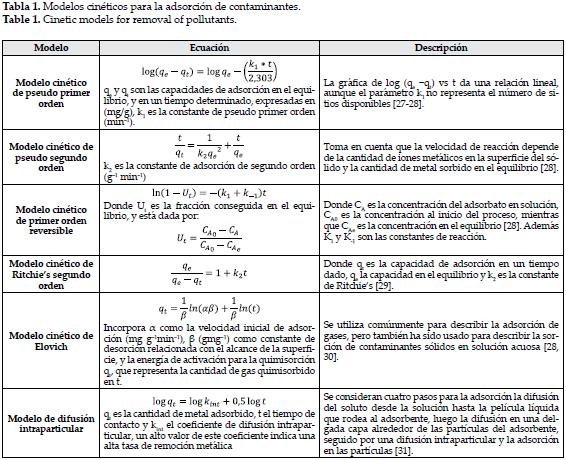
El estudio de la dinámica de adsorción describe la manera como es tomado el soluto, la tasa, y el tiempo de residencia del sorbato en la interfase sólido-solución. La cinética química da información sobre los pasos y tiempos de reacción en el equilibrio, cabe destacar que esta es altamente dependiente de las características fisicoquímicas del material sorbente. Diferentes modelos han sido usados, teniendo en cuenta la correlación existente entre los datos experimentales y los predichos por el modelo, en el que un alto valor del coeficiente de correlación indica que el modelo describe adecuadamente la cinética del proceso [26]. En la tabla 1, se muestra un resumen de los modelos revisados.
4. Isotermas de adsorción
Luego del proceso de adsorción se obtiene como resultado una concentración de metal remanente en la solución en equilibrio con el metal sobre el adsorbente, en este punto existe una distribución tal del metal entre el sólido y el líquido que puede representarse mediante la relación entre la cantidad de soluto por masa de adsorbente qe y la concentración de metal en solución en el equilibrio Ce. Las isotermas de adsorción suministran esta relación cuando se tienen dos fases de equilibrio, usadas para caracterizar la interacción de los iones metálicos con el adsorbente. Entre estas, se destaca el modelo de Langmuir, este se deriva originalmente de los estudios de adsorción de gas en carbón activado. Este modelo es usado para estimar la capacidad de adsorción del adsorbente, suponiendo que el metal es tomado en una superficie homogénea, es decir una adsorción monocapa sin interacción entre las moléculas adsorbidas. Además, el modelo asume energías de adsorción uniformes en la superficie y la no migración del adsorbato hacia otros sitios [32]. Otro de los modelos más usados es el de Freundlich, el cual se basa en una adsorción multicapa en superficies heterogéneas con interacción entre las moléculas adsorbidas, además considera una energía de distribución uniforme, la aplicación de este modelo sugiere que la energía decrece exponencialmente con la finalización de los centros de adsorción del adsorbente [31].
También se destaca el de Langmuir-Freundlich, en el que la superficie del adsorbente es considerada homogénea y la sorción como un proceso cooperativo de la interacción adsorbato-adsorbato [33].
Otros modelos usados incluyen el de Brunauer, Emmer y Teller (BET), una extensión del modelo de Langmuir, teniendo en cuenta una aparente adsorción multicapas en el adsorbente. Este asume que la ecuación de Langmuir es aplicable a cada capa y cada una de estas no está completamente formada antes de que se forme la siguiente. A bajas concentraciones del metal, donde la primera capa no queda saturada, este modelo queda resumido al de Langmuir [32]. Además, el de Redlich-Peterson, usado para representar el equilibrio de adsorción sobre un amplio rango de concentración, también puede ser aplicado indistintamente en sistemas que sean homogéneos o heterogéneos [7]. Por último, vale resaltar el modelo de Temkin, que contiene un factor que toma en cuenta todas las interacciones del adsorbente con el adsorbato. Temkin muestra que experimentalmente el calor de adsorción disminuye con un incremento de la superficie [19].
En la tabla 2, se realiza un resumen de los principales modelos de isotermas y sus ecuaciones.
5. Revisión de materiales residuales para la adsorción de metales pesados
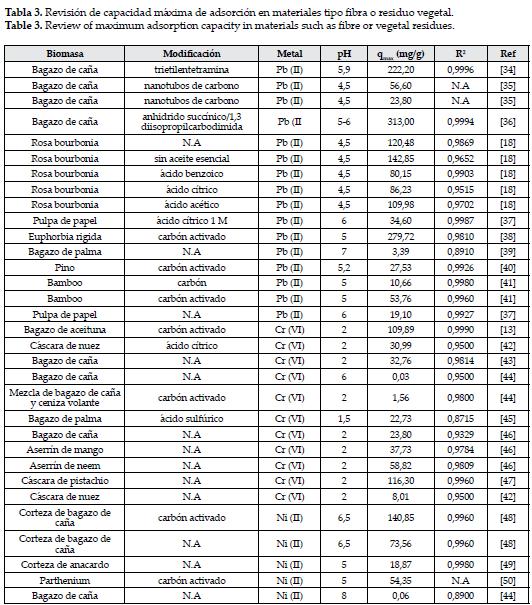
Una gran cantidad de materiales agrícolas han sido estudiados para la remoción de iones metálicos en solución. Muchos de estos usados con algunas modificaciones a fin de incrementar su eficiencia en la toma de metales. en la tabla 3, se hace una recopilación de algunas biomasas, tipo fibra, tales como el bagazo de caña de azúcar y el de palma africana, y residuos vegetales, usadas con y sin modificación, para la remoción de cromo, plomo y níquel, describiendo el qmax obtenido del ajuste a la isoterma de Langmuir, puesto que es el parámetro más usado en la literatura para describir el proceso de adsorción. Se escoge este tipo de materiales por ser residuos que se obtienen en grandes cantidades, los cuales su acumulación y disposición constituye un gran problema ambiental, que podría ser solucionado con el reuso de estos materiales para fines tales como la adsorción de iones metálicos y la generación de energía por su gran contenido de carbono.
Se puede establecer que existe un amplio rango de valores obtenidos para cada uno de los metales en estudio, 3,39mg/g-313mg/g para el plomo; 0,026mg/g-109,89mg/g para el cromo; y 0,06mg/g-140,85mg/g para el níquel, además se observa que las biomasas modificadas mejoran la adsorción de cada uno de los metales en estudio, que incluyen métodos de pretratamiento con ácidos como el clorhídrico, cítrico, sulfúrico, y acético, poliaminas, y modificación carbón activado.
Se observa que para el plomo, es el bagazo de caña el material que muestra mejores resultados, este contiene cerca de un 50% de celulosa, 27% de poliosas, y 23% de lignina, todos estos polímeros conocidos por la gran cantidad de grupos hidroxilos y fenólicos que pueden ser químicamente modificados para diversos usos [51]. En este caso los autores evaluaron la preparación de un material quelante, introduciendo una función carboxil al bagazo de caña con anhidro succínico, y produciendo una amida mediante una modificación química con una línea comercial de una poliamina, ya que estas son conocidas por su alta eficiencia en la toma de iones metálicos como el Pb (II). Encontrando así una metodología rápida, efectiva y económica para introducir funciones quelantes al bagazo que mejoran la capacidad de adsorción del mismo, demostrando además que la eficiencia en la toma del ion metálico es proporcional al número de funciones aminas introducidas [36].
En otro trabajo, se sugiere el bagazo de caña como una excelente matriz (material estable e insoluble con presencia de grupos en su mayoría orgánicos que interactúan con iones metálicos) porque es un material de poco costo comparado con materiales como los polímeros sintéticos, y además en países como Brasil donde se condujo el estudio, se producen miles de toneladas diarias, que aunque son usadas para la producción de energía, todavía es significante la cantidad de biomasa que permanece como residuo, convirtiéndose en una amenaza para el ambiente. Los autores modifican inicialmente con anhidro succínico para activar la función ácido carboxílico con 1,3 diisopropilcarbodimida que permite la unión con la amina correspondiente, sin embargo el qmax se ve disminuido comparado con el material al cual no se le ha introducido la trietilentetramina [34].
Para el cromo y el níquel es la modificación a carbón activado la que muestra una adsorción máxima en este tipo de materiales, muchos reportes han sido publicados mostrando la alta eficiencia de los carbones activados, pero el gran costo de estos ha limitado su uso, por lo que es bastante interesante obtener carbones a partir de materiales con alta disponibilidad y de bajo costo tales como los desechos agrícolas y vegetales. Además, algo que los hace interesantes para la remoción de metales es su alta área superficial y su superficie microporosa que permite un mayor contacto con el metal [14].
La superficie del carbón contiene una serie de grupos funcionales principalmente grupos oxigenados y nitrogenados responsables de su actividad química, estos se forman en los procesos de activación cuando los radicales libres de la superficie del carbón interactúan con átomos de oxígeno y nitrógeno, provenientes ya sea del precursor o de la atmósfera, así se pueden introducir en la superficie del carbón grupos funcionales hidroxilo, carbonilo y carboxilo, asociados al carácter hidrófilo de un material, y a la capacidad de adsorción de los mismos [19]. Entre otros objetivos del proceso de activación se encuentran: mejorar el volumen del poro, agrandar el diámetro de los poros y aumentar la porosidad del carbón activado, cabe destacar que el proceso de activación se puede realizar por tres diferentes métodos: activación física, química, y fisicoquímica (combinación de ambos procesos), la primera de estas se realiza principalmente con vapor o CO2, mientras que la química, utiliza varios productos químicos, como el ácido nítrico y el sulfúrico [52].
Para el níquel, el carbón activado con vapor a partir de bagazo de caña dio como resultado una remoción de 140,85 mg/g, mientras que el obtenido a partir del bagazo de aceituna para la remoción de cromo, el cual fue también activado con vapor, mostró un qmax de 88,59 mg/g a 25°C y de 109,89 mg/g a 45°C, mostrando que este material es efectivo para la adsorción de estos iones metálicos, además los autores reportan que el incremento en la temperatura mejora la adsorción, sugiriendo que el proceso es endotérmico, este hecho puede atribuirse al aumento en la movilidad y difusión del adsorbato, ya que un aumento en el número de moléculas podría adquirir la suficiente energía para experimentar una interacción con los sitios activos en la superficie, además el aumento de la temperatura aumenta el tamaño de los poros y su ensanchamiento crea más superficie para la adsorción [13].
En general se puede establecer que la adsorción, en este tipo de adsorbentes, al ser mejor descrito por la isoterma de Langmuir, son materiales en cuyos sitios de remoción no existen interacciones entre las moléculas adsorbidas, solo de estas con los sitios activos del adsorbente.
En referencia al pH, este es un factor determinante en la adsorción de cada metal, y no solo en la toma de este, sino también cuando se desee llevar este proceso a escala industrial, puesto que se deben cumplir con disposiciones legales referentes al pH del efluente tratado. Por lo general para metales divalentes, como el níquel y el plomo diferentes autores reportan que al aumentar el pH aumenta la adsorción, siendo el de 5 un pH óptimo.
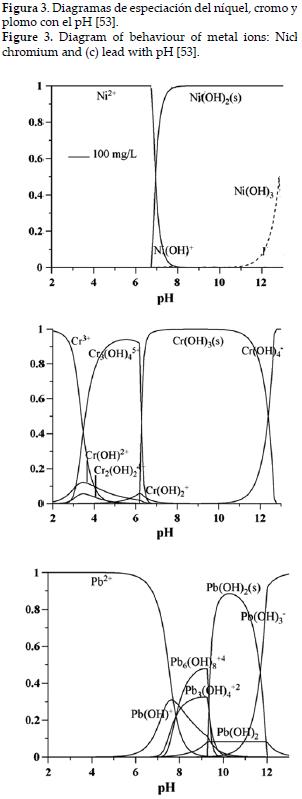
En la figura 3, se muestran las especies metálicas del cromo, plomo y níquel, y el pH en el cual predominan, lo que permite explicar la dependencia de la adsorción con este parámetro, se observa la presencia de hidróxidos dando un indicativo de la precipitación de los mismo con el cambio de pH, y que por tanto limita la remoción metálica, por ejemplo en el caso del níquel la adsorción se ve favorecida a pH superiores a 4, pero después de 7, este decrece rápidamente [48], determinando un máximo a pH 6,5 donde se obtuvo una capacidad de 23,08 mg/g y 41,60 mg/g para las concentraciones iniciales de 50 y 100 mg/L, respectivamente. De igual forma, diversos autores afirman que una carga negativa favorece la adsorción del metal ya sea por intercambio iónico o por interacción electrostática, determinada por el comportamiento de los grupos funcionales en la superficie del material sorbente.
Sin embargo, para el cromo hexavalente la adsorción aumenta al disminuir el pH, ya que la estabilidad de las especies iónicas del cromo HCrO4-,Cr2O72-, y CrO42- depende altamente del valor del pH, y a valores bajos los sitios activos de los adsorbentes son protonados y es entonces donde estas especies aniónicas pueden ser enlazadas en el adsorbente debido a las fuerzas electrostáticas, además es bien conocido que la forma dominante de cromo hexavalente entre pH 1 y 4 es HCrO4-, así que esta es la que se aloja principalmente en la superficie del adsorbente [54-55].
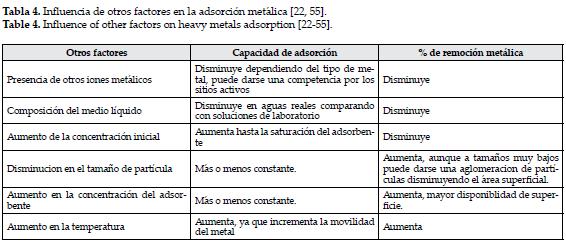
Aunque el pH es quizás el factor que más influye en la adsorción metálica, existen otros determinantes en este proceso, tales como la temperatura, la presencia de distintos iones metálicos, entre otros, mientras que el tamaño y la cantidad de biomasa no influyen considerablemente, asimismo, en cuanto a la relación entre la lignina y la adsorción, se comprobó además que la cantidad de lignina presente en el adsorbente no interfiere en el proceso, pues para la adsorción de cobre, materiales como el bagazo de caña de azúcar con un 19% de lignina tienen una capacidad de 0,3 mg/g, mientras que otros como el cáñamo con un 3%, presentan una capacidad de 9,5mg/g, por lo que se puede suponer que los grupos característicos, carbonilos y metoxilos presentes en la lignina, no interfieren en la adsorción metálica [54].
En general, en la tabla 4, se resume la tendencia general de estos factores.
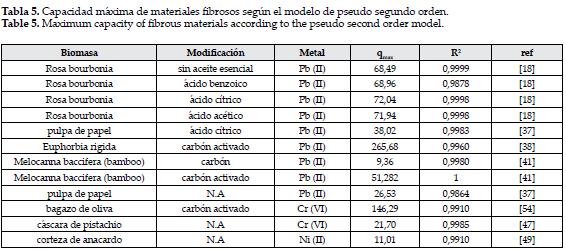
Ahora al considerar los modelos cinéticos que describen el proceso de adsorción, se encontró que estos materiales se ajustan al modelo de pseudo segundo orden, tal como se observa en la tabla 5, en consecuencia en la adsorción en estos materiales fibrosos y vegetales la etapa limitante de la cinética es la quimisorción debida a la formación de enlaces químicos entre adsorbente y el metal en una monocapa en la superficie del material.
Se observa que el material que muestra una capacidad de adsorción máxima es el carbón activado obtenido a partir de Euphorbia rigida, lo que permite comprobar la efectividad de la modificación, en este estudio los autores trabajaron una concentración de 200 mg/L, mientras que en el trabajo en el cual se estudió la rosa bourbonia se usaron concentraciones de 400mg/L y en la pulpa de papel de 300mg/L, esta sería la razón por la cual tienen una menor capacidad de adsorción, ya que al aumentar la concentración del contaminante se espera una mayor interacción entre moléculas de adsorbato, lo que disminuye el proceso de adsorción, asimismo se da una saturación más rápida de la biomasa, por lo que se sugiere evaluar la relación biomasa/solucion usada y la concentración de metal a trabajar. Sin embargo, no todos los procesos de adsorción con estos materiales fueron descritos por el modelo de pseudo segundo orden, el compuesto bagazo de caña/nanotubos de carbono para la remoción de Pb (II) siguió un comportamiento de adsorción regido por el modelo de Elovich, lo cual es un indicativo de que a diferencia del resto de materiales estos presentan sitios heterogéneos para la adsorción [12]. Los nanotubos de carbono han presentado gran interés por sus excelentes propiedades físicas y químicas, y en especial para la adsorción de metales al ser materiales altamente porosos y al presentar una gran área superficial, aunque al ser químicamente inertes se requiere de modificaciones en su superficie para mejorar la interacción con los metales divalentes, entre estas la oxidación química que permite incorporar grupos carboxílicos, hidroxilos en su superficie, estas aumentan el número de grupos funcionales que contienen oxígeno y elevan la carga negativa superficial, favoreciendo la capacidad de intercambio iónico, precisamente con este fin los autores realizaron la oxidación con ácido nítrico y sulfúrico, además de realizarle un tratamiento al bagazo con glutaraldehido.
6. Conclusiones
- Esta revisión muestra el estudio de materiales lignocelulósicos, tipo fibra y residuos vegetales modificados químicamente para la remoción de metales divalentes como el plomo, el níquel y el cromo, elementos altamente tóxicos. Los tratamientos químicos para estos materiales incluyen modificaciones principalmente con ácidos y transformación a carbón activado, se establece que estos aumentan la eficiencia de remoción de la matriz, al incluir en esta grupos hidroxilo y carboxilo a los cuales se ha asociado el proceso de adsorción, además se establece que es la isoterma de Langmuir la que mejor describe estos procesos, y es el modelo de pseudo segundo orden el que mejor ajusta el proceso de adsorción, mostrando que en su mayoría la remoción se da en una monocapa en la cual solo existe interacciones entre el adsorbato y el adsorbente. Se recomienda realizar más investigaciones encaminadas al uso de biomateriales abundantes en Colombia, tales como el bagazo de palma y de caña para la remoción de metales pesados, pues estos materiales se convierten en un problema ambiental al producirse diariamente grandes toneladas de desechos.
Referencias
[1] A. Bhatnagar, M. Sillanpää, "Utilization of agro-industrial and municipal waste materials as potential adsorbents for water treatment-A review", Chemical Engineering Journal., 157, 277-296, 2010. [ Links ]
[2] R.A. Anayurt, A. Sari, M. Tuzen, "Equilibrium, thermodynamic and kinetic studies on biosorption of Pb(II) and Cd(II) from aqueous solution by macrofungus (Lactarius scrobiculatus) biomass", Journal Chemical Engineering., 151 (1-3), 255-261, 2009. [ Links ]
[3] V. Sotero-Solís, M. Alva-Astudillo, "Contenido de metales pesados en agua y sedimento en el bajo Nanay", Cienc amaz (Iquitos)., 3(1): 24-32, 2013. [ Links ]
[4] S. Taha, S. Ricordel, I. Cisse, "Kinetic study and modeling of heavy metals removal by adsorption onto peanut husks incinerated residues", Energy Procedia., 6, 143-152, 2011. [ Links ]
[5] Z. Li, L. Wu, H. Liu, H. Lan, J. Qua, "Improvement of aqueous mercury adsorption on activated coke by thiolfunctionalization", Chemical Engineering Journal., 228, 925- 934, 2013. [ Links ]
[6] A.F. Cardona-Gutiérrez, D.D. Cabañas-Vargas, A. Zepeda-Pedreguera, "Evaluación del poder biosorbente de cáscara de naranja para la eliminación de metales pesados, Pb (II) y Zn (II)", Revista Académica de la Facultad de Ingeniería, Universidad Autónoma de Yucatán., 17 (1), 1-9, 2013. [ Links ]
[7] R.M. Shrestha, I. Varga, J. Bajtai, M. Varga, "Design of surface functionalization of waste material originated charcoals by an optimized chemical carbonization for the purpose of heavy metal removal from industrial waste waters", Microchemical Journal., 108, 224-232, 2013. [ Links ]
[8] M. Torab-Mostaedi, M. Asadollahzadeh, A. Hemmati, A. Khosravi, "Equilibrium, kinetic, and thermodynamic studies for biosorption of cadmium and nickel on grapefruit peel", Journal of the Taiwan Institute of Chemical Engineers., 44, 295-302, 2013. [ Links ]
[9] E. Eren, B. Asin, "Removal of basic dye using raw and acid activated bentonite samples", Journal of Hazardous Materials., 166, 830-835, 2009. [ Links ]
[10] S. Chakravarty, A. Mohanty, T.N. Sudha, A.K. Upadhyay, J. Konar, J.K. Sircar, "Removal of Pb(II) ions from aqueous solution by adsorption using bael leaves (Aegle marmelos)", Journal Hazardous Materials., 170, 969-77, 2009. [ Links ]
[11] M.J. Melgar, J. Alonso, M.A. García, "Removal of toxic metals from aqueous solutions by fungal biomass of Agaricus macrospores", Science Total Environmental., 385, 12-17, 2007. [ Links ]
[12] Z. Li, Q. Tang, T. Katsumi, X. Tang, T. Inui, S. Imaizumi, "Leaf char: an alternative adsorbent for Cr(III)", Desalination., 264, 70-77, 2010. [ Links ]
[13] H. Demiral, G. Gündüzog˘lu, "Removal of nitrate from aqueous solutions by activated carbon prepared from sugar beet bagasse", Bioresource Technology., 101, 1675-1680, 2010. [ Links ]
[14] S. Boumaza, F. Kaouah, T. Berrama, M. Trari, Z. Bendjama. "Optimization of preparation conditions for activated carbon from waste materials of agricultural origin for the removal of basic red 46", Chemometrics and Intelligent Laboratory Systems., 118, 311-316, 2012. [ Links ]
[15] H. Trevino-Cordero, L.G. Juárez-Aguilar, D.I. Mendoza-Castillo, V. Hernández-Montoya, A. Bonilla-Petriciolet, M.A. Montes-Morán, "Synthesis and adsorption properties of activated carbons from biomass of Prunus domestica and Jacaranda mimosifolia for the removal of heavy metals and dyes from water", Industrial Crops and Products., 42, 315-323, 2013. [ Links ]
[16] F. Ning-chuan, G. Xue-yi, "Characterization of adsorptive capacity and mechanisms on adsorption of copper, lead and zinc by modified orange peel", Transactions Nonferrous Metals Society of China., 22, 1224-1231, 2012. [ Links ]
[17] F. Ning-chuan, G. Xue-yi, L. Sha, "Enhanced Cu (II) adsorption by orange peel modified with sodium hydroxide", Transactions of Nonferrous Metals Society of China., 20, 146-152, 2010. [ Links ]
[18] Q. Manzoor, R. Nadeem, M. Iqbal, R. Saeed, T.M. Ansari, "Organic acids pretreatment effect on Rosa bourbonia phyto-biomass", Bioresource Technology., 132, 446-455, 2013. [ Links ]
[19] F. Ahmad., W.M. Daud, M.A. Ahmad, R. Radzi, "Cocoa (Theobroma cacao) shell-based activated carbon by CO2 activation in removing of Cationic dye from aqueous solution: Kinetics and equilibrium studies", Chemical engineering research and design., 90, 1480-1490, 2012. [ Links ]
[20] G. Mahajan, D. Sud, "Application of ligno-cellulosic waste material for heavy metal ions removal from aqueous solution", Journal of Environmental Chemical Engineering., 1, 1020-1027, 2013. [ Links ]
[21] D.S. Aguilar, (2010) Uso de residuos de naranja (Citrus sinensis) y tamarindo (Tamarindus indica) como biosorbentes en la remoción de plomo, cadmio y zinc de aguas contaminadas. Tesis para obtener el título de químico farmacobiologo. Universidad michoacana de San Nicolás de Hidalgo, Morelia, Michoacan, México, 2010. [ Links ]
[22] S. Malamis, E. Katsou, "A review on zinc and nickel adsorption on natural and modified zeolite, bentonite and vermiculite: Examination of process parameters, kinetics and isotherms", Journal of Hazardous Materials., 252- 253, 428- 461, 2013. [ Links ]
[23] M.R. Lasheen, N.S. Ammar, H.S. Ibrahim, "Adsorption/desorption of Cd(II), Cu(II) and Pb(II) using chemically modified orange peel: Equilibrium and kinetic studies", Solid State Sciences., 14,202-210, 2012. [ Links ]
[24] A. Demirbas, "Heavy metal adsorption onto agro-based waste materials: A review", Journal of Hazardous Materials., 157, 220-229, 2008. [ Links ]
[25] M. Xu, P. Yin, X. Liu, Q. Tang, R. Qu, Q. Xu, "Utilization of rice husks modified by organomultiphosphonic acids as low-cost biosorbents for enhanced adsorption of heavy metal ions", Bioresource Technology., 149, 420-424, 2013. [ Links ]
[26] C. Tejada, A. Villabona, V. Ruiz, "Biomasa residual para remoción de mercurio y cadmio: una revisión", Ingenium., 6(14), 11-21, 2012. [ Links ]
[27] M. Asgher, H.N. Bhatti, "Mechanistic and kinetic evaluation of biosorption of reactive azo dyes by free, immobilized and chemically treated Citrus sinensis waste biomass", Ecological Engineering., 36, 1660-1665, 2010. [ Links ]
[28] B. Saha, C. Orvig, "Biosorbents for hexavalent chromium elimination from industrial and municipal effluents", Coordination Chemistry Reviews., 254, 2959-2972, 2010. [ Links ]
[29] S.S. Baral, N. Das, G.R. Chaudhury, S.N. Das, "A preliminary study on the adsorptive removal of Cr(VI) using seaweed, Hydrilla verticillata", Journal of Hazardous Materials., 171, 358-369, 2009. [ Links ]
[30] F.C. Wu, R.L. Tseng, R.C. Juang, "Characteristics of Elovich equation used for the analysis of adsorption kinetics in dye-chitosan systems", Chemical Engineering Journal., 150, 366-373, 2009. [ Links ]
[31] S. Liang, X. Guo, N. Feng, Q. Tian, "Isotherms, kinetics and thermodynamic studies of adsorption of Cu2+ from aqueous solutions by Mg2+/K+ type orange peel adsorbents", Journal of Hazardous Materials, 174, 756-762, 2010. [ Links ]
[32] E. Njikam, S. Schiewer, "Optimization and kinetic modeling of cadmium desorption from citrus peels: A process for biosorbent regeneration", Journal of Hazardous Materials., 213- 214, 242-248, 2012. [ Links ]
[33] D. Lu, Q. Cao, X. Li, X. Cao, F. Luo, W. Shao, "Kinetics and equilibrium of Cu(II) adsorption onto chemically modified orange peel cellulose biosorbentes", Hydrometallurgy., 95, 145-152, 2009. [ Links ]
[34] L.V. Alves, L.F. Gil, "Adsorption of Cu(II), Cd(II) and Pb(II) from aqueous single metal solutions by succinylated twice-mercerized sugarcane bagasse functionalized with triethylenetetramine", Water research., 43, 4479-4481, 2009. [ Links ]
[35] I.A.A. Hamza, B.S. Martincigh, J.K. Ngila, V.O. Nyamori, "Adsorption studies of aqueous Pb(II) onto a sugarcane bagasse/multi-walled carbon nanotube composite", Physics and Chemistry of the Earth., 66, 157-166, 2013. [ Links ]
[36] O. Karnitz, L.V. Alves, J.C. Perin de Melo, V.R. Botaro, T.M. Sacramento, R. Pereira, L.F. Gil, "Adsorption of heavy metal ion from aqueous single metal solution by chemically modified sugarcane bagasse", Bioresource Technology., 98, 1291-1297, 2007. [ Links ]
[37] S. Pitsari, E. Tsoufakis, M. Loizidou, "Enhanced lead adsorption by unbleached newspaper pulp modified", Chemical Engineering Journal., 223,18-30, 2013. [ Links ]
[38] O. Gercel, H.F. Gercel, "Adsorption of lead(II) ions from aqueous solutions by activated carbon prepared from biomass plant material of Euphorbia rigida", Chemical Engineering Journal., 132, 289-297, 2007. [ Links ]
[39] H.L.H. Chong, P.S. Chia, M.N. Ahmad, "The adsorption of heavy metal by Bornean oil palm shell and its potential", Bioresource Technology., 130, 181-186, 2013. [ Links ]
[40] M. Momčilović, M. Purenović, A. Bojić, A. Zarubica, M. Ranđelović, "Removal of lead(II) ions from aqueous solutions by adsorption onto pine cone activated carbon", Desalination., 276, 53-59, 2011. [ Links ]
[41] H. Lalhruaitluanga, K. Jayaram, M.N.V. Prasad, K.K. Kumar, "Lead(II) adsorption from aqueous solutions by raw and activated charcoals of Melocanna baccifera Roxburgh (bamboo)-A comparative study", Journal of Hazardous Materials., 175, 311-318, 2010. [ Links ]
[42] T. Altun, E. Pehlivan, "Removal of Cr (VI) from aqueous solutions by modified walnut shells", Food Chemistry., 132, 693-700, 2012. [ Links ]
[43] U.K. Garg, M.P. Kaur, V.K. Garg, D. Suda, "Removal of hexavalent chromium from aqueous solution by agricultural waste biomass", Journal of Hazardous Materials., 140, 60-68, 2007. [ Links ]
[44] M. Rao, A.V. Parwate, A.G. Bhole, "Removal of Cr (VI) and Ni (II) from aqueous solution using bagasse and fly ash", Waste Management., 22, 821-830, 2002. [ Links ]
[45] M.H. Isa, N. Ibrahim, H.A. Aziz, M.N. Adlan, N.H. Sabiani, A.A. Lorestani, S.R. Mohamed, "Removal of chromium (VI) from aqueous solution using treated oil palm fibre", Journal of Hazardous Materials., 152, 662-668, 2008. [ Links ]
[46] V. Vinodhini, N. Das, "Biowaste materials as sorbents to remove chromium (VI) from aqueous environment-a comparative study", ARPN Journal of Agricultural and Biological Science, 4, 6, 19-25, 2009. [ Links ]
[47] G. Moussavi, B. Barikbin, "Biosorption of chromium (VI) from industrial wastewater onto pistachio hull waste biomass", Chemical Engineering Journal., 162, 893-900, 2010. [ Links ]
[48] K. Anoop, K.G. Sreejalekshmi, R.S. Baiju, "Nickel (II) adsorption onto biomass based activated carbon obtained from sugarcane bagasse pith", Bioresource Technology., 102, 10239-10247, 2011. [ Links ]
[49] P. Senthil, S. Ramalingamb, S. Dinesh, A. Murugesanc, T. Vidhyadevic, S. Sivanesanc, "Adsorption behavior of nickel(II) onto cashew nut shell: Equilibrium, thermodynamics, kinetics, mechanism and process design", Chemical Engineering Journal., 167, 122-131, 2011. [ Links ]
[50] K. Kadirvelu, P. Senthilkumar, K. Thamaraiselvi, V. Subburam, "Actived carbon prepared from biomass as adsorbent: elimination of Ni (II) from aqueous solution", Bioresource technology., 81, 87-90, 2002. [ Links ]
[51] W.S. Wan Ngah, M.A.K.M. Hanafiah, "Removal of heavy metal ions from wastewater by chemically modified plant wastes as adsorbents: A review", Bioresource Technology, 99, 3935-3948, 2008. [ Links ]
[52] N. Mohamad Nor, L. Lee Chung, L. Keat Teong, A. Rahman Mohamed, "Synthesis of activated carbon from lignocellulosic biomass and its applications in air pollution control-a review", Journal of Environmental Chemical Engineering., 1, 658-666, 2013. [ Links ]
[53] V.M. Nurchi, I. Villaescusa, "Agricultural biomasses as sorbents of some trace metals", Coordination Chemistry Reviews., 252, 1178-1188, 2008. [ Links ]
[54] H. Demiral, I. Demiral, F. Tumsek, B. Karabacakoglu, "Adsorption of chromium (VI) from aqueous solution by activated carbon derived from olive bagasse", Chemical Engineering Journal., 144, 188-196, 2008. [ Links ]
[55] V. Lugo-Lugo, C. Barrera-Díaz, F. Ureña-Núñez, B. Bilyeu, I. Linares-Hernández, "Biosorption of Cr(III) and Fe(III) in single and binary systems onto pretreated orange peel", Journal of Environmental Management, 112, 120- 127, 2012. [ Links ]