Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Prospectiva
versión impresa ISSN 1692-8261
Prospect. vol.12 no.2 Barranquilla jul./dic. 2014
https://doi.org/10.15665/rp.v12i2.293
http://dx.doi.org/10.15665/rp.v12i2.293.
Transesterificación de aceites vegetales empleando catalizadores heterogéneos
Transesterification vegetable oils using heterogeneous catalysts
Grey C. Castellar Ortega1, Edgardo R. Angulo Mercado2, Beatriz M. Cardozo Arrieta3
1 Mg. Ciencias Química, Docente Investigador, Grupo de Investigación en Energías Alternativas, Universidad Autónoma del Caribe. Barranquilla, Colombia.
2 Mg. Ciencias Química, Grupo de Investigación en Biotecnología de Microalgas, Fisicoquímica Aplicada y Estudios Ambientales, Universidad del Atlántico. Barranquilla, Colombia.
3 Esp. Ciencias Ambientales, Docente Tiempo Completo, Universidad Autónoma del Caribe. Barranquilla, Colombia.
Email: grey.castellar@uac.edu.co.
Recibido 20/05/14, Aceptado 10/06/2014
Citar como: G.Castellar, E.R.Angulo, B.M.Cardozo, "Transesterification vegetable oils using Heterogeneous catalysts", Prospect, Vol 12, N° 2, 90-104, 2014.
Resumen
El progresivo aumento en los precios del petróleo y el agotamiento de sus reservas ha motivado a la sociedad científica a pensar en combustibles alternativos y renovables como el biodiesel. La producción de biodiesel se lleva a cabo principalmente por transesterificación de triacilglicéridos (aceites vegetales y grasas animales) y un alcohol liviano en presencia de catalizadores. Los catalizadores homogéneos tipo hidróxidos de sodio o de potasio son típicamente los más empleados en la producción de biodiesel; desafortunadamente problemas asociados principalmente con el aumento de costos debido a la implementación de etapas de separación y el tratamiento posterior de aguas residuales, ha enfocado la atención de los investigadores hacia el empleo de catalizadores heterogéneos. Este artículo presenta una revisión sobre tres tipos de catalizadores heterogéneos, los óxidos de metales alcalinotérreos, las zeolitas y los heteropoliácidos, empleados en reacciones de transestrificación de aceites para la obtención de biodiesel. En términos generales, estos catalizadores han demostrado ser eficientes, selectivos, fáciles de separar, reutilizables y algunos más que otros, tolerables a la presencia de agua y de ácidos grasos libres.
Palabras clave: Biodiesel; Transesterificación; Triacilglicéridos; Catálisis; Sitio activo.
Abstract
The progressive increase in oil prices and the depletion of their reserves has prompted the scientific community to think of alternative and renewable fuels such as biodiesel. Biodiesel production is carried out mainly by transesterification of triglycerides (vegetable oils and animal fats) and a alcohol in the presence of catalysts. Hydroxides such homogeneous catalysts sodium or potassium are typically used in the production of biodiesel; unfortunately problems associated primarily with increased costs due to the implementation of separation stages and subsequent wastewater treatment, has focused the attention of researchers towards the use of heterogeneous catalysts. This article presents a review of three types of heterogeneous catalysts, alkaline earth metal oxides, zeolites and heteropoly acids, employees transestrification reactions of oils for biodiesel production. Generally, these catalysts have proven effective, selective, easy to separate, reusable and some more than others, tolerable to the presence of water and free fatty acids.
Key words: Biodiesel; Transesterification; Triglyceride; Catalysis; Active site.
1. Introducción
El petróleo es la fuente de energía más importante de la sociedad actual y casi todo el mundo lo necesita. De una u otra forma, el petróleo o sus derivados se usan cada día con mayor demanda; proporciona fuerza, calor y luz; lubrica la maquinaria (piezas mecánicas) y produce alquitranes que se aplican en la formulación de compósitos para pavimentos, entre otros. A partir del petróleo se fabrica una gran variedad de productos químicos que hacen más confortable la vida cotidiana [1].
A pesar de lo indispensable que resulta, el uso extensivo del petróleo está seriamente cuestionado. Uno de los problemas de contaminación ambiental que se le atribuye está relacionado con el calentamiento global, por lo cual es necesario hacer un gran esfuerzo para disminuir las emisiones de gases de efecto invernadero. Esta es una de las principales razones del gran interés que se tiene en convertir los recursos disponibles de la biomasa, generados a partir del dióxido de carbono y agua con la ayuda de la fotosíntesis, como una alternativa en la producción de sustancias combustibles [2].
En este sentido, los triésteres de glicerilo (aceites vegetales y grasas animales) se constituyen en uno de los recursos de biomasa que se emplean, como materia prima, en la producción del combustible alternativo conocido como biodiesel. El biodiesel es un combustible líquido similar al diesel derivado del petróleo en propiedades de combustión, pero esencialmente libre de azufre, por lo que es un combustible más limpio [3]. Los aceites vegetales provenientes de las plantas oleaginosas representan la principal fuente para la producción de biodiesel [4], principalmente los extraídos de semillas oleaginosas tradicionales, especialmente girasol, soya, colza y palma africana. Sin embargo, cualquier sustancia que contenga triacilglicéridos puede utilizarse para la producción de biodiesel (aceites de fritura usados, sebos y otras grasas animales, entre otros) [1]. Cerca de un 98% de la composición de los aceites vegetales son triacilglicéridos; una pequeña cantidad está representada por mono y diacilglicéridos [5]. Químicamente los triacilglicéridos son ésteres de tres ácidos grasos (C12 a C18 , saturados e insaturados) y glicerol; luego, contienen una gran cantidad de oxígeno en su estructura [6]. Los ácidos grasos varían dependiendo de la longitud de la cadena de carbonos y el número de dobles enlaces [7].
El uso de aceites vegetales para la producción de biodiesel ofrece algunas ventajas. En primer lugar, las plantas oleaginosas crecen en casi todas las partes del mundo; en segundo lugar, son sustancias renovables ya que las plantas oleaginosas pueden sembrarse y cosecharse durante prácticamente todo el año; en tercer lugar, el biodiesel es un combustible potencialmente más "verde", debido a que no contiene azufre o contiene menos que el diesel del petróleo [8, 9]; en cuarto lugar, las plantas verdes ayudan a la fijación del CO2 durante la fotosíntesis [4]. Dentro de los principales inconvenientes en el uso de aceites vegetales se encuentra la alta viscosidad del biodiesel obtenido, la baja volatilidad y reactividad de las cadenas de hidrocarburos insaturados [10] y, como muchos afirman, para el crecimiento de las plantas se requiere de grandes extensiones de tierra y del uso de fertilizantes resultando, en una situación que puede conducir al aumento de precios de algunos alimentos debido a la demanda del biodiesel [4].
Convencionalmente, la producción de biodiesel se lleva a cabo por transesterificación de triacilglicéridos con metanol o etanol en presencia de catalizadores básicos homogéneos, tales como hidróxidos de sodio o potasio, carbonatos o alcóxidos [11-14]. El empleo de estos sistemas catalíticos presenta algunos inconvenientes tales como dificultad en la eliminación de los catalizadores básicos después de la reacción, la producción de una gran cantidad de aguas residuales y la emulsificación asociada a la producción de jabón, especialmente si se utiliza etanol. Por otra parte, la creciente preocupación por el entorno ambiental incita a la industria química a desarrollar procesos químicos menos contaminantes [4]. Bajo este contexto, los catalizadores sólidos son promisorios al momento de reemplazar los catalizadores homogéneos, ya que son menos corrosivos, más fáciles de manejar, reutilizables y generan menos cantidad de residuos tóxicos. El uso de la catálisis heterogénea en reacciones de transesterificación impide la indeseable saponificación, permite la simplificación del proceso y ofrece una disminución de los costos de procesamiento al eliminar los pasos adicionales requeridos por los catalizadores homogéneos [4].
Existe un gran número de estudios sobre catalizadores sólidos tales como los óxidos de metales alcalinotérreos, zeolitas y heterolopiácidos empleados en la producción de biodiesel a escala de laboratorio. En esta revisión los autores pretenden mostrar una visión general sobre la actividad catalítica, condiciones de reacción, características ácidas y básicas de los sitios activos entre otras, de investigaciones realizadas alrededor de los catalizadores mencionados.
2. Biodiesel
El biodiesel es un combustible alternativo para motores diesel que se obtiene principalmente por reacción de un triacilglicérido (presente en aceites vegetales o en grasas animales) con un alcohol. Esta reacción requiere de catalizadores (normalmente una base fuerte) y entre los más usados están el hidróxido de sodio o el hidróxido de potasio, obteniéndose una mezcla ésteres metílicos (si se emplea metanol). Los alcoholes empleados con mayor frecuencia son el metanol y el etanol, aunque también se puede usar propanol, butanol, iso-propanol, ter-butanol, octanol y algunos ramificados que introducen un mayor costo.
Con respecto a la elección entre metanol y etanol, el primero es más barato, más reactivo y los ésteres metílicos de ácidos grasos (FAME) que se producen son más volátiles que los ésteres etílicos de ácidos grasos (FAEE); sin embargo, el etanol es menos tóxico y se considera más renovable, porque se obtiene por fermentación de una fuente amilácea o sacarificable. Por el contrario, el metanol se obtiene principalmente del gas natural, una fuente no renovable [14]. En cuanto a sus características como combustibles, los FAME y los FAEE muestran ligeras diferencias; por ejemplo, los FAEE tienen viscosidades más altas y puntos de nube y fluidez más bajos que los correspondientes FAME [15].
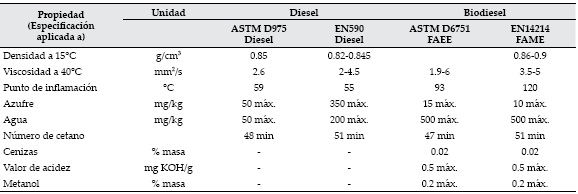
El biodiesel es un líquido de color amarillo-ámbar, con una viscosidad similar a la del diesel de petróleo, no es inflamable, no es explosivo, con un punto de inflamación superior comparado con el diesel de petróleo, es biodegradable, disminuye significativamente las emisiones de gases tóxicos y de otras sustancias volátiles cuando se quema como combustible [14]. Además, presenta mejor índice de cetano y mejor eficiencia en la lubricación [16]. Las normas (ASTM y EN) para el biodiesel y el diesel de petróleo se muestran en la tabla 1.
La práctica internacional condujo a la adopción de una nomenclatura única para identificar la concentración de biodiesel en las mezclas, conocida como nomenclatura BXX, donde XX corresponde al porcentaje en volumen del biodiesel en la mezcla diesel/biodiesel. Por ejemplo, B2, B5, B20 y B100 son combustibles con una concentración de 2%, 5%, 20% y 100% de biodiesel, respectivamente. Actualmente existen cuatro concentraciones principales de biodiesel que se utilizan en el mercado de los combustibles: El total (B100), las mezclas (B20 a B30), el aditivo (B5) y el aditivo lubricante (B2). Las mezclas B5 y B20 son las más comunes.
2.1 Producción de biodiesel a partir de aceites vegetales
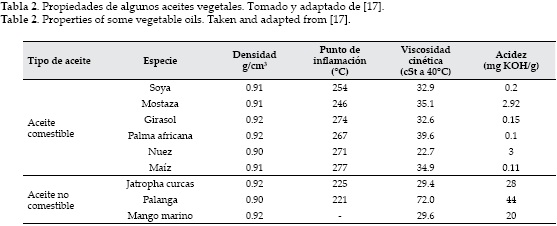
Químicamente, el biodiesel es una mezcla de ésteres de alquilo (metilo, etilo, ...) que contienen largas cadenas de ácidos grasos obtenidos típicamente a partir de recursos biológicos no tóxicos, tales como los aceites vegetales [17, 18], las grasas animales [19, 20] e incluso aceite de cocina usado [21]. La tabla 2 muestra algunas materias primas utilizadas en la producción de biodiesel y sus propiedades fisicoquímicas.
Más del 95% de la materia prima para producción de biodiesel se obtiene a partir de aceite comestible debido a que se produce ampliamente en muchas regiones y la calidad del biodiesel obtenido a partir de estos aceites se acerca mucho al combustible diesel. Sin embargo, existen algunos problemas tales como la competencia con el mercado de los aceites comestibles incrementando tanto el costo de los aceites como del biodiesel [22]. Por otra parte, causa desforestación en algunos países porque algunos bosques han sido talados con fines de cultivo.
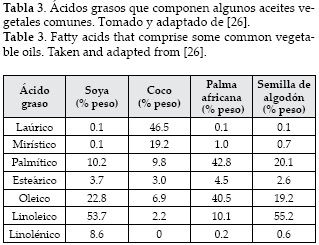
Con el fin de superar estos inconvenientes, muchos investigadores están interesados en los aceites no comestibles que no son adecuados para el consumo humano debido a la presencia de algunos componentes tóxicos en los aceites. Además, pueden cultivarse en terrenos no adecuados para el cultivo de alimentos, que no necesitan gran atención [23]. Sin embargo, la mayoría de aceites no comestibles tienen un alto contenido de ácidos grasos libres. Así que pueden requerir de pasos químicos adicionales, lo que aumentará los costos de producción [24, 25]. Las grasas animales tienen un contenido de grasas saturadas mayor al de los ácidos grasos y generalmente son sólidas a temperatura ambiente, lo cual puede causar problemas en el sistema de producción [17]. Los aceites de cocina usados no son aptos para el consumo humano, pero son una alternativa para la producción de biodiesel. La calidad de estos aceites preocupa por el alto contenido de impurezas, además que sus propiedades fisicoquímicas dependen del tipo de aceite. La tabla 3 muestra la composición de algunos aceites vegetales importantes.
Los aceites y las grasas normalmente contienen esteroles, fosfolípidos, ácidos grasos libres, agua y otros contaminantes, incluso refinados contienen pequeñas cantidades de ácidos grasos libres y agua que afectan la reacción de transesterificación de triglicéridos e interfieren en la separación y purificación de los ésteres de alquilo de los ácidos grasos afectando el rendimiento.
2.2 Transesterificación y mecanismo de reacción
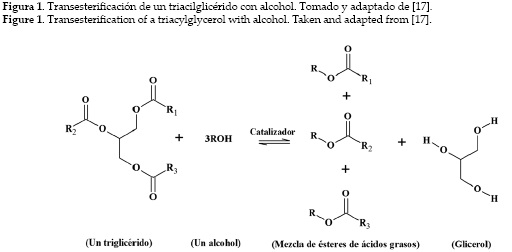
La transesterificación consiste en la reacción de un triéster de glicerilo (triglicérido) con un alcohol para formar alquil ésteres y glicerol. En la figura 1 se muestra una forma simplificada de la reacción de transesterificación de un triacilglicérido.
Debido a que la reacción es reversible, se utiliza alcohol en exceso para desplazar el equilibrio hacia el lado de los productos. El metanol y el etanol son los alcoholes usados con mayor frecuencia, especialmente el metanol debido a su bajo costo y a sus ventajas físicas y químicas (es polar y es un alcohol de cadena corta); además, el metanol reacciona rápidamente con los triacilglicéridos y se disuelve fácilmente en álcalis. Para realizar una transesterificación estequiométricamente completa es necesario mantener una relación molar de alcohol a triacilglicérido de 3:1. En la práctica es necesaria una relación mayor para desplazar el equilibrio y aumentar el rendimiento [17]; desde luego, la velocidad de transesterificación no solo depende de las condiciones de operación o del tipo de catalizador sino también del tipo y variedad de triacilglicéridos presentes en el aceite o en la grasa.
Desde el punto de vista mecanístico, la transesterificación consiste en una serie de reacciones consecutivas reversibles, donde los triacilglicéridos se convierten paso a paso a diglicéridos, monoglicéridos y por último a glicerol, produciendo en cada etapa una mol de alquil éster [17].
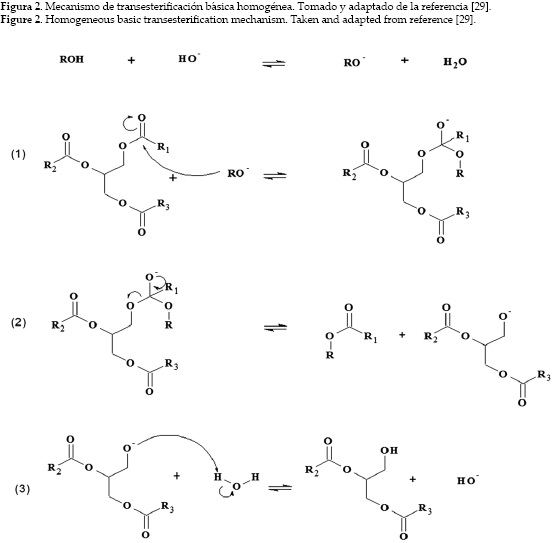
El mecanismo de la reacción de transesterificación por catálisis heterogénea tiene principios similares a los establecidos en la catálisis homogénea de sistemas ácidos o básicos [27], el cual se fundamenta en las características nucleofílicas y electrofílicas del grupo carbonilo de los triacilglicéridos y del alcohol. En la catálisis homogénea básica el factor importante es producir un alcóxido nucleofílico a partir del alcohol (ver figura 2) que luego ataque la parte electrofílica del grupo carbonilo [28]. La ruptura de los triglicéridos requiere de tres pasos: en el primero, se forma un intermediario tetraédrico debido al ataque nucloefílico del alcóxido al carbono electrofílico del grupo carbonilo. En el segundo paso, el intermediario se descompone formando un ion diacilglicérido y el éster alquílico del ácido graso. En el último paso se recupera el catalizador por transferencia de un protón. Estos pasos se repiten hasta formar los tres ésteres de ácidos grasos y glicerina [21]. En catálisis ácida homogénea, inicialmente el grupo carbonilo del triglicérido se protona por acción del catalizador ácido, luego sufre el ataque del alcohol formando un intermediario tetraédrico inestable que se descompone en el éster del ácido graso y el ion diacilglicérido. A diferencia de la catálisis básica, el átomo de carbono del grupo carbonilo de los triacilglicéridos se vuelve más electrofílico y más susceptible a ser atacado por el alcohol. Este proceso es más lento que el mecanismo básico. Esta importante diferencia en el mecanismo hace que los procesos tengan lugar a través de distintas velocidades de reacción [27].
Al igual que en catálisis homogénea, las características ácidas y básicas en catálisis heterogénea son propiedades importantes en la transesterificación de triacilglicéridos. A diferencia de los sistemas homogéneos, en la catálisis heterogénea la adsorción de especies y la desorción de productos se llevan a cabo en la superficie del catalizador sólido [27].
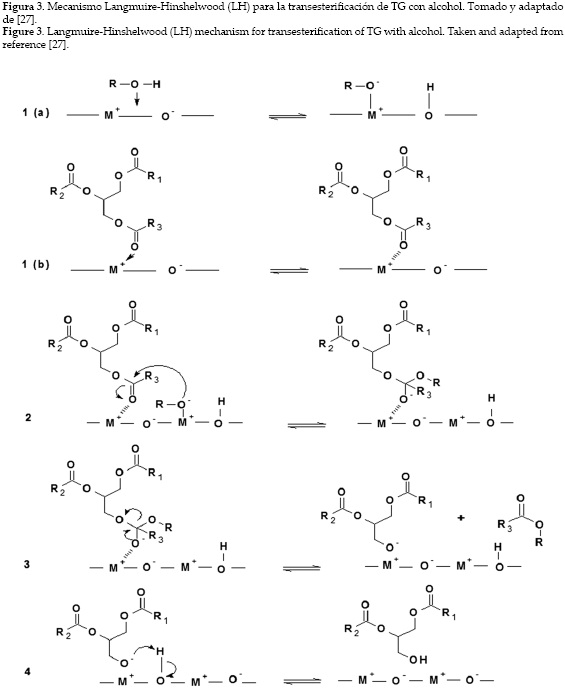
Con respecto a la catálisis heterogénea ácida en reacciones de transesterificación, se han propuesto dos hipótesis sobre el mecanismo de reacción: mecanismo de un solo sitio (tipo Eley-Rideal (ER)) o de doble sitio (modelo de Langmuir-Hinshelwood (LH)) [30-32]. En el mecanismo de reacción de un solo sitio, un carbonilo del triacilglicérido se adsorbe en el sitio activo del catalizador y luego es atacado por el alcohol en la fase líquida. El mecanismo del doble sitio sugiere que los dos reactantes (triacilglicérido y alcohol) se adsorben en sitios activos del catalizador, de manera que la reacción ocurre con las dos especies adsorbidas. El modelo LH para la transesterificación de acetato de etilo con metanol empleando óxido de magnesio como catalizador fue estudiada por Dossin et al. [32]. Ambos reactivos son adsorbidos por dos sitios del catalizador y luego reaccionan. La figura 3 muestra que el modelo LH describe la reacción de transesterificación básica. El mecanismo tiene cuatro pasos importantes. El primer paso 1(a) y 1(b) consiste en la adsorción de ambos reactantes en la superficie del catalizador. En el segundo paso (2) se produce un intermediario tetraédrico a partir del grupo alcóxido. Un éster del ácido graso se produce en el tercer paso y un diacilglicérido es el producto en el último paso.
Tanto los catalizadores sólidos ácidos como los básicos pueden ser del tipo Brønsted y Lewis. El mecanismo de transesterificación de triacilglicéridos empleando catalizadores sólidos básicos con fundamento en el modelo ER consiste en la adsorción del alcohol en el sitio catalítico para formar un ion alcóxido, que luego ataca al carbono positivamente polarizado del triacilglicérido en la fase líquida [27].
3. Catalizadores heterogéneos empleados en la transesterificación de triglicéridos
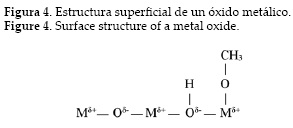
3.1 Óxidos de metales alcalinotérreos Los óxidos de metales alcalinotérreos (MgO, CaO, SrO y BaO) son conocidos como catalizadores tipo óxidos metálicos básicos; en consecuencia, son susceptibles de utilizarlos en reacciones de transesterificación de aceites vegetales. El sitio básico de estos óxidos metálicos se genera por la presencia del ion metálico (catión) el cual se comporta como un ácido de Lewis y el ion oxígeno negativo (anión) como un sitio básico de Brønsted. En la metanólisis por ejemplo, el metanol es adsorbido en la superficie y el enlace O-H se rompe formando el ion metóxido, luego el catión hidrógeno es atacado por el anión oxígeno, como se muestra en la figura 4 [27].
Los óxidos de metales alcalinotérreos son catalizadores promisorios porque son más económicos, menos solubles que los óxidos metálicos del grupo I y la mayoría de ellos no son tóxicos. Su estudio ha sido muy amplio principalmente en reacciones orgánicas [27]. En los óxidos de los metales alcalinotérreos, el número de sitios básicos disminuye con el orden MgO > CaO > SrO > BaO mientras que la fortaleza básica se incrementa en el orden MgO < CaO < SrO < BaO [33-36].
El MgO es un sólido de gran importancia técnica, usado ampliamente como material refractario. Su interés catalítico radica en el carácter básico de su superficie, lo que lo convierte en un catalizador y soporte catalítico eficaz. El óxido de magnesio presenta una alta basicidad en virtud de la presencia en la superficie de iones O2-por lo que fácilmente puede capturar protones. Pero exhibe una débil basicidad de Lewis debido a los iones Mg2+. El MgO se obtiene principalmente por tratamiento térmico de carbonato o de hidróxido de magnesio y más recientemente, por el método sol-gel [37] a partir de alcóxidos.
López et al. [38] emplearon MgO como catalizador en la transesterificación de triacetina y obtuvieron una conversión del 18% de la materia prima después de 8 h de reacción; la razón de este bajo rendimiento lo atribuyen a la baja área superficial del catalizador. Recientemente el MgO ha demostrado tener actividad catalítica para la síntesis de biodiesel. Di Serio et al. [39] obtuvieron un 92% de rendimiento de biodiesel empleando una relación molar de metanol: aceite de 12:1 con un 5% en peso de catalizador y metanol en condiciones supercríticas después de 1 h de reacción. En otra investigación de Di Serio et al. [40] se estudió la actividad del MgO a partir de tres precursores diferentes en la transesterificación de aceite de soya con metanol. El MgO preparado a partir de (MgCO3)4. Mg(OH)2 demostró tener un área superficial y basicidad mayor que el MgO obtenido a partir de Mg(OH)2y Mg(NO3)2. Los catalizadores se calcinaron a 400°C durante 18 h. El rendimiento de FAME obtenido fue del 98% con el MgO más básico a una temperatura de reacción de 200°C, 5% en peso de catalizador y 60 minutos de tiempo de reacción. La temperatura de calcinación, los precursores y el método de preparación son los principales aspectos que afectan la basicidad.
El CaO es el catalizador sólido básico más ampliamente estudiado, ya que presenta varias ventajas, entre las que se encuentran una larga vida útil, alta actividad catalítica y sólo requiere de condiciones moderadas de reacción [41]. Por otro lado, el CaO ha atraído mucho la atención por sus diversas fuentes naturales a partir de desechos, como las cáscaras de huevo o conchas de moluscos; estos depósitos representan una fuente de CaCO3 que, al ser calcinados, producen óxido de calcio [42, 43].
Yoosuk et al. [44] han utilizado calcita como fuente natural para producir CaO. Esta fuente es barata, muestra elevada basicidad y es amigable con el medio ambiente. Ellos demostraron que la hidratación y posterior descomposición térmica es un método eficaz para aumentar la actividad de la calcita calcinada. Esta técnica genera un óxido de calcio con excelentes propiedades de textura y un gran número de sitios básicos [45, 46]. Sin embargo, la mayoría de las investigaciones utilizan CaO puro [46, 47] o CaO obtenido por descomposición térmica de sales de calcio disponibles comercialmente tales como carbonato de calcio, acetato de calcio, oxalato de calcio y nitrato de calcio [44, 47 48]. Todos los autores están de acuerdo en la obtención de buenos rendimientos de FAME trabajando con temperaturas relativamente bajas, entre los 50°C y 80°C. Sin embargo, el principal inconveniente presentado por el óxido de calcio es que requiere una activación térmica con el fin de eliminar el CO2 y humedad adsorbidas. Esto implica trabajar bajo condiciones de vacío o condiciones de flujo de nitrógeno con el fin de evitar su carbonatación [41].
Granados et al. [49] han estudiado el efecto del agua y el CO2 en el deterioro del catalizador en la reacción de transesterificación de aceite de girasol con metanol. Se encontró que, al ponerlo en contacto con el aire, se hidrata y se carbonata rápidamente. Con el fin de evitar el envenenamiento, se debe realizar un tratamiento térmico previo a una temperatura de hasta 700°C. Otro estudio realizado por el mismo autor [50] investigó la lixiviación del catalizador y su contribución en la reacción homogénea en fase líquida en la transesterificación de aceite de girasol con metanol. Se obtuvo que la contribución del catalizador lixiviado es insignificante y que en la porción no lixiviada se encontró como Ca-diacilglicérido.
El CaO obtenido por calcinación de CaCO3 a 900°C ha mostrado una actividad mucho mayor en comparación con sus otros precursores tales como Ca(OH)2, Ca(NO3)2, situación que se ve afectada si el contenido de ácidos grasos libres en el material de partida es alto; en consecuencia, la actividad catalítica del CaO disminuye debido a la formación de jabón [51]. Por otro lado, Cho et al. [52] prepararon CaO por calcinación de diferentes precursores: acetato de calcio, carbonato de calcio, hidróxido de calcio, nitrato de calcio y oxalato de calcio y lo utilizaron en la reacción de transesterificación de tributirina con metanol, y CaO obtenido a partir de Ca(OH)2 a un rango de temperatura de calcinación entre 600°C y 800°C. En este sentido, se mostró que el CaO es mucho más activo en función del rendimiento de metilbutirato obtenido, lo cual contradice un informe presentado por Kouzu et al. [51].
Zabeti et al. [63] indican la conveniencia de utilizar SrO como catalizador heterogéneo en las reacciones de transesterificación. Sin embargo la literatura disponible sobre este tema es muy limitada [54]. Liu et al. [55] observaron que el SrO tiene elevada basicidad y que es insoluble en metanol, en aceite vegetal y en ésteres de metilo; bajo estas condiciones podría ser un catalizador heterogéneo adecuado. Entonces, utilizaron SrO en la transesterificación de aceite de soya, reportando un 90% de rendimiento de FAME en 30 minutos, a una temperatura de 65°C, relación molar alcohol/aceite de 12 y 3% en peso de catalizador. Se reportó además 10 veces su reutilización.
Koberg et al. [56] optimizaron la transesterificación de aceites vírgenes de soya y de cocina para la obtención de biodiesel, con base en la irradiación de microondas como una fuerza impulsora en la reacción de alcohólisis. Según los autores, esta combinación demostró una alta actividad catalítica y estabilidad en el catalizador, obteniendo finalmente conversiones óptimas superiores al 90% de metil ésteres. Medina [57] reportó un rendimiento de FAME del 94,5% en la transesterificación de trioleína con metanol empleando SrO como catalizador heterogéneo en 5 h, a una temperatura de 65°C, relación molar alcohol/aceite de 12 y 3% en peso de catalizador.
Patil y Deng [58] y Patil et al. [59] han estudiado el funcionamiento de los catalizadores del grupo II (óxidos de metales alcalinotérreos) en la reacción de transesterificación de aceite de Camelina sativa (herbácea), jatropha y aceite de cocina usado. En el primer estudio, la transesterificación del aceite de Camelina sativa con metanol se reportó que el rendimiento disminuye en el siguiente orden BaO > SrO > CaO > MgO. El máximo rendimiento de FAME fue de 83% con 1% de BaO a 100°C y un tiempo de reacción de 3 h; sin embargo, el BaO es tóxico y se disuelve en metanol. En el segundo estudio, se diseñó un proceso mixto de transesterificación: una primera etapa de esterificación catalizada por H2SO4, seguida de una transesterificación con óxidos de metales alcalinotérreos como catalizadores. En este estudio el BaO mostró la mayor actividad (que resultó en un rendimiento del 80% de FAME) empleando 2% en peso de catalizador, a 130°C, para el aceite de Camelina sativa. El rendimiento fue menor que el primer estudio debido a la necesidad de neutralizar el contenido de ácido que proviene de la primera etapa de esterificación.
3.2 Zeolitas ácidas
Las zeolitas son una clase de aluminosilicatos cristalinos basados en un esqueleto estructural aniónico rígido, con canales y cavidades bien definidas. Estas cavidades contienen cationes metálicos intercambiables (Na+, K+, etc.) y pueden retener moléculas huésped removibles y reemplazables. La fórmula general de la composición de una zeolita es:
Mx/n[(AlO2)x(SiO2)y].mH2O
Donde los cationes M de valencia n neutralizan las cargas negativas del esqueleto estructural del aluminosilicato [60].
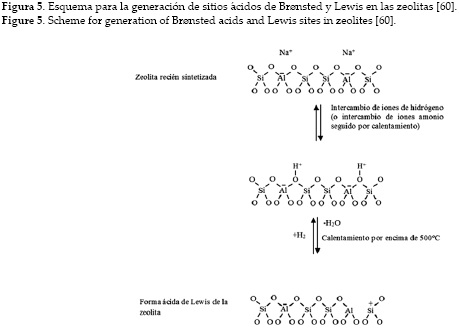
La actividad catalítica de las zeolitas descationizadas se atribuye a la presencia de los sitios acidícos debidos a las unidades tetraédricas de [AlO4] en el armazón. Estos sitios ácidos pueden tener carácter tipo Brønsted o Lewis. Las zeolitas sintetizadas normalmente casi siempre tienen iones Na+ que equilibran las cargas del armazón, pero se pueden intercambiar fácilmente por protones mediante la reacción directa con un ácido, produciendo grupos hidroxilo superficiales: los sitios de Brønsted. Como alternativa, si la zeolita no es estable en disolución ácida, es muy común formar la sal de amonio, NH4+, y luego calentarla para que el amoniaco se desprenda, dejando un protón. Un calentamiento posterior elimina el agua de los sitios Brønsted, quedando un ion de Al tricoordinado que tiene propiedades de aceptor de par de electrones; este se identifica como sitio ácido de Lewis. Un esquema de la formación de estos sitios puede verse en la figura 5. Por consiguiente, las zeolitas pueden presentar sitios ácidos de Brønsted o de Lewis, o ambos dependiendo de cómo se prepare la zeolita [60].
Las zeolitas como catalizadores son muy útiles porque ofrecen un área superficial interna considerable, además son cristalinas y por tanto pueden prepararse con un alto grado de reproducibilidad [60]. Sin embargo su actividad catalítica en las reacciones de transesterificación es relativamente baja (ver tabla 4). Esto se debe principalmente a la limitación de la difusión de los reactivos voluminosos (triglicéridos) en la estructura microporosa de la zeolita [33].
Los triglicéridos con un tamaño molecular medio de 2 nm sufren la resistencia a la transferencia de masa en el microporo de la zeolita. Para superar esta limitación, el tamaño de los poros y la estructura de la zeolita debe ajustarse mediante la relación Si/Al. En general, una mayor relación de Si/Al produce una zeolita con un tamaño de poro más grande [61] pero con una fuerza ácida menor [62]. Por lo tanto, a pesar de que al aumentar el tamaño de poro de la zeolita se supera el problema de limitación difusional la velocidad de reacción es bastante lenta, debido a la disminución de la acidez [63]. En este sentido el diseño de zeolitas mesoporosas que no presenten inconvenientes difusionales ha sido de gran interés en la transesterificación de aceites vegetales [64]. Shah et al [65] sintetizaron una sílice mesoporosa SBA-15 con una alta área superficial, diámetro de poro y volumen de poro con capacidad de acomodar moléculas orgánicas grandes. Este catalizador se probó en la transesterificación de dietilmalonato (DEM) con butanol. A 100°C como temperatura de reacción, relación molar de alcohol/ DEM de 3:1 y 16.5% en peso de catalizador se obtuvo una conversión del 90% después de 24 h de reacción.
3.3 Zeolitas básicas
Las zeolitas pueden modificarse por intercambio de cationes alcalinos o por descomposición de una sal alcalina de un metal ocluido convirtiéndose en sólidos básicos interesantes [69]. La presencia de cationes alcalinos aumenta la densidad electrónica del oxígeno en el armazón, actuando de esta manera como sitio básico. La fuerza de estos centros depende de la estructura del armazón, su composición química y la naturaleza de las interacciones. Las especies compatibles se introducen típicamente a través de impregnación húmeda de una disolución que contiene el precursor solvatado en los poros de la zeolita. La calcinación descompone los compuestos ocluidos y crea los óxidos de metales alcalinos soportados [70].
Los estudios sobre el uso de zeolitas con intercambio de cationes para la producción de biodiesel han sido reportados [71-74], siendo las zeolitas NaX y NaY las más estudiadas [27]. Xie et al. [73] reportaron la transesterificación de aceite de soya usando KOH cargado sobre NaX. Se obtuvo un rendimiento del 85% representado en FAME con un 3% en peso de catalizador, una relación de metanol: aceite de 10:1, a 66°C y tiempo de reacción de 8 h. Pero un segundo uso redujo el rendimiento al 48.7% debido a la lixiviación del potasio en el catalizador. Una situación muy similar fue reportada por Noiroj et al. [75]. En esta investigación emplearon KOH cargado sobre NaY en la transesterificación de aceite de palma con metanol, pero después del primer uso el catalizador presentó lixiviación de potasio. Los resultados de estos estudios muestran que la interacción entre el KOH y las zeolitas NaX y NaY es baja, en consecuencia hay una disminución significativa en su actividad catalítica. Es posible que la causa de este comportamiento se deba a limitaciones difusionales relacionadas con el pequeño diámetro de poro en estos catalizadores [27].
Leclercq et al. [14] estudiaron la alcoholisis de aceite de colza con metanol empleando faujasitas NaX con intercambio de cesio e hidrotalcitas como catalizadores. Para una relación alta de metanol: aceite de 275: 1 y un tiempo de reacción de 22 h se alcanzó un 70% de conversión para la faujasita, mientras que con hidrotalcita solo se obtuvo un 34%. Suppes et al [72] investigaron la transesterificación de aceite de soya con metanol a 60, 120 y 150°C con las zeolitas NaX, ETS-10, y catalizadores metálicos. A 60°C y 24 h de reacción, el rendimiento obtenido fue del 80.7% empleando la zeolita ETS-10 y del 82% cuando se utilizó NaX ocluida con especies de sodio en exceso.
3.4 Heteropoliácidos (HPAs)
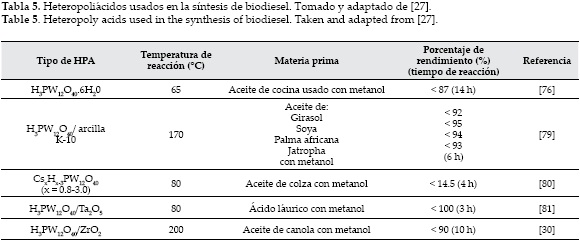
Los heteropoliácidos (HPAs) son ácidos complejos formados a partir de heteropolianiones que tienen como unidad básica octaedros metal-oxígeno. Los tipos Keggin (ver figura 6) son los principalmente usados en el diseño de una variedad de catalizadores ácidos. Las fórmulas generales de las clases de HPAs son: H8-XXxMVI12O40 y H8-x+nXxMVI12-nVVnO40 donde Xx=SiIV,GeIV,PV y AsV y M = MoVI y WVI . En los últimos años se han sintetizado nuevos HPAs por sustitución de Xx = TiIV, ZrIV y ThV. Además de ser considerados ácidos fuertes de Brønsted e inclusive acercarse a la categoría de superácidos, los HPAs han demostrado ser muy estables a altas temperaturas, presentan buenas propiedades mecánicas, facilidad en el manejo, son reutilizables, benignos con el medio ambiente y económicamente factibles. Pero presentan algunos inconvenientes relacionados con su baja área superficial, baja porosidad y dificultades en la recuperación [27]. Los HPAs tipo Keggin, a pesar de ser catalizadores sólidos empleados en reacciones en fase gaseosa, presentan alta solubilidad en medios polares como el agua y metanol, razón por la cual, en la metanólisis del aceite de colza, los heteropoliácidos (H3PW12O40, H4SiW12O40 y H3PMo12O40) actúan como catalizadores homogéneos con un desempeño mayor que los ácidos minerales (H2SO4 y H3PO4). Sin embargo publicaciones recientes han demostrado que heteropoliácidos (H3PW12 y H3PMo12O40) soportados sobre arcilla ácida K-10 mostraron alta eficiencia y estabilidad [76]. Por otro lado, la adición de una relación apropiada de cationes monovalentes (Cs+, NH4+ y Ag+) aumentó significativamente el área superficial, lo cual permitió mayor accesibilidad de los reactivos a los sitios activos [76, 77]. Un resumen sobre el rendimiento de HPAs y condiciones de reacción empleando diferentes materias primas para la producción de biodiesel a partir de aceites vegetales se muestra en la tabla 5.
4. CONCLUSIONES
-
El biodiesel es un combustible renovable y una alternativa energética. Actualmente se produce por transesterificación de aceites vegetales empleando principalmente hidróxidos de sodio y potasio como catalizadores, pero inconvenientes en el proceso de producción como la formación de jabones, dificultad en la recuperación del catalizador y neutralización de aguas residuales, entre otras, han enfocado la atención de los investigadores en la implementación de la catálisis heterogénea empleando catalizadores sólidos, que en virtud de sus características pueden aliviar estos problemas.
-
Los catalizadores sólidos básicos tipo óxidos de metales alcalinotérreos han demostrado ser eficientes en la transesterificación de aceites vegetales, tienen una fuerte capacidad básica y son económicos, desafortunadamente, son sensibles al agua, el CO2 y la presencia de altas concentraciones de ácidos grasos libres en los aceites.
-
Los catalizadores sólidos ácidos tipo zeolitas o heteropoliácidos, pueden emplearse para reacciones de esterificación y transesterificación de manera simultánea, son tolerantes a los ácidos grasos libres y al agua. Pero su morfología limita su estabilidad presentando problemas de lixiviación de los sitios activos, además que las reacciones son más lentas que las catalizadas en medio básico.
Referencias
[1] Avellaneda, F. A. Producción y caracterización de biodiesel de palma y de aceite reciclado mediante un proceso batch y un proceso continuo de un reactor helicoidal. Tesis Doctoral. Universitat Rovira I Virgili, 2010. [ Links ]
[2] M. Kouzu, J. Hidaka, "Transesterification of vegetable oil into biodiesel catalyzed by CaO: A review", Fuel, 93, 1-12, 2012. [ Links ]
[3] D, Cantrell, L. Gillie, A. Lee, K. Wilson, "Structurereactivity correlations in Mg-Al hidrotalcite catalysts for biodiesel synthesis", Appl. Catal. A: Gen., 287,183- 190, 2005. [ Links ]
[4] Z. Helwani, M. R. Othman, N. Aziz, J. Kim, W. J. N. Fernando, "Solid heterogeneous catalysts for transesterification of triclycerides with methanol: A review", Appl. Catal. A: Gen., 363, 1-10, 2009. [ Links ]
[5] A. Demirbas, H. Kara, "New options for conversion of vegetable oils to alternative fuels", Energy Source Part. A, 28, 619-626, 2006. [ Links ]
[6] M. Balat, "Production of biodiesel from vegetable oils: a survey", Energy Source Part. A, 29, 895-913, 2007. [ Links ]
[7] N. Tippayawong, T. Wongsiriamnuay, W. Jompakdee, "Performance and Emissions of a Small Agricultural Diesel Engine Fueled with 100% Vegetable Oil: Effects of Fuel Type and Elevated Inlet Temperature", Asian J. Energy Environ., 3, 139-158, 2002. [ Links ]
[8] B. K. Barnwal, M. P. Sharma, "Prospects of biodiesel production from vegetable oils in India", Renew. Sustain. Energy Rev., 9, 363-378, 2005. [ Links ]
[9] Y. D. Wang, T. Al-Shemmeri, P. Eames, J. McMullan, N. Hewitt, Y. Huang, S. Rezvani, "An experimental investigation of the performance and gaseous exhaust emissions of a diesel engine using blends of a vegetable oil", Appl. Thermal Eng., 26, 1684-1691, 2006. [ Links ]
[10] R. B. da Silva, A. F. L. Neto, L. S. S. dos Santos, J. R.O. Lima, M. H. Chaves, G. M. de Lima, E. M. Moura, C. V. R. Moura, "Catalysts of Cu(II) and Co(II) ions adsorbed in chitosan used in transesterification of soy bean and babas-su oils - A new route for biodiesel syntheses", Bioresour. Technol, 99, 6793-6798, 2008. [ Links ]
[11] Y. Liu, E. Lotero, J. G. Goodwin Jr., X. Mo, "Transesterification of poultry fat with methanol using Mg-Al hydrotalcite derived catalysts". Appl. Catal. A: Gen., 331, 138-148, 2007. [ Links ]
[12] E. Lotero, Y. Liu, D. E. Lopez, K. Suwannakaran, D. A. Bruce, J. G. Goodwin Jr., "Synthesis of biodiesel via acid catalysis", Ind. Eng. Chem. Res. 44, 5353-5363, 2005. [ Links ]
[13] Y. Zhang, M. A. Dube, D. D. McLean, M. Kates, "Biodiesel production from waste cooking oil: Economic assessment and sensitivity analysis", Bioresour. Technol., 90, 229-240, 2003. [ Links ]
[14] E. Leclercq, A. Finiels, C. Moreau, "Transesterification of Rapeseed Oil in the Presence of Basic Zeolites and Related Solid Catalysts", C. J. Am. Oil Chem. Soc., 78, 1161-1169, 2001. [ Links ]
[15] K. Bozbas, "Biodiesel as an alternative motor fuel: production and policies in the European Union". Renew. Sustain. Energy Rev., 12, 542-552, 2008. [ Links ]
[16] K. Ramachandran, T. Suganya, N. Nagendra Gandhi, S. Renganathan, "Recent developments for biodiesel production by ultrasonic assist transesterification using different heterogeneous catalyst: A review", Renew. Sustain. Energy Rev., 22, 410-418, 2013. [ Links ]
[17] D. Leung, X. Wu, M. K. H. Leung, "A review on biodiesel production using catalyzed transesterification", Appl. Energy, 87, 1083-1095, 2010. [ Links ]
[18] N. Azcan, A. Danisman, "Microwave assisted transesterification of rapeseed oil", Fuel, 87, 1781-1788, 2008. [ Links ]
[19] J. W. Goodrum, D. P. Geller, T. T. Adams, "Rheological characterization of animal fats and their mixtures with # 2 fuel oil", Biomass Bioenerg., 24, 249-56, 2003. [ Links ]
[20] K. K. M. Liu, F. T. Barrows, RW. Hardy, F. M. Dong, "Body composition, growth performance, and product quality of rainbow trout (Oncorhynchus mykiss) fed diets containing poultry fat, soybean/corn lecithin, or menhaden oil", Aquaculture, 238, 309-328, 2004. [ Links ]
[21] A. Demirbas, "Biodiesel from waste cooking oil via base-catalytic and supercritical methanol transesterification", Energ. Convers. Manage., 50, 923-927, 2009. [ Links ]
[22] J. Kansedo, K. T. Lee, S. Bhatia, "Cerbera odollam (sea mango) oil as a promising non-edible feedstock for biodiesel production", Fuel, 88, 1148-1150, 2009. [ Links ]
[23] T. A. Kumar, A. Kumar, H. Raheman, "Biodiesel production from jatropha oil (Jatropha curcas) with high free fatty acids: an optimized process", Biomass Bioenerg., 37, 569-575, 2007. [ Links ]
[24] P. K. Sahoo, L. M. Das, "Process optimization for biodiesel production from Jatropha, Karanja and Polanga oils", Fuel, 88, 1588-1594, 2009. [ Links ]
[25] P. D. Patil, S. Deng, "Optimization of biodiesel production from edible and nonedible vegetable oils", Fuel, 88, 1302-1306, 2009. [ Links ]
[26] M. Fangrui, A. H. Milford, "Biodiesel production: a review", Bioresource Technol., 70, 1-15, 1990. [ Links ]
[27] A. Endalew, J. Kiros, R. Zanzi, "Inorganic heterogeneous catalysts for biodiesel production from vegetable oils", Biomass Bioenerg., 35, 3787-3809, 2011. [ Links ]
[28] U. Schuchardta, R. Serchelia, R. M. Vargas, "Transesterification of vegetable oils: a review". J. Braz. Chem. Soc., 9,199-210, 1998. [ Links ]
[29] K. L. Man, T. L. Keat, R. M. Abdul, "Homogeneous, heterogeneous and enzymatic catalysis for transesterification of high free fatty acid oil (waste cooking oil) to biodiesel: A review", Biotechnol. Adv. 28, 500-518, 2010. [ Links ]
[30] K. Suwannakarn, E. Lotero, J. G. Goodwin Jr., "Solid Brønsted acid catalysis in the gas-phase esterification of acetic acid", Ind. Eng. Chem. Res., 46, 7050-7056, 2007. [ Links ]
[31] S. Z. M. Shamshuddin, N. Nagaraju, "Liquid phase transesterification of methyl salicylate and phenol over solid acids: kinetic studies", J. Mol. Catal. A Chem., 273, 55-63, 2007. [ Links ]
[32] T. F. Dossin, M-F. Reyniers, G. B. Marin, "Kinetics of heterogeneously MgO-catalyzed transesterification", Appl. Catal. B, 61, 35-45, 2006. [ Links ]
[33] A. Kiss, A. C. Dimian, G. Rothenberg, "Solid acid catalysts for biodiesel production towards sustainable energy" Adv. Synth. Catal., 348, 75-81, 2006. [ Links ]
[34] K. I. Mbaraka, RR. Daniela, VS-Y. Lin, B. H. Shanks, "Organosulfonic acid functionalized mesoporous silicas for the esterification", J. Catal., 219, 329-336, 2003. [ Links ]
[35] X. Mo, E. Lotero, C. Lu, Y. Liu, J. G. Goodwin Jr, "A novel sulfonated carbon composite solid acid catalyst for biodiesel synthesis", Catal. Lett., 123, 1-6, 2008. [ Links ]
[36] M. Zabeti, W. M. A.W. Daud, M. K. Aroua, "Activity of solid catalysts for biodiesel production: a review", Fuel Process Technol., 90, 770-777, 2009. [ Links ]
[37] B. Yoosuk, P. Krasaea, B. Puttasawata, P. Udomsapa, N. >Viriya-empikulb, F. Kajornsak, "Magnesia modified with strontium as a solid base catalyst for transesterification of palm olein", Chem. Eng. J., 162, 58-66, 2010. [ Links ]
[38] D. E. Lopez, D. A. Bruce Jr., J. G. E. Lotero, J. G. E. "Transesterification of triacetin with metanol on solid acid and base catalysts", Appl. Catal. A: Gen., 295, 97-105, 2005. [ Links ]
[39] M. Di Serio, R. Tesser, L. Pengmei, E. Santacesaria, "Heterogeneous catalysts for biodiesel production", Energ. Fuels, 22, 207-217, 2008. [ Links ]
[40] M. Di Serio, M. Ledda, M. Cozzolino, G. Minutillo, R. Tesser, E. Santacesaria, "Transesterification of soybean oil to biodiesel by using heterogeneous basic catalysts. Ind. Eng. Chem. Res., 45, 3009-3014, 2006. [ Links ]
[41] M. E. Borges, L. Díaz, "Recent developments on heterogeneous catalysts for biodiesel production by oil esterification and transesterification reactions: A review", Renew. Sust. Energ. Rev., 216, 2839-2849, 2012. [ Links ]
[42] N. Viriya-empikul, P. Krasae, B. Puttasawat, B. Yoosuk, N. Chollacoop, K. Faungnawakij, "Waste shells of mollusk and egg as biodiesel production catalyst", Bioresource Technol., 101,3765-3767, 2010. [ Links ]
[43] YB. Cho, G. Seo, "High activity of acid-treated quail eggshell catalyst in the transesterification of palm oil with methanol". Bioresource Technol, 101, 8515-8519, 2010. [ Links ]
[44] B.Yoosuk, P. Udomsap, B. Puttasawat, P. Krasae, "Modification of calcite by hydration-dehydration method for heterogeneous biodiesel production process: the effects of water on properties and activity", Chem. Eng. J., 162, 135-141, 2010. [ Links ]
[45] M. Verziu, S. M. Coman, R. Richards, V. I. Parvulescu, "Transesterification of vegetable oils over CaO catalysts", Catal. Today, 167, 64-70, 2011. [ Links ]
[46] D. Vujicic, D. Comic, A. Zarubica, R. Micic, G. Boskovic, "Kinetics of biodiesel synthesis from sunflower oil over CaO heterogeneous catalyst", Fuel, 89, 2054-2061, 2010. [ Links ]
[47] D. Martín Alonso, F. Vila, R. Mariscal, M. Ojeda, M. López Granados, J. Santamaría-González, "Relevance of the physicochemical properties of CaO catalyst for the methanolysis of triglycerides to obtain biodiesel", Catal. Today, 158, 114-120, 2010. [ Links ]
[48] M. López Granados, A. C. Alba-Rubio, F. Vila, D. Martín Alonso, R. Mariscal, "Surface chemical promotion of Ca oxide catalyst in biodiesel production reaction by the addition of monoglycerides, diglycerides and glycerol", J. Catal., 276, 229-236, 2010. [ Links ]
[49] M. López Granados, D. Martín Alonso, M. D. Z. Zafra Poves, R. Mariscal, F. Cabello Galisteo, R. Moreno-Tost, J. Santamaría, J. L. G. Fierro, "Biodiesel from sunflower oil by using activated calcium oxide", Appl. Catal. B, 73, 317-326, 2007. [ Links ]
[50] M. López Granados, D. Martín Alonso, I. Sádaba, R. Mariscal, P. Ocón, "Leaching and homogeneous contribution in liquid phase reaction catalyzed by solids: the case of triglycerides methanolysis using CaO", Appl. Catal. B, 89, 265-272, 2009. [ Links ]
[51] M. Kouzu, T. Kasuno, M. Tajika, Y. Sugimoto, S. Yamanaka, J. Hidaka, "Calcium oxide as a solid base catalyst for transesterification of soybean oil and its application to biodiesel production", Fuel, 87, 2798-2806, 2008. [ Links ]
[52] B. Y. Cho, G. Seo, D. R. Chang, "Transesterification of tributyrin with methanol over calcium oxide catalyst prepared from varies precursors", Fuel Process Technol., 90, 1252-1258, 2009. [ Links ]
[53] M. Zabeti, M. Wan, D. Wan, "Activity of solid catalysts for biodiesel production: a review". Fuel Process Technol., 90, 770-777, 2009. [ Links ]
[54] A. P. Singh Chouhan, A. K. Sarma, "Modern heterogeneous catalysts for biodiesel production: A comprehensive review", Renew. Sust. Energ. Rev., 15, 4378- 4399, 2011. [ Links ]
[55] R. Liu, X. Wang, X. Zhao, P. Feng, "Sulfonated ordered mesoporous carbon for catalytic preparation of biodiesel", Carbon, 46,1664-1669, 2008. [ Links ]
[56] M. Koberg, R. Abu-Much, A. Gedanken, "Optimization of bio-diesel production from soybean and wastes of cooked oil: Combining dielectric microwave irradiation and a SrO catalyst", Bioresource Technol., 102, 1073-1078, 2011. [ Links ]
[57] A. J. Medina, Transesterificación de triacilglicéridos con metanol sobre un catalizador de SrO/SiO2. Trabajo de Grado de Maestría. Universidad Nacional de Colombia, Bogotá D.C., 2011. [ Links ]
[58] P. D. Patil, S. Deng, "Transesterification of camelina sativa oil using heterogeneous metal oxide catalysts", Energ. Fuels, 23, 4619-4624, 2009. [ Links ]
[59] P. D. Patil, V. G. Gude, S. Deng, "Biodiesel production from jatropha curcas, waste cooking, and camelina sativa oils". Ind. Eng. Chem. Res., 48, 10850-10856, 2009. [ Links ]
[60] L. Smart, E. Moore, Química del estado sólido. Wilmington, Delaware, E. U. A. 1995. p. 191. [ Links ]
[61] T. Okuhara, "Water-tolerant solid acid catalysts", Chem Rev., 102, 3641-66, 2002. [ Links ]
[62] K. H. Chung, D. R. Chang, B. G. Park, "Removal of free fatty acid in waste frying oil by esterification with methanol on zeolite catalysts", Bioresour. Technol., 99, 7438-43, 2008. [ Links ]
[63] A. Brito, M. E. Borges, N. Otero, "Zeolite Y as a heterogeneous catalyst in biodiesel fuel production from used vegetable oil", Energ. Fuels., 21, 3280-3283, 2007. [ Links ]
[64] Z. C. Zhang, M. Dery, S. Zhang, D. Steichen, "New process for the production of branched-chain fatty acids", J. Surfactants Deterg., 7, 211-215, 2004. [ Links ]
[65] P. Shah, A. V. Ramaswamy, K. Lazar, V. Ramaswamy, "Synthesis and characterization of tin oxide-modified mesoporous SBA-15 molecular sieves and catalytic activity in transesterification reaction", Appl. Catal. A, 73, 239-248, 2004. [ Links ]
[66] M. Sasidharan, R. Kumar, "Transesterification over various zeolites under liquid-phase conditions", J. Mol. Catal. A: Chem., 210, 93-98, 2004. [ Links ]
[67] Q. Shu, B. Yang, H. Yuan, S. Qing, G. Zhu, "Synthesis of biodiesel from soybean oil and methanol catalyzed by zeolite beta modified with La3+". Catal. Commun., 8, 2159-2165, 2007. [ Links ]
[68] A. A. Kiss, F. Omota, A.C. Dimian, G. Rothenberg, "The heterogeneous advantage: biodiesel by catalytic re-active distillation", Top. Catal., 40,141-150, 2006. [ Links ]
[69] G. Suppes, M. Dasari, E. Doskocil, P. Mankidy, M. Goff, "Transesterification of soybean oil with zeolite and metal catalysts", Appl. Catal. A: Gen., 257, 213-223, 2004. [ Links ]
[70] S. Martínez, R. Romero, R. Natividad, J. González, "Optimization of biodiesel production from sunflower oil bytransesterification using Na2O/NaX and metanol", Catal. Today, 220- 222, 12- 20, 2014. [ Links ]
[71] A. Teng, L. Gao, G. Xiao, H. Liu, "Transesterification of soybean oil to biodiesel over heterogeneous solid base catalyst", Energ. Fuels, 23,4630-4634, 2009. [ Links ]
[72] G. J. Suppes, M. A. Dasari, E. J. Doskocil, P.J. Mankidy, M. J. Goff, "Transesterification of soybean oil with zeolite and metal catalysts", Appl. Catal. A, 257, 213-223, 2004. [ Links ]
[73] W. Xie, X. Huang, H. Li, "Soybean oil methyl esters preparation using NaX zeolites loaded with KOH as a heterogeneous catalyst", Bioresour. Technol., 98,936-939, 2007. [ Links ]
[74] L. Wang, J. Yang, "Transesterification of soybean oil with nano-MgO or not in supercritical and subcritical methanol", Fuel, 86, 328-333, 2007. [ Links ]
[75] K. Noiroj, P. Intarapong, A. Luengnaruemitchai, S. Jai-In, S. "A comparative study of KOH/Al2O3 and KOH/ NaY catalysts for biodiesel production via transesterification from palm oil", Renew. Energ., 34, 1145-1150, 2009. [ Links ]
[76] A. Zieba, L. Matachowski, J. Gurgul, E. Bielańska, A. Drelinkiewicz, "Transesterification reaction of triglycerides in the presence of Ag-doped H3PW12O40", J. Mol. Catal. A: Chem., 310, 30-44, 2010. [ Links ]
[77] K. Narasimharao, D. R. Brown, A. F. Lee, A. D. Newman, P. F. Siril, S. J. Tavener, "Structure-activity relations in Cs-doped heteropoly acid catalysts for biodiesel production". J. Catal., 248,226-34, 2007. [ Links ]
[78] J. Maestre, X. Lopez, C. Bo, J-M. Poblet, N. Casañ-Pastor, "Electronic and Magnetic Properties of R-Keggin Anions: A DFT Study of [XM12O40]n-, (M = W, Mo; X = A1III,SiIV, PV, FeIII, CoII, CoIII) and [SiM11VO40]m-(M = Mo and W)", J. Am. Chem. Soc., 123, 3749-3758, 2001. [ Links ]
[79] S. Furuta, H. Matsuhashi, K. Arata, "Biodiesel fuel production with solid amorphous-zirconia catalysis in fixed bed reactor", Biomass Bioenerg., 30, 870-873, 2006. [ Links ]
[80] K. Suwannakarn, E. Lotero, K. Ngaosuwan, J. G. Goodwin Jr., "Simultaneous free fatty acid esterification and triglyceride transesterification using a solid acid catalyst with in situ removal of water and un reacted methanol". Ind. Eng. Chem. Res., 48, 2810-288, 2009. [ Links ]
[81] X-R. Chen, Y-H. Ju, C-Y. Mou, "Direct synthesis of mesoporous sulfated silica-zirconia catalysts with high catalytic activity for biodiesel via esterification", J. Phys. Chem. C, 111, 18731-18737, 2007. [ Links ]