Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Prospectiva
versão impressa ISSN 1692-8261
Prospect. vol.13 no.2 Barranquilla jul./dez. 2015
https://doi.org/10.15665/rp.v13i2.486
DOI: http://dx.doi.org/10.15665/rp.v13i2.486
Degradación de fenol por proceso Haber-Weiss fotoinducido por luz visible con tetracarboxifenilporfirina de cobre (II) anclada al dióxido de titanio
Phenol photodegradation by Haber-Weiss process under visible light on copper (II) tetracarboxyphenyl porphyrin supported on titanium dioxide
Carlos E. Diaz-Uribe1*, William Vallejo1, Yelitce Reales1, Paola Correa1
1 Grupo de Investigación en Fotoquímica y Fotobiología. Programa de Química. Facultad de Ciencias Básicas. Universidad del Atlántico. Kilómetro 7 Antigua Vía Puerto Colombia, Barranquilla, Colombia.
carlosdiaz@mail.uniatlantico.edu.co
Recibido 15/02/15, Aceptado 19/06/2015
Cite this article as: C. Diaz, W. Vallejo, Y. Reales, P. Correa, "Phenol photodegradation by Haber-Weiss process under visible light on copper (II) tetracarboxyphenyl porphyrin supported on titanium dioxide", Prospect, Vol 13, N° 2, 47-53, 2015.
Resumen
La degradación de fenol por radicales hidroxilo fue estudiada en solución acuosa. Las reacciones fueron realizadas en un sistema heterogéneo utilizando la tetra(4-carboxifenil)porfirina de cobre (II) adsorbida sobre dióxido de titanio (TCPPCu/TiO2) bajo radiación de luz visible. La TCPPCu/TiO2 fue caracterizada por UV-Vis, IR y EPR. Se demostró la generación de radical hidroxilo a partir del sistema TCPPCu/TiO2/H2O2 en presencia de luz visible, midiendo la fluorescencia del 2-hidroxitereftalato disódico, producto de reacción entre el radical hidroxilo y el tereftalato disódico. Adicionalmente se estudió el efecto del pH sobre el proceso de foto-oxidación. La hidroquinona, catecol, y benzoquinona fueron identificadas por HPLC como los productos principales de la reacción de la fotooxidación. La oxidación catalítica del fenol siguió una cinética global de pseudo-primer orden con una constante de velocidad igual a 0,0192 min-1.
Palabras clave: Radical hidroxilo, Porfirina, TiO2, Fenol.
Abstract
In this work we studied phenol photo-degradation by hydroxyl radicals action in aqueous solution. The reactions were performed in a heterogeneous system for using tetra (4-carboxyphenyl) porphyrin copper (II) supported on titanium dioxide (TCPPCu/TiO2) under visible light radiation. UV-Vis, IR and EPR analysis were used to study physicochemical properties of the TCPPCu/TiO2. Hydroxyl radical generation was detected to TCPPCu/TiO2/H2O2 system under visible light radiation through chemical trapping reaction between hydroxyl radicals and disodium terephthalate. Along, we studied pH effect on photo-oxidation process. Hydroquinone, catechol, benzoquinone and HPLC were identified as the major products of the photo-degradation reaction. Finally, the catalytic phenol oxidation fitted a global pseudo-first kinetics; we determined that rate constant to the phenol oxidation was 0. 0192 min-1.
Keywords: Hydroxyl radical, porphyrin, TiO2, Phenol.
1. Introducción
Los fenoles ocupan un lugar prominente entre los mayores contaminantes de las aguas subterráneas, debido a su alta toxicidad y a los efectos carcinogénicos y mutagénicos que pueden causar en los seres humanos [1, 2]. Estos compuestos y sus derivados están presentes en las aguas residuales provenientes de la industria de adhesivos, antisépticos, petroquímica, pinturas, textiles, plantas de plaguicidas, entre otras [3].
Los métodos más comunes para el tratamiento de aguas residuales contaminadas con fenoles utilizan la combinación de procesos biológicos, físicos y químicos [4, 5]. Los procesos biológicos tienden a ser muy demorados y los métodos físicos no implican transformaciones químicas; por lo general este tipo de procedimientos transfieren componentes de una fase a otra, pero no los eliminan. Adicionalmente, el tratamiento químico de fenoles, como la cloración, conduce a la formación de fenoles clorados y sus derivados han sido reportados como compuestos tóxicos [6].
Entre otras alternativas para el tratamiento de aguas con fenoles se encuentran los procesos de oxidación avanzada y entre ellos las tecnologías fotocatalíticas [7-9]. Sin embargo, la irradiación directa de fenoles en el agua con luz UV genera compuestos orgánicos más tóxicos como las dibenzo-p-dioxinas [10]. Para evitar utilizar luz ultra-violeta, en este trabajo se buscó un método para degradar el fenol mediante la acción del radical hidroxiloformado fotocatalíticamente en presencia de luz visible, peróxido de hidrógeno y el radical anión superóxido generado en el proceso de transferencia electrónica fotoinducida entre un sensibilizador y el TiO2 [11]. Como sensibilizador se utilizó la tetracarboxifenilporfirina (TCPP) de cobre. Se encontró que la reacción de oxidación del fenol sigue una cinética global de pseudo-primer orden y la hidroquinona, catecol, y benzoquinona fueron identificadas por HPLC como los productos principales de la reacción de la fotooxidación.
2. Materiales y Métodos
2. 1 Síntesis y caracterización de la TCPPCu/TiO2
La tetracarboxifenilporfirina sin metal se sintetizó añadiendo 30 mmol de pirrol previamente destilado a una mezcla de 4-carboxibenzaldehido (30 mmol), ácido propiónico (105 mL) y nitrobenceno (45 mL). La mezcla se calentó a 120 °C durante 1h. El solvente se removió por destilación al vacío y el sólido obtenido se disolvió con una solución de NaOH (0,1 M). La porfirina se precipitó con una solución de HCl 1 M, se disolvió en etanol y se cristalizó por evaporación del solvente [12]. La metaloporfirina se preparó colocando a reflujo la TCPP(0. 33mmol) con 1. 82 mmol de cloruro de cobre (II) decahidratado, en N,N’-dimetilformamida (70 mL) durante 2 h. La N,N’-dimetilformamida se removió por destilación y el sólido obtenido se disolvió en solución de NaOH (0,1 M). La TCPPCu (II) se precipitó con una solución de HCl 1M. Finalmente la porfirina se filtró y se secó a temperatura ambiente.
2. 2 Adsorción de la TCPPCu sobre el TiO2
La adsorción de TCPP en la superficie de TiO2 (TCPP/TiO2) se realizó de acuerdo con el siguiente procedimiento: 0,25 g TiO2 se agregó a 250 mL de una solución etanólica de TCPP (0,2 mM). La suspensión se calentó a 60°C durante 12 h. El sólido se filtró y se lavó con etanol con el fin de remover el colorante sin adsorber. Finalmente se secó a temperatura ambiente [13].
2. 3 Caracterización de los materiales
Los espectros UV-vis de la TCPP y TCPPCu en etanol se registraron usando un espectrofotómetro Hewlett-Packard 8453. El espectro de reflectancia difusa UV-vis de la porfirina adsorbida se registró utilizando un espectrofotómetro Lambda 4 Perkin-Elmer equipado con una esfera de integración, como patrón de referencia se utilizó sulfato de bario. Los espectros IR (pastilla KBr) se tomaron en un espectrofotómetro Bruker Tensor 27. Para la medición por EPR las muestras sólidas de porfirinas se introdujeron en tubos de cuarzo y los espectros se registraron en un espectrofotómetro de resonancia paramagnética electrónica, JOEL (JES-PE-3X), operando en la banda-X (9 GHz) a una temperatura de 298 K.
2. 4 Generación y detección del radical hidroxilo
Las reacciones se llevaron a cabo en un foto reactor de cuarzo tipo "inmersión well", fabricado por Ace Glass-7880. Para la generación de radical hidroxilo se utilizaron 1g/Lde TCPPCu/TiO2 a una temperatura de 25°C, posterior se adicionó 100 μL H2O2 (30%) a un pH=3 en atmósfera de oxígeno. Las reacciones se llevaron a cabo en presencia de irradiación visible utilizando una lámpara azul de 8 watts marca Philips. Varias muestras de la solución se colectaron, se filtraron y se registraron en un espectrofluorímetro SHIMADZU RF-5301PC en modo de emisión a una longitud de onda de excitación de 315 nm.
2. 5 Reacción de foto oxidación del fenol
Las reacciones de fotooxidación del fenol se realizaron en atmósfera de oxígeno en un fotoreactor (immersion well) a diferentes valores de pH (2. 0, 3. 0, 4. 0, 5. 0). Antes de la irradiación, las suspensiones se agitaron durante 1 h en oscuridad con el fin de asegurar el equilibrio adsorción/desorción del fenol sobre la superficie del sólido. Todos los experimentos fueron llevados a 25°C y la concentración de la TCPPCu (0,21 mmol)/TiO2 fue de 1g/L. La identificación y cuantificación de los productos de oxidación se realizó por HPLC (Agilent 1100) utilizando un detector de arreglo de diodos y una columna Agilent Zorbax C18 como fase estacionaria. Se utilizó un flujo isocrático de la fase móvil (70% acetonitrilo y 30% agua) de 1mL/min. El fenol y los intermediarios aromáticos se identificaron ajustando el detector UV en λ = 210 nm (fenol, hidroquinona, catecol) y 245 nm (p-benzoquinona).
3. Resultados y Discusión
3. 1 Síntesis y caracterización de la TCPPCu/TiO2
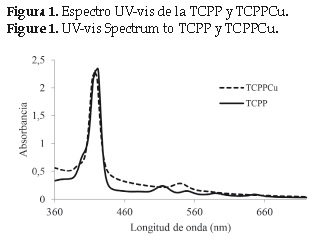
El espectro UV-vis de la TCPP obtenida en este trabajo se muestra en la (figura 1), en él se observa la banda de absorción Soret a 419 nm (transición a1u(π)-eg*(π)), y 4 bandas Q(514, 548, 588 y 645 nm) características de la porfirina no metálica, correspondientes a transiciones a2u(π)-eg*(π) [14]. El espectro UV-vis de la TCPPCu exhibe la banda Soret a 417 nm y 1 banda Q en 539 nm. La disminución del número de bandas Q es típico de las metaloporfirinas. Cuando el ión metálico se coordina con los átomos de nitrógeno del macrociclo, la simetría de la molécula se incrementa y el número de bandas Q decrece [15]. La metalación de las porfirinas produce desplazamiento de la bandas Soret y Q por la interacción del metal con la nube electrónica π de los macrociclos. En el espectro de la TCPPCu se observa un desplazamiento de las bandas de absorción hacia el azul, posiblemente debido a la desestabilización de la nube electrónica π del ligando inducida por el metal e incremento de la energía de transición [15].
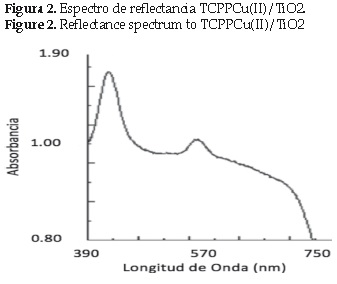
El espectro de reflectancia difusa de la TCPPCu/TiO2 se muestra en la figura 2. Las bandas de absorción de TCPP-Cu adsorbida sobre TiO2 son anchas y de menor intensidad con respecto al espectro de TCPPCu (II), y muestran un corrimiento hacia la región del rojo que puede atribuirse a la distorsión de los anillos de porfirina; el desplazamiento hacia el rojo generalmente se observa cuando las porfirinas son inmovilizadas sobre soportes inorgánicos [16]. En el caso de la TCPPCu adsorbida al TiO2, labanda Soret es desplazada de 417 a 425 nm y la banda Q de igual manera es desplazada de 539 a 547 nm.
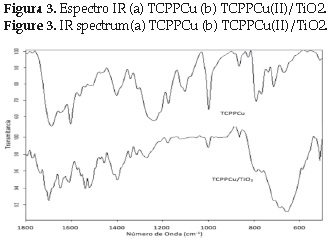
Los espectros de absorción (1800-1000 cm-1) de la TCPP-Cu y TCPPCu /TiO2 se muestran en la figura 3. Para la porfirina, la banda característica del grupo ácido carboxílico, ν(C=O), se observa en torno a 1701 cm-1. Los modos de tensión C-O se observan en 1225 cm-1 y 1268 cm-1. Debido a que la TCPPCu puede adsorberse a la superficie del TiO2 a través de los ácidos carboxílicos, se observó una disminución significativa en la intensidad de las bandas correspondientes a los grupos carboxilato. El espectro de la porfirina adsorbida muestra la presencia de las bandas asimétrica y simétrica de los grupos carboxilato: en 1650 cm-1ν(-COOas-) y en 1381 cm-1ν(-COOs-). Estos resultados permiten indicar que probablemente la porfirina se encuentra anclada a través de un enlace carboxilato sobre la superficie del TiO2.
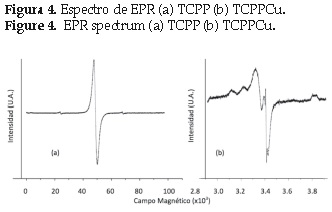
En la figura 4a se muestra un espectro EPR típico de la TCPP, los espectros EPR de la TCPP exhiben una sola línea (La señal observada de la porfirina es generada por la interacción de los electrones π deslocalizados del macrociclo con el campo magnético. La intensidad en la señal sugiere que los radicales libres (g= 2. 003) producidos por la porfirina son estables y pueden medirse por EPR en condiciones normales, a temperatura ambiente y sin la adición de trampas de radicales [15]. La figura 4b muestra el espectro EPR de la TCPPCu, en este espectro el Cu2+ exhibe propiedades paramagnéticas ya que tiene un electrón no apareado en los orbitales d. Se puede observar un grupo de cuatro líneas resueltas en dirección paralela para el Cu en la TCPPCu. Estas líneas son características del Cu2+ (3d9), con S=1/2 y I=3/2. La estructura hiperfina de la TCPPCu2+ es debida a la interacción del electrón no apareado con su propio núcleo (I=3/2) [13]. La intensidad de la señal de EPR generada por el Cu2+ es menor que la señal de radical libre y se observó una superposición.
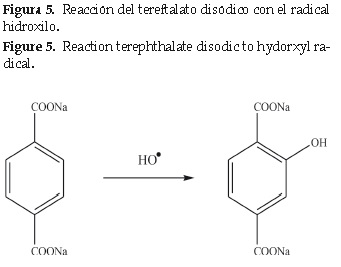
El seguimiento de la reacción de realizó midiendo cada 10 min el espectro de la emisión de fluorescencia de la solución durante la irradiación. La figura 6 muestra que cuando no hay iluminación no se genera ninguna señal de fluorescencia indicando que no se generó ningún radical, también se observó un incremento gradual de la intensidad de fluorescencia a 425 nm con el aumento en el tiempo de iluminación. El espectro observado corresponde al compuesto 2-hidroxitereftalato disódico, producto de la reacción entre el radical hidroxilo y el tereftalato disódico (figura 5) [17].
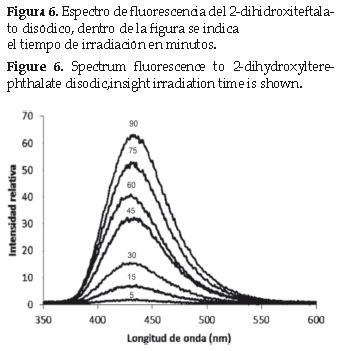
La presencia de fluorescencia indica que el sistema TCPPCu/TiO2/H2O2/O2 en presencia de luz visible genera el radical hidroxilo permitiendo la formación de la especie fluorescente. El proceso de transferencia electrónica desde el estado excitado de la porfirina a la BC del TiO2 y desde esta al 3O2 es un proceso termodinámicamente posible. El estado 1TCPPCu* adsorbido sobre el TiO2 le transfiere un electrón a la banda de conducción del TiO2, este también puede ser transferido al 3O2 para generar el radical anión superóxido [13]. A su vez, el radical anión superóxido puede reaccionar con el peróxido de hidrógeno bajo una reacción tipo Haber Weiss para producir radical hidroxilo.
3. 3 Reacción de foto oxidación del fenol
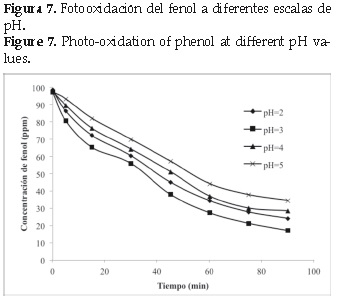
En la foto oxidación del fenol se realizaron pruebas preliminares de degradación a pH (2. 0, 3. 0, 4. 0, 5. 0) y los resultados obtenidos se muestran en la (figura 7). Estos resultados indican que el pH influye en la degradación del fenol. La gráfica muestra que el pH óptimo para la degradación fotocatalítica del fenol es de 3. 0, esto puede ser debido a que el radical hidroxilo presenta el mayor potencial de oxidación (2. 80 V) [18].
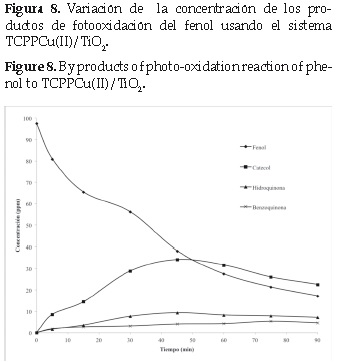
El cambio en la concentración de los productos de oxidación en función del tiempo se indica en la (figura 8). Se puede apreciar que, en la primera hora de la reacción, el catecol (CT), la hidroquinona (HQ) y la benzoquinona (BQ), son los productos mayoritarios. Sin embargo, después de los 45 minutos se observa que la concentraciónde estos disminuye, esto puede ser debido a la formación de otros productos de la reacción (ácidos de cadena corta), que no pudieron ser separados e identificados por HPLC. Estudios recientes muestran que la oxidación de fenoles por radicales hidroxilo culmina con la formación de ácidos de cadena corta como ácido cis-mucónico, ácido succínico, ácido oxálico, ácido acético y ácido fórmico, sin embargo aún no se conoce el mecanismo a partir de la benzoquinona, y el radical hidroxilo se forman los respectivos ácidos [19]. El estudio cinético se llevó a cabo con los resultados experimentales a partir del tiempo cero de la reacción. La reacción se realizó a una temperatura de 25°C, la concentración inicial de fenol fue de 97,6 ppm y la del sensibilizador adsorbido (TCPPCu/TiO2) 1gL-1 a pH = 3. 0. La gráfica se muestra en la figura 9.
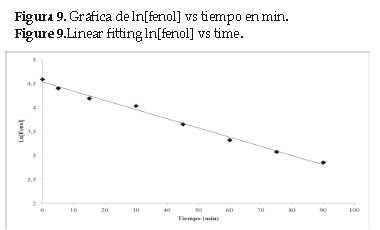
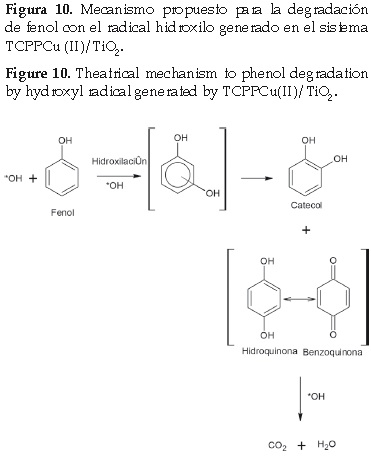
La relación entre ln[Fenol] frente al tiempo es lineal, por lo tanto, el mecanismo propuesto para desarrollar la cinética de la reacción catalítica del fenol se basa en un modelo de pseudo primer orden. El valor de la constante de velocidad en las condiciones de reacción dada se calcula a partir de la pendiente, el valor de la constante es: 0,0192 min-1. Con respecto al mecanismo de reacción, diferentes vías han sido propuestas para la oxidación del fenol en fase acuosa [20, 21]. En general, la degradación del fenol se lleva a cabo en un proceso secuencial que pasa a través de la formación de varios productos intermedios. En este proceso fotocatalítico se propone un esquema de reacción similar al reportado por Wang y colaboradores [22]. El radical hidroxilo ya formado puede iniciar un ataque electrofílico al fenol conduciendo a la hidroxilación del anillo bencénico. La descomposición del fenol podría seguir rutas diferentes, dando lugar a los principales intermedios detectados (hidroquinona, catecol y benzoquinona). Los subproductos finales son ácidos carboxílicos y en caso de llevar la oxidación completa se genera dióxido de carbono y agua. En la figura 10 se muestra el esquema general del mecanismo propuesto.
4. Conclusiones
El sistema TCPPCu(II)/TiO2 en presencia de peróxido de hidrógeno y luz visible genera radical hidroxilo y esta especie reactiva del oxígeno es la responsable de iniciar el proceso de oxidación del fenol; los estudios de pH indicaros que bajo las condiciones experimentalesutilizadas el pH óptimo para el proceso de foto oxidación fue 3. 0. Losprincipales productos de la oxidación el fenol fueron benzoquinona, catecol, e hidroquinona después de 90 minutos de reacción. La fotooxidación del fenol se ajustó a un modelo cinético de pseudo primer orden con un valor de la constante de 0,0192 min-1, finalmente el mecanismo propuesto según lo reportado en literatura explica una posible ruta para la generación de los principales productos de la fotooxidación.
Referencias
[1] A. Santos, P. Yustos, A. Quintanilla, F. Garcia-Ochoa, J. A. Casas, J. J. Rodríguez, "Evolution of toxicityuponwetcatalyticoxidation of phenol", Environmental Science & Technology, 38, 133-138, 2004. [ Links ]
[2] R. Shijin, "Phenol mechanism of toxic action classification and prediction: a decision tree approach", Toxicology Letters, 144, 313-323, 2003. [ Links ]
[3] S. Rengaraj, S. H. Moon, R. Sivabalan, B. Arabindoo, V. Murugesan, "Removal of phenol from aqueous solution and resin manufacturing industry wastewater using an agricultural waste: rubber seed coat", Journal of Hazardous Materials, 89, 185-196, 2002. [ Links ]
[4] J. Wang, X. Ma, S. Liu, P. Sun, P. Fan, C. Xia, "Biodegradation of Phenol and 4-Chlorophenol by Candida tropicalis W1Procedia", Environmental Sciences, 16,299-303, 2012. [ Links ]
[5] A. B. Ahmed, B. Jibril, S. Danwittayakul, J. Dutta, "Microwave-enhanced degradation of phenol over Ni-loaded ZnOnanorods catalyst", Applied Catalysis B: Environmental, 156, 456-465, 2014. [ Links ]
[6] H. Li, T. T. Shen, X. L. Wang, K. F. Lin, Y. D. Liu, S. G. Lu, J. D. Gu, P. Wang, Q. Lu, X. M. Du, "Biodegradation of perchloroethylene and chlorophenol co-contamination and toxic effect on activated sludge performance", Bioresource Technology, 137, 286-293, 2013. [ Links ]
[7] Y. Zhang, J. Lu, X. Wang, Q. Xin, Y. Cong, Q. Wang, C. Li, "Phenol degradation by TiO2 photocatalysts combined with different pulsed discharge systems", Journal of Colloid and Interface Science, 409, 104-111, 2013. [ Links ]
[8] A. Jamali, R. Vanraes, P. Hanselaer, T. V. "Gerven, Abatch LED reactor for the photocatalytic degradation of phenol", Chemical Engineering and Processing: Process Intensification, 71, 43-50, 2013. [ Links ]
[9] M. Aslam, I. Ismail, S. Chandrasekaran, A. Hameed, "Morphology controlled bulk synthesis of disc-shaped WO3 powder and evaluation of its photocatalytic activity for the degradation of phenols", Journal of Hazardous Materials, 276, 120-128, 2014. [ Links ]
[10] M. Muñoz, Z. De Pedro, J. Casas, J, Rodriguez, "Assessment of the generation ofchlorinated byproducts upon Fenton-like oxidation of chlorophenols at different conditions", Journal of Hazardous Materials, 190, 993-1000, 2011. [ Links ]
[11] C. E. Diaz-Uribe, M. Daza, F. Martínez, E. A. Páez-Mozo, C. Guedes, E. Di Mauro, "Visible light superoxide radical anion generation by tetra(4-carboxyphenyl)porphyrin/TiO2: EPR characterization", Journal of Photochemistry and Photobiology A: Chemistry, 215, 172-178, 2010. [ Links ]
[12] A. D. Adler, F. R. Longo, J. D. Finarelli, J. Goldmacher, J. Assour, L. Korsakoff, "Asimplified synthesis for meso-tetraphenylporphyrin", Journal of Organic Chemistry, 32,476, 1967. [ Links ]
[13] G. Granados-Oliveros, E. Páez-Mozo, F. Martínez Ortega, M. Piccinato, F. Silva, C. L. Barbosa, E. Di Mauro, M. Da Costa, A. Tsutomu, "Visible light production ofsuperoxide anion with MCarboxyphenylporphyrins (M = H, Fe, Co, Ni, Cu, andZn) free and anchored on TiO2: EPR characterization", Journal of Molecular Catalysis A: Chemical, 339, 79-85, 2011. [ Links ]
[14] M. Gouterman, G. H. Wagnière, L. C. Snyder, "Spectra of porphyrins: Part II. Fourorbital model", Journal of Molecular Spectroscopy 11, 108-127, 1963. [ Links ]
[15] W. Zheng, N. Shan, L. Yu, X. Wang, "UV-vis, fluorescence and EPR properties ofporphyrins and metalloporphyrins", Dyes Pigments, 77, 153-157, 2008. [ Links ]
[16] C. E. Diaz-Uribe, M. Daza, F. Martínez, E. A. Páez-Mozo, C. Guedes, E. Di Mauro, "Visible light singlet oxygen production with tetra(4-carboxyphenyl) porphyrin/SiO2", Journal of Photochemistry and Photobiology A: Chemistry, 259, 47-52, 2013. [ Links ]
[17] K. Ishibashia, A. Fujishima, T. Watanabe, K. Hashimoto, "Detection of active oxidative species in TiO2photocatalysis using the fluorescence technique", Electrochemistry Communications, 2, 207-210, 2000. [ Links ]
[18] A. Babuponnusami, K. Muthukumar, "Degradation of phenol in aqueous solutionby Fenton, Sono-Fenton, Sono-photo-Fenton methods", Clean - Soil Air Water, 39, 142-147, 2011. [ Links ]
[19] Y. Liu, Y. Zhu, J. Xu, X. Bai, R. Zong, Y. Zhu, "Degradation and mineralization mechanism of phenol by BiPO4photocatalysis assisted with H2O2", Applied Catalysis B: Environmental, 142, 561-567, 2013. [ Links ]
[20] A. Babuponnusami, K. Muthukumar, "A review on Fenton and improvements to the Fenton process for wastewater treatment", Journal of Environmental Chemical Engineering, 2, 557-572, 2014. 52. [ Links ]
[21] E. Grabowska, J. Reszczynska, A. Zaleska, "Mechanism of phenol photodegradation in the presence of pure and modified-TiO2: a review", Water Research, 46, 5453-5471, 2012. [ Links ] [ Links ]













