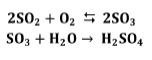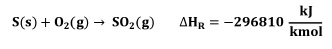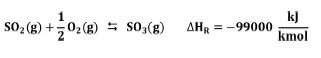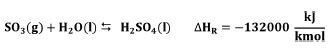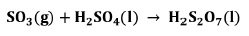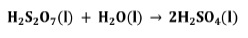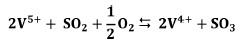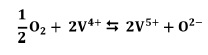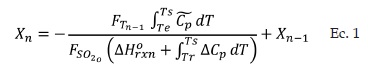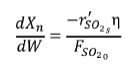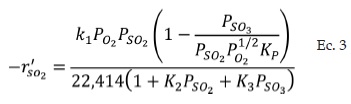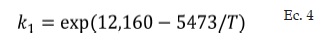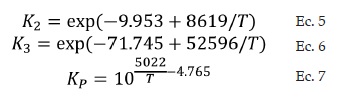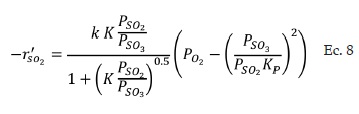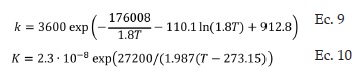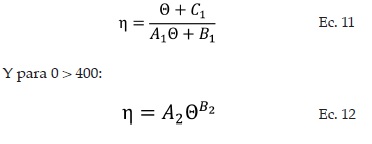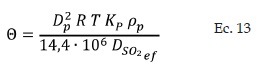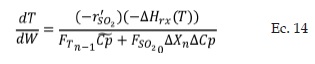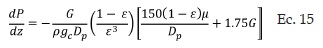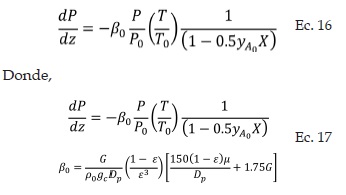Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Prospectiva
Print version ISSN 1692-8261
Prospect. vol.14 no.1 Barranquilla Jan./June 2016
https://doi.org/10.15665/rp.v14i1.647
Modelamiento y simulación de un reactor catalítico para la oxidación de SO2 a SO3, utilizando V2O5 como catalizador
Modeling and simulation of a catalytic reactor for the oxidation of SO2 to SO3, using V2O5 as catalyst
Leda Pernett Bolaño1, Iván A. Ochoa Martínez2, Mauricio E. Robledo Barrios3, César A. Rueda Durán3
1 M. Sc. Ingeniería Química, Docente Investigador, Grupo de Investigación de Procesos Catalíticos, Universidad del Atlántico. Barranquilla, Colombia.
2Ing. Químico, M. Sc. Ingeniería Mecánica.
3Ing. Químico, Grupo de Investigación de Procesos Catalíticos, Universidad del Atlántico. Barranquilla, Colombia. Email: ledapernett@mail.uniatlantico.edu.co
Cite this article as: L. Pernett, I. Ochoa, M. Robledo,C. Rueda, "Modeling and simulation of a catalytic reactor for the oxidation of SO2 to SO3, using V2O5 as catalyst", Prospect, Vol 14, N° 1, 39-46, 2016.
Doi: http://dx.doi.org/10.15665/rp.v14i1.647
Recibido 14/04/2015 Aceptado 30/11/2015
RESUMEN
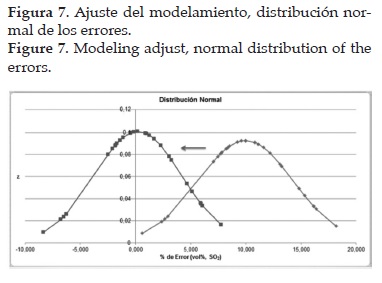
El H2SO4 es uno de los productos químicos de mayor importancia en la industria. Actualmente el H2SO4 se produce mediante el proceso de doble contacto, en donde el SO3 precursor del H2SO4 se forma a partir de la oxidación del SO2 en un reactor catalítico de lecho empacado, utilizando V2O5 como catalizador. Durante el proceso una pequeña cantidad de SO2 se emite a la atmósfera. El modelamiento del reactor catalítico se realizó desde el punto de vista cinético y termodinámico. Además, un programa de simulación en MATLAB® se creó para estudiar el comportamiento del reactor en términos de conversión, temperatura y caída de presión, y realizar evaluaciones del cumplimiento ambiental de emisiones de SO2. El modelo se validó comparando los resultados con datos reales. Posteriormente, se evaluaron dos hipótesis empleando simulaciones en Solid Works®, Aspen HYSYS® y herramientas estadísticas para determinar las causas de las desviaciones, y se realizó un ajuste en el modelo. Los resultados muestran que la distribución de los errores es normal, con una media cercana al 0% con una desviación del 4%, causado posiblemente a errores originados en la medición del SO2 a la entrada del reactor y a la variabilidad inherente al proceso.
Palabras clave: Modelamiento; Simulación; Oxidación; Óxidos de azufre; Pentóxido de vanadio; Ácido sulfúrico.
ABSTRACT
The H2SO4 is one of the chemicals of greatest importance in the industry. Currently H2SO4 is produced by the double contact process, where, the Sulfuric acid precursor SO3 is formed from the SO2 oxidation in a catalytic packed bed reactor, using V2O5 as catalyst. During the process, a small amount of SO2 is emitted to the atmosphere. The modeling of the catalytic reactor, where this process is carried out, is made considering the kinetic and thermodynamic perspective. In addition, a simulation program in MATLAB® is created that allows the study of the behavior of the reactor in terms of conversion, temperature and pressure drop, and makes assessments of the environmental compliance of SO2 emissions as well. The model was validated by comparing results of simulation with real data. Two hypotheses were evaluated using simulations in SolidWorks®, Aspen HYSYS® and statistical tools to determine the causes of the deviations, and an adjustment on the model was made. The results show a normal distribution of the errors, with an average close to 0% with a deviation of 4%, produced possibly because of errors in the SO2 measurement in the inlet of the reactor and the variability inherent to the process.
Key words: Modeling; Simulation; Oxidation; Sulphur oxides, Vanadium pentoxide, Sulphuric acid.
1. INTRODUCCIÓN
El ácido sulfúrico data del siglo VIII, y la primera referencia hecha en la literatura fue realizada por Valentinus en la segunda mitad del siglo XV [1]. Es uno de los productos químicos de mayor importancia en la industria química debido a su alto nivel de producción y demanda [2]. A nivel mundial se han desarrollado dos métodos para el proceso de producción del ácido sulfúrico, el método de cámara de plomo y el método de contacto. Actualmente la mayor parte del suministro de ácido sulfúrico se obtiene por el método de contacto, el cual produce ácido en un rango de concentración entre el 98-99% [3]. En Colombia, la producción de ácido sulfúrico satisface las necesidades de grandes, medianas y pequeñas industrias, que dependen de él ya sea de manera directa o indirecta para sus procesos productivos. Algunas de las industrias económicamente importantes a nivel nacional que usan el ácido sulfúrico dentro de sus procesos son: las refinerías de petróleo, las industrias de fertilizantes, hierro, acero, pinturas, pigmentos, procesamiento de minerales, explosivos, pesticidas, pulpa y papel, textiles, tratamiento de agua y productos farmacéuticos [4].
El trióxido de azufre (SO3) precursor del H2SO4 se produce a partir de la oxidación del dióxido de azufre (SO2) utilizando como catalizador pentóxido de vanadio (V2O5). La reacción ocurre en un reactor de lecho empacado de cuatro etapas con interenfriamientos, empleando dos líneas de catalizadores con forma de anillos Raschig; catalizadores compuesto de sales de potasio y vanadio soportados sobre un portador de sílice y catalizadores con compuestos de cesio como promotor en lugar de sales de potasio. El cesio ayuda a estabilizar las sales fundidas de vanadio, y previene que se precipiten a temperaturas menores de 410°C, tal y como sucede en los catalizadores que usan potasio como promotor [5]. Infortunadamente, la reacción no es completa y una pequeña cantidad del SO2 es emitido hacia la atmósfera como contaminante, por esta razón es necesario realizar el control de dichas emisiones para cumplir con la legislación ambiental vigente (Decreto 02/82), equivalente a un máximo de 3.5 kg de SO2 por kg de H2SO4 producido. El límite de las emisiones en chimenea estipulado en planta es de 1000 ppm de SO2.
El modelamiento y la simulación proveen una herramienta para el estudio del desempeño del reactor en términos de las variables que determinan su estado, y ayuda a evaluar las acciones pertinentes para la toma de decisiones con el fin de mantener dentro de los límites de control los requerimientos de producción y disminuir las emisiones de SO2.
2. MARCO REFERENCIAL
2.1 Proceso de contacto
Actualmente la mayor parte del ácido sulfúrico se produce con el proceso de contacto. Este proceso se basa en el uso de un catalizador para convertir el SO2 en SO3, del que se obtiene ácido sulfúrico por hidratación.
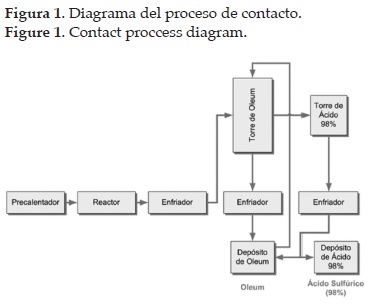
En este proceso (véase figura 1), una mezcla de gases secos que contiene del 7 al 11% de SO2, según la fuente de producción de SO2 (el valor inferior corresponde a plantas que tuestan piritas y el superior a las que queman azufre), y de un 11 a 14% de O2, se precalienta y una vez depurada al máximo, pasa a un reactor de uno o más lechos catalíticos, por regla general de platino o pentóxido de vanadio, donde se forma el SO3 [6].
Los rendimientos de conversión del SO2 a SO3 en una planta en funcionamiento normal oscilan entre el 96 y 97%, pues la eficacia inicial del 98% se reduce con el paso del tiempo. Este efecto de reducciones se ve más acusado en las plantas donde se utilizan piritas de partida con un alto contenido de arsénico, que no se elimina totalmente y acompaña a los gases de reacción, provocando el envenenamiento del catalizador. Por consiguiente, en ocasiones, el rendimiento puede descender hasta alcanzar valores próximos al 95%. En la segunda etapa del reactor, la temperatura varía entre 500° y 600°C. Esta se selecciona para obtener una constante óptima de equilibrio con una conversión máxima a un costo mínimo. El tiempo de residencia de los gases en el reactor es aproximadamente de 2 a 4 segundos. Los gases procedentes de la catálisis se enfrían a unos 100°C aproximadamente y atraviesan una torre de óleum, para lograr la absorción parcial de SO3. Los gases residuales atraviesan una segunda torre, donde el SO3 restante se pone en contacto con ácido sulfúrico de 98%. Por último, los gases no absorbidos se descargan a la atmósfera a través de una chimenea. La producción de ácido sulfúrico por combustión de azufre elemental presenta un mejor balance energético pues no tiene que ajustarse a los sistemas de depuración forzosamente necesarios en las plantas de tostación de piritas [6].
2.2 Producción de dióxido de azufre (anhídrido sulfuroso)
El azufre reacciona con oxígeno para producir dióxido de azufre, de acuerdo con la siguiente reacción:
El azufre se funde con vapor saturado de 50 psig. El punto de fusión del azufre se encuentra entre 388 y 393 K, dependiendo de la estructura del cristal. El azufre se atomiza en un horno caliente a 1400 K, luego se quema con exceso de aire seco para formar una mezcla de gases calientes de SO2, O2 y N2 [7].
2.3 Oxidación catalítica de SO2 a SO3 (anhídrido sulfúrico)
El SO2 reacciona con oxígeno en presencia de un catalizador de pentóxido de vanadio (V2O5) para formar SO3:
Esta reacción es tanto reversible como altamente exotérmica. La oxidación en fase gaseosa es inhibida cinéticamente y virtualmente imposible sin un catalizador a cualquier temperatura [7]. A temperaturas ordinarias, la reacción es tan lenta que, en términos prácticos, ésta no ocurre. Al incrementar la temperatura, incrementa la velocidad de reacción; sin embargo, simultáneamente la posición del equilibrio se desplaza desfavorablemente, el trióxido de azufre se descompone para formar dióxido de azufre y oxígeno. Sin un catalizador, la temperatura necesaria para una buena velocidad de reacción superaría los 600°C y la conversión que se obtendría, a dicha temperatura, sería no mayor a un 40% [8].
2.4 Absorción de SO3 para formar H2SO4 y óleum
La reacción global para la formación del ácido sulfúrico de manera directa puede expresarse de la siguiente manera:
Sin embargo, en la práctica el SO3 de la torre de óleum no se combina directamente con H2O, sino que indirectamente absorbiéndolo en H2SO4 al 98% en las torres de absorción, debido a que la reacción directa forma una neblina de ácido sulfúrico muy difícil de controlar [9].
Este producto es conocido como ácido sulfúrico fumante u óleum. Dicho óleum reacciona de forma segura con agua para producir ácido sulfúrico concentrado.
2.5 Mecanismo de reacción y cinética
La oxidación de SO2 sobre un catalizador de pentóxido de vanadio fue, por muchos años, considerada exclusivamente como una reacción heterogénea gas-sólido. Según el estado del arte actual, la fase activa, compuesta por una mezcla de pentóxido de vanadio con sulfatos de metales alcalinos o pirosulfatos está, bajo las condiciones de operación, presente como material fundido en los poros del soporte de sílice [10, 11].
Sobre la base de este modelo, se han llevado a cabo numerosas investigaciones durante los últimos 30 años con el objetivo de describir la cinética de la oxidación de SO2 suficientemente precisa [10-14]. El modelo más conocido para el curso de la reacción en el material fundido es la de Mars y Maessen [12]. De acuerdo con esto, el equilibrio establecido en el material fundido se expresa formalmente como:
El paso determinante de la reacción se cree que es la reoxidación del V4+ por con oxígeno molecular:
Debe tenerse en cuenta que la validez de las expresiones cinéticas derivadas de cualquier modelo de reacción está limitada a los muy definidos rangos de temperatura [15]. Además, los procesos de transporte en la interface gas-líquido siempre deben tenerse en cuenta [11].
Otro punto interesante en este contexto es lo referente a dos especies diferentes del tipo V4+, una es una especie soluble activa que participa en la reacción rédox, y la otra es una especie inactiva e insoluble [15]. En la desactivación irreversible del catalizador, la última especie se forma en mayor proporción.
3. METODOLOGÍA
Este proyecto se desarrolló en las siguientes etapas:
- Modelamiento de un convertidor catalítico de cuatro etapas con interenfriamientos de una planta de H2SO4 de doble contacto (3-1) [2], con capacidad de producción de 189 tmd de H2SO4; se plantean las ecuaciones del balance de energía, balance de cantidad de movimiento, ecuación de diseño del reactor PBR, y la ley de velocidad de la reacción catalítica.
- Simulación del reactor catalítico; se codifican las ecuaciones en el lenguaje de programación MATLAB® R2010a y se resuelven simultáneamente empleando métodos numéricos.
- Análisis estadístico; se verifica y se valida el modelamiento y la simulación, calculando el porcentaje de error entre los resultados de la simulación y los datos medidos en planta.
4. RESULTADOS Y DISCUSIÓN
Se realizó el modelamiento del reactor de lecho empacado donde se da la oxidación del SO2 y se desarrolló un programa de simulación en MATLAB® R2010a, que permite observar el desempeño cinético y termodinámico de cada una de las etapas de reacción, a las condiciones de operación. Para ello se planteó la termodinámica de la reacción, el balance de moles, las leyes de velocidad de reacción, el balance de energía y el balance de cantidad de movimiento del reactor.
El desarrollo del modelo matemático desde el punto de vista termodinámico para el convertidor catalítico, define tanto el calor de reacción como la conversión de equilibrio a las condiciones del proceso [16].
A partir del balance de energía para la etapa n del reactor de conversión, se obtiene una ecuación que relaciona la fracción de SO2 que se oxida y la temperatura de reacción para cualquier etapa (Ec.1).
La ecuación de diseño, (Ec. 2), se obtiene a partir del balance de moles de un elemento diferencial del reactor:
Livbjerg y Villadsen [13], propusieron una expresión cinética (Ec. 3) para la reacción de oxidación de SO2 a SO3 con un catalizador de pentóxido de vanadio V2O5 para un intervalo de temperaturas entre 400°C y 590°C.
Dónde -rSO2 es la velocidad de desaparición de SO2 y cuyas unidades son [kmol SO2/kg cat. h]. La velocidad específica de reacción k4 (Ec. 4), depende de la temperatura y está dada por la siguiente ecuación:
El resto de las constantes de la ecuación de velocidad de reacción (Ec. 3), se muestran a continuación:
Por otro lado, Simicek et al. [13,17], reportaron la siguiente expresión de velocidad de reacción, para un rango de temperatura entre 380 y 480°C:
Donde:
La velocidad de reacción global u observada rSO2 está influenciada por la difusión, lo que significa que no todos los puntos de la superficie de catalizador se encuentran accesibles para la misma concentración de reactivo. Kadlec [17], definió una expresión del factor de efectividad (η) en función del módulo de Thiele (Θ) (Ecs. 11-13):
Para módulos de Thiele entre 3 < 0 < 400:
El módulo de Thiele se halla a partir de la siguiente relación:
Donde Dp es el diámetro efectivo, Qp es la densidad de las partículas sólidas del catalizador y DSO2ef es la difusividad efectiva.
La ecuación de diseño y la ley de velocidad, entre otras, varían con el cambio de temperatura a lo largo de la etapa de reacción, es por tal razón que se necesita encontrar una expresión que relacione la temperatura con la fracción de SO2 oxidado y la masa de catalizador o altura del lecho catalítico. El balance de energía de la etapa n provee dicha relación (Ec.14):
La caída de presión de los gases que fluyen a través del lecho poroso se modeló con la ecuación de Ergun [18]:
Expresando la ecuación anterior en términos de conversión, se obtiene la ecuación diferencial que describe el cambio de la presión a lo largo del lecho catalítico para una etapa del reactor de conversión:
Además, se hizo seguimiento de la actividad del catalizador encontrando que la desactivación se debe fundamentalmente a un proceso físico, el cual consiste en la obstrucción de los poros de catalizador y el espacio libre en el reactor a causa de polvos finos producidos por el desgaste del catalizador debido a vibración y fricción. En general el tiempo de vida de este catalizador es de 5 años o más [19].
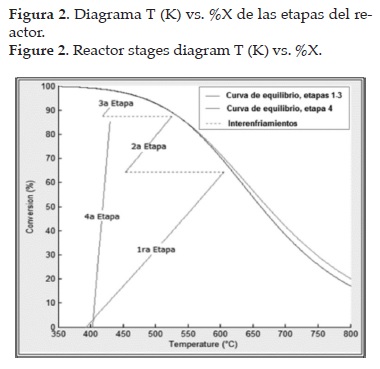
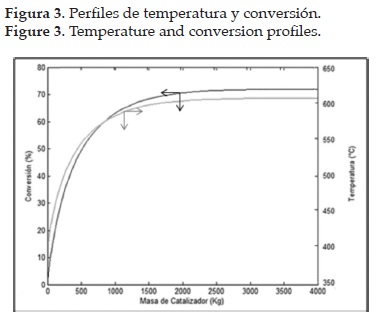
Los resultados de la simulación de las etapas de reacción se muestran en las figuras 2 y 3. Los perfiles de temperatura y conversión de la primera etapa se muestran en la figura 3. Los perfiles se hallaron a partir de la resolución simultánea de los balances de moles, energía y cantidad de movimiento, usando métodos numéricos (Ec. 1-17).
Al comparar los resultados de la simulación con los datos reales, se observó que las temperaturas de salida (de equilibrio) de las etapas de reacción calculadas, presentan desviaciones positivas no menores al 10% con respecto a las temperaturas medidas en planta. Se analizaron las posibles causas por las cuales se presentan las desviaciones:
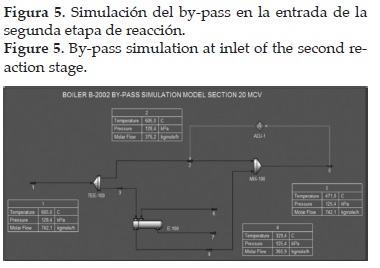
Se analizó si la presencia del By-pass, ubicado a la entrada de la segunda etapa del reactor, influye en la lectura hecha por el termopar a la entrada de la segunda etapa. Se realizó una simulación en CFD (Computational Fluid Dynamics) usando SolidWork 2012® (véase figura 3). Las condiciones de operación y las temperaturas de las corrientes que se mezclan en el By-pass se simularon usando el software Aspen HYSYS®. Se encontró que la temperatura medida por el termopar puede considerarse representativa de la mezcla debido a que la formación de remolinos en las tuberías favorece la transferencia de calor entre las dos corrientes que se mezclan.
Por otro lado, se analizó si la composición de SO2 a la entrada del reactor influye significativamente en la operación del reactor. Durante la verificación de cerca de 300 datos de planta se encontró que la composición de entrada de SO2 calculada haciendo uso del programa presenta desviaciones con respecto a la medida en el laboratorio, encontrando errores relativos con un promedio cercano al 8% y una desviación del 4%. Se observó que la curva de operación es sensible a la composición de SO2, debido a que pequeños errores en la medición de la composición de SO2 produce desviaciones significativas en las temperaturas de salida de las etapas calculadas con el programa.
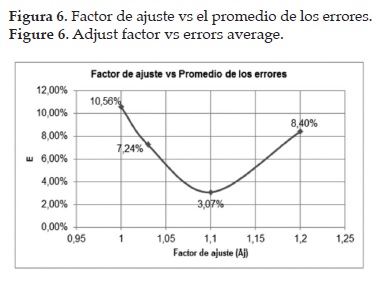
En vista de lo anterior, se realizó un ajuste en el modelo usando el método de los mínimos cuadrados, encontrando un factor de ajuste, para la ecuación Ec. 1, equivalente a 1,10, correspondiente al valor mínimo del promedio de los errores, tal y como se muestra en la figura 7. Además, tal factor ayuda a cuantificar las pérdidas de calor, debido a que el reactor no es completamente adiabático, y la desactivación del catalizador. Finalmente, se validó el modelo comprobando que los resultados de la simulación son coherentes y acordes con los datos reportados en la planta; el porcentaje de error entre los resultados de la simulación y los datos reales de la planta ahora se encuentra entre el 4% y -4%. La distribución de los errores se ajusta a una distribución de probabilidad normal, lo que permite concluir que la causa de dichos errores se debe probablemente al ruido del proceso.
El estudio realizado en este proyecto permite predecir el comportamiento del reactor catalítico de conversión de SO2 y ayuda al ingeniero de procesos en la toma de decisiones para alcanzar la meta de emisiones de SO2 en la chimenea y el seguimiento de la actividad del catalizador para el cambio o reposición del mismo, mediante una estrategia de control; ajustando la temperatura de entrada a la segunda etapa mediante el by-pass y de esta manera lograr una mayor conversión de SO2 en ésta y las siguientes etapas [20].
5. CONCLUSIONES
- Se realizó el modelamiento del reactor de conversión de SO2 a SO3.
- La composición de entrada de SO2 al reactor, es una variable crítica que influye significativamente en la curva de operación de cada una de las etapas del reactor.
- Se plantearon dos hipótesis para explicar las desviaciones entre los datos reales y los de simulación encontrando que la de mayor validez era error en la composición inicial de SO2.
- Se halló un factor de ajuste equivalente a 1.1 para el modelamiento del reactor, el cual cuantifica la influencia de los factores inherentes al proceso y las pérdidas por calor.
- Se verificó que los resultados de la simulación son coherentes y acordes con los datos reportados en la planta. % Error = 0 ± 4%.
AGRADECIMIENTOS
Agradecemos a los Ingenieros Óscar Cortés y Alberto Tous por su valiosa colaboración en la ejecución de este proyecto.
REFERENCIAS
[1] L. Friedman, & S. Friedman (2008) Citing references: The history of the contact sulphuric acid process [Internet]. Florida, Acid Engineering & Consulting Inc. Disponible desde: <http://www.aiche-cf.org/ Clearwater/2008/Paper2/8.2.7.pdf> [Acceso 7 de diciembre 2014] [ Links ].
[2] A. A. Kiss, C. S. Bildea, J. Grievink, (2010) Dynamic modeling and process optimization of an industrial sulfuric acid plant. Chemical Engineering Journal [on line], 158, p.241-249. Disponible desde <http://www.sciencedirect.com/science/article/pii/ S1385894710000446> [Acceso 15 de mayo de 2015] [ Links ].
[3] W. Davenport & M. King, "Optimum double contact acidmaking". En: Sulfuric acid manufacture, ed.; Elsevier, Oxford, 2005, pp. 229-234. [ Links ]
[4] E. F. Castillo (2001) Citing references: Producción de ácido sulfúrico [Internet]. Bogotá D.C., Centro Nacional de Producción más Limpia, IDEAM, COLCIENCIAS. Disponible desde: <http://www.tecnologiaslimpias.org/html/central/351204b/351204b_prod.htm> [Acceso 7 diciembre 2014] [ Links ].
[5] C. D. Winkler. (2009, May.). MECS catalyst products & technical services update. Presentado en Sulphur and Sulphuric Acid Conference, Sun City - South Africa, 2009. [En linea] Disponible: http://www.mecsglobal.com/Catalyst%20Products%20%20Technical%20Services%20-%202009.pdf [ Links ]
[6] G. Ertl, H. Knözinger, F. Schüth, J. Weitkamp, "Oxidation of Sulfur Dioxide". En: Handbook of heterogeneous catalysis; second, completely revised and enlarged Edition, ed.: Wiley-VCH, Weinheim, Germany, 2008, p.2623-2635. [ Links ]
[7] M. J. King, W. Davenport, M. S. Moats, Sulfuric acid manufacture; second Edition, Oxford: Elsevier, 2013, pp. 1-120. [ Links ]
[8] U. Sander, H. Fischer, U. Rothe, R. Kola, A. More. Sulphur, sulphur dioxide and sulphuric acid: an introduction to their industrial chemistry and technology. London: British Sulphur Corp, 1984, p.283. [ Links ]
[9] J. Clark (2002), Citicing references: The contact process [Internet]. UK, Cambridge University. Disponible desde: <http://www.chemguide.co.uk/physical/equilibria/contact.html>. [Citado 18 diciembre 2014] [ Links ].
[10] N. Neth, G. Kautz, H. Huster, U. Wagner. "Zur Kinetik der SO2-Oxidation". Chemical Engineering Technology. 51, 825-826, 1979. [ Links ]
[11] C. Kemball, D. A. Dowden, C. Kenney. "The catalytic oxidation of sulphur dioxide". En: "Catalysis", ed.; Royal Society of Chemistry, Oxford, London, p.123-135. [ Links ]
[12] P. Mars, J. Maessen, "The Mechanism and the Kinetics of Sulfur Dioxide Oxidation on Catalysts Contanining Vanadium and Alkali Oxides", Journal of Catatysis, 10, 1-12, 1968. [ Links ]
[13] J. Villadsen, H. Livbjerg, "Kinetics and effectiveness factor for SO2 oxidation on an industrial vanadium catalyst". Chemical Engineering Science. 27, 21-38, 1972. [ Links ]
[14] H. Becker, W. Gösele, N. Neth, J. Adlkofer. "Zum Stand der Schwefelsäure-Produktion", Chemical Engineering Technology. 51, 789-795, 1979. [ Links ]
[15] M. Appl, N. Neth. (1979, Nov.). Paper XX: Problems and Advances in the Catalytic Oxidation of Sulphur. Presentado en: 3rd International Conference on Fertilizers. London, 1979. [ Links ]
[16] G. Froment, K. Bischoff, J. De Wilde, Chemical reactor analysis and design, 3 ed., USA: John Wiley & Sons, Inc., 2011, pp. 522-530. [ Links ]
[17] B. Kadlec, J. Michalek, A. Simecek. "Effectiveness factor and the structure model of vanadium catalyst for sulfur dioxide oxidation", Chemical Engineering Science, 25, 319-329, 1970. 215-220. [ Links ]
[18] R. Bird, W. Stewart, E. Lightfoot, Fenómenos de Transporte 2a ed., México: Limusa Wiley, 2006, pp. 215-220. [ Links ]
[20] C. Bendjaouahdou, M. H. Bendjaouahdou, "Control of the hot spot temperatura in an industrial SO2 converter", Energy Procedia, 36, 428-443, 2013. [ Links ]
[19] D. K. Louie, "Contact Section". En: Handbook of sulphuric acid manufacturing, Canada: DKL Engineering, Inc. 2005, pp. 1-81. [ Links ]