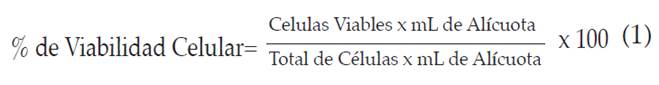1. INTRODUCCIÓN
Debido al compromiso óseo, los tratamientos para algunas lesiones de hueso, requieren reconstrucción y fijación con material de osteosíntesis. La fijación con placas metálicas comerciales conlleva grandes costos debido a que se necesita una segunda intervención quirúrgica para ser retirada, además, tiene implicaciones para el paciente como nuevas fracturas tras el retiro del material, aumento indeseable del volumen en el sitio y dificultades estéticas, esto sumado a nuevas estancias hospitalarias e incapacidades [1]. Es así que se hace necesario el uso de materiales que puedan estabilizar los procedimientos reconstructivos con la misma capacidad mecánica de los implantes metálicos, que permitan la reparación activa del hueso y que el cuerpo pueda convertirlo fácilmente en un producto metabòlico no tóxico que desaparezca a medida que el hueso vaya recuperando su ubicación natural.
El enfoque actual de la ingeniería de tejidos para el tratamiento médico de lesiones óseas, se ha centrado en la posibilidad de reemplazar el tejido dañado haciendo uso de células vivas en combinación con diferentes biomateriales usados como andamio o soporte para la regeneración del tejido [2]. Las aleaciones de Mg son consideradas como uno de los materiales más promisorios para ser utilizados en aplicaciones biomédicas, debido a su alto requerimiento metabólico. El Mg es el cuarto catión más abundante en el cuerpo humano, se presenta en aproximadamente 760 mg al nacer e incrementa unos 25 g a 35 g en el adulto, por cada 70 kg de peso corporal. La ingesta recomendada de Mg es entre 300 mg y 400 mg por día. Entre el 50% y el 60% del Mg fisiológico está localizado en el hueso y es uno de los iones más importantes que constituye la mayor parte del mineral óseo. Adicionalmente, está involucrado en un gran número de reacciones y mecanismos biológicos por lo que es considerado como biocompatible y bioabsorbible [3, 4].
Estudios previos in vivo [5, 6], han demostrado que las aleaciones de magnesio tienen comportamientos adecuados que las hacen excelentes candidatas para su posible aplicación como implantes metálicos biodegradables. Investigaciones actuales indican que existe una gran demanda en el diseño de aleaciones de magnesio con velocidades de corrosión ajustables y que al mismo tiempo no comprometan sus propiedades mecánicas o incluso se vean mejoradas [7, 8, 9]. Los materiales porosos obtenidos a partir de aleaciones basadas en Mg, presentan estructuras y propiedades mecánicas muy similares a las del hueso, incluso más cercanas que las propiedades de biomateriales comúnmente usados en implantes como el acero inoxidable o el titanio [10] y polímeros como el ácido poliláctico (PLA) o el ácido poliglicólico (PGA). Adicional a esto resulta de vital importancia determinar los efectos que puedan tener los iones liberados durante el proceso de corrosión del material, debido a que estos pueden generar reacciones adversas en las células y en los tejidos que pueden comprometer la posibilidad de uso como implantes biomédicos para la regeneración de tejido óseo.
El uso de aleaciones de Mg en aplicaciones ortopédicas también ha resultado de gran interés, debido a la posibilidad de obtener estructuras tridimensionales porosas, que actúen como soporte sobre el que se pueda obtener un tejido óseo a partir del cultivo de una línea celular osteogénica, como consecuencia de la colonización celular, la formación de vasos sanguíneos y la absorción del metal por parte de las células, con el fin de que el material sea gradualmente reemplazado por la formación de nuevo hueso [11]. En los últimos años, la investigación relacionada con la implementación de aleaciones de Mg para el desarrollo de materiales biodegradables, ha reportado un alto número de investigaciones, en este trabajo se realiza una evaluación de la biocompatibilidad y el comportamiento citotóxico de una espuma metálica obtenida a partir de la aleación AZ31B, la cual se encuentra disponible comercialmente, por el método de fundición-infiltración debido a la capacidad de replicación del método.
Los ensayos de viabilidad celular son utilizados como pruebas de rutina con el fin de estudiar el efecto que puede tener un determinado compuesto sobre la proliferación celular así como los efectos citotóxicos directos que eventualmente conducen a la muerte celular. La línea celular CHO-K1 es ampliamente utilizada en diferentes evaluaciones a nivel celular, entre ellas las de citotoxicidad. Dicha línea celular es derivada de tejido ovario de hámster chino adulto y es aneuploide con número modal cromosómico de entre 20-21 cromosomas. Además, es una línea celular adherente al sustrato y su ciclo celular estimado es de 14 horas, lo cual la hace viable para desarrollo de este tipo de ensayos [12], teniendo en cuenta su corto tiempo de replicación, resistencia, disponibilidad, manejo en el laboratorio y requerimientos en términos de medios de cultivo y reactivos necesarios para su mantenimiento.
Por estas razones, el objetivo de este trabajo es hacer una evaluación preliminar del grado de biocompatibilidad una espuma metálica fabricada a partir de la aleación AZ31B, con el fin de determinar la posibilidad de uso de este tipo de materiales en la fabricación para aplicaciones ortopédicas, principalmente en las relacionadas con la regeneración de tejido óseo a través de la evaluación del efecto citotóxico de los productos de la corrosión del material sobre la viabilidad de células CHO. Los resultados de porcentaje de viabilidad celular obtenidos se comparan con los estándares internacionales establecidos por la norma ISO 10993-5: 2009, para la evaluación de dispositivos médicos, especialmente las x100 (2) % de Viabilidad pruebas in vitro de citotoxicidad y adicionalmente con los resultados presentados por investigaciones realizados con otras líneas celulares.
2. METODOLOGÍA
El potencial citotóxico de la aleación AZ31B se evaluó haciendo uso de dos métodos: 1) la técnica de reducción del MTT (Bromuro de 3-(4,5-dimetiltiazol-2-ilo)-2,5- difeniltetrazol) y 2) el colorante azul de tripano. Estos métodos permiten determinar el porcentaje de viabilidad celular teniendo en cuenta la integridad de la membrana.
Los efectos citotóxicos fueron evaluados en los productos de corrosión del material poroso. Esta cuantificación se llevó a cabo de manera indirecta haciendo uso de células epiteliales de ovario de hámster chino (CHO-K1), cultivadas en un medio de cultivo RPMI 1640, suplementado con suero fetal bovino (SFB), en caja de cultivo de 96 pozos incubados durante 24 horas. Antes de someter el cultivo a los diferentes tratamientos, se tomó una línea celular CHO-K1 con una confluencia del 90%. Las células adheridas al frasco de cultivo fueron resuspendidas y teñidas con azul de tripano para ser contabilizadas. El azul de tripano, es un colorante de tinción selectiva que permite observar una diferencia entre las células viables y no viables dado que las células vivas poseen membranas celulares intactas que excluyen ciertos colorantes, por lo que las células vivas tienen citoplasma claro, mientras que las no viables se observan con un citoplasma azul.
Se tomaron 10gL de la suspensión celular y se mezclaron en un tubo eppendorf con 10gL de solución de azul de tripano (stock a una concentración del 0.4%). 10gl de esta nueva suspensión fueron contabilizados en la cámara de Neubauer. El porcentaje de células viables se calculó siguiendo la ecuación 1.
Después de 24 horas se descartó el medio de cultivo de cada uno de los pozos y se sustituyó por medio suplementado con SFB al 10% y 50gL del extracto acuoso producto de la corrosión de las dos configuraciones de la superficie. Las cantidades de los componentes usados para la inoculación de las placas están descritas en la tabla 1. Se partió de una viabilidad de la suspensión celular del 94%. Adicionalmente, teniendo en cuenta que este tipo de células crecen en forma de monocapa, se evaluó el crecimiento y la adherencia sobre los dos tipos de superficie.
Tabla 1 Cantidad de los componentes usados para la inoculación de placas.
| Componente | Cantidad por pozo | Cantidad por Placa (96x) |
|---|---|---|
| Células CHO-K1 | 5 μL | 480 μL |
| Medio de Cultivo | 79 μL | 7584 μL |
| Suero | 4 μL | 384 μL |
| Antibiótico | 1 μL | 96 μL |
| Extracto | 1 μL | 96 μL |
| Volumen Total | 90 μL | 8640 μL |
Después de 48 horas de exposición al tratamiento, se realizó una prueba colorimétrica para estimar el porcentaje de células viables. 100 gL de MTT (3- (4,5-dimetiltiazol-2-il) -2,5-difeniltetrazolio bromuro) fueron adicionados a cada pozo. Esta técnica permite cuantificar la reducción de sales de tetrazolium que causan la formación de un precipitado insoluble de coloración intensa, conocido con el nombre de Formazan por acción de las células metabólicamente activas para la formación de cristales violeta. La reacción de reducción se llevó a cabo durante aproximadamente tres horas. Los cristales formados fueron resuspendidos, agregando 100gL de isopropanol ácido en las siguientes proporciones: 89.2% de isopropanol, 10% de tritón y 0.8% de HCl.
La formación de cristales fue cuantificada registrando los cambios en la absorbancia de las muestras a una longitud de onda de 570nm con un lector de placas de ELISA acoplado al espectrofotómetro Multiskango (Thermo). Los resultados en términos de la viabilidad fueron hallados siguiendo la ecuación 2.
Donde:
Promedio del tratamiento: Absorbancia promedio obtenida con el tratamiento.
Promedio del blanco: Absorbancia promedio obtenida del blanco
Promedio del control negativo: Absorbancia obtenida del control negativo.
3. RESULTADOS
Después de 48 horas de incubación del cultivo con fragmentos de aproximadamente 0.1 g de la aleación, se realizó una inspección visual y se observó que los pozos que fueron cultivados con Mg presentan una coloración amarilla diferente a la coloración de los pozos control de la placa. Además, se identificó que en el estado inicial las células de los pozos cultivados con Mg no estaban adheridas, lo que da una muestra inicial del efecto negativo del extracto sobre las células.
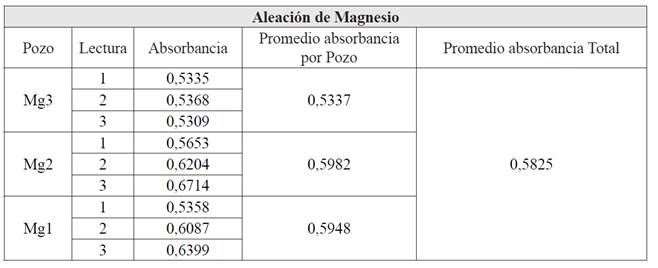
La tabla 2 muestra el resumen de los valores de las absorbancias leídas de los pozos cultivados con los dos tipos de superficies de Mg. El porcentaje de viabilidad celular calculado con la ecuación 2, resultó de 29,47+ 0,05% para el tratamiento con la aleación de Mg en forma de matriz porosa. Estos resultados indican que de las ~5000 células sembradas por pozo, para un total de ~15000, sólo ~1450 sobrevivieron al tratamiento.
4. DISCUSIÓN
De acuerdo con la norma ISO 10993-5:2009 [Standardization 2009], para la evaluación biológica de dispositivos médicos, cuando hay una reducción en la viabilidad celular de más del 30%, se considera que hay efectos citotóxicos. Según la tabla 2, la aleación de Mg usada en este trabajo tiene efectos citotóxicos sobre la línea celular CHO.
La línea celular CHO se caracteriza por su resistencia, rápido tiempo de generación y facilidad en el manejo y cultivo in vitro. La respuesta celular observada, en presencia tanto de la aleación como de los productos de su corrosión, sugieren que deben considerarse otro tipo de aleantes para la fabricación y desarrollo de estructuras tridimensionales que permitan el crecimiento celular y sirvan como soporte para la regeneración de tejidos óseos. Los resultados obtenidos muestran que la viabilidad celular está directamente influenciada por la liberación de iones desde la aleación e indirectamente por las variaciones en los valores de pH y osmolalidad que estos iones producen dada la coloración amarilla que se observó en los pozos tratados.
El Mg tiene un límite de consumo diario permitido de 400 mg, muy superior al límite permitido para metales como el Zn (15 mg) y el Fe (40 Mg) [13] (World Health Organization, Food and Agriculture Organization of the United Nations, and International Atomic Energy Agency, Trace elements in human nutrition and health. Geneva: World Health Organization, 1996). Además, algunos estudios de citotoxicidad sobre esta misma aleación y otras aleaciones de Mg que prometen ser biocompatibles, han mostrado valores de viabilidad entre el 55% [3] con la línea celular L929 y el 111% [14] con la línea NIH3T3. Particularmente para la aleación AZ31, se han reportado valores de alrededor del 88% en ensayos realizados con la línea celular L929 [15].
Los iones de Mg2+, son los principales productos de la corrosión de este material. Para mantener un porcentaje de viabilidad celular aceptable en el cultivo (superior al 80%), que no represente efectos citotóxicos considerables, la concentración de estos iones debe permanecer en un rango de entre 20-40 mM, dependiendo de la línea celular utilizada [16]. Como primera aproximación, bajo las condiciones de cultivo y teniendo en cuenta el comportamiento de la corrosión del material, es posible considerar que la aleación tiene efectos citotóxicos apreciables y se requieren pruebas más rigurosas tales como pruebas de genotoxicidad y adherencia, a fin de determinar el uso potencial de este material como matriz porosa, al interior del cual se establezca el cultivo de una línea celular osteogénica; que permita la regeneración del tejido.
Con el fin de garantizar la seguridad de los materiales biodegradables base Mg, investigadores han trabajado en el desarrollo de nuevos tipos de aleaciones con otros metales de transición, sin toxicidad o con baja toxicidad, incluyendo principalmente los sistemas Mg-Ca, Mg-Zn y Mg-Mn [17, 18, 3]. Se han encontrado adelantos en la descripción de las propiedades que promueven los nuevos grupos de aleaciones. Por ejemplo, las aleaciones Mg-Ca no inducen citotoxicidad en las células y reducen la tasa de corrosión con respecto al Mg puro. Además, se ha observado alta actividad de los osteoblastos y los osteocitos alrededor de los implantes de Mg-Ca [19]. El Zn es un elemento esencial en el cuerpo humano y tiene un efecto de fortalecimiento en las aleaciones. Además, puede elevar tanto el potencial de corrosión como la resistencia del Mg [20]. Otros elementos aleantes como el Mn, el Si y la Ag se han estudiado para evaluar los comportamientos biológicos comparados con el Mg puro y se encontró que las aleaciones Mg-X tienen menores efectos negativos comparadas con el control de Mg puro[14].
Además de considerar los elementos aleantes, recientes investigaciones han demostrado que para aplicaciones de ingeniería de tejidos óseos, se hace necesario el diseño de andamios tridimensionales, en los cuales, la geometría de la microestructura porosa se convierte en un factor clave para el control de la función mecánica del sistema hueso-andamio, en el proceso de regeneración del tejido, así como también después de la regeneración. El andamio que sirve como soporte para la regeneración ósea generalmente debe tener propiedades biológicas y biomecánicas [21], que incluyen (1) la porosidad adecuada para la difusión de nutrientes y la vascularización del tejido, (2) la superficie del material debe tener una composición química apropiada, que garantice biocompatibilidad para permitir que las células se adhieran y expresan sus fenotipos normales, (3) suficiente propiedades mecánicas que brinden soporte de carga durante el proceso de reconstrucción y de regeneración del tejido, y (4) la biodegradabilidad adecuada después de la formación de hueso nuevo. Por lo tanto, un andamio poroso debe equilibrar estas funciones complejas, a través del diseño controlado de la microestructura, así como de las propiedades del biomaterial [2].
5. CONCLUSIONES
Para el desarrollo de este estudio se fabricaron estructuras porosas a partir de la aleación AZ31B, que se utilizaron para evaluar el potencial de aplicación en aplicaciones de ingeniería de tejidos óseos y adicionalmente los posibles efectos citotóxicos que pueden generar los productos de la biodegradación del material una vez inmerso en un medio biológico. Los resultados obtenidos muestran un apreciable efecto citotóxico en las células CHO, el cual puede estar relacionado con la alta concentración de iones metálicos producto de la biocorrosión del material, lo cual produce un rápido cambio en el pH del medio de cultivo evidenciado en su cambio de color. Estos resultados muestran la necesidad de realizar estudios mucho más rigurosos del comportamiento de la aleación en medios biológicos, de la misma forma que vislumbra la necesidad de hacer este tipo de estudios haciendo uso de líneas celulares osteogénicas, que permitan demostrar la formación de tejido óseo alrededor de la aleación de magnesio.