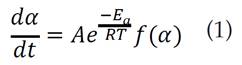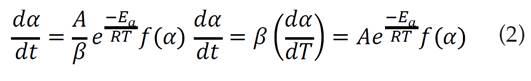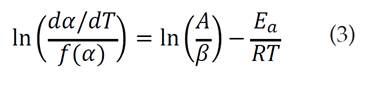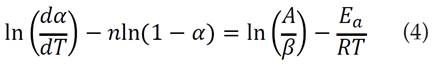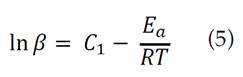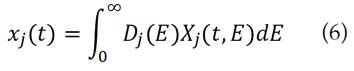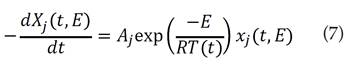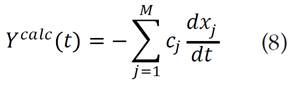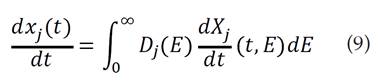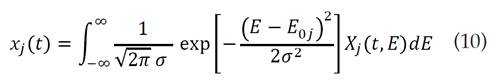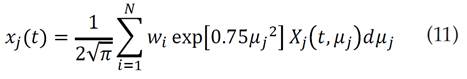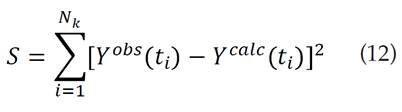1. INTRODUCCIÓN
Entre las nuevas alternativas que se han implementado para tratar de disminuir la cantidad de emisiones de CO2 y NOx (sustancias producidas durante procesos de combustión interna[1]), la biomasa surge como una fuente renovable de energía que no sólo permite reemplazar parcialmente los combustibles fósiles [2], sino también reducir las concentraciones de éstos gases contaminantes en la atmósfera [3]. La transformación termoquímica de la biomasa usualmente genera combustibles sólidos, líquidos y gaseosos, los cuales además de reemplazar parcialmente los combustibles fósiles generan calor, electricidad y productos químicos [4]. La pirólisis y la gasificación constituyen los procesos de transformación termoquímica más usados comercialmente [5].
La biomasa de origen lignocelulósico, es el material orgánico más abundante en la tierra; sus fuentes son los bosques, cultivos agrícolas, residuos de cosechas y otros residuos industriales [6]. Ésta se encuentra constituida fundamentalmente por celulosa, hemicelu losa y lignina [6,7]. Para caracterizar sistemáticamente el comportamiento de la pirólisis de la biomasa, se ha optado por investigar inicialmente la pirólisis de cada uno de estos tres componentes, usando técnicas de caracterización tales como análisis termogravimétrico (TG), análisis simultáneo de termogravimetría y cromatografía de gases (TG-GC) y análisis simultáneo de termogravimetría y espectroscopía infrarroja con transformada de Fourier (TG-FTIR) [8,9]. Usualmente en etapas más adelantadas de las investigaciones (usando estas mismas técnicas) se ha estudiado las interacciones que ocurren entre los indicados componentes, como también las interacciones que tienen lugarentre cada uno de ellos con algunos minerales alcalinos, minerales alcalinotérreos [10] y sales metálicas tales como cloruros de zinc y de níquel [11].
Los metales de transición, Fe y Zn, son elementos que de forma natural se encuentran presente en la biomasa lignocelulósica, no obstante, sus concentraciones presentan variaciones que pueden depender tanto de factores ambientales como de la especie de estudio. Por otra parte, es de esperar que las propiedades electrónicas de estos metales, cumplan un rol fundamental en los procesos de descomposición térmica en cada uno de los componentes de la biomasa. Con el propósito de analizar la influencia de Fe y Zn (componentes minoritarios), que pueden actuar como catalizadores en procesos de conversión térmica, es fundamental estudiar sus efectos sobre la celulosa, hemicelulosa y lignina (componentes mayoritarios). El Fe y Zn agregados en proporciones mayores a las presentes naturalmente, podrían favorecer el proceso de conversión térmica o mejorar la calidad de los productos (combustibles líquidos o gaseosos). Por tanto, este trabajo busca evaluar si el Fe y Zn presentan efectos catalíticos sobre la pirolisis de la lignina, para lo cual, se investigó la cinética de devolatilización de este componente mayoritario en presencia y ausencia de sulfato férrico Fe2(SO4)3 y sulfato de zinc ZnSO4, mediante la aplicación del método diferencial de Friedman con un modelo de orden de reacción n, del método de Ozawa, Flynn y Wall (OFW) o isoconversional, y del modelo de distribución de energías de activación, DAEM. En la implementación de este trabajo se usó como método de análisis experimental la técnica TG.
2. METODOLOGÍA
2.1 Modelos cinéticos
2.1.1 Modelo de orden de reacción n
Bajo condiciones isotérmicas, la ecuación de velocidad de descomposición de la biomasa sólida puede expresarse como [12]:
Donde A es el factor pre-exponencial o de frecuencia, Ea la energía de activación, R la constante universal de los gases, T la temperatura absoluta, f(∝) es la función cinética que representa el modelo cinético y ∝ es la conversión. Introduciendo la velocidad de calentamiento para el caso de los ensayos no isotérmicos, la ecuación (1) se transforma en [13]:
La ecuación (2) es la expresión fundamental comúnmente usada en los métodos de cálculo de los modelos de ajuste cinético con datos termogravimétricos. Aplicando logaritmo a la expresión anterior, se tiene:
Asumiendo un modelo de reacción 𝑓 𝛼 =( 1−𝛼) 𝑛 , típicamente usado en este tipo de análisis [14], se obtiene la modificación de la ecuación (3):
2.1.2 Método isoconversional
El método isoconversional no requiere del conocimiento de mecanismo de reacción para calcular la energía de activación. Por esta razón, se denomina método libre de modelo [15] y constituye una técnica isoconversional integral, en la cual la energía de activación está relacionada con la velocidad de calentamiento y la temperatura a una conversión constante [15,16]. La respectiva ecuación es:
donde C1 es una constante.
2.1.3 Modelo de distribución de energías de activación, DAEM
El modelo de distribución de energía de activación, DAEM, asume una serie de reacciones paralelas irreversibles de primer orden, caracterizada por una distribución continua de las energías de activación que puede ser representada por la función de distribución Dj (E) [17,18]. Este modelo describe los procesos de pirólisis, en el cual la fracción del material sin reaccionar xj (t), en el tiempo t es [19]:
donde Xj (t, E) es la solución de la ecuación cinética de primer orden para una específica energía de activación [15], y se representa por la siguiente ecuación:
Para cada pseudocomponente se asume una ecuación cinética como la ecuación (1). La curva de velocidad de pérdida de peso (DTG) es la suma ponderada de las velocidades de reacciones individuales [17], la cual se calcula usando la siguiente ecuación:
donde x
j
es la fracción sin reaccionar del material representado por la j-ésima ecuación cinética, Cj corresponde a la contribución de la j-ésima reacción parcial de la cantidad medida y M es el número de pseudocomponentes usados para el ajuste [16]. Cada curva 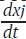 de la ecuación (8), se puede obtener de la ecuación (6) así:
de la ecuación (8), se puede obtener de la ecuación (6) así:
Para hacer posible el uso de las técnicas disponibles de integración numéricas, se requiere cambiar el límite de integración inferior del miembro derecho de esta ecuación E = 0 por E = -∞. Asumiendo valores de factores pre-exponenciales usuales, obtener resultados de E = 0 ó E < 0 correspondería a eventos que tendrían lugar por debajo de la temperatura ambiente. Teniendo en cuenta este análisis, el cambio del dicho límite de integración no revierte cambio significativo alguno en el valor de la integral [20]. Asumiendo una función de distribución Gaussiana Dj (E), normalmente usada para este tipo de procesos [18,21] con una energía de activación promedio aparente E 0 y una desviación estándar o se obtiene que:
Introduciendo el cambio de variable propuesto por [21], la regla de cuadratura de Gauss-Hermite y el reescalamiento planteado por [22] (que consiste en un factor entre 0.3 y 0.5) para aumentar la eficiencia de la fórmula se tiene
donde w i representa los valores de ponderación. En este caso se ha escogido el factor de re-escalamiento 0.5, sugerido por [20]. Además, en esta ecuación se ha usado 80 como el número de particiones N de la fórmula de cuadratura de Gauss-Hermite [24].
Para realizar el ajuste de la curva por mínimos cuadrados, se usó un método no lineal del mismo tipo (mínimos cuadrados), en donde para el conjunto de curvas experimentales, Yk obs y calculadas, Yk calc, se busca minimizar el valor de la siguiente expresión:
dónde Nk representa el número de puntos de la i-ésima curva evaluada [23].
2.2 Materiales
La lignina alcalina, con bajo contenido de sulfonatos, (96%) fue adquirida de Sigma-Aldrich y usada sin posterior purificación. Los catalizadores sulfato de zinc (99%) y sulfato férrico (75%) fueron obtenidos de PanReac. Se prepararon por pesada, mezclas de lignina/ catalizador al 3% en peso de catalizador, usando masas adecuadas de cada uno de los componentes. Las muestras preparadas que se agitaron hasta lograr uniformidad, fueron secadas isotérmicamente a 105 °C durante 24 horas, para luego ser almacenadas en un desecador.
2.3 Análisis termogravimétrico
El análisis termogravimétrico de los componentes puros y las mezclas lignina/catalizador se llevaron a cabo en una balanza termogravimétrica TGA 2950 (TA instruments). Se usaron tres velocidades de calentamiento: 10, 30 y 100 °C/min. Como gas de purga se empleó helio (grado de pureza 5) con un flujo constante de 100 mL/min. Con el objeto de reducir los efectos de transferencia de calor y masa [16], la masa de las muestras cargadas en la termobalanza, se ajustaron al rango 2 15 mg. Se estudió el efecto de la velocidad de calentamiento y el tipo de catalizador sobre la temperatura de pico DTG de la pirólisis de la lignina.
2.4 Ajuste a modelos cinéticos
Los resultados experimentales fueron analizados con varios métodos ampliamente reconocidos [14-16]. Específicamente, para determinar los parámetros cinéticos de la descomposición de la lignina y sus mezclas con los catalizadores de estudio, se usó el modelo de orden de reacción n, el método isoconversional y el modelo de distribución de energía de activación, DAEM.
2.4.1 Modelo de orden de reacción n
Para obtener de los parámetros cinéticos, se grafica la parte izquierda de la ecuación (4) en función de 1/T; lo cual permite obtener la energía de activación (Ea) a partir de la pendiente y el factor pre-exponencial (A) del intercepto con la ordenada. Para encontrar el mejor ajuste, se busca el orden n de la reacción de la ecuación (4) que ofrezca el valor más cercano a la unidad para el coeficiente de determinación R2. Para hacer este cálculo se usó la herramienta Buscar Objetivo y las funciones incluidas por defecto en el software MS Excel®.
2.4.2 Método isoconversional
De acuerdo con la ecuación (5), la energía de activación puede calcularse a partir de la pendiente de 1nβ en función de 1/T. Las medidas de la temperatura se obtuvieron para conversiones fijas en las distintas velocidades de calentamiento. Entonces, se calculó la energía de activación para el proceso de pirólisis a partir de las pendientes (-Ea/R) de las gráficas para distintos valores de conversión.
2.4.3 Modelo de distribución de energías de activación, DAEM
La construcción de los códigos necesarios para la implementación del modelo DAEM, se codificó en el lenguaje de programación Matlab®. En dicho modelo se evalúa la suma de la ecuación (11) teniendo como criterio de aceptación la minimización del valor de la ecuación (12).
3. RESULTADOS Y DISCUSIÓN
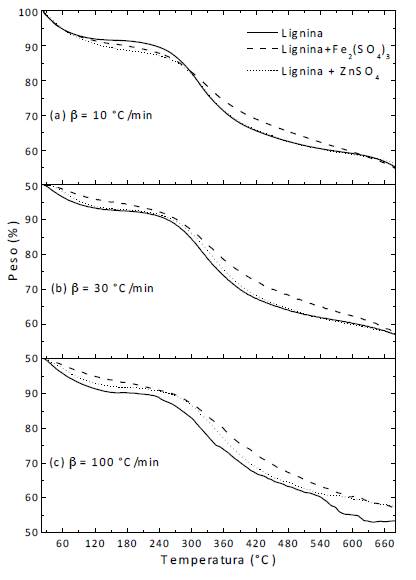
En las subfiguras (a), (b) y (c) de la figura 1 se muestran las curvas TG de la lignina y lignina con cada catalizador (sulfato férrico y sulfato de zinc) a las respectivas velocidades de calentamiento 10, 30 y 100 °C/min. Dichas curvas presentan un comportamiento similar al reportado en estudios previos [24]. Al comparar estos resultados de la lignina, con los reportados en literatura para los otros componentes de la biomasa lignocelulósica [25], la lignina exhibe una lenta velocidad de degradación, incluso hasta temperaturas tan altas como 540 °C. En estos resultados es posible apreciar que la adición de los catalizadores no afecta el porcentaje de carbonizado a las velocidades de calentamiento 10 y 30 °C/min. Sin embargo, cuando las muestras se calientan a 100 °C/min, el porcentaje de carbonizado es mayor con ambos catalizadores si se compara con la pirólisis de la lignina pura.
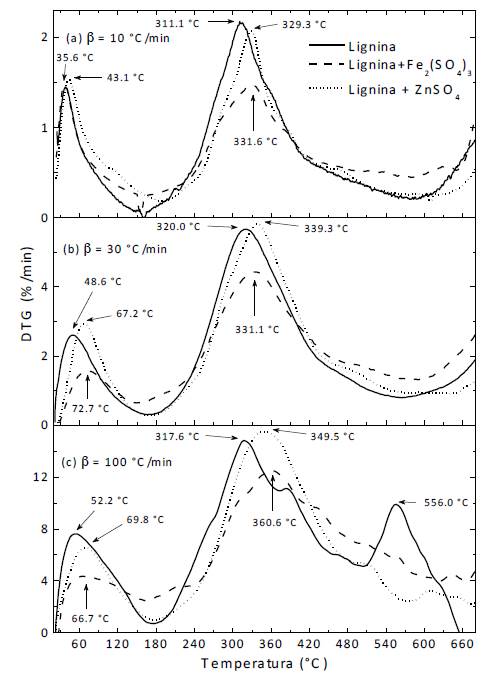
En las subfiguras (a), (b) y (c) de la figura 2 se presentan los termogramas DTG obtenidos para la lignina con y sin catalizadores a las respectivas velocidades de calentamiento 10, 30 y 100 °C/min. Estos muestran un primer evento correspondiente a la liberación o desprendimiento de agua [26], seguido de un segundo evento que corresponde al primer evento de degradación térmica. Dependiendo de la velocidad de calentamiento y del catalizador usado, dicho evento presenta diferentes efectos retardantes.
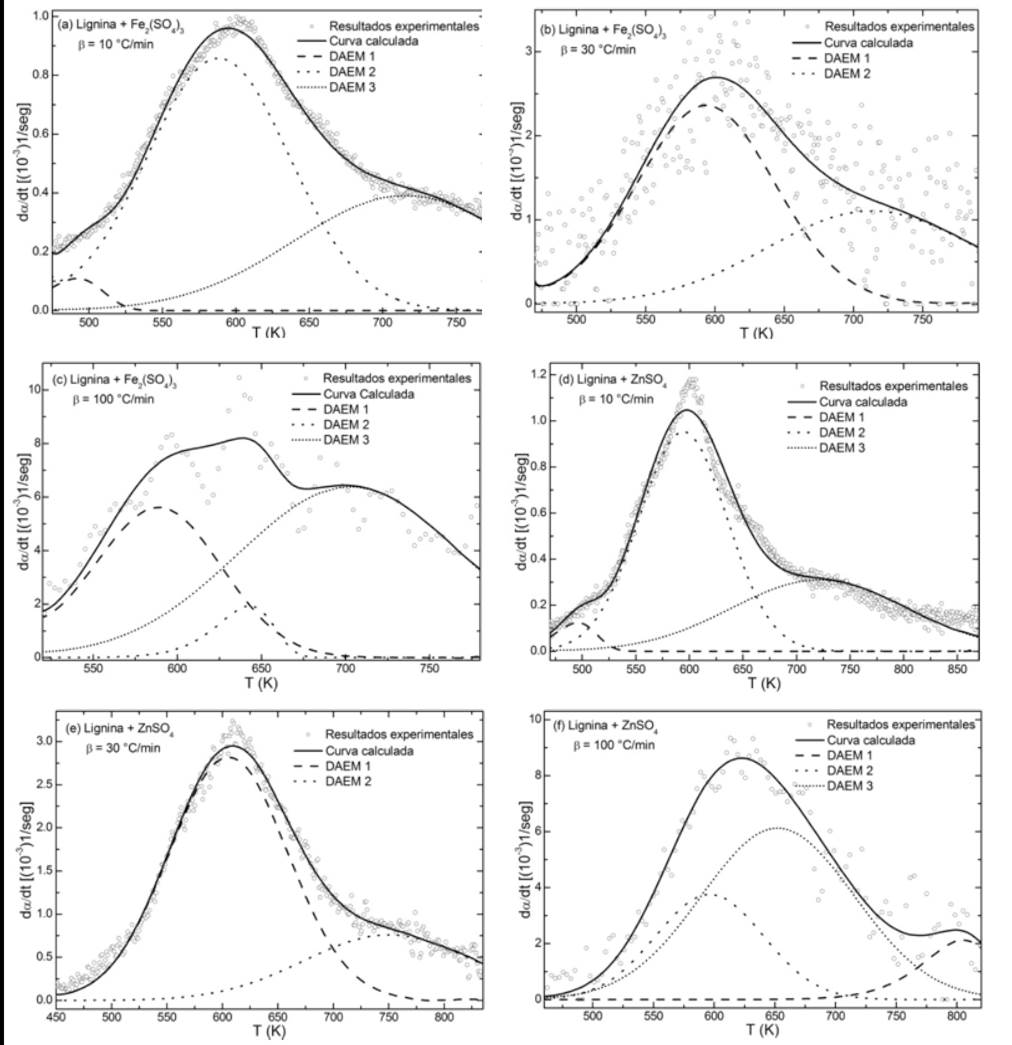
Haciendo un análisis comparativo de las curvas DTG obtenidas a las diferentes velocidades de calentamiento, específicamente para el primer evento de degradación térmica (después de la liberación de agua), se observa que la lignina sin catalizador presenta la temperatura de pico más baja indiferentemente de la velocidad de calentamiento. En el termograma de la muestra de lignina con sulfato de zinc calentada a 100 °C/min, se aprecia en mayor proporción el mencionado efecto retardante, al observar que la temperatura máxima del pico se desplaza 32 °C hacia mayores temperaturas con respecto al pico de la lignina pura. Esto contrasta con el desplazamiento de 18 y 19 °C obtenido a las velocidades de calentamiento más bajas de 10 y 30 °C/min, respectivamente. Al añadir sulfato férrico, se observa que cuando la muestra se calienta a 10 y 30 °C/min, la temperatura del pico permanece prácticamente constante a 331 °C. Sin embargo, al aumentar la velocidad de calentamiento a 100 °C/min, la máxima velocidad de pérdida de peso se presenta a 360 °C.
Esto indica que al calentar rápidamente una muestra de lignina con sulfato férrico se magnifica el efecto retardante del catalizador de hierro.
La adición de sulfato férrico, indiferentemente de la velocidad de calentamiento, produjo una significativa reducción en la velocidad máxima de degradación. Un comportamiento contrario se obtuvo al adicionar sulfato de zinc, ya que este catalizador aumentó ligeramente la velocidad máxima de degradación de la lignina. Por otro lado, según la figura 2, cuando la lignina se calienta a 100 °C/min, a 556 °C se presenta un tercer evento que no se observa en las otras velocidades de calentamiento. Esto sugiere que a esta particular velocidad de calentamiento un cambio de mecanismo en la cinética química tiene lugar. Este evento desaparece bajo la presencia de los dos catalizadores involucrados en la presente investigación, evidenciando que ellos afectan la pirólisis de la lignina.
3.1 Efecto de la velocidad de calentamiento y los catalizadores estudiados
Mediante la utilización del análisis de varianza, se analizó la influencia de los catalizadores y de las velocidades de calentamiento, en la temperatura de pico DTG del evento más significativo en la pirólisis de la lignina. Esta tarea se ejecutó usando el software estadístico Statgraphics Centurion XVII. Los valores del análisis estadístico para la lignina se presentan en la tabla 1. Los resultados muestran que la presencia de los catalizadores afecta significativamente la temperatura de pico DTG del evento de pirólisis principal, mientras que el efecto de la velocidad de calentamiento estadísticamente no es significativa. Esto resulta sorprendente puesto que es bien conocido que la pirólisis es un fenómeno cinético. Precisamente por esta razón la experiencia se repitió múltiples veces con el propósito de examinar si algún error sistemático pudiese tener lugar, sin embargo, los resultados confirman que esta es la respuesta térmica de las muestras.
3.2 Análisis cinético
3.2.1 Modelo de orden de reacción n
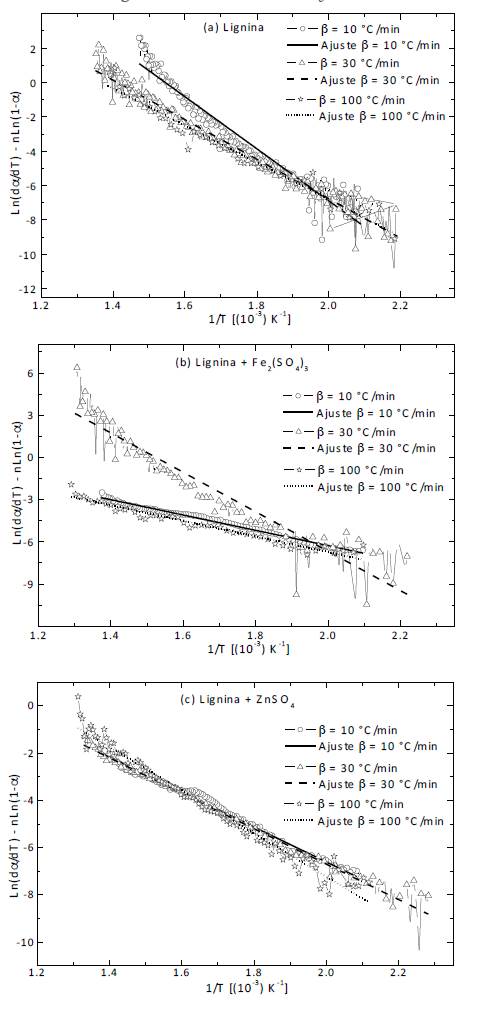
El coeficiente de determinación R2 que se obtuvo usando el modelo de orden de reacción n para todos los ensayos fue superior a 0.9, indicando un buen ajuste de los datos (ver figura 3). No obstante como se nota en la tabla 2, los órdenes de reacción obtenidos en varios ensayos son muy altos desde un punto de vista cinético.
Esto demuestra poca confiabilidad en las relaciones que establece el modelo, y por tanto, impide obtener sólidas conclusiones. Aunque el modelo ofrezca poca confiabilidad, cabe anotar que se aprecia un cambio en los órdenes de reacción al añadir los catalizadores. Así por ejemplo, para la lignina sin adicionar catalizador alguno, el orden es aproximadamente 3; sin embargo, 349.5 ° C al adicionar sulfato férrico el orden de la reacción es 5,1.5 y 1.7 cuando las muestras se calientan a 30, 10 y 100 °C/min, respectivamente. La adición de sulfato de zinc a la lignina resulta en un cambio de orden de reacción de 3 a aproximadamente 2 independientemente de la velocidad de calentamiento, lo cual representa un interesante resultado al aplicar este modelo. Esto sugiere un cambio del mecanismo de la cinética de reacción de la pirólisis de la lignina en presencia de los catalizadores involucrados en este trabajo.
Tabla 2 Ajustes y datos obtenidos con modelo de orden de reacción n.
| Muestras | β (°C/min) | N | R2 | f(α) |
| Lignina | 10 | 3 | 0.972 | (1 - α )3.0 |
| 30 | 3.5 | 0.959 | (1 - α )3.5 | |
| 100 | 3 | 0.959 | (1 - α )3.0 | |
| Lignina + Fe2(SO4)3 | 10 | 1.5 | 0.99 | (1 α )1.5 |
| 30 | 5 | 0.904 | (1 - α )5.0 | |
| 100 | 1.7 | 0.957 | (1 - α )1.7 | |
| Lignina + ZnSO4 | 10 | 1.8 | 0.989 | (1 α )1.8 |
| 30 | 2.2 | 0.986 | (1 α )2.2 | |
| 100 | 2.3 | 0.974 | (1 - α )2.3 |
3.2.2 Método isoconversional
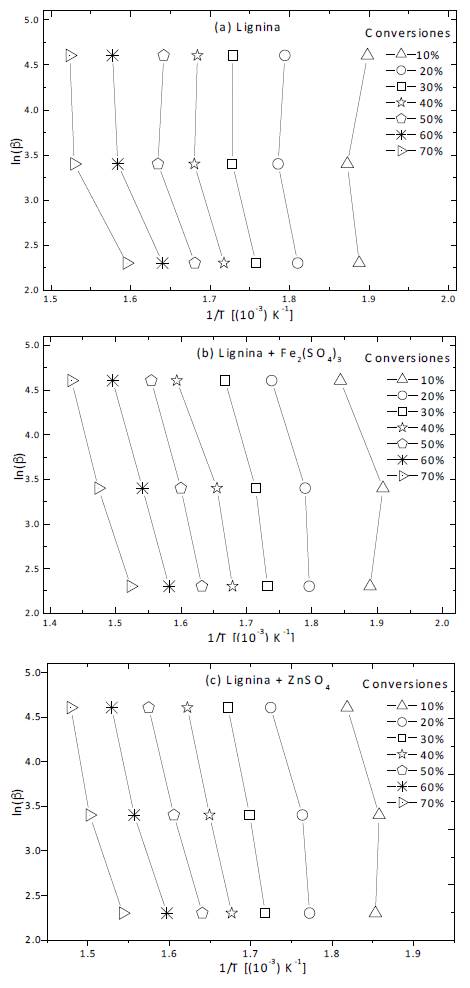
La figura 4, que grafica el ln β en función de 1/T, representa la aplicación de este método a los datos de los termogramas DTG de la lignina con y sin catalizador. Para la muestra de lignina hay un ligero desplazamiento hacia la derecha de los puntos medidos a la velocidad de calentamiento más alta. Dicho desplazamiento es evidente, pues se altera el esperado comportamiento lineal [27]. Ciertamente, los coeficientes de determinación R2 corresponden incluso a valores tan bajos como 0.8. Esto sugiere que a altas velocidades de calentamiento un cambio de mecanismo cinético tiene lugar. Por otro lado, las muestras con catalizador exhiben un buen ajuste para conversiones superiores al 30%, presentando valores de R2 muy cercanos a 1; esto sugiere que el mecanismo de reacción en presencia de los catalizadores es independiente de la velocidad de calentamiento dentro del rango estudiado; lo cual contrasta con el caso de la lignina pura. Se obtuvo una energía de activación promedio de 328 kJ/mol para la lignina con sulfato de zinc y de 240 kJ/mol al añadir sulfato férrico. Dichos valores corresponden al promedio de los resultados que presentan un ajuste con R2 de al menos 0.9. Los valores obtenidos son superiores a los reportados por otros autores para el caso de la lignina (207 kJ/mol [28-30]).
3.3 Modelo de distribución de energías de activación, DAEM
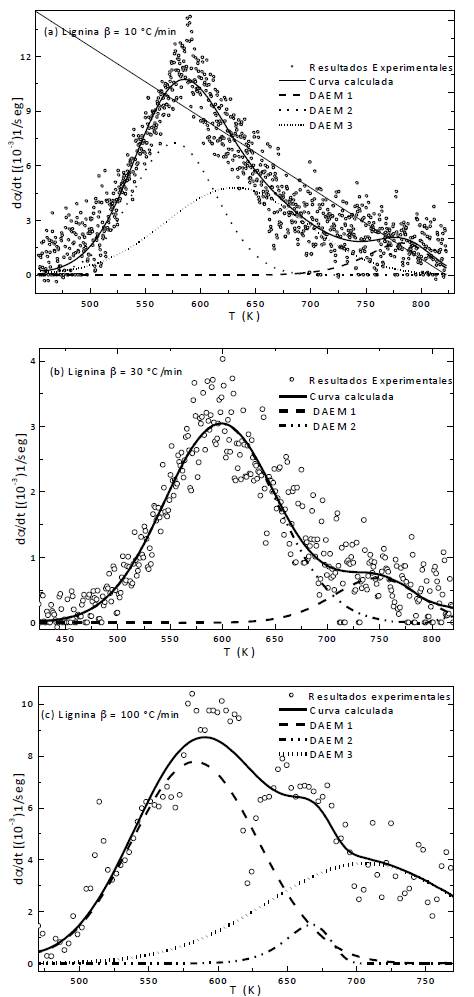
Teniendo en cuenta que durante la pirólisis de los sistemas estudiados se producen numerosas especies (hidrocarburos aromáticos policíclicos, compuestos fenólicos y especies orgánicas oxigenadas [31]) se optó por escoger el número de conjuntos de reacciones o pseudocomponentes que ofreció el mejor ajuste. En la mayoría de los casos, esto se logró cuando al seleccionar 3 pseudocomponentes, lo cual resulta atípico por ser la lignina un componente puro. En el caso de las muestras de lignina con y sin catalizador calentadas a 30 °C/min, el mejor ajuste se obtuvo usando 2 pseudocomponentes. Igualmente en este caso fue necesario usar más de un pseudocomponente para describir el proceso de pirólisis de la lignina.
Los ajustes obtenidos se muestran en las subfiguras a, b y c de la figura 5, que corresponde respectivamente a las velocidades de calentamiento 10, 30 y 100 °C/min.
Los resultados de los parámetros cinéticos obtenidos con este modelo para la lignina sin catalizador a las diferentes velocidades de calentamiento (ver tabla 3) muestran energías de activación que se encuentran dentro de los rangos reportados por la literatura (35 361 kJ/ mol) [32,33].
Las curvas que se ajustaron para las muestras de lignina con catalizadores, a las diferentes velocidades de calentamiento, se presentan en la figura 6.
Los datos indicados en la tabla 3, evidencian que la adición de los sulfatos afecta los parámetros cinéticos de uno o varios de los conjuntos de reacciones, principalmente sobre el parámetro pre-exponencial que en la mayoría de los casos disminuye, lo que ocasiona que la curva parcial DAEM se desplace hacia mayores temperaturas. Estos resultados reiteran un cambio en el mecanismo de reacción de la pirólisis de la lignina en la presencia de los catalizadores objeto de estudio de la presente investigación.
Tabla 3 Parámetros del modelo DAEM para la lignina con y sin catalizadores.
| Parámetros | Lignina | Lignina + Fe 2 (SO 4 ) 3 β = 10 °C/min | Lignina + ZnSO 4 | Lignina | Lignina + Fe 2 (SO 4 ) 3 β = 30 °C/min | Lignina + ZnSO 4 | Lignina | Lignina + Fe 2 (SO 4 ) 3 β = 100 °C/min | Lignina + ZnSO 4 |
|---|---|---|---|---|---|---|---|---|---|
| c1 | 0.079 | 0.0245 | 0.0328 | 0.1436 | 0.5825 | 0.7463 | 0.5834 | 0.3485 | 0.0979 |
| A1 (s-1) | 9.08E09 | 6.66E09 | 5.64E09 | 7.83E10 | 5.95E15 | 2.59E15 | 3.75E16 | 2.67E16 | 5.72E10 |
| E01 (kJ/mol) | 182.7 | 112.2 | 112.3 | 182.3 | 198.3 | 198.3 | 198.3 | 198.4 | 185.1 |
| σ1 (kJ/mol) | 1.758 | 1.758 | 1.719 | 7.83 | 16.09 | 17.01 | 14.4 | 11.3 | 1.8 |
| c2 | 0.4219 | 0.6329 | 0.5936 | 0.8073 | 0.4169 | 0.2931 | 0.0403 | 0.0562 | 0.275 |
| A2 (s-1) | 2.64E14 | 1.10E14 | 7.70E13 | 4.36E15 | 4.60E12 | 8.09E11 | 6.97E16 | 1.65E15 | 6.37E14 |
| E02 (kJ/mol) | 182.8 | 182.8 | 182.8 | 198.3 | 198.3 | 198.3 | 228.9 | 200.1 | 182.8 |
| σ2 (kJ/mol) | 11.1 | 14.3 | 11.6 | 17.3 | 20.3 | 19.5 | 0.001 | 0.001 | 12.4 |
| c3 | 0.4593 | 0.451 | 0.3834 | - | - | - | 0.426 | 0.6658 | 0.6178 |
| A3 (s-1) | 1.54E14 | 1.41E12 | 1.07E12 | - | - | - | 2.52E13 | 2.96E13 | 4.57E14 |
| E03 (kJ/mol) | 198.3 | 198.3 | 198.3 | - | - | - | 198.3 | 198.3 | 198.3 |
| σ3 (kJ/mol) | 19.2 | 20.4 | 21.9 | - | - | - | 19.1 | 17.9 | 18.3 |
4. CONCLUSIONES
En este trabajo se estudió el proceso de descomposición térmica de uno de los principales componentes de la biomasa lignocelulósica, la lignina, en presencia de sulfato férrico y sulfato de zinc. El análisis de varianza mostró un efecto significativo de la presencia de los sulfatos sobre la temperatura de máxima velocidad de descomposición del principal evento de pirólisis. En contraste, se encontró que la pirólisis de la lignina pura se afecta muy poco con el cambio de las velocidad de calentamiento entre 10 y 100 °C/min, lo cual es inesperado por la naturaleza cinética de la pirólisis. En términos generales, los sulfatos de zinc y férrico retardan el proceso de pirólisis de la lignina. Este efecto retardante es más pronunciado en el caso del sulfato férrico y se magnifica a velocidades de calentamiento altas (100 °C/min). Estos sugiere que el efecto de los sulfatos de zinc y férrico es más pronunciado sobre el mecanismo de pirólisis a altas velocidades de calentamiento que sobre el mecanismo dominante a bajas velocidades de calentamiento.
El modelo de orden de reacción n, mostró un buen ajuste a los datos experimentales, pero en algunos casos, valores de orden de reacción muy elevados y por tanto poco realistas. El método isoconversional no ajustó a los datos de la pirólisis de la lignina sin catalizador, pero sí a los datos de la lignina en presencia de los sulfatos de zinc y férrico, lo cual dificultó la interpretación de los resultados del efecto de los catalizadores sobre la pirólisis de la lignina. Para describir la cinética de pirólisis de la lignina con y sin catalizadores, con el modelo DAEM, fue necesario el uso de tres pseudocomponentes, lo cual muestra que es un proceso complejo y que difícilmente puede modelarse como una sola reacción de descomposición. Esto tiene fuertes implicaciones en los modelos de descomposición de la biomasa lignocelulósica. Los tres modelos cinéticos que se usaron para analizar los datos termogravimétricos mostraron que los parámetros cinéticos de la pirólisis de la lignina pura cambian si esta se mezcla con sulfato de zinc o sulfato férrico, lo cual a su vez sugiere un cambio de mecanismo de reacción.