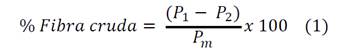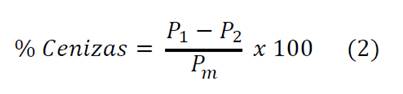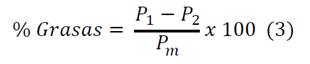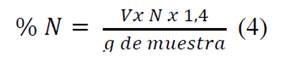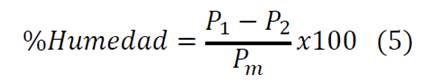1. INTRODUCCIÓN
La continua acumulación de los residuos sólidos a medida que aumenta la industrialización y el consumo de polímeros derivados del petróleo, generan un problema que afecta la salud de los seres vivos y el ambiente.
Uno de los materiales remanentes más persistentes son los plásticos, que permanecen en la extensión terrestre prácticamente indestructibles por miles de años [1,2].
Para contrarrestar esta situación se han desarrollado nuevas alternativas con características similares a los polímeros, siendo productos amigables con el medio ambiente, los cuales se conocen como biopolímeros y en su mayoría se sintetizan a partir de materia prima rica en almidón, como es el caso del ñame espino el cual es producido en Colombia abundantemente, especialmente en la región norte, y se considera una opción viable para la producción de ácido poliláctico (APL) [3].
Como producto microbiano, la producción de AL a partir de fuentes biodegradables ha atraído la atención debido a las múltiples aplicaciones extendidas de sus polímeros, es decir como plástico biodegradable y biocompatible [4]. Las fermentaciones industriales actuales de AL usan cultivos de glucosa pura o de almidón, como el maíz y la papa como sustratos siendo su costo de pretratamiento bajo y su rendimiento alto, la materia prima es costosa y compite directamente con la alimentación de humanos [3]. Por lo tanto, la forma de obtener un alto rendimiento de producción y el título de ácido L-láctico se convierte en un desafío clave para la utilización eficaz de materias primas celulósicas [5].
El AL que se puede obtener a través de la fermentación, es un compuesto interesante, ya que puede ser utilizado en diferentes campos, como en las industrias alimentaria, farmacéutica y química como una molécula de bio-base para la bio-refinería. Además, el AL ha ganado recientemente más interés debido a la posibilidad de fabricar poli-láctico, un polímero verde que puede sustituir a los plásticos derivados del petróleo y ser aplicado en medicina para la regeneración de tejidos y en suturas, reparaciones e implantes. Una de las grandes ventajas de la fermentación es la posibilidad de utilizar desechos agroindustriales para obtener AL ópticamente puro [2,6,7].
En este sentido, diferentes investigadores han reportado la obtención de AL a partir de desechos industriales usando fermentación, obteniéndose una máxima producción de 143,7 g L-1 y después de la purificación de la muestra de AL, la recuperación de azúcares reductores y la eliminación de proteína y color fueron 0,28%, 100% y 100%, respectivamente [8]. También se investigó el efecto del pH ácido (4, 5, 6 y no controlado) sobre la fermentación del AL a partir de residuos alimentarios mediante experimentos de fermentación discontinua utilizando lodos metanogénicos, desechos de alimentos frescos y lodos activados anaeróbicos como inóculos. Se obtuvo que debido al aumento de la hidrólisis, la velocidad de degradación del sustrato y la actividad enzimática, se obtuvieran la concentración óptima de LA y el rendimiento a pH 5, independientemente del inóculo utilizado. La concentración de LA más alta (28,4 g L-1) y el rendimiento (0,46 gg-1-TS) se obtuvieron con residuos de alimentos frescos como inóculo. Además, después de que el sustrato se utilizó completamente, la población de bacterias de AL disminuyó bruscamente, y la producción de LA se convirtió en ácidos grasos volátiles (AGV) a pH 6 en un corto período. Los componentes de VFA variaron con el inóculo suministrado. El análisis de la comunidad microbiana utilizando secuenciación piro de alto rendimiento reveló que la diversidad disminuyó y una abundancia abundante de Lactobacillus (83,4-98,5%) se acumuló durante la fermentación con todos los inóculos [9].
En este contexto, el objetivo de este trabajo científico fue obtener AL a partir del almidón de ñame espino (Dioscorea rotundata) usando Lactobacillus del brueckii ssp. bulgaricus y Streptococcus thermophilus por el método de rayado y decantación convencionales.
2. METODOLOGÍA
2.1 Obtención y caracterización del almidón
El almidón se obtuvo de 5 kg de tubérculos de ñame (Dioscorea rotundata P.) fresco, entero, sin señales de deterioro y en estado de madurez, los cuales se compraron en el municipio de San Juan Nepomuceno, ubicado en el norte del departamento de Bolívar (9º 37’ latitud norte y 74º 15’ longitud oeste). El material inicialmente se lavó para retirar polvo, tierra y suciedad en general, descortezó y lavo nuevamente; luego se redujo de tamaño y licuó con agua destilada para obtener una lechada, esta se filtró por medio de una tela. El filtrado se dejó en reposo, decantó, y el sobrenadante se eliminó, lavándose el sedimento obtenido con agua destilada, filtrados al vacío y secados a 60ºC por 12 h, posteriormente se molió y empacó [10].
La caracterización del almidón obtenido se realizó determinando el contenido de fibra cruda, de cenizas, grasa, proteínas y amilosa.
Para la determinación del contenido de fibra cruda inicialmente se pesaron 2 g de almidón en un vaso de precipitado y se desengrasó con éter, después se agregaron 200 mL de ácido sulfúrico al 1,25% v/vcaliente y se puso a reflujo durante 30 min. Se filtró en caliente a través de una tela en un Buchner, lavándose con agua destilada caliente hasta la eliminación de la reacción ácida y usando 200 mL de NaOH al 1,25% en peso se transfirió todo el material que pudo haber quedado en la tela al vaso de precipitado de la reacción anterior.
Luego se calentó por 30 min, al cabo de los cuales se filtró de nuevo a través de la tela y se lavó con agua caliente para eliminar la reacción alcalina. El residuo se filtró a través del crisol de Gooch. El contenido del crisol se llevó a una estufa cerrada y secándose hasta peso constante a una temperatura no mayor a 110ºC, se enfrió y se pesó, después se calcinó el crisol y su contenido en una mufla a 550ºC de una a dos horas, se enfrió y se pesó [10]. El porcentaje de fibra cruda se calculó a partir de la ecuación 1.
Donde P1 es el peso en gramos del crisol calcinado, P2 el peso en gramos del crisol vacío y Pm el peso en gramos de la muestra.
La determinación del contenido de cenizas se realizó pesando 2 g de muestra en una capsula de porcelana previamente tarada, esta fue llevada a una mufla que se encontraba a 300ºC aproximadamente y se calcinó completamente aumentando la temperatura hasta 600ºC por 6 h. Transcurrido el tiempo necesario se apagó la mufla y se esperó a que la temperatura bajara hasta 120ºC aproximadamente, entonces se retiró el crisol con el residuo (cenizas) y se colocó en un desecador.
Por último, al cabo de por lo menos 40 minutos, se determinó el peso de las cenizas en una balanza analítica [10,11,12]. El porcentaje de cenizas se calculó a partir de la ecuación 2.
Donde P1 es el peso en gramos del crisol con cenizas, P2 es el peso en gramos del crisol vacío, Pm es el peso en gramos de la muestra.
Para el cálculo del contenido de grasa se pesaron 100 g de almidón en un cartucho de papel filtro y se transfirió a un equipo Soxhlet, posteriormente se adicionó éter de petróleo suficiente para extraer las grasas en un balón previamente tarado, este proceso se llevó a cabo durante una hora, luego se evaporó el solvente del balón y se pesó con el contenido de grasa extraído [9,13].
Donde P1 es el peso en gramos del balón con grasa, el P2 peso en gramos del balón vacío y Pm el peso en gramos de la muestra.
El contenido de proteínas se determinó pesando 0,5 g de almidón y se colocaron en un frasco digestor, luego se añadieron 8 mL de ácido sulfúrico concentrado y posteriormente 0,20 g de catalizador (K2SO4+CuSO4). La muestra se colocó en una cabina de extracción para realizar la digestión, este proceso duro hasta cuando la solución tomo un color verde manzana transparente, posteriormente se dejó enfriar, y se le adicionaron 150 mL de agua aproximadamente, 14 mL de hidróxido de sodio al 50% y posteriormente se destiló por 40 minutos, el destilado se recogió en 6 mL de ácido bórico al 4% el cual contenía una solución indicadora mixta (rojo de metilo-azul de metileno). Una vez fue terminada la destilación, se valoró la solución con ácido sulfúrico 0,02 N [10].
Donde V es volumen de ácido sulfúrico gastado en la valoración, N la normalidad del ácido, siendo el % proteínas = %N x 5,75.
Se entiende por humedad residual la cantidad de agua que posee cualquier material en equilibrio con la atmósfera que lo rodea. Para la determinación del contenido de humedad residual se pesaron 3 g de almidón en una cápsula de porcelana, posteriormente se colocó el recipiente que contiene la muestra pesada, en una estufa, a una temperatura entre 100 y 105°C, por espacio de 4 a 6 horas. Luego se retiró de la estufa y se enfrió en un desecador, se pesó una vez frío el producto. Se determinó la pérdida de peso [10,14]. Los resultados se expresaron en tanto por ciento mediante la ecuación 5.
Donde P1 es el peso en gramos de la cápsula con el alimento a analizar, P2 el peso en gramos de la cápsula después del calentamiento y Pm el peso en gramos de la muestra.
Para determinar el contenido de amilosa se disolvieron 20 mg de almidón (base seca) en 8 mL de dimetilsulfoxido (DMSO) al 90%, se agitó vigorosamente en un Vortex por 20 minutos y posteriormente se calentó la dispersión en un baño de maría Mermet a 85ºC por 15 min. En seguida fue enfriada la mezcla y se aforó a 25 mL con agua destilada. Se tomó 1 mL de esta dispersión y se transfirió a un matraz aforado de 50 mL, al cual se le había agregado 40 mL de agua destilada y 5 mL de una solución de yodo/yoduro de potasio (0,0025 M - 0,0065 M). Finalmente se aforó con agua, se homogenizó y se dejó en reposo por 15 min antes de leer en espectrofotómetro a 630 nm usando una curva patrón de almidón soluble (amilosa) estandarizado para la realización de los cálculos [10,14,15].
2.2 Siembra de microorganismos utilizados
Se empleó una mezcla de cultivos liofilizados de Lactobacillus del brueckii ssp. bulgaricus y Streptococcus thermophilus, los cuales se mantuvieron congelados a -18 °C para garantizar su calidad. Para la activación de los microorganismos, se modificaron las cantidades de caldo y la concentración del inóculo; se tomaron 0,5 g de cultivo y se activaron en 50 mL de caldo MSR, incubando a 37ºC durante 24 h. Posteriormente, se tomó 1 mL de la muestra y se realizaron 10 siembras en profundidad por duplicado en Agar MRS, incubándose a las mismas condiciones por 48 h [16].
2.3 Cuantificación del ácido láctico obtenido
La obtención del AL se realizó usando 1000 mL de la solución de almidón y 500 mL del cultivo bacteriano, manteniendo la temperatura a 37ºC y pH 6. La cantidad de ácido láctico se determinó por triplicado, mediante la titulación de 10mL de muestra fermentada con NaOH 0,1 N, empleando fenolftaleína como indicador [17,18]. El AL producido para su separación se filtró y luego centrifugó a 2500 rpm durante 5 min; posteriormente la solución se destiló con temperaturas entre 96 y 100ºC. La concentración de AL se midió por HPLC Agilent Tecnhnology® (EEUU) con una columna C-610 H y 30 cm de longitud; H3PO4 al 0,1% y 0,5 mL/min como la fase móvil, detección UV a 210 nm y 30°C [17,19]. Todos los ensayos se realizaron por triplicado. Los resultados se expresaron como la media ± DE (desviación estándar). Las diferencias significativas se determinaron mediante análisis de T de student.
3. RESULTADOS Y DISCUSIÓN
Los resultados de los análisis bromatológicos del almidón de Dioscorea rotundata P. se presentan en la tabla 1. Los resultados mostrados en la tabla 1 establecen que el nivel de proteína se encuentra por encima del nivel permitido por la FDA en almidones de maíz (0,35%), por lo tanto, el almidón de ñame no es apto para ser utilizado en la elaboración de jarabes, debido a que presentó un mayor contenido de proteína (7,64%).
Tabla 1 Análisis químico proximal del almidón de ñame.
| Parámetros | Valores para almidón de ñame |
|---|---|
| Proteína cruda, % | 7,64±0,04 |
| Grasas, % | 0,28±0,02 |
| Amilosa, % | 26,78±0,12 |
| Amilopectina, % | 73,22±0,12 |
| Cenizas, % | 0,48±0,08 |
| Fibra cruda, % | 0,88±0,03 |
| Humedad, % | 8,26±0,24 |
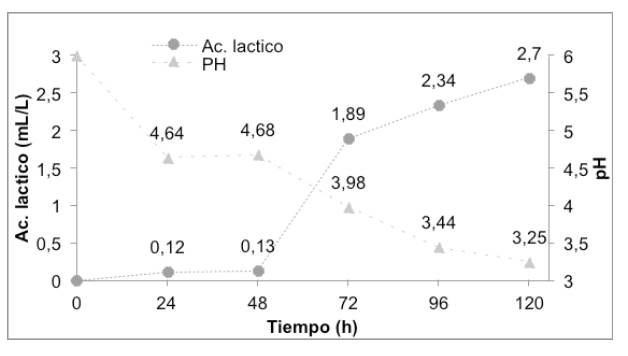
En la figura 1 se observó una disminución del pH en la solución inicial de almidón e inóculo lo cual se considera como indicador de producción de ácido, evidenciándose en las primeras 24 h una reducción pronunciada del pH e identificándose una estabilización entre las 120 144 h; esto se debe principalmente al consumo total del sustrato. Por otro lado, el contenido de proteína con respecto al de fibra es claramente mayor, por lo cual el almidón a partir de ñame espino puede ser considerado como el sustituto parcial o total de ingredientes con alto valor proteico en la elaboración de productos alimenticios, considerando la digestibilidad de dichas proteínas así como en la elaboración de AL [20].
La humedad residual en el almidón no se encontró dentro de los niveles normales con un valor de 8,26%, este valor puede alcanzar valores entre el 10 y el 13% [10]. Un contenido inferior del 15% de humedad se puede asociar con un nivel reducido de actividad con el agua, por tanto un tiempo de vida útil mayor [20]. El almidón consiste en dos tipos de moléculas, la amilosa y la amilopectina. Los almidones normales contienen 20-30% de amilosa, siendo la diferencia constituida por amilopectina. Los almidones cerosos y de alto contenido de amilosa contienen menos del 15% y más del 40% de amilosa, respectivamente, sin embargo, la proporción relativa de amilosa a amilopectina puede variar de cultivo a cultivo y con variedad. El contenido de amilosa del almidón es una característica importante que afecta su funcionalidad. Se ha encontrado que un aumento en el contenido de amilosa del almidón reduce la potencia de hinchamiento y la solubilidad de los almidones de coco y de trigo [21]. El porcentaje de amilosa del almidón, se encontró dentro de los límites esperados de 25 a 27 con un valor del 26,78±0,12 lo cual se asocia con menor tendencia a la retro-degradación del almidón y, por consiguiente, a una menor tendencia del producto a sufrir “envejecimiento” [9,10]. Se ha estudiado la influencia de los perfiles de las cadenas de amilopectina en las propiedades de los almidones, encontrándose que a mayor presencia de estas los almidones muestran una viscosidad de pico más alta, aumentando así la capacidad de pegado [22,23].
El contenido de lípidos (grasas totales) se encuentra dentro del rango, y es importante en el almidón debido a que estos forman un complejo con la amilosa, la cual tiende a constreñir el abultamiento y la solubilización de los gránulos de almidón; por esto se necesitan temperaturas superiores a 125°C para romper la estructura amilosa-lípido y solubilizar la fracción de amilosa, ya que la mayor parte de estos lípidos son lisofosfolípidos; es decir una cadena de ácido graso esterificada con ácido fosfórico [24]. Además, un mayor contenido de fibra cruda que de mineral (cenizas) implica un aumento de la capacidad de retención de agua, especialmente de la humedad relativa intermedia, según lo reportado por Zhang et al. (2011) y Cano et al. (2014), ya que una mayor cantidad de fibra y cenizas favorece las interacciones polares del almidón con las moléculas de agua [25,26].
El AL y sus derivados como sales y esteres son ampliamente utilizados como en la industria alimenticia, química, farmacéutica, del plástico, textil, la agricultura, alimentación animal, entre otros. En la industria alimentaria se usa como acidulante y conservante y en la industria de plásticos es utilizado como precursor del ácido poliláctico (PLA), un polímero biodegradable con interesantes usos en la industria y la medicina; se considera que ésta es la principal aplicación del ácido y la causa por la cual ha aumentado considerablemente su demanda siendo la pureza óptica un pre-requisito para la síntesis de éste homopolímero [27,28]. Gudjónsdóttir et al. (2016), obtuvieron almidón a partir de mafafa (Xanthosoma sagittifolium) en sus variedades roja y blanca, teniendo la variedad roja un contenido elevado de amilopectina (relación amilosa/amilopectina de 0,65), mientras que la variedad blanca era alta en contenido de amilosa (relación amilosa/amilopectina de 1,43) [29].
Los resultados de la figura 1, muestran que el pH afecta significativamente las actividades enzimáticas y la asimilación de nutrientes por parte de los microorganismos utilizados en la fermentación del almidón, siendo notorio que al aumentar la producción de AL el pH del caldo de cultivo cae rápidamente por debajo de 5 conduciendo a una disminución de la actividad celular e inhibiendo completamente su producción, ya que el pH del medio afecta significativamente el metabolismo bacteriano, que a su vez puede afectar el crecimiento celular y la producción de los metabolitos objetivo [30].
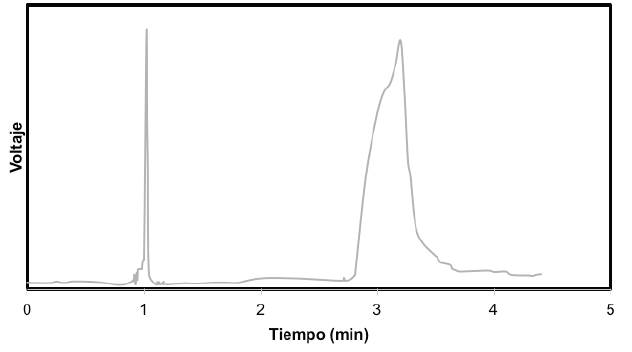
En la figura 2 el cromatograma correspondiente al AL producido al finalizar las 120 h obteniéndose una concentración 16,26% p/p, como consecuencia de la fermentación del almidón de ñame espino con Lactobacillus del brueckii ssp. bulgaricus y el Streptococcus thermophilus.
En la figura 2 se muestra la presencia de ácido láctico en el pico 3,4, para la concentración alcanzada; siendo los resultados del presente estudio superiores a los reportados por Komesu et al. (2014), los cuales fueron de 5% p/p al fermentar caña de azúcar para la producción de AL [31]. Al utilizar bacterias sobre la producción de ácido láctico se busca que éstas sean preferiblemente termófilas, que fermenten rápida y completamente los sustratos baratos, con adición mínima de nutrientes nitrogenados, que crezcan en valores bajos de pH, que presenten poca producción de biomasa y una despreciable cantidad de subproductos. Los géneros Lactobacillus, Streptococcus, Enterococcus son los más estudiados en la producción [12,33], Medina et al. (2014), obtuvieron resultados para ácido láctico inferiores a los reportados en éste estudio con un porcentaje del 13,9% [34].
4. CONCLUSIONES
Teniendo en cuenta los porcentajes de proteína cruda, grasas, amilosa, amilopectina, cenizas, fibra cruda y humedad obtenidos durante la caracterización fisicoquímica del material realizada se considera que el almidón obtenido a partir de ñame espino puede sustituir total o parcialmente ingredientes con alto valor proteico en la elaboración de productos alimenticios, con una vida útil larga debido al bajo contenido de agua en su estructura, además se puede establecer que el almidón cuenta con baja tendencia a sufrir ‘envejecimiento’. Por lo anterior, se puede considerar el almidón sintetizado como un buen precursor para la síntesis de ácido láctico. El ácido láctico puede ser obtenido a partir de derivados de recursos renovables como el almidón de ñame espino con una concentración del 16,26% p/p, transformando este recurso natural en un precursor potencial, siendo un producto amigable con el medio ambiente, lo cual representa un proceso factible para la producción de ácido láctico a partir de desechos lignocelulósicos de origen agrícola.