1. INTRODUCCIÓN
La minería aurífera en el departamento de Caldas, municipio de Marmato, tradicionalmente se ha desarrollado a escala media desde tiempos prehispánicos, siendo que hasta la fecha existen más de 500 minas que operan en condiciones precarias, con alrededor de 2.900 mineros que trabajan de forma artesanal [1] empleando diversos procesos de recuperación y extracción del oro, que han generado hasta la actualidad una gran cantidad de desechos ricos en sulfuros metálicos, los cuales con el paso del tiempo y debido a la degradación natural generan una contaminación, tanto en el suelo como en las aguas, produciendo drenajes ácidos y constituyéndose, de esta manera, en un problema de tipo ambiental muy severo debido a la recurrencia de éste en el tiempo. Estos desechos son concentrados constituidos por los sulfuros acompañantes del oro, muchos de ellos de interés económico, ya que son fuente de diversos metales como el Zn, Cu, Pb, Cd, entre otros [2], [3]. Los residuos de la zona de Marmato son reconocidos por sus contenidos importantes en minerales como la esfalerita, principal fuente de extracción de Zn y tal vez la única fuente natural del Cd [4].
Desde hace varias décadas, la biotecnología viene siendo utilizada en la minería como una opción para la recuperación de metales como Cu y Au principalmente, donde se utiliza industrialmente manejándose volúmenes de mineral tratado en tanques agitados de hasta 1.000 ton de capacidad para beneficio de Au y en pilas de lixiviación principalmente para el Cu [5], [6]. Adicionalmente, en los últimos años se viene explorando la posibilidad de utilizar este medio para recuperar otros metales como el Zn, Pb, Ni, Co, dentro de los más comunes [7].
Al igual que muchos otros sulfuros, la esfalerita se lixivia en presencia de iones férricos. El hierro está presente como una impureza en todos los minerales naturales de esfalerita siendo que la velocidad de disolución de la esfalerita es proporcional al contenido de hierro [8]. En este caso entonces, el papel fundamental de los microorganismos es mantener niveles adecuados de iones férricos en solución. La ecuación (1) muestra el mecanismo general de lixiviación de la esfalerita [9].
El principal propósito de este estudio es mostrar los resultados iniciales de la lixiviación de Zn a partir de esfalerita proveniente de la zona alta del distrito minero de Marmato, así como comparar el comportamiento de varias cepas aisladas a partir de lixiviados en la zona, con el fin de tener un rápido criterio de selección de microorganismos oxidantes de hierro y azufre eficientes, para su posterior utilización en ensayos de mayor escala.
2. METODOLOGÍA
2.1 Toma de muestras
Después de hacer un reconocimiento general, con el fin de definir lugares de enriquecimiento en esfalerita en el municipio de Marmato, Caldas, se colectaron muestras tanto biológicas como mineralógicas, en la parte alta del distrito aurífero. Se tomaron muestras líquidas en minas ubicadas en zonas de bajo tráfico, que presentaban color rojo intenso típico de oxidación activa, como se observa en la figura 1(a); muestras de espeleotemas como estalactitas y cortinas, que fueron muestreadas mediante raspado de las paredes, ver figura 1(b), y que igualmente evidenciaban procesos de oxidación intensiva. En total se colectaron ocho muestras de las minas: El Corozo, La Ochoa 1, La Floresta, El Patacón y San Antonio, ubicadas en la parte alta del municipio de Marmato, zona reconocida por ser rica en esfalerita, principal mineral objeto de este estudio.
Fuente: propia.
Figure 1 Liquid sample from San Antonio mine (a); solid sample of the speleotemes (b).
Las muestras biológicas fueron recogidas en frascos de vidrio previamente esterilizados y transportadas en nevera de icopor, a una temperatura aproximada de 4°C, para su posterior procesamiento en laboratorio, el cual fue realizado en las siguientes 24 horas.
2.2 Aislamiento de microorganismos
Siguiendo el procedimiento utilizado en investigaciones anteriores [10], [11], de acuerdo con García et al. (1992) [12] y Fowler et al. (1999) [13], cada una de las muestras obtenidas en las minas descritas se procesó para aislar selectivamente microorganismos acidófilos oxidantes de hierro, utilizando el medio de cultivo 9K, el cual consiste en: 0,4 g (NH4)2SO4; 0,1 g K2HPO4; 0,4 g MgSO4.7H2O cantidades ajustadas a 1 L; adicionando hierro preparado así: 9K+Fe: 100-400 mM FeSO4; ajustado a pH 1,8 con H2SO4. Para el comienzo del aislamiento, se tomaron 10 g o 10 mL de muestra (total de 8 muestras descritas en el apartado anterior) y se agregaron a 90 mL de medio de cultivo 9K, se incubaron en agitación constante a 200 rpm, a una temperatura de 35°C, monitoreándose diariamente el pH y el potencial de óxido-reducción (Eh) por un período de quince días. De estos cultivos iniciales se realizaron tres réplicas sucesivas, tomando 10% del inóculo obtenido e incubando en medio fresco 9K por el mismo período de tiempo y bajo las mismas condiciones, esto con el fin de seleccionar los microorganismos de interés y eliminar aquellos que no son oxidantes de hierro pero que pueden estar presentes en las muestras originales.
2.3 Montaje y monitoreo de ensayos
Una vez adaptados y seleccionados los cultivos (descritos en el apartado anterior) crecidos en medio 9K para oxidar activamente hierro ferroso, fueron realizadas series bioquímicas y crecimiento en medio sólido [13], [14], con el fin de evidenciar la presencia de cepas de acidófilos oxidantes de hierro compatibles con Acidithiobacillus ferrooxidans, las cuales forman colonias de borde liso y coloración marrón. Todas las muestras de las minas demostraron la presencia de estas bacterias, siendo que una vez confirmada se procedió a hacer montajes de ensayos con cada muestra de las minas tomadas inicialmente, utilizando como sustrato concentrados de pirita y esfalerita molidos a pasante malla 200 (Tyler), en proporciones 1:1, con el fin de seleccionar las mejores cepas de acuerdo a la rapidez para lixiviar Zn.
Para comenzar con la selección de las mejores cepas nativas oxidantes de los sulfuros, cada una de las muestras se cultivó en el medio 9K, adicionando 1.25% (p/v) de esfalerita + 1.25% (p/v) de pirita y 10% (v/v) de inoculo para un volumen final de 100 mL, usando las mismas condiciones de incubación: 35°C, 180 - 200 rpm, monitoreando diariamente el pH, Eh y evaluando la concentración de Zn en solución a través del tiempo. Las medidas de pH y Eh fueron realizadas utilizando un pehachímetro portátil Hanna HI 9910, para las medidas de ORP se utilizó un electrodo Sentix con solución de Ag/Cl punta de platino. La determinación de Zn en solución fue realizada por método complexo métrico [15]. Para cada muestra se realizó un conteo de células utilizando cámara de Newbauer, con el fin de evaluar que la concentración de células fuera similar en todas las muestras, las cuales estuvieron entre 2 x 107 cel/mL y 2.5 x 107 cel/mL.
Cada una de las muestras se sometió a un porcentaje de pulpa de 5% (p/v) (2,5% esfalerita + 2.5% pirita) en las mismas condiciones antes mencionadas. De este último ensayo, se seleccionaron los mejores cultivos, de acuerdo a la concentración de Zn lixiviado, para ser sometidos a concentraciones de pulpa del 8% (p/v) y 10% (p/v), adaptando de esta manera las cepas, para ser utilizadas en posteriores trabajos en reactores de mayor capacidad.
La denominación de los cultivos se realizó de acuerdo a las muestras biológicas tomadas inicialmente así: (i) San Antonio 1 y 2: muestras líquidas tomadas en la mina San Antonio; (ii) #2: muestra líquida con sedimentos, tomada en la mina El Corozo, frente Carrizales; (iii) #5: muestra de estalactitas, tomada en un punto de oxidación en un socavón cerrado de la mina El Corozo; (iv) #6: muestra tomada de la mina La Floresta, guía El Caliente; (v) #7: muestra líquida con sedimentos, tomada en la guía antigua de la mina El Patacón; (vi) #8: muestra de estalactitas, tomada de la mina El Corozo en zona que evidencia oxidación natural; (vii) Ochoa: muestra tomada en la mina La Ochoa, guía principal, mediante raspado de las paredes.
3. RESULTADOS Y DISCUSIÓN
A partir de los resultados de la siembra en medio líquido, se pudo constatar que todas las muestras biológicas tomadas en el distrito minero de Marmato se mostraron positivas para la presencia y crecimiento de microorganismos acidófilos oxidantes de hierro, evidenciado por los valores de pH, potencial de oxidorreducción y coloración rojo intenso de los medios de cultivo enriquecidos con hierro [16,18].
En todos los ensayos con mineral, el comportamiento del pH y el Eh es similar a los cultivos enriquecidos con Fe2+ (selección inicial siembra en medio líquido), observándose una tendencia en todas las muestras a aumentar el pH en las primeras horas a valores cercanos a 4, para luego establecerse alrededor de 2, siendo las muestras denominadas: San Antonio 2 y #7 las que alcanzaron pH más bajos en torno a 1.7, seguida de la muestra #8, ver figura 2. Un comportamiento inverso fue observado con los valores de Eh, los cuales alcanzaron valores por encima de los 600 mV como se muestra en la figura 3, evidenciando una oxidación activa de hierro por acción microbiana [17], [18].
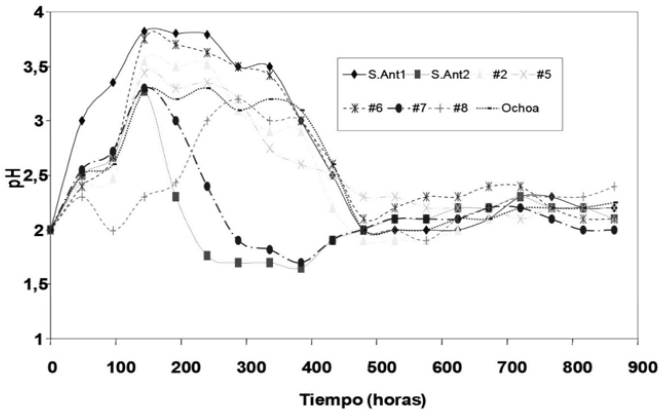
Figure 2 pH variation over time (35 days) of samples obtained in the mines of Marmato, Caldas, with 5% (w/v) mineral.

Figure 3 Eh variation over time (35 days) of samples obtained in the mines of Marmato, Caldas, with 5% (w/v) mineral.
El aumento en el pH durante las primeras horas de cultivo puede ser explicado por varias razones: (i) por el consumo de H+ en el sistema ya que las bacterias utilizan los protones para generar ATP en su ciclo de respiración [19], disminuyendo posteriormente, hasta alcanzar una alta acidez interpretada como producción de ácido sulfúrico debida a la acción bacteriana sobre la esfalerita y por hidrólisis del hierro férrico liberado en solución acuosa; (ii) Fowler et al (1999) [13] explican además que el aumento inicial de pH puede ser debido a la acción buffer de los exopolisacáridos celulares y; (iii) debido a la disolución de carbonatos tipo calcita, el cual es un mineral comúnmente presente en este tipo de minas y que fue asociado a los sulfuros en la zona [10], [11].
En cuanto a la concentración de Zn lixiviado, los cultivos de las muestras San Antonio 1 y 2, y la #7 fueron los seleccionados como los más aptos para continuar con las adaptaciones al mineral a concentraciones de 8% y 10% de pulpa (p/v), ya que fueron los que lograron mayores cantidades de Zn en solución al final del tiempo (35 días), ver figura 4, siendo San Antonio 1 el cultivo que alcanzó el nivel más alto de lixiviación, cercano a 70000 ppm, a los 30 días del ensayo. A pesar que la muestra San Antonio 2 obtuvo 35000 ppm de Zn a las 96 horas (4 días), sólo llegó a un máximo de 55000 ppm a los 30 días, de igual manera que el cultivo #7. Las concentraciones alcanzadas por estos cultivos, aunque menores, se consideraron importantes para continuar los ensayos con mayores porcentajes de pulpa.
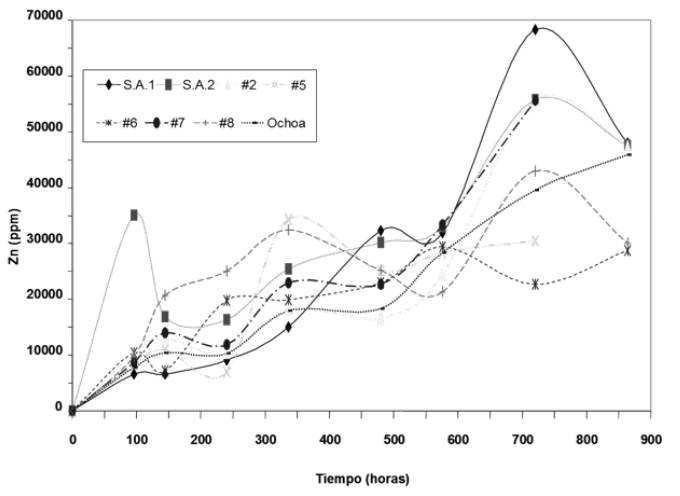
Figure 4 Variation in the concentration of Zn in solution over time (35 days) of the original samples obtained in the mines of Marmato, Caldas, with 5% (2.5% (w/v) sph + 2.5% (w/v) py) ore.
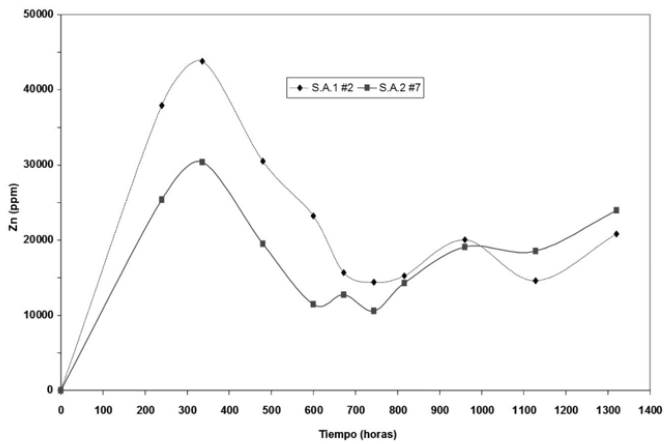
Figure 5 Variation in the concentration of Zn in solution over time (55 days) of the selected samples, San Antonio 1 and 2, mines of Marmato, Caldas, with 8% (4% (w/v) sph + 4% (w/v) py) ore.
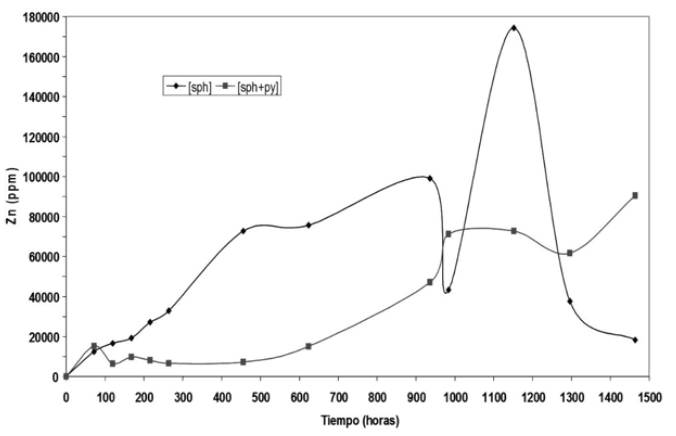
Figure 6 Variation in the concentration of Zn in solution over time (61 days) of the selected samples, San Antonio 1 and 2, mines of Marmato, Caldas, with 10% (w/v) ore. (4% (w/v) sph + 4% (w/v) py). In this assay were used two substrates: 10% (w/v) concentrate ore of sph. and 10% (p/v) concentrate ore (5% py + 5% sph).
Los resultados de la lixiviación de Zn en los cultivos seleccionados sometidos a 8% (p/v) de sustrato, muestran en general que existe una adaptación gradual de las cepas a oxidar mayores concentraciones de mineral, ya que, como se observa en la figura 5, se disminuye el tiempo en el cual se alcanzan niveles altos de extracción de Zn. Por ejemplo, comparando los cultivos con 5% y 8% (p/v) de mineral a las 336 horas, las cepas con 8% (p/v) alcanzan valores cercanos a 45000 ppm, mientras que con 5% (p/v) la mayoría de los cultivos poseen alrededor de 25000 ppm, con el mismo tiempo de oxidación, ver figuras 4 y 5.
En los ensayos utilizando 10% (p/v) de sustrato, se hizo una variación en el montaje ya que se utilizó un cultivo con un sustrato constituido únicamente por esfalerita. Como era de esperarse, las cepas con (sph) lixiviaron el doble de Zn que las cultivadas con mezcla (sph+py), ver figura 6. De otro lado, al comparar el cultivo mezcla (sph+py) con los ensayos anteriores, se observa una clara inhibición en la lixiviación de Zn con 10% (p/v) de pulpa respecto a 5% (p/v) y 8% (p/v) de pulpa, ya que se requirió un mayor período de tiempo para alcanzar altos niveles de Zn en solución según los resultados mostrados en las figuras: 4, 5 y 6, lo que podría estar indicando que un 10% (p/v) de sustrato, sería una concentración límite para estas cepas nativas. Este resultado está acorde a otros estudios reportados, en los cuales la mayor cantidad Zn lixiviado se encuentra alrededor de 10% (p/v) de pulpa y utilizando aislados nativos [7], [9], [16], [20,21].
Es importante resaltar que los ensayos con 8% (p/v) y 10% (p/v) de mineral experimentaron una caída importante en la concentración de Zn disuelto, ver figuras 5 y 6, el cual aparentemente se precipitó como un sólido blanco, depositándose visiblemente sobre el mineral, siendo esto más significativo para los cultivos con 10% (p/v) de pulpa y concentrado de esfalerita. Este resultado es interesante para posteriores trabajos que consideren la utilización de este elemento, Zn, con una posible utilidad comercial, siendo que por métodos gravimétricos se podría separar el zinc lixiviado del sulfuro no oxidado.
4. CONCLUSIONES
A partir de los resultados se puede concluir lo siguiente:
Todos los aislados tomados del distrito minero de Marmato, Caldas, presentaron respuesta positiva hacia la oxidación de hierro y la disolución de esfalerita. Sin embargo, dichas cepas provenientes de diferentes minas de la misma zona y tomadas bajo las mismas condiciones presentaron comportamientos diferentes frente la oxidación de la esfalerita y la pirita, siendo que, de ocho aislados, solo tres mostraron una mayor habilidad para lixiviar zinc.
El límite de porcentaje de pulpa para las cepas aisladas de minas de Marmato, Caldas, está alrededor del 10% (p/v), ya que a estos niveles se pudo observar una disminución considerable en la velocidad y eficiencia de oxidación de los sulfuros estudiados con la consecuente lixiviación de Zn.
La metodología realizada en este estudio fue útil para comparar eficiencias entre aislados de cepas oxidantes de hierro con capacidad de lixiviar zinc, y por tanto definir con un criterio adecuado, la selección de las cepas más aptas para continuar evaluaciones de biolixiviación a mayor escala.
Este estudio demuestra que es posible brindar alternativas para el manejo de residuos generados en la explotación minera, principalmente la artesanal, de Marmato, Caldas, los cuales pueden generar valor agregado por la recuperación de metales de interés económico como el zinc.















