Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista EIA
Print version ISSN 1794-1237
Rev.EIA.Esc.Ing.Antioq no.5 Envigado Jan./June 2006
EVALUACIÓN DE LA RESISTENCIA DE UN AISLADO BACTERIANO NATIVO COMPATIBLE CON PSEUDOMONA SP. AL INSECTICIDA LORSBAN 4 EC
Adriana María Quinchía1; Felipe Andrés Gómez2; Karol Palencia Penagos3; Clara Eugenia Giraldo Lopera4
1 Ingeniera Agrícola, Universidad Nacional Sede Medellín. Especialista en Ingeniería Ambiental y Magíster en Ingeniería con énfasis en Ambiental, UPB. Docente e investigadora del Grupo de Investigación Gabis -Gestión del Ambiente para el Bienestar Social-, EIA. pfadqui@eia.edu.co.
2 Biólogo, Universidad de Antioquia. Docente de la Universidad de Antioquia y la Escuela de Ingeniería de Antioquia.
3 Ingeniera Ambiental, EIA. Consultora independiente. palenciakarol@yahoo.es.
4 Ingeniera Ambiental, EIA. claragiraldo@epm.net.co.
Artículo recibido 22-II-2006. Aprobado 7-VI-2006
Discusión abierta hasta noviembre 2006
RESUMEN
Se evaluó la resistencia de un aislado bacteriano compatible con Pseudomona sp. frente al insecticida Lorsban 4EC (ingrediente activo Chlorpyrifos) a escala de laboratorio. El aislado bacteriano se obtuvo a partir de un suelo del Oriente Antioqueño sometido a la aplicación del insecticida para el cultivo de pastos.
Al suelo se le analizaron los principales factores que afectan la movilidad y adsorción del insecticida en él, se obtuvieron como resultados un porcentaje alto de materia orgánica, elementos mayores y menores así como media a alta capacidad de intercambio catiónico, lo que facilita la adsorción del plaguicida en su fracción coloidal de la micela orgánica e inorgánica. La textura franco arenosa del suelo genera buena aireación, que favorece los procesos de volatilización y degradación del plaguicida.
El aislado bacteriano se expuso a diferentes concentraciones del insecticida (480 ppm, 4.800 ppm, 24.000 ppm y 48.000 ppm), evaluando de esta manera el efecto del agente sobre la población bacteriana. Según los resultados de los ensayos, la bacteria nativa compatible con Pseudomona sp. es resistente al insecticida con las concentraciones estudiadas y puede poseer la capacidad de degradar el insecticida.
PALABRAS CLAVE: Pseudomona sp.; Lorsban 4 EC; plaguicida; aislamiento bacteriano.
ABSTRACT
The resistance of an isolated bacterial culture compatible with Pseudomona sp. to the insecticide Lorsban 4 EC (active ingredient Chlorpyrifos) was evaluated at laboratory scale. The bacterial culture was isolated from a soil sample obtained in East Antioquia that was exposed to the application of the insecticide which is used in grass culture.
The principal factors that affect the mobility and adsorption of insecticides in soil were analyzed. The results showed a high percentage of organic matter, and macro and micronutrients as well as medium to high cationic capacity of exchange, which facilitates the adsorption of the pesticide in the colloidal fraction of organic and inorganic fraction. The sandy texture of the soil generates good aeration that favors the processes of volatilization and degradation of the pesticide.
Isolated bacterial culture was exposed to different concentrations of the insecticide (480, 4,800, 24,000 and 48,000 ppm), to evaluate the effect of the agent on the bacterial population. According to the results of the tests, the native isolated bacterium compatible with Pseudomona sp. is resistant to the insecticide concentrations studied and possibly has the capacity to degrade the Lorsban 4 EC.
KEY WORDS: Pseudomona sp.; Lorsban 4 EC; pesticides; bacterial culture.
INTRODUCCIÓN
La agricultura es una actividad productiva que el hombre ha venido desarrollando desde hace unos 12.000 años. Con el fin de evitar las incalculables pérdidas en las cosechas a causa de las plagas que atacan los cultivos, se han sintetizado plaguicidas, los cuales son productos químicos que permitan controlar, manejar o erradicar las plagas.
Los plaguicidas causan un impacto ambiental negativo en el ecosistema, ya que intervienen directamente en la reducción de la microfauna y presentan incidencia en la disminución de los procesos de nitrificación y descomposición de la celulosa, debido a que interrumpen la función de los hongos, bacterias y microartrópodos (Gallo, 2002). Otro impacto que generan es el cambio en la salinidad y alteración de la fertilidad del suelo y según el Instituto Tecnológico Geominero de España (1995), la persistencia de ellos en el medio puede generar asimilación y acumulación en partes aéreas, raíces y frutos de las plantas. En los ecosistemas acuáticos los plaguicidas desencadenan una serie de cambios en el componente biótico, sobre todo los relacionados con la bioacumulación y biomagnificación de las sustancias lipofílicas y con el potencial biótico de los organismos acuáticos como lo plantea Rhenals (2000).
El Oriente Antioqueño se caracteriza por ser una región de tradición agrícola en el departamento de Antioquia, en la cual se utiliza un gran número de plaguicidas en manejo de cultivos y control de plagas. Según el ICA (2000), en esta región, el insecticida Lorsban 4 EC es uno de los más utilizados, en cultivos de papa, maíz, pastos, tomate de árbol y fríjol principalmente.
El Lorsban 4 EC de ingrediente activo Chlorpyrifos es un insecticida organofosforado clasificado por el Institute for Environmental Toxicology (1997) como moderadamente tóxico, clase II y moderadamente persistente en suelos con una vida media entre los 60 y 120 días; sin embargo, según Márquez (2001), cuenta con un rango de actividad que puede comprender desde dos semanas hasta cerca de un año dependiendo del tipo de suelo, clima, método y dosis de aplicación.
La Agencia de Protección Ambiental de los Estados Unidos (EPA, 2000) registra el Chlorpyrifos como un compuesto de poca movilidad en el suelo y que, debido a su baja solubilidad en agua, presenta un alto potencial para ser adsorbido en el suelo y poca movilidad hacia las aguas subterráneas. El Chlorpyrifos puede ser degradado por hidrólisis, fotodegradación y por vía biológica. Gallo (2004) ha demostrado los efectos negativos del Chlorpyrifos sobre el crecimiento y el tiempo de la metamorfosis de la rana Smilisca phaeota; pese a esto no se conocen reportes del efecto del Lorsban 4 EC sobre poblaciones bacterianas; por tanto, este trabajo, que se basa en la evaluación de la resistencia de una cepa nativa compatible con Pseudomona sp. a la aplicación del insecticida, constituye un aporte significativo en esta línea de investigación.
METODOLOGÍA
Se utilizó una muestra de suelo del Oriente Antioqueño sometido a la aplicación del Lorsban 4 EC y se le analizaron los principales factores que afectan el movimiento y adsorción del plaguicida, como son textura, contenido de materia orgánica, intercambio iónico, pH, entre otros. Luego se identificó la microbiota dominante para aislar de allí las bacterias compatibles con Pseudomona sp., ya que son microorganismos abundantes en el suelo y que participan en los procesos de mineralización de la materia orgánica, caracterizándose según Madigan, (2000) por ser bacterias muy eficientes en la degradación de compuestos tóxicos.
Para realizar el aislamiento bacteriano compatible con Pseudomona sp. se hicieron diluciones seriadas hasta 10-10 a las que se les adicionó dispersante. A partir de la dilución 10-6 se hizo vertido en medio D1M para diferenciar las colonias de Pseudomona sp., las cuales se sembraron en agar cetrimide y selectivo para Pseudomona, posteriormente se realizaron pruebas bioquímicas para su determinación. Con el fin de conocer la capacidad de resistencia o tolerancia del nativo microbiano aislado, se hicieron bioensayos que consistieron en exponer el microorganismo aislado a diferentes concentraciones del insecticida Lorsban 4 EC: 480, 4.800, 24.000 y 48.000 ppm, seleccionadas según la ficha técnica del compuesto y las dosis realmente utilizadas en campo. El conteo de microorganismos para evaluar su resistencia a las diferentes concentraciones se hizo a diferentes tiempos de exposición: 0, 0,25, 24, 48, 72, 96 y 120 horas. El crecimiento bacteriano se evaluó por recuentos utilizando el método de recuento por vertido en placa.
Se establecieron dos controles. El primero, un aislado bacteriano sin plaguicida con el fin de monitorizar el crecimiento del microorganismo durante el tiempo del ensayo. El segundo control se realizó con el insecticida sin inóculo para asegurar que el compuesto no estuviese previamente contaminado por microorganismos.
Análisis estadístico: Para evaluar el efecto de las diferentes soluciones del insecticida sobre la población bacteriana, se hizo un análisis de varianza (ANOVA) de dos factores: concentración y tiempo con un porcentaje de confianza del 95% para evaluar diferencias estadísticamente significativas entre los tratamientos.
RESULTADOS Y DISCUSIÓN
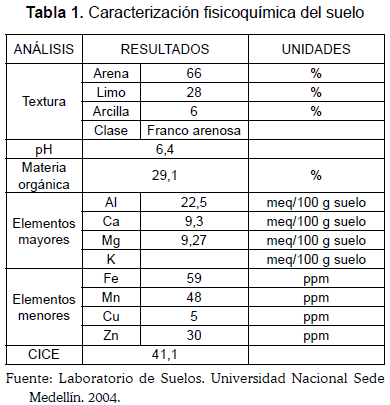
Caracterización de la muestra de suelo: Las características del suelo analizado se muestran en la Tabla 1.
La evaluación de elementos mayores y menores indica que el suelo es fértil debido a la aplicación de fertilizantes, condición que favorece la retención del plaguicida por altos períodos de tiempo, que pueden comprender desde 11 hasta 141 días según la EPA (2004); la capacidad de intercambio catiónico y el pH del suelo indican que el plaguicida puede ser adsorbido en la micela orgánica e inorgánica del suelo y la textura franco arenosa favorece la aireación, pero según la EPA (2004) las características del Chlorpyrifos reportan como máximo un 10% de volatilización y baja solubilidad en agua, lo que permite presumir un bajo potencial de lixiviación.
La Agencia de Protección Ambiental de los Estados Unidos cataloga el Chlorpyrifos como un compuesto de poca movilidad en el suelo, a causa de su baja solubilidad en agua, por lo que presenta un alto potencial para ser adsorbido en la fracción sólida del suelo y su llegada a las aguas superficiales ocurre más por erosión que por lixiviación (EPA, 2000).
Aislamiento e identificación del microorganismo con capacidad de resistencia al insecticida
En la tabla 2 se relacionan las pruebas bioquímicas realizadas para la identificación de los microorganismos con capacidad de resistencia al insecticida Lorsban 4 EC y los resultados relativos a cada prueba.
El aislado bacteriano correspondió a bacilos Gram negativos móviles, no formadores de espora, compatible con Pseudomona sp. Este resultado es muy relevante, ya que las bacterias relacionadas con el género Pseudomona están reportadas con procesos de biodegradación de compuestos tóxicos. La capacidad de estas para degradar compuestos tóxicos, según Rodriguez (2003), depende del tiempo de contacto con el compuesto, las condiciones ambientales en las que se desarrollen y su versatilidad fisiológica.
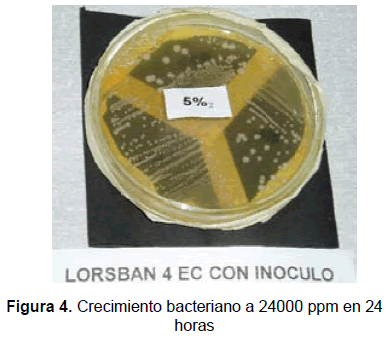
El microorganismo muestra tolerancia al insecticida bajo 480, 4800 y 24000 ppm, y, aunque no se observó crecimiento a 48000 ppm, sí se observó movilidad de éste al microscopio durante el tiempo de evaluación, lo que indica que el microorganismo puede tolerar esta concentración del plaguicida.
Bioensayos
El crecimiento bacteriano a las diferentes concentraciones del insecticida con respecto al tiempo se muestra en la tabla 3.
La mayor población bacteriana al final del ensayo se da a una concentración de 4.800 ppm y el menor crecimiento, a 480 ppm y 48.000 ppm, que son la concentración más baja y más alta respectivamente. Esto se debe quizás a un efecto limitante por baja disponibilidad de nutrientes a una concentración de 480 ppm, contrastado con un efecto inhibidor en la concentración más alta.
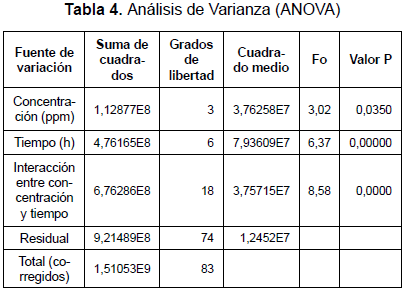
Para evaluar el efecto de las diferentes soluciones del insecticida sobre la población bacteriana, se hizo un análisis de varianza (ANOVA) de dos factores: concentración y tiempo (tabla 4).
Como P < 0,05, se concluye que existen diferencias estadísticamente significativas entre las concentraciones del insecticida, indicando que cada concentración tiene un efecto diferente sobre el número de bacterias inhibidas, manteniendo constantes el efecto supresor a las diferentes concentraciones.
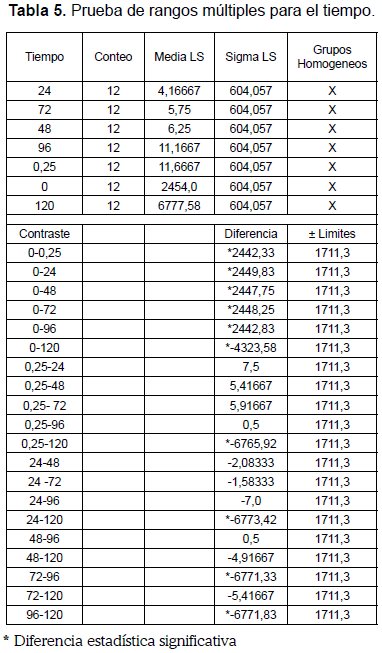
La prueba de rangos múltiples para el tiempo se muestra en la tabla 5. Los resultados exhiben diferencias estadísticamente significativas con un nivel de confianza del 95,0% entre las medias de los siguientes pares de tiempos: 0-0,25, 0-24, 0-48, 0-72, 0-96, 0-120, 0,25-120, 24-120, 72-96 y 96-120. Entre las 0,25 y 96 horas las medias forman un grupo homogéneo, lo cual indica que estadísticamente en este intervalo de tiempo el crecimiento del microorganismo sigue el mismo patrón de comportamiento. Mientras que a 0 y 120 horas el crecimiento promedio del microorganismo tiene un comportamiento diferente al intervalo de tiempo mencionado y son diferentes entre sí. De las 96 hasta las 120 horas existe otro intervalo homogéneo para todos los tiempos.
Se concluye que el insecticida tiene un efecto supresor, en todas las concentraciones a un intervalo tiempo comprendido entre 0-0,25 horas, pero sin eliminar toda la población bacteriana, indicado en el intervalo 0,25 a 96 horas y, finalmente, los microorganismos resistentes recuperan su viabilidad (intervalo 96-120 horas).
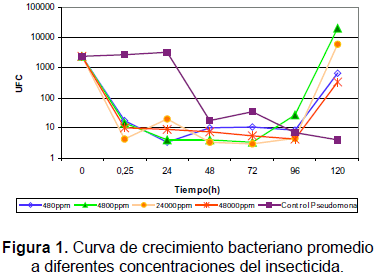
En la figura 1 se observa la respuesta del crecimiento bacteriano frente a las diferentes concentraciones del insecticida en un período de tiempo de 120 horas de exposición. En ésta se puede apreciar que durante los primeros 15 minutos de exposición al insecticida, la población bacteriana se reduce de modo considerable en todas las concentraciones. Esta muerte por contacto se debe al efecto inhibitorio del plaguicida sobre el microorganismo y a una supervivencia de las bacterias resistentes.
Aunque la disminución de la población es considerable en cada una de las concentraciones, no hubo extinción, lo cual indica que la población remanente es la resistente. Esta resistencia se debe a varios factores. De un lado el microorganismo fue aislado de una muestra de suelo sometida a la aplicación del insecticida, lo que permite suponer su adaptación al compuesto; y de otro, los microorganismos desarrollan mecanismos de resistencia a xenobióticos, lo cual se puede dar por evolución del sistema de transporte a través de la pared celular de enzimas más eficientes o de enzimas con nuevas actividades, o por factores que intervienen en la adaptación metabólica de los microorganismos. Lo anterior se relaciona con la utilización de plásmidos, que son elementos genéticos autónomos que se replican independientemente del cromosoma y codifican para enzimas que poseen un amplio rango de funciones, tal como lo referencia Ortiz (1997).
Entre las 96 y 120 horas, el crecimiento muestra un marcado ascenso en cada una de las concentraciones, indicando que los microorganismos pueden estar utilizando el insecticida como fuente de carbono o nitrógeno. La capacidad de degradación del microorganismo también se puede inferir según lo reportado por Mandelbaum, Allan y Wackett (1995), pues alrededor de las colonias se observaron zonas claras. Esta situación se presenta cuando existe degradación de un plaguicida.
A las 24 horas para el tratamiento a 24.000 ppm, se detectó un pequeño ascenso en la población bacteriana, lo que es atribuible a la población remanente, es decir, que no es totalmente inhibida; luego, en el periodo entre las 24 a 48 horas el conteo de bacterias viables desciende, siguiendo la tendencia general, por exposición prolongada al pesticida.
Las figuras 2 a 5 ilustran la evolución de la población bacteriana ante concentraciones crecientes del insecticida Lorsban 4 EC.
CONCLUSIONES
Las condiciones fisicoquímicas del suelo permiten la adsorción del plaguicida en la fracción coloidal. La bacteria nativa compatible con Pseudomona sp. es resistente al insecticida Lorsban 4 EC a las diferentes concentraciones evaluadas.
La bacteria nativa compatible con Pseudomona sp. utiliza como fuente energía el insecticida Lorsban 4 EC, lo que permite presumir su posible degradación. El insecticida Lorsban 4 EC provoca una disminución en la población de la bacteria estudiada, pero una exposición prolongada a aquel ejerce un efecto seleccionador de las bacterias resistentes.
BIBLIOGRAFÍA
ENVIRONMENTAL PROTECTION AGENCY (EPA). Registration eligibility science chapter for Chlorpyrifos fate and environmental risk assessment chapter. En: www.epa.gov. agosto. 2004. [ Links ]
GALLO, Sandra Milena. Efectos del insecticida Chlorpyrifos sobre el crecimiento y la metamorfosis de Smilisca phaeota (Anura: Hylidae). Medellín, 2004, 32 p. Trabajo de grado (Bióloga). Universidad de Antioquia. Facultad de Ciencias Exactas y Naturales. Área de Biología. [ Links ]
GOLOVLEVA, L. A.; AHARONSON, N.; GREENHALGH, R.; SETHUNATHAN, N. and VONK, J. W. The role and limitation of microorganisms in the conversion of xenobiotics. En: Pure and Applied Chemistry. Vol 62 No 2. (1990) p. 351-364. [ Links ]
INSTITUTE FOR ENVIRONMENTAL TOXICOLOGY. Michigan State University. Pesticide profiles: toxicity, environmental impact, and fate. Lewis Publishers, 1997. [ Links ]
INSTITUTO TECNOLÓGICO GEOMINERO DE ESPAÑA. Contaminación y depuración de suelos. Madrid: 1995, p. 69. [ Links ]
MADIGAN, Michael; MARTINKO, John M. y PARKER, Jack. Brock Biología de los microorganismos. Prentice Hall, 2000. p. 698-699. [ Links ]
MANDELBAUM, Raphi; ALLAN, Deborah and WACKETT, Lawrence. Isolation and characterization of a Pseudomona sp. that mineralizes the s-triazine herbicide atrazine. En: Applied and Environmental Microbiology. Vol. 61. No. 4. (Abril 1995). p. 1451-1457. [ Links ]
MÁRQUEZ, Sara. Identificación de algunos productos de degradación del Chlorpyrifos. Medellín: Universidad de Antioquia, 2001. [ Links ]
MUNNECKE, Douglas. Enzymatic detoxification of waste organophosphate pesticides. En: Journal of Agricultural and Food Chemistry. Vol 28. (1980) p. 105-111. [ Links ]
ORTIZ, M. L.; SÁNCHEZ, E.; VAZQUEZ, R. D. y QUINTERO, R. Plaguicidas organofosforados y ambiente. Revista Biotecnología. Vol 2 No. 3. 1997. p. 129-142. [ Links ]
RHENALS, Nimia C. Efecto inhibitorio del Chlorothalonil sobre poblaciones de bacterias nitrogenadas en un ecosistema acuático. Medellín, 2000, 33 p. Trabajo de grado (Bióloga). Universidad de Antioquia. Facultad de Ciencias Exactas y Naturales. Área de Biología. [ Links ]