Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista EIA
Print version ISSN 1794-1237
Rev.EIA.Esc.Ing.Antioq no.5 Envigado Jan./June 2006
CARACTERÍSTICAS CRISTALOQUÍMICAS DE LA HIDROXIAPATITA SINTÉTICA TRATADA A DIFERENTES TEMPERATURAS
Marta Elena Londoño1; Alejandro Echavarría2; Francenith De La Calle3
1 Física y Magíster en Ingeniería, Universidad de Antioquia. Profesora, Programa de Ingeniería Biomédica, Escuela de Ingeniería de Antioquia e Instituto de Ciencias de la Salud CES. Grupo de Investigación en Ingeniería Biomédica EIA-CES (Gibec). pfmalon@eia.edu.co.
2 Ingeniero Metalúrgico y Doctor en Ciencias Químicas, Universidad de Antioquia. aechave@udea.edu.co.
3 Ingeniera Metalúrgica, Universidad de Antioquia. france133@hotmail.com.
Artículo recibido 15-III-2006. Aprobado 13-VI-2006
Discusión abierta hasta noviembre 2006
RESUMEN
La hidroxiapatita sintética (HA) es un fosfato de calcio con una composición química muy similar a la del hueso humano, lo cual la hace biocompatible con los tejidos vivos. La biocompatibilidad posibilita su uso en variadas aplicaciones médicas. En esta investigación se realizó un seguimiento a las propiedades cristaloquímicas de muestras de HA sintética tratadas a diferentes temperaturas, las que se sometieron a solución fisiológica de Ringer durante periodos de 5 y de 30 días. La medición de la conductividad y el análisis de las muestras, por medio de espectrofotometría UV-VIS, análisis por ion selectivo, DRX, FTIR y SEM, permitieron mostrar la gran dependencia de la cristalinidad con el tratamiento térmico. La muestra más cristalina se obtuvo a una temperatura de 1050 °C. La mayor solubilidad se presentó en las muestras más cristalinas; además, se evidenció la presencia de dos mecanismos que compiten cuando las muestras se someten a solución Ringer: la disolución y la precipitación.
PALABRAS CLAVE: Biomateriales; fosfatos de calcio; hidroxiapatita; solubilidad.
ABSTRACT
Synthetic Hydroxyapatite (HA) is a calcium phosphate whose chemical composition is very similar to that present in human bones. This characteristic makes it biocompatible with live tissue. Due to this biocompatibility, it is possible to use HA in many medical applications. In this research, crystalochemical properties of HA obtained by different thermal treatments and put later in physiological Ringer solution, during 5 and 30 days, were followed. Conductivity measurement and analysis by spectrophotometric UV-VIS, selective ion, DRX, FTIR, and SEM showed the high dependence of crystalinity of both thermal treatment and higher solubility of the more crystalline samples. Besides, when the samples were immersed in Ringer solution, the competition between two mechanisms, dissolution and precipitation, was reveled.
KEY WORDS: Biomaterials; calcium phosphate; hydroxyapatite; solubility.
INTRODUCCIÓN
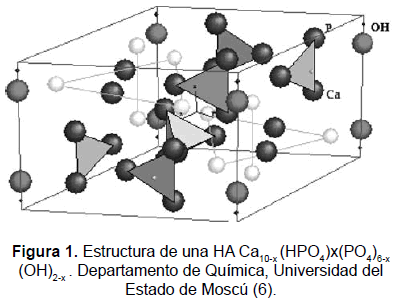
La hidroxiapatita Ca10-x(PO4)x(HPO4)6-x(OH)2-x con 0 < x < 1 es el principal componente inorgánico del hueso de los vertebrados; también la encontramos en la dentina y el esmalte dental [1]. Este fosfato de calcio, que se puede obtener de forma sintética, presenta características de biocompatibilidad, no toxicidad, estabilidad química, osteoconducción y bioactividad; tales propiedades hacen al material muy práctico para usos médicos. La HA se puede usar como reemplazo de partes pequeñas de hueso, relleno de cavidades en odontología, recubrimiento de superficies de metales para implantes, refuerzo en materiales compuestos y como liberador de medicamentos, entre otros. Para una aplicación determinada se requieren diferentes características de la HA, como pueden ser su capacidad de reabsorción o bioactividad [2].
El estudio de la HA se ha realizado desde hace varias décadas; Aaron y Posner (1958) propusieron su estructura cristalina a partir del análisis de un monocristal [3]. Este fosfato cristaliza en el sistema hexagonal, grupo de simetría P63/m, con valores de red a = b = 9,432 Å y c = 6,88 Å (figura 1). El carácter iónico de la HA la hace una cerámica dura, refractaria, con punto de fusión mayor que 1500 °C. Además, este carácter iónico le proporciona la capacidad de la sustitución parcial o completa de iones de la red por otros de tamaño similar (PO43- por HPO42-, Ca2+ por K+ o Mg2+, OH- por F-, Cl-, Br-) [4] y le proporciona su propiedad de insolubilidad. La relación ideal Ca/P es 10:6 (1,6667), su densidad calculada es de 3,219 g/cm3 y sus propiedades mecánicas varían de acuerdo con el proceso de manufactura; la HA policristalina tiene un módulo elástico alto, 40-117 Gpa [5].
El método más común para la obtención de HA es el de precipitación [7], con el que se obtienen cantidades apreciables del material de forma económica y fácilmente reproducible. En este método, sin embargo, se deben controlar el pH, la temperatura de reacción, el tiempo de la reacción, la atmósfera de tratamiento y la relación Ca/P de los reactivos, para impedir la aparición de otras fases como los ortofosfatos [8-10]. Una HA apropiada para cualquier aplicación específica debe controlar su composición, las impurezas, morfología, cristalinidad, tamaño del cristal y de las partículas [5, 8, 11]. Las variaciones pequeñas en las anteriores características ocasionan diferentes comportamientos del material implantado [2], tanto en su bioactividad y rango de disolución como en su reabsorción [13].
Varios grupos de investigadores han realizado estudios para determinar el comportamiento de diversos fosfatos de calcio en solución fisiológica, sin llegar a ninguna conclusión definitiva [14-18]; sin embargo, pocos estudios se han realizado para determinar la respuesta en disolución de la HA sintética obtenida mediante diferentes tratamientos térmicos. En este trabajo se determinó la influencia del tratamiento térmico en las propiedades cristaloquímicas de la HA sintética y su comportamiento en solución fisiológica de Ringer.
MATERIALES Y MÉTODOS
Síntesis y tratamiento térmico
Para la síntesis de la HA se adoptó la ruta seguida por Echavarría et al. [19], que consiste en su obtención por la vía del nitrato de calcio / fosfato de amonio así:
10Ca(NO3)2.4H2O + 6NH4H2PO4 +14NH4OH → Ca10(PO4)6(OH)2 + 20NH4NO3 + 52H2O
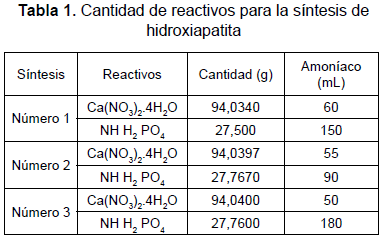
La reacción se realiza en condiciones de alta basicidad y evitando la presencia de contaminantes metálicos como Mg++ y Cl-. La pulpa se obtiene a partir de sucesivos procesos de agitación, reposo, decantación y lavado, para finalmente centrifugar. En el proceso se llevaron a cabo tres síntesis relacionadas en la tabla 1.
Luego de obtener la pulpa, se elaboraron manualmente los bloques de HA húmeda, de unos 15 g cada bloque, para proceder a su secado a 80 °C durante 12 horas. Un bloque de cada síntesis fue llevado a tratamiento térmico a las temperaturas de (550, 650, 750, 850, 950, 1050) °C. Luego de este tratamiento, los bloques fueron triturados a mano con mortero cerámico y tamizados para obtener una granulometría de (-14, +30). Todos los gránulos se caracterizaron por difracción de rayos X (DRX), espectroscopia de infrarrojos por transformada de Fourier (FTIR) y microscopía electrónica de barrido (SEM).
Disolución
Para los ensayos de disolución, las muestras en forma de gránulos se sumergieron en 100 mL de solución de Ringer a 37 °C, con agitación constante a 30 r. p. m. Se realizaron dos ensayos de disolución. En el primero, las muestras correspondientes a cada tratamiento térmico, por triplicado, se mantuvieron en disolución por un lapso de 30 días, al cabo de los cuales se filtraron los gránulos y se midió la cantidad de fosfatos presentes en la solución por medio de espectrofotometría ultravioleta visible, UV-VIS. Para la segunda disolución, las muestras tratadas a 650 °C y 1050 °C, por triplicado, se sometieron a disolución en solución Ringer a 37 °C, con agitación constante a 30 r. p. m., por 5 días, durante los cuales se midió directamente la conductividad de la solución. Los gránulos se filtraron y a la solución se le midió el calcio presente por la técnica de ion selectivo. Después de la disolución los gránulos se caracterizaron por FTIR y SEM.
RESULTADOS Y ANÁLISIS DE RESULTADOS
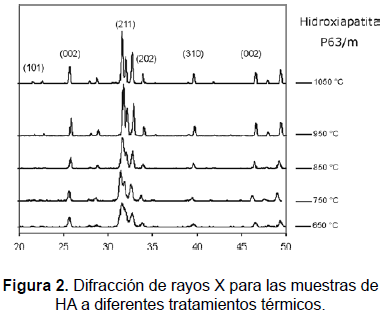
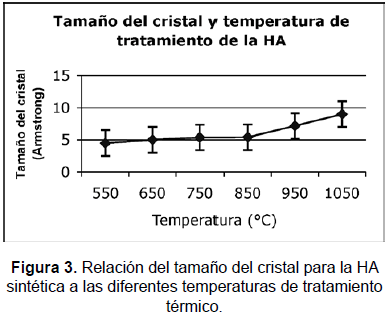
Los resultados de la difracción de rayos X, realizados en difractómetro Rikagu Miniflex (lámpara de cobre 100 a 8.000 cps), se muestran en la figura 2. Todos los picos son representativos de HA, los difractogramas muestran la evolución de la cristalinidad de la HA con el tratamiento térmico. Se obtuvo una estructura poco cristalina a una temperatura de 550 °C, 650 °C y 750 °C, y una evolución hacia una estructura más cristalina, avanzando desde una temperatura de 850 °C, donde se presentan picos más agudos y menos amplios (relación h/w, o tamaño del cristal) (figura 3), hasta llegar a 1.050 °C, donde se obtuvo una estructura completamente cristalina, con una relación Ca/P de 1,62 (tabla 4). No se registra en ninguna de las muestras presencia de fases amorfas.
De los espectros DRX obtenidos para las diferentes muestras, puede verse que el ancho del pico (002) decrece con la temperatura de sinterización de 550 °C a 1050 °C.
El tamaño del cristal D, calculado con la ecuación de Scherer, se incrementa con la temperatura de tratamiento térmico, como se muestra en la figura 3.
Ecuación de Scherer: 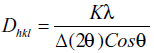
Donde Dhkl es la dimensión cristalina; K es la constante de Scherer (K=0,9); λ es la longitud de onda, λ = 1405 Å y θ es el ángulo de difracción.
ESPECTROSCOPIA INFRARROJA -FTIR-
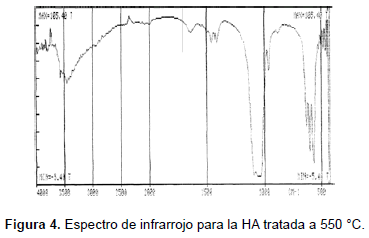
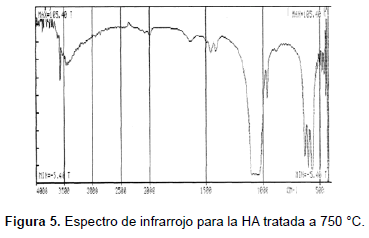
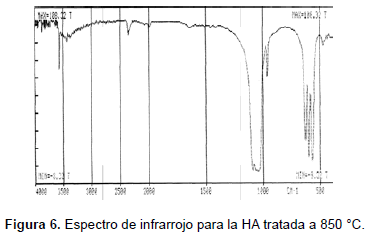
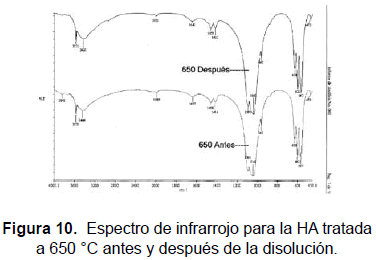
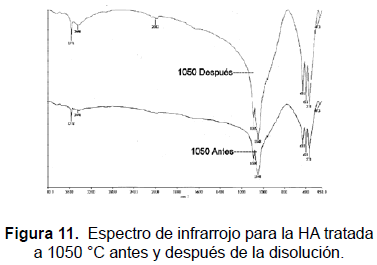
El análisis de espectroscopia infrarroja se realizó en un espectrómetro Perkin Elmer FTIR 1760X (KBr, 450-4.000 cm-1). Las bandas obtenidas para las muestras sinterizadas a (1050, 950, 850, 750, 650 y 550) °C se muestran en la tabla 2 y en las figuras 4, 5, 6, 7, 10 y 11. Una HA típica muestra bandas para un espectro FTIR en (3600, 3569, 3578, 3448 y 633) cm-1 correspondientes a grupos OH-; bandas en (474, 571, 601, 692, 1032 ≈ 1087, 1092, 1040) cm-1 correspondientes a grupos PO43- y bandas entre (870, 1420 y 1480) cm-1 si la muestra contiene grupos CO3 [20].
Las muestras tratadas a 550 °C presentan bandas en (482, 571, 604, 633, 963, 1.051, 1.095 y 3.573) cm-1; las muestras tratadas a 650 °C presentan bandas en (472, 567, 602, 632, 962, 1.042, 1.091, 3.570) cm-1, las tratadas a 750 °C, presentan picos en (482, 570, 603, 633, 963, 1063, 3572) cm-1; las muestras tratadas a 850 °C presentan picos en (475, 572, 603, 633, 963, 1.053, 1.093, 3.572) cm-1; las muestras tratadas a 950 °C exhiben picos en (482, 572, 603, 633, 963, 1.047, 1.094, 3.572) cm-1; las muestras tratadas a 1050 °C presentan bandas en (473, 571. 601, 631, 962, 1.048, 1.089, 3.572) cm-1. Ello significa que se han obtenido los picos representativos de la HA en las muestras tratadas a las diferentes temperaturas. Así mismo, la evolución de los picos desde la temperatura más baja, 550 °C, hasta la más alta, 1.050 °C, indica que se obtuvo HA muy cercana a la estequiométrica.
Las bandas en la región de 474, 572, 601, 1032 a 1090 cm-1 se pueden asignar a los cambios en las distancias de enlace (stretching) y al cambio en el ángulo de enlace (bending) de los grupos PO43-. Se observa cómo las bandas más fuertes están en las regiones de 1100 a 1000 cm-1. Las bandas alrededor de 630 cm-1 y 3570 cm-1 corresponden a stretching de los grupos hidroxil, OH-, de la HA. Las muestras tratadas a (550, 650, 750 y 850) °C también presentan bandas alrededor de los 1458 cm-1 y 1412 cm-1 correspondientes al ácido fosfórico HPO42- y no a NH4+, ya que la muestra está calcinada y a temperaturas mayores de 700 °C éste no debe aparecer en la estructura. Las bandas alrededor de los 1630 cm-1 pueden ser atribuidas a los cambios en el ángulo de enlace del hidrógeno en aguas cristalizadas; esta banda también aparece en las muestras tratadas a (550, 650 750 y 850 y 950) °C.
El FTIR tampoco reveló la presencia de fases secundarias en las muestras sinterizadas a las diferentes temperaturas, lo que concuerda con lo mostrado con los análisis de DRX. También se observan pequeños desplazamientos en las bandas correspondientes a los OH-. Es de anotar la diferencia que ocurre entre las muestra tratadas a temperaturas menores que 900 °C y las tratadas a temperaturas mayores que esa, presente sólo en las muestras tratadas por debajo de 900 °C (bandas en 1458 cm-1 y 1413 cm-1) que resultan ser la menos cristalinas. La presencia de este ion, ocluido dentro de la estructura y no como fase, muestra cómo compite con los OH- y los fosfatos. Además, a temperaturas de calcinación bajas su presencia puede deberse a una reacción inconclusa, dado el poco tiempo que tiene el sistema para lograr su estabilidad.
DISOLUCIÓN
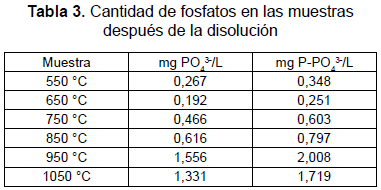
Las muestras de HA, por triplicado, se sometieron a disolución con agitación en una solución fisiológica Ringer. Después de 30 días, a dicha solución se le determinó la cantidad de fósforo por medio de espectrofotometría UV visible. Los resultados se muestran en la tabla 3. Se evidencia una mayor cantidad de fósforo en la solución a medida que aumenta la temperatura del tratamiento térmico de la muestra; esto indica que el ion PO43- se disuelve con mayor facilidad al aumentar la temperatura de sinterización, lo cual puede atribuirse tal vez al tamaño del cristal y la agitación del sistema. La agitación continua permite que ocurran más colisiones de los protones que aún no han reaccionado con la superficie del mineral; las partículas más grandes están divididas en pequeñas fracciones, lo que les permite disolverse en mayor proporción [21].
La mayor concentración de fosfatos se presentó a la temperatura de 950 °C. La disminución del ion fosfato en la muestra de 1050 °C es atribuible a que parte de los fosfatos disueltos pudieran haberse precipitado, esto sugiere que los mecanismos de disolución y precipitación compiten en el proceso.
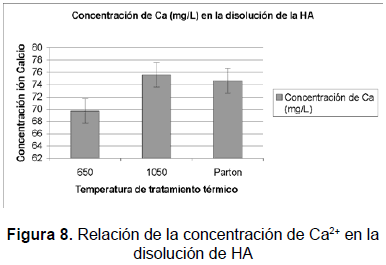
Una segunda disolución consistió en someter las muestras de HA tratadas a 650 °C y 1050 °C a disolución durante cinco días, en solución de Ringer con agitación. Durante la prueba se midió la conductividad y al cabo de los cinco días se determinó el calcio presente en la solución por la técnica ion selectivo, figura 8. Los resultados muestran una menor cantidad de Ca en la muestra de 650 °C al ser sometida a agitación, lo cual podría deberse a que parte del calcio disuelto inicialmente se precipita, esto se comprueba con los resultados arrojados por el SEM. Aquí se revela cómo los mecanismos de disolución y precipitación están presentes en el proceso de disolución de la HA. La muestra tratada a 1050 °C presentó mayor cantidad de calcio disuelto, comparada con la de 650 °C, lo cual indica la facilidad con que la HA tratada a alta temperatura libera Ca de su superficie, el cual precipita poco. Al parecer los iones HPO intervienen en la precipitación del calcio. Si se libera más calcio, de alguna manera estos iones quedan con más liberad en la red para evitar la nueva precipitación del ion.
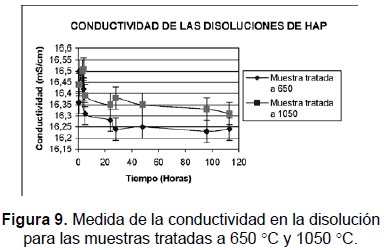
CONDUCTIVIDAD
A las muestras sometidas a una segunda disolución se les midió la conductividad durante cinco días. Los resultados se muestran en la figura 9. Los gráficos muestran la conductividad causada por la presencia de iones en la solución; se incrementa más rápidamente en la muestra tratada a 650 °C respecto a la de 1050 °C. La muestra de menor temperatura alcanza su máxima conductividad a los 45 minutos, mientras que la de mayor temperatura solo llega a su máximo luego de 4 horas, indicando cómo el paso de iones al medio en la muestra tratada a 1050 °C es más lenta. Luego de alcanzado el máximo de conductividad, en la disolución de mayor temperatura se mantienen mayores valores durante el tiempo de la prueba respecto a los presentados por la muestra de menor temperatura de tratamiento. Esto concuerda con las medidas de la concentración de iones Ca2+ y PO43- mostrados en las gráficas anteriores para las respectivas muestras.
A partir de las primeras 4 horas la conductividad de la muestra de 1050 °C empieza a descender, lo que puede deberse a fenómenos de precipitación de iones; después de las 5 horas se alcanza un estado casi estacionario. La muestra de 650 °C empieza su disminución de la conductividad después de los 45 minutos; a partir de este momento la cantidad de iones disueltos desciende con mayor regularidad que la de 1050 °C, aunque le toma más tiempo alcanzar una conductividad más estable. Los iones provenientes del sólido que se disuelve (PO43- u OH-) pueden reaccionar con iones H+ presentes en la solución y formar HPO42- o HOH.
FTIR DESPUÉS DE LA DISOLUCIÓN
Las muestras después de la disolución fueron analizadas mediante FTIR. A 650 °C se manifiesta un incremento en la intensidad de la banda OH- y ligeros desplazamientos de las bandas entre los 3600 cm-1 a 1200 cm-1. La HA a 650 °C obtiene Ca2+ de la solución Ringer y con él asegura el fosfato para formar fases menores como productos de la precipitación. Las bandas de absorción se muestran en las figuras 10 y 11.
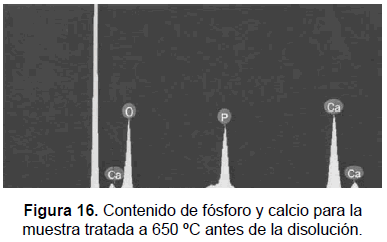
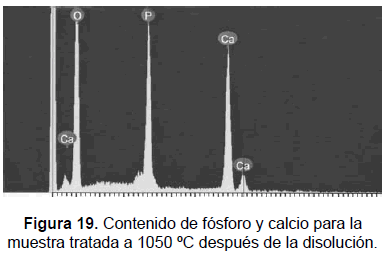
Microscopía electrónica de barrido -SEM-
Las muestras se analizaron en un microscopio JEOL JSM 5910 LV (30 kV). La HA tratada a 1050°C y 650 °C fue sometida a SEM tanto antes como después de la disolución, figuras 12, 13, 14 y 15. Mediante el EDS, figuras 16, 17, 18 y 19, se determinó la composición química de las muestras, la que aparece registrada en la tabla 4. La microscopía electrónica de barrido muestra una HA con cristales de una morfología subangulada, uniforme, con una relación Ca/P de 1,55 y 1,52 para las muestras tratadas a 650 °C antes y después de la disolución; 1,62 y 1,65 respectivamente para las muestras obtenidas a 1050 °C antes y después de la disolución. Los anteriores resultados confirman la mayor cristalinidad de la muestra obtenida a la mayor temperatura. El análisis registra una disminución en el calcio presente en el espécimen tratado a 650 °C y sometido a disolución. En los SEM de las muestras de 650 °C, después de la disolución, se registran unos puntos más claros donde se concentra mayor cantidad de calcio, esto probablemente es indicio de la precipitación del calcio.
Esta disminución de calcio puede estar representada en pequeñas fases formadas durante la precipitación, imposibles de detectar con los análisis realizados.
CONCLUSIONES
De los procesos experimentales y de los análisis realizados a la HA tratada a diferentes temperaturas se puede observar que a mayor temperatura de tratamiento térmico se presenta mayor cristalinidad de la HA, mayor tamaño de partícula, mayor contenido de Ca2+, mayor presencia de grupos PO43-, menor presencia de grupos HPO42-, menor presencia de grupos OH-, mayores distancias y ángulos de enlace de los grupos PO43-.
Los ensayos de disolución con agitación vibratoria evidencian la presencia de dos mecanismos que compiten: la disolución y la precipitación. La HA de 650 °C inicialmente se disuelve muy rápidamente, pero el Ca de la solución se reprecipita como una fase insoluble por su alto contenido de HPO42- y un menor contenido de Ca2+ y OH-. La HA de 1050 °C inicialmente se disuelve de manera más lenta, pero el Ca de la solución se reprecipita como una fase con mayor solubilidad por el mayor contenido de fosfato y mayor contenido de Ca.
RECOMENDACIONES
Se necesita una modelación de la estructura cristalina en función de la temperatura de tratamiento térmico y dilucidar la influencia del ion HPO42- en la cristalinidad de la HA.
Las medidas de concentración de Ca2+ y fosfatos en las pruebas de disolución deben realizarse continuamente para observar sus cambios en el tiempo.
A las muestras en disolución se les debe realizar SEM, FTIR y la DRX en tiempos menos espaciados.
AGRADECIMIENTOS
Los autores expresan los agradecimientos a la Escuela de Ingeniería de Antioquia, a la Universidad de Antioquia y a la Universidad Pontificia Bolivariana por el apoyo brindado a este trabajo.
REFERENCIAS
[1] BOSKEY Adele L. Amorphous calcium phosphate: the contention of bone. Journal of Dental Research; Houston; Aug 1997. Vol. 76 No 8 p. 1433-1439. [ Links ]
[2] RATNER, B. and HOFFMAN, A. Biomaterials science: an introduction to materials in medicine. Academic Press. 1996. 473 p. [ Links ]
[3] IVANOVA T. I.; FRANK-KAMENETSKAYA, O. V.; KOL'TSOV, A. B. and UGOLKOV, V. L. Crystal structure of calcium-deficient carbonated hydroxyapatite. Thermal decomposition. Journal of Solid State Chemistry 160, (2001) 340-349. [ Links ]
[4] WILLIAMS, R. A. D. y ELLIOT J. C. Bioquímica dental básica y aplicada. El Manual Moderno. México. ISBN 0-443-03144-4. p. 316. [ Links ]
[5] PARKS, J. and LAKES, R. Biomaterials: an introduction. New York, Plenum PRESS. 1992. 2a ed. [ Links ]
[6] PUTLAYEV, Valery. Calcium phosphates. Departamento de Química de la Universidad de Moscú. www.hsms.msu.ru/pdf/bio-dresden.ppt. Página consultada en marzo de 2005. [ Links ]
[7] RODRÍGUEZ-LORENZO, L. M. and VALLET-REGÍ, M. Controlled crystallization of calcium phosphate apatites. Chem. Mater. 2000, 12, 2460-2465. [ Links ]
[8] LIU, J.; YE X.; WANG H.; ZHU M.; WANG B. and YAN H. The influence of pH and temperature on the morphology of hydroxyapatite synthesized by hydrothermal method. Ceramics International. 29, 2003: 629-633. [ Links ]
[9] VALLET-REGÍ, María. Biocerámicas: inertes y bioactivas. Rev. R. Acad. Cienc. Exact. Fís. Nat. V. 90, No. 4, 269-279. España. 1996. [ Links ]
[10] BERNACHE-ASSOLLANT D.; ABABOU, A.; CHAMPION, E. and HEUGHEBAERT, M. Sintering of calcium phosphate hydroxyapatite Ca10(PO4)6(OH)2 I. Calcination and particle growth. Journal of the European Ceramic Society 23 (2003) 229-241. [ Links ]
[11] KHOR K. A.; CHEANG, P. and WANG, B. The thermal spray processing of HA powders and coatings. New York, Feb. 1997. Journal of Minerals, Metals & Materials Society 49 (1997), 51-57. ISSN 10474838. [ Links ]
[12] LIU, Changsheng; SHEN, Wei and CHEN, Jianguo. Solution property of calcium phosphate cement hardening body. Materials Chemistry and Physics. Vol. 58 number 1. (Feb. 1999) 78-82. [ Links ]
[13] FULMER Mark T.; ISON, Ira C.; HANKERMAYER, Christine R.; CONSTANTZ, Brent R. and ROSS, John. Measurements of the solubilities and dissolution rates of several hydroxyapatites. Biomaterials. Elsevier. 23 (2002) 751-755. [ Links ]
[14] OVERGAARD S.; BROMOSE, U.; LIND, M.; BUNGER, C. and SOBALLE, K. The influence of the hydroxyapatite coating on the fixation of implants: mechanical and histomorphometric results. Journal of Bone and Joint Surgery; Vol. 81 No 4 pág. 725-731 London; Jul 1999. [ Links ]
[15] MONTEIRO, Magna María; DA ROCHA, Nilce Carbonel Campos; ROSSI, Alexandre Malta and SOARES, Gloria de Almeida. Dissolution properties of calcium phosphate granules with different compositions in simulated body fluid. Journal of Biomedical Materials Research. Vol 65A (July 2002). 299-305. [ Links ]
[16] QUEIROZ, A.C., SANTOS, J. D., MONTEIRO, F. J. and PRADO DA SILVA, M. H. Dissolution studies of hydroxyapatite and glass-reinforced hydroxyapatite ceramics. Materials Characterization. Vol. 50. 2003 197-202. [ Links ]
[17] MATHEW, Mathai and TAKAGI, Shozo. Crystal structures of calcium orthophosphates. Monographsin Oral Science 2001. Vol. 18. Basel, Switzerland. 1-16. [ Links ]
[18] MATTHEW, Mathai and TAKAGI, Shozo. Structures of biological minerals in dental research. Journal of Research of National Institute of Standards and Technology. Gathersburg. Vol. 106 No 6, pp. 1035-1044. Nov/Dec 2001. [ Links ]
[19] ECHAVARRÍA, V. Alejandro; RIAFLO, B. Carlos y NOREÑA, G. Antonio. Hidroxiapatita sintética de porosidad inducida: comparación con el hueso calcinado. Revista de la Facultad de Ingeniería. Universidad de Antioquia. No 19. Medellín, 1999. 56-64. [ Links ]
[20] FOWLER, B. O.; MORENO, E. C. and BROWN, W. E. Infra-red spectra of hydroxyapatite, octacalcium phosphate and pyrolysed octacalcium phosphate. Arch. Oral Biology. Pergamon Press. Vol. 11, 1966. 477-492. [ Links ]
[21] HANKERMEYER, Chistine R.; OHASHI, Kevin L.; DELANEY David C.; ROSS, John and CONSTANTZ Brent R. Dissolution rates of carbonated hydroxyapatite in hydrochloric acid. Biomaterials. Elsevier. Vol. 23 (2002). 743-750. [ Links ]