Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista EIA
Print version ISSN 1794-1237On-line version ISSN 2463-0950
Rev.EIA.Esc.Ing.Antioq no.7 Envigado Jan./June 2007
INMUNOSENSORES PIEZOELÉCTRICOS: REVISION GENERAL Y SU APLICACIÓN EN EL ANÁLISIS DE PESTICIDAS
Aquiles Ocampo*, Carmen March**, Ángel Montoya***
* Ph.D. en Ingeniería Química. Investigador de los grupos GPC, Gibec y Gabis. EIA.
** Doctora en Ciencias Biológicas. Instituto de Investigación e Innovación en Biotecnología, Universidad Politécnica de Valencia (UPV).
*** Doctor en Ciencias Químicas. Instituto de Investigación e Innovación en Biotecnología, UPV
Artículo recibido 23-III-2007. Aprobado 25-V-2007
Discusión abierta hasta diciembre de 2007
RESUMEN
En este artículo se presenta una revisión bibliográfica de los aspectos más relevantes en el desarrollo de inmunosensores, acompañada de algunos de los resultados experimentales en una aplicación en análisis del plaguicida Carbaril que ilustra la metodología analítica y los resultados esperados. El inmunosensor de microbalanza de cristal de cuarzo (QCM), más conocido como inmunosensor piezoeléctrico, es un sistema analítico que contiene un inmunorreactivo como componente biológico, un transductor de cristal de cuarzo con un antígeno, un conjugado o un anticuerpo inmovilizado en su superficie, acoplado a un sistema de procesamiento de información. Debido a su simplicidad, conveniencia, bajo costo, exactitud, estabilidad y respuesta en tiempo real, este dispositivo se ha vuelto cada vez más importante, especialmente para análisis de materiales en biomedicina, alimentos, medio ambiente y veterinaria.
PALABRAS CLAVE: inmunosensores; piezoelectricidad; QCM; pesticidas.
ABSTRACT
A bibliographic review about the main aspects concerning the development of immunosensors is presented in this article, as well as some of the experimental results in an application in the analysis of carbaryl plaguicide that illustrates the analytical methodology and the expected results. The quartz crystal microbalance immunosensor (QCM), known as piezoelectric immunosensor, is an analytical system which combines an immunoreagent as the biologic component, a quartz crystal transducer with an immobilized antigen or antibody on its surface, coupled to an information processing system. Due to its simplicity, convenience, low cost, accuracy, stability, and real time response, this device has become very important, especially for material analysis in biomedicine, food, environment, and veterinary.
KEY WORDS: immunosensors; piezoelectricity; QCM; pesticides.
1. INTRODUCCIÓN
Un biosensor es un dispositivo analítico constituido por un componente biológico tal como una enzima, un anticuerpo o una célula, que es inmovilizado en un elemento de reconocimiento, el cual está comunicado con un sistema de transducción que transforma la señal bioquímica en eléctrica cuantificable. La figura 1 muestra un esquema de los componentes fundamentales de un biosensor [1].
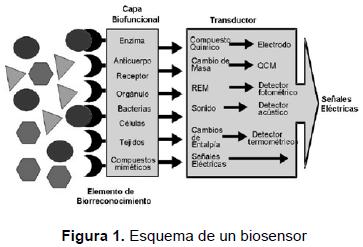
Un inmunosensor es un biosensor en el cual el componente biológico es un inmunorreactivo. Cuando el analito es una molécula pequeña, se requiere realizar un proceso adicional para lograr la reacción inmune con una molécula similar llamada hapteno. Generalmente el elemento objetivo es el antígeno (el analito o el hapteno) y el anticuerpo se adhiere al receptor, aunque en algunos casos se obtiene una mejor respuesta cuando el analito, o una forma modificada de él, se adhiere al receptor.
El inmunosensor piezoeléctrico usa una mi-crobalanza de cristal de cuarzo (QCM) como un transductor altamente preciso y estable que contiene un cristal de cuarzo con un antígeno, un conjugado o un anticuerpo inmovilizado en su superficie [2]. La tecnología QCM utiliza un detector sensible a la masa formado por un cristal piezoeléctrico oscilante de cuarzo que resuena a una frecuencia fundamental, propiedad que le ha permitido su uso en biosensores basados en afinidad [3, 4]. La operación de resonadores piezoeléctricos en fase líquida incluye cambios de la frecuencia de la masa y efectos inducidos por el cambio de la densidad o de la viscosidad de la capa líquida circundante [5, 6].
Un gran número de estudios recientes han demostrado prometedoras aplicaciones de los inmuno-sensores piezoeléctricos en la realización de análisis en muchos campos, tales como el alimentario, bio-médico, veterinario y medioambiental. Representan una herramienta conveniente para la determinación rápida y simple de virus, proteínas, bacterias y otras células, ácidos nucleicos y moléculas pequeñas como drogas, hormonas y pesticidas [7-9].
Existen reportes donde se propone la aplicación de inmunosensores en análisis de materiales para la industria y las oficinas gubernamentales, tales como cerveza, concentración de micotoxinas en muestras de cereales y de alimentos, detección temprana de materiales peligrosos como gérmenes o materiales de guerra química, drogas ilícitas y explosivos, con propósitos de seguridad, por ejemplo, en aeropuertos [10, 11].
En el área de biomedicina se presenta una clara oportunidad de mejorar sus procesos, bajando el tiempo y el costo de los análisis. Se destacan casos como la determinación de proteínas urinarias como marcadores para la nefropatía de la diabetes [12], la inmunoglobulina IgM y la proteína C-reactiva [13]; células humanas tales como T-linfocitos [14], eritrocitos [15]; bacterias tales como Escherichia coli [16, 17], estafilococos aureus [18, 19], tyfimurium de salmonelas [20] y legionella pneumófila [21]; drogas como cocaína en los fluidos corporales [22] y metan-fetamina en la orina humana [23]; virus como los de herpes humano [24], hepatitis [25] y VIH [26], virus Ébola [27] y antígeno carcino-embrionario [28].
Los usos veterinarios propuestos incluyen la detección del virus de la peste porcina africana (ASF) [29], antígeno del gusano adulto (AWA) en la detección del Schistosoma japonicum en la infección de los conejos [30, 31] y de Salmonella enteritidis en los pollos [20].
Los inmunosensores basados en diferentes transductores son herramientas de amplias posibilidades para la supervisión de los agentes contaminadores orgánicos [2, 32-34]. Han encontrado uso en áreas extensamente variadas tales como herbicidas en el agua potable [35], concentración de dioxinas en muestras ambientales reales [36, 37], atrazina [38, 39], herbicida 2,4-D [40] y bifenilos policlorinados (PCB) [41], entre otros.
Las secciones siguientes presentan una descripción general de los modelos que soportan el funcionamiento de los inmunosensores piezoeléctricos, de las etapas envueltas en la producción e inmovilización de los inmunorreactivos y también una ilustración de la manera como se lleva a cabo la caracterización de un inmunosensor.
2. EL INMUNOSENSOR PIEZOELÉCTRICO COMO MÉTODO ANALíTICO PARA EL ANÁLISIS DE PESTICIDAS
El uso de cristales piezoeléctricos como elementos transductores en el desarrollo de inmunosensores microgravimétricos tiene su origen en los trabajos de Sauerbrey a finales de la década de los sesenta [42]. Sus estudios demostraron que, en ciertas condiciones, la variación de la frecuencia de resonancia de un cristal piezoeléctrico tenía un comportamiento lineal con la densidad de masa superficial depositada sobre él. La sensibilidad de esta variación para cristales de cuarzo AT vibrantes en modo de cizalla es proporcional al cuadrado de la frecuencia de resonancia, f, según la siguiente expresión:
donde Δρs es el incremento de masa por unidad de superficie activa del sensor.
Por lo tanto, para un cristal de cuarzo AT de 10 MHz, la sensibilidad es de 0,23 Hz cm2 ng-1. Esto significa sensibilidades superficiales de masa de 0,4 ng/cm y 40 ng/cm2 para variaciones mínimas detectables (VMD) de frecuencia de 0,1 y 10 Hz respectivamente. Estas VMD son típicas en sistemas de microbalanza de cuarzo en medios gaseosos y en medios líquidos respectivamente.
Estos datos indican que en estado gaseoso un sensor microgravimétrico de cuarzo AT y frecuencia de resonancia 10 MHz es capaz de detectar la depositación de moléculas monoatómicas sobre su superficie. Por otra parte, en medio líquido la sensibilidad es suficiente para detectar la adherencia de prácticamente cualquier molécula de peso superior a 2500 daltons, distribuida de modo uniforme sobre la superficie activa del sensor. Sin embargo, esta sensibilidad de masa es inespecífica y la relación lineal entre la variación de frecuencia y de densidad superficial de masa obtenida por Sauerbrey sólo es válida cuando la masa depositada sobre el cristal es lo suficientemente fina o rígida para asegurar que sus propiedades viscoelásticas no afectan la variación de frecuencia.
El entorno líquido afecta también la frecuencia de resonancia del cristal [6]. Sin embargo, se ha demostrado [43] que si el medio en que se halla inmerso el sensor puede considerarse semiinfinito (normalmente se expone sólo una cara del sensor al entorno de ensayo), es decir, no se producen reflexiones de la onda acústica, la variación de frecuencia del resonador corresponde a la suma de las contribuciones debidas al líquido y a la capa de recubrimiento. En consecuencia, si las características de densidad y viscosidad del medio fluido, que por lo general puede considerarse newtoniano, se mantienen constantes, la variación de frecuencia sigue el mismo comportamiento lineal establecido por Sauerbrey, siempre que la capa de recubrimiento pueda considerarse rígida.
Los métodos analíticos existentes para la determinación de pesticidas organofosforados y N-metil carbamatos son complejos y generalmente no disponibles, sobre todo para los compuestos más polares. La baja estabilidad térmica de estos compuestos hace inapropiada la técnica de cromatografía de gases y convierte la cromatografía líquida HPLC como la más apropiada para su determinación. Aunque el método es adecuado, requiere procedimientos de extracción y limpieza y con frecuencia exige etapas de derivación y concentración para obtener la sensibilidad requerida [44-46]. Debido a estas limitaciones de las metodologías convencionales, las técnicas inmunoquímicas, y entre ellas los inmunosensores piezoeléctricos, están ganando una aceptación creciente como métodos alternativos o complementarios para el análisis de pesticidas.
3. PREPARACIÓN DE REACTIVOS Y ANTICUERPOS
La generación acertada de anticuerpos específicos y los análisis de sensibilidad hacia una molécula pequeña dependen en alto grado del diseño apropiado de los haptenos para hacer posible su inmovilización y análisis. Las moléculas pequeñas, como las de pesticidas, drogas, etc., son generalmente no inmunogénicas, o sea que no provocan una respuesta inmune, a menos que estén unidas con algunas macromoléculas tales como proteínas. Esto implica una modificación de estas sustancias para unirse con macromoléculas (portadoras) para hacer así un complejo o conjugado estable del portador-hapteno. El hapteno debe ser tan similar como sea posible al analito, manteniendo sus características estructurales principales, grupos químicos y distribución electrónica [47-50].
Es difícil predecir cuál hapteno es teóricamente el más apropiado para un analito particular y, además, si este hapteno se comportará adecuadamente en los ensayos, como se discutirá más adelante. Si se emplea la tecnología del anticuerpo monoclonal, debe realizarse una selección cuidadosa del hapteno, para aprovechar las diferentes características de los anticuerpos eventualmente obtenidos [51-54].
El diseño del hapteno es, por lo tanto, un paso determinante en el desarrollo de los inmunoensayos para las moléculas pequeñas, porque el hapteno es el responsable de determinar las características del reconocimiento del anticuerpo [55-57]. Para explorar el número máximo de posibilidades para obtener anticuerpos de buena calidad, se suele recomendar la síntesis de varios haptenos con diferentes brazos espaciadores obtenidos por medio de diversas cadenas moleculares [58-60].
La figura 2 muestra la estrategia de síntesis realizada en el Instituto de Investigación e Innovación en Bioingeniería de la Universidad Politécnica de Valencia (UPV), España, para el hapteno CNH utilizado en el análisis de un insecticida modelo, el carbaril [61]. Fue basada en los procedimientos de síntesis industrial del propio insecticida.
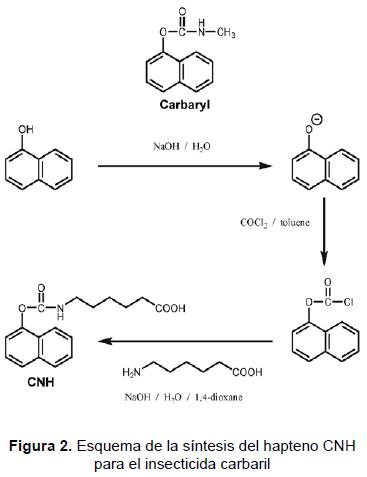
La síntesis del ácido 6-[[(1-naftiloxi)carbonil] amino]hexanoico (CNH) fue un proceso en dos etapas: la primera fue la síntesis de 1-naftil cloroformato, que fue obtenido a partir del 1-naftol e hidróxido de sodio para obtener un radical intermedio, el cual tratado con fosgeno (COCl2) produjo, después de purificar, el cloroformato como un aceite amarillo claro; la segunda etapa fue la síntesis del CNH a partir del cloroformato obtenido antes y ácido aminohexa-noico disuelto en hidróxido de sodio y tratado con una solución de dioxano y luego purificado, como se describe en [61].
La preparación de anticuerpos contra hap-tenos, diseñada para aplicaciones especiales tales como pesticidas y bifenilos policlorinados (PCB), se basa en el enlace covalente del hapteno a una proteína (portador) y la inmunización de animales con los inmunógenos sintetizados. El enlace químico del hapteno a una proteína determina el carácter de la especificidad del anticuerpo. Una gran cantidad de haptenos conjugados a proteínas han sido utilizados para el desarrollo de anticuerpos. Actualmente, la ingeniería de anticuerpos y la producción de anticuerpos recombinantes son campos muy prometedores para la investigación y sus aplicaciones [62-66].
El desarrollo de inmunoensayos requiere la producción de anticuerpos para los analitos y su incorporación en los distintos tipos y procedimientos de análisis, por lo general inmunoensayos enzimáti-cos en fase sólida (ELISA). La generación acertada de anticuerpos específicos y sensibles a una molécula pequeña depende de un diseño apropiado de los haptenos, la inmunización y el procedimiento de análisis. A este respecto, sigue siendo imprevisible cómo los haptenos se presentan al sistema inmune, por lo que es recomendable examinar varias estructuras hapténicas [55, 59]. Particularmente, la detección de un grupo de compuestos de estructura similar puede lograrse a menudo mediante la síntesis juiciosa de los inmunógenos o conjugados hapteno-proteína para exponer al máximo las características comunes a todos los miembros del grupo y a la vez reducir al mínimo la presentación de diferencias estructurales al sistema inmune [56].
Una vez que los inmunógenos del analito estén preparados, la discusión se presenta sobre si obtener anticuerpos policlonales o monoclonales. Los anticuerpos policlonales son producidos usando procedimientos tradicionales de inmunización, con conejos, cabras, ovejas y cerdos. Los anticuerpos policlonales, especialmente de conejos, son reactivos ampliamente utilizados en análisis inmunoquímico, aunque una de sus principales desventajas estriba en el hecho de que no es posible producir especificidad idéntica del anticuerpo incluso en dos animales de la misma especie. Por otra parte, el uso de anticuerpos monoclonales está limitado por la dificultad en el manejo de la tecnología del hibridoma resultante. Aun así, si se requiere una fuente ilimitada de un tipo solo y homogéneo de anticuerpo, la opción es la tecnología monoclonal. Además, los inmunorreactivos estandarizados pueden facilitar la aceptación de inmunoensayos en el laboratorio analítico asegurando una fuente a largo plazo de kits con un funcionamiento definido [59, 67, 68].
El procedimiento para producir los anticuerpos monoclonales es similar para diversos analitos; en particular para el insecticida modelo carbaril se ejecutaron los pasos siguientes [66]: (1) inmunización de las ratonas adultas de 8-10 semanas, (2) fusión celular de los linfocitos del bazo de la ratona con células del mieloma, (3) selección de los anticuerpos de alta afinidad secretados por los clones de hibri-doma, que fueron expandidos y criopreservados en nitrógeno líquido y (4) purificación de los anticuerpos monoclonales y almacenaje a 4 oC como precipitados de sulfato de amonio. La afinidad y la especificidad de los anticuerpos monoclonales producidos para el insecticida modelo carbaril se caracterizó usando procedimientos de ELISA de anticuerpo inmovilizado o de conjugado inmovilizado [66, 69, 70].
La selección y la clonación del hibridoma es uno de los pasos básicos en el desarrollo de anticuerpos monoclonales. Un método común usado en el laboratorio de la UPV fue el siguiente: ocho a diez días después de la fusión celular, los sobrenadantes de cultivo fueron seleccionados por la presencia de anticuerpos que reconocieron el analito. La selección consistió en la ejecución simultánea de un ELISA no competitivo y un ELISA competitivo indirecto, para probar la capacidad de los anticuerpos de unirse al conjugado proteico del hapteno inmunizante y de reconocer el analito, respectivamente. Los hibridomas seleccionados fueron clonados y los clones estables productores de anticuerpos fueron expandidos y criopreservados en nitrógeno líquido.
4. INMOVILIZACIÓN DE INMMUNORREACTIVOS
La inmovilización de biomoléculas en un sustrato es fundamental para asegurar el funcionamiento del sensor, debido a su papel en la especificidad, sensibilidad, reproducibilidad y capacidad de reciclaje. Los métodos para inmovilizar biomoléculas divulgados en la literatura son adsorción física, atrapamiento dentro de una membrana, películas de Langmuir-Blodgett (LB) y enlace covalente en el soporte. Cada método tiene sus propias características y limitaciones, aunque el enlace covalente es el más empleado, porque proporciona la carga superficial estable más alta [71-73].
Algunos de los requisitos que debe satisfacer un proceso de inmovilización son los siguientes: (1) retención de la actividad biológica de las biomolé-culas después de la inmovilización sobre la superficie del sensor; (2) enlace reproducible, duradero y estable con el sustrato, frente a las variaciones de pH, temperatura, fuerza iónica y a la naturaleza química del microambiente; y (3) localización de las biomolé-culas de manera uniforme, densa y orientada. Entre todos los métodos, el enlace covalente satisface la mayor parte de estos requisitos, aunque en ocasiones tiene algunas limitaciones, entre ellas pérdida de actividad de biomoléculas [72].
Monocapa autoensamblada (SAM) es el nombre general dado a la tecnología que proporciona el método para generar películas monomoleculares (monocapas) de moléculas biológicas en una variedad de sustratos. La formación de tales sistemas de monocapa es muy versátil, permitiendo el desarrollo in vitro de las biosuperficies que pueden mimetizar los procesos moleculares naturales en el proceso de reconocimiento [74].
Los tioles y los sulfuros son de particular interés ante todo debido a su adsorción química espontánea en la superficie de oro, lo que da una organización regular y elevada estabilidad térmica, mecánica y química. Los tioles y los sulfuros con cadena larga son más estables térmicamente; se ha propuesto que su adsorción a la superficie procede por dos métodos: (1) disociación iónica y (2) formación de radical, ésta más probable [75].
Debido a la estabilidad, la orientación y la capacidad para funcionalizar los grupos terminales de las moléculas, las SAM de los ácidos mercaptoalca-noicos pueden ofrecer un método muy conveniente y simple para la inmovilización de biomoléculas en la superficie del electrodo de oro, siendo por ello muy utilizadas en el desarrollo de biosensores, facilitando a las proteínas y las enzimas la transferencia de electrones directamente con la superficie del electrodo, mientras que mantienen sus actividades fisiológicas [76-78].
La inmovilización del conjugado para el análisis del insecticida modelo carbaril se llevó a cabo previamente según se ha descrito [70] y se ilustra en la figura 3, cortesía de Laura M. Lechuga (IMM-CSIC, Madrid, España). El conjugado proteína-hapteno, BSA-CNH, fue inmovilizado en la superficie del sensor mediante la formación de monocapas autoensambladas (SAM), que proporcionan el enlace covalente de los derivados del analito a la superficie funcionalizada de una manera controlada. Para formar la SAM, una solución de alcanotiol o de ácido mercaptoundecanoico se dejó reaccionar por adsorción sobre la superficie del electrodo de oro del sensor [70]. Los grupos carboxílicos se activaron mediante reacción con un reactivo intermedio N-hidroxisuccinimida (NHS) usando una mezcla de carbodiimida (EDC) y NHS en agua. En la reacción la EDC convierte el ácido carboxílico en el éster de N-hidroxisuccinimida, que puede unirse covalente-mente a los grupos amino libres de los conjugados de BSA-hapteno.
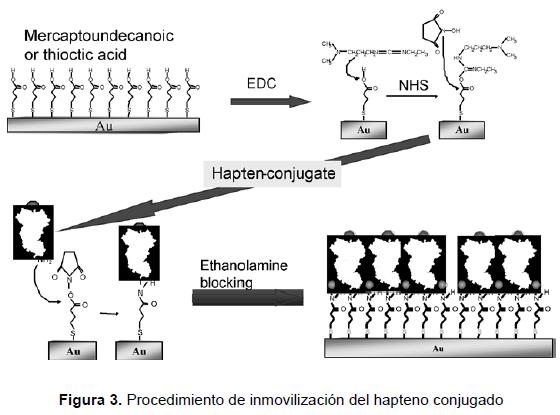
El conjugado BSA-hapteno fue inmovilizado en una solución salina de tampón fosfato (PBS). Luego se agregó etanolamina para eliminar los conjugados no covalentemente unidos a la capa y desactivar todos los NHS-ésteres que no reaccionaron y que quedaban como residuo en la superficie del sensor. Este procedimiento aseguró que sólo quedaran en la superficie del sensor los derivados covalentemente unidos al analito.
Para prevenir la desnaturalización de la proteína, reducir el ocultamiento estérico y también para mejorar la bioactividad de una proteína inmovilizada, los investigadores han propuesto el uso de monocapas autoensambladas mixtas (MSAM) de alcanotioles sobre oro. Las MSAM generalmente se forman por coadsorción de mezclas de dos tioles constituidos por un tiolato con un grupo funcional principal (como un ácido carboxílico) a baja fracción molar y de otro tiolato diluyente de alta fracción molar [79, 80]. El segundo tiol reduce primero la concentración superficial de los grupos funcionales y reduce así a un mínimo el ocultamiento estérico, la desnaturalización parcial de la proteína y las interacciones no específicas que pueden producir señales de interferencia [79]. También el tiolato diluyente puede actuar para orientar las características fisicoquímicas globales de la frontera de separación (tales como su carácter hidrofóbico/hidrofílico). La caracterización de las superficies cubiertas con MSAM sigue siendo tema de numerosos estudios [81].
El uso de MSAM puede controlar las propiedades químicas, estructurales y biológicas de la proteína inmovilizada. Esta capacidad de controlar las características superficiales en el nivel de nanoes-cala, incluyendo la abundancia, el tipo y distribución espacial (normal y lateral) de los sitios del grupo funcional extremo, facilitará los esfuerzos de desarrollar biomateriales biocompatibles, biosensores y electrónica molecular. El control de las características de la superficie de nanoescala permite ajustar el microambiente superficial para ajustarse a las formas distintas y las funcionalidades superficiales de biomoléculas. De hecho, las MSAM han mostrado ya comportamientos interesantes de la adsorción con la variación en la composición superficial de los grupos funcionales extremos [82].
5. CARACTERIZACIÓN DE UN INMUNOSENSOR
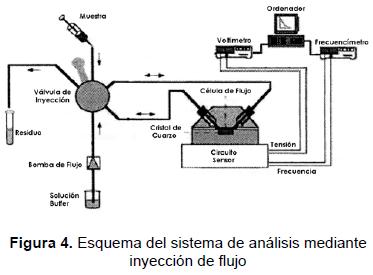
La etapa final en el desarrollo de un inmu-nosensor es su caracterización. Se presenta a continuación un ejemplo práctico del desarrollo de un biosensor piezoeléctrico para el análisis del pesticida modelo carbaril [83]. El inmunosensor piezoeléctrico que trabaja en el modo microgravimétrico para la determinación de moléculas orgánicas pequeñas, tales como pesticidas, sigue un procedimiento analítico para la detección muy similar al esquema presentado en la figura 4.
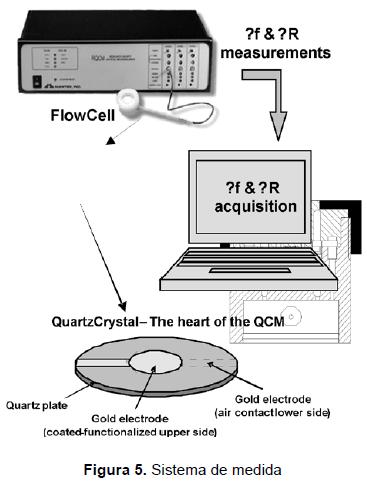
El transductor piezoeléctrico y el sistema de medida. Los cristales del cuarzo obtenidos por corte AT recubiertos con oro de 9-10 MHz (0,167 mm de espesor, 5 mm de diámetro y 0,196 cm2 de área activa) fueron adquiridos en International Crystal Manufacturing Company, Inc., Oklahoma, EE. UU. Una vez químicamente funcionalizado, el cristal pie-zoeléctrico de cuarzo fue colocado y sellado en una celda de arnita con dos anillos de nitrilo. Solamente una de las caras del cristal estará en contacto con los reactivos durante los análisis.
La celda fue incluida en el sistema de flujo, controlado a su vez mediante una bomba peristáltica. Las medidas de la frecuencia y de la resistencia durante los análisis se realizaron en un equipo de microbalanza de cristal de cuarzo para investigación (RQCM) de Maxtek, Inc. Este instrumento es un sistema que proporciona la medida de los efectos de variación en la masa del cristal y se basa en la técnica de la cancelación de la capacitancia y se diseña para los usos de la investigación. Un esquema del sistema completo de la medición se muestra en la figura 5.
Análisis de datos. Las curvas patrón normalizadas se obtuvieron trazando la disminución de la frecuencia contra el logaritmo de la concentración del analito. Los puntos experimentales se adaptaron a la ecuación logística de cuatro variables:
donde A es el asintótico máximo (señal máxima en la ausencia del analito, Smáx), B es la pendiente de la curva en el punto de inflexión (relacionado con la concentración del analito que da un 50% de inhibición de Smáx: C, I50) y D es el mínimo asintótico (señal del fondo).
Procedimiento del inmunoensayo. Los inmunoensayos desarrollados para la determinación del insecticida fueron pruebas de inhibición basadas en el procedimiento de conjugado inmovilizado, en el cual el hapteno conjugado fue inmovilizado covalentemente sobre la superficie del sensor. Para los análisis de inhibición, una cantidad fija del anticuerpo monoclonal respectivo fue mezclada con soluciones patrón del analito, y la mezcla se bombeó sobre la superficie del sensor. Puesto que los analitos inhiben la unión del anticuerpo a los conjugados inmovilizados respectivos, el aumento en las concentraciones del analito reducirá el decremento de frecuencia del sensor piezoeléctrico.
Se prepararon diversas concentraciones patrón del insecticida mediante diluciones seriadas en dimetilformamida (DMF). Los patrones fueron mezclados con una concentración fija del anticuerpo monoclonal, LIB-CNH45. Las soluciones del analito-anticuerpo fueron incubadas por una hora a temperatura ambiente y después inyectadas sobre la superficie del sensor. La frecuencia de resonancia del cristal piezoeléctrico se registró en tiempo real mientras ocurría el enlace entre el anticuerpo libre y el conjugado inmovilizado. Terminado cada ensayo, la regeneración de la superficie del biosensor se realizó usando ácido clorhídrico diluido para romper la asociación anticuerpo-analito. Las curvas patrón representativas del ensayo se obtuvieron como promedio de varias curvas patrón individuales, previamente normalizadas, expresando la disminución de la frecuencia provocada por cada concentración patrón como el porcentaje de la máxima respuesta (disminución de la frecuencia obtenida en ausencia del analito).
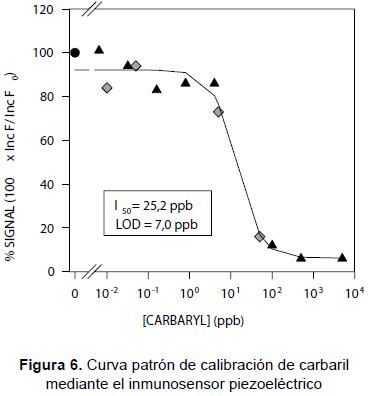
Determinaciones del pesticida. La finalidad última de un inmunosensor es siempre poder determinar la concentración de un pesticida en muestras problema. Como era de esperar, en el caso del carbaril que se está ilustrando, las señales de frecuencia proporcionadas por el sensor como respuesta a las diferentes concentraciones del pesticida siguieron curvas de calibración típicas de los ensayos de inhibición, de forma sigmoidea decreciente, similares a la mostrada en la figura 6. Estas curvas se obtuvieron mediante el ajuste de los puntos experimentales a la ecuación logística de cuatro variables ya mencionada. Las curvas se normalizaron expresando el valor de la absorbancia Inc F como (Inc F)/ (Inc F0)*100, donde Inc F0 es la absorbancia indicada a una concentración cero de insecticida. La misma ecuación permite también obtener el valor de la I50, que se define como la concentración de analito que reduce la señal del análisis al 50% de la máxima. Este valor se utiliza habitualmente como una predicción de la sensibilidad del inmunosensor, de tal modo que los valores menores que I50 indican mayor sensibilidad. En el caso del carbaril la I50 se situó alrededor de 25 ppb, mientras que el límite de predicción del ensayo (LOD) se calculó como 7 ppb.
Reutilización del sensor. Para este pesticida los cristales piezoeléctricos funcionalizados con el conjugado inmovilizado pudieron ser reutilizados por más de cien veces, con reducciones leves de la señal máxima y sin pérdidas significativas de sensibilidad. El tiempo total requerido para un ciclo completo de análisis, incluyendo la regeneración, fue de alrededor de 20 min.
6. CONCLUSIÓN
Los inmunosensores piezoeléctricos pueden considerarse ya como una técnica inmunoquímica alterna, en algunos casos comparable a otras bien establecidas como ELISA. En contraste con las técnicas ELISA que requieren la marcación de los reactivos y tardan unas dos horas por ensayo, esta técnica puede ser automatizada, no utiliza marcadores y los resultados de los análisis se pueden obtener en pocos minutos. En contrapartida, hoy por hoy es necesario realizar los análisis muestra a muestra. Por tanto, todavía se precisa mucho esfuerzo de investigación para optimizar las técnicas de inmovilización y asegurar la regeneración del sensor, así como para obtener sensibilidades comparables a las técnicas ELISA y poder implementar el análisis simultáneo de muchas muestras. No obstante, las técnicas de inmunoensayo microgravimétrico deben considerarse como alternativas, de gran valor en muchos casos, a las actualmente establecidas.
AGRADECIMIENTOS
Los autores agradecen al subprograma Petra II del programa Alfa II por su soporte financiero. También agradecen el soporte de la Universidad Politécnica de Valencia (UPV) y la Escuela de Ingeniería de Antioquia (EIA).
REFERENCIAS
1. Ortega Ortiz, F. Biosensores y biochips: Herramientas para el diagnóstico y la terapéutica. Documento para su ingreso como académico de número, Real Academia Nacional de Farmacia, España, 11 de mayo de 2006. [ Links ]
2. Kurosawa, S.; Park, J. W; Aizawa, H.; Wakida, S. I.; Tao, H. and Ishihara, K. Quartz crystal microbalance immunosensors for environmental monitoring. Biosensors and Bioelectronics 22 (2006) 473-481. [ Links ]
3. Kim, N.; Park, I. S. and Kim, D. K. High-sensitivity detection for model organophosphorus and carbamate pesticide with quartz crystal microbalance-precipitation sensor. Biosensors and Bioelectronics 22 (2007) 1593-1599. [ Links ]
4. Abad, J. M.; Pariente, F.; Hernández, L.; Abruña, H. D. and Lorenzo, E. Determination of organophosphorus and carbamate pesticides using a piezoelectric biosensor. Anal. Chem., 70 (1998) 2848-2855. [ Links ]
5. Kanazawa, K. K. and Gordon, J. The oscillation frequency of a quartz resonator in contact with liquid, 1985. Anal. Chim. Acta 175, 99-105. [ Links ]
6. Fohlerová, Z.; Skládal, P. and Turánek, J. Adhesion of eukaryotic cell lines on the gold surface modified with extracellular matrix proteins monitored by the piezoelectric sensor. Biosensors and Bioelectronics (2007) in press. [ Links ]
7. Kurosawa S.; Nakamura M.; Park J. W.; Aizawa H.; Yamada K. and Hirata M. Evaluation of a high-affinity QCM immunosensor using antibody fragmentation and 2-methacryloyloxyethyl phosphorylcholine (MPC) polymer. Biosensors and Bioelectronics 20 (2004) 1134-1139. [ Links ]
8. Skládal, P. Piezoelectric quartz crystal sensors applied for bioanalytical assays and characterization of affinity interactions. J. Braz. Chem. Soc., 14 (4), (2003) 491502. [ Links ]
9. Franek M. and Hruska K. Antibody based methods for environmental and food analysis: a review. Vet. Med., Czech, 50 (1), (2005) 1-10. [ Links ]
10. Rodriguez-Mozaz S.; Marco M. P.; Lopez de Alda M. J. and Barceló, D. Biosensors for environmental applications: Future development trends. Pure Appl. Chem., 76 (4), (2004) 723-752. [ Links ]
11. Urraca, J. L.; Benito-Peña, E.; Pérez-Conde, C. N.; Moreno-Bondi, M. C. and Pestka, J. J. Analysis of zearalenone in cereal and swine feed samples using an automated flow-through immunosensor. J. Agric. Food Chem., 53 (2005) 3338-3344. [ Links ]
12. Luo, Y.; Chen, M.; Wen, Q.; Zhao, M.; Zhang, B.; Li, X; Wang, F.; Huang, Q.; Yao, C.; Jiang, T.; Cai, G. and Fu, W. Rapid and simultaneous quantification of 4 urinary proteins by piezoelectric quartz crystal microbalance immunosensor array. Clinical Chemistry. 52 (2006) 2273-2280. [ Links ]
13. Chiu, X.; Jiang, J.; Shen, G., and Yu, R., Simultaneous immunoassay using piezoelectric immunosensor array and robust method. Anal. Chim. Acta 336 (1996) 185-193. [ Links ]
14. Kõnig, B. and Grãtzel, M. Detection of human T-lym-phocytes with a piezoelectric immunosensor. Anal. Chim. Acta, 281 (1993) 13-18. [ Links ]
15. Kõnig, B. and Grãtzel, M., Development of piezoelectric immunosensor for the detection of human erythrocytes. Anal. Chim. Acta, 276 (1993) 329-233. [ Links ]
16. Maramatsu, H.; Watanabe, Y.; Hikuma, M.; Ataka, I.; Tamiya, E. and Karube, I. Piezoelectric crystal biosensor system for detection of E. coli. Anal. Lett., 229 (1989) 2155-2166. [ Links ]
17. Subramanian, A.; Irudayaraj, J. and Ryanc, T. A mixed self-assembled monolayer-based surface plasmon im-munosensor for detection of E. coli O157:H7. Biosensors and Bioelectronics 21 (2006) 998-1006. [ Links ]
18. Deng, L.; Feng-Jiang, H.; Tai, J. J.; Lihua, N. and Shouzhuo, Y. A goat-anti-human Ig G modified piezo-immunosensor for Staphylococcus aureus detection. J. Microbiol. Methods, 23 (1995) 229-234. [ Links ]
19. Coté, G. L.; Lec, R. M. and Pishko, M. V. Emerging biomedical sensing technologies and their applications. IEEE Sensors Journal, 3 (3), (2003) 251-266. [ Links ]
20. Oh, B. K.; Kim, Y. K.; Park, K. W.; Lee, W. H. and Choi, J. W. Surface plasmon resonance immunosensor for the detection of Salmonella typhimurium. Biosens. Bioelectron. 19 (2004) 1497-1504. [ Links ]
21. Oh, B. K.; Kim, Y. K.; Lee, W; Bae, Y. M.; Lee, W H. and Choi, J. W. Immunosensor for detection of Legio-nella pneumophila using surface plasmon resonance. Biosens. Bioelectron. 18 (2003) 605-611. [ Links ]
22. Halámek J.; Makower A.; Skládal P. and Scheller F. W. Highly sensitive detection of cocaine using a piezoelectric immunosensor. Biosensors and Bioelectronics 17 (2002) 1045-1050. [ Links ]
23. Miura, N.; Higobashi, H.; Sakai, G.; Takeyashu, A.; Uda, T. and Yamazoe, N. Piezoelectric crystal immunosensor for sensitive detection of methamphetamine (stimulant drug) in human urine. Sens. Actuators B, 13, (1993) 188-191. [ Links ]
24. Kõnig, B. and Grãtzel, M., A novel immunosensor for herpes viruses. Anal. Chem., 68, (1994) 341-344. [ Links ]
25. Kõnig, B. and Grãtzel, M. A piezoelectric immunosen-sor for hepatitis viruses. Anal. Chim. Acta, 309 (1995) 19-25. [ Links ]
26. Arberl F. and Wolf H. HIV serology using piezoelectric immunosensors. Sens. Actuators B, vol. 18-19, (1994) 271-275. [ Links ]
27. Yu J. S.; Liao H. X.; Gerdon A. E.; Huffman B.; Scearce R. M.; McAdams M.; Alam S. M.; Popernack P. M.; Sullivan N. J.; Wright D.; Cliffel D. E.; Nabel G. J. and Haynes B. F. Detection of Ebola virus envelope using monoclonal and polyclonal antibodies in ELISA, surface plasmon resonance and a quartz crystal microbalance immunosensor. Journal of Virological Methods 137 (2006) 219-228. [ Links ]
28. Wu, J.; Tang, J.; Dai, Z; Yan, F.; Ju, H. and El Murr, N. A disposable electrochemical immunosensor for flow injection immunoassay of carcinoembryonic antigen. Biosensors and Bioelectronics 22 (2006) 102-108. [ Links ]
29. Uttenthaler, E.; Kolinger, C. and Drost, S. Characterization of immobilization methods for African swine fever virus protein and antibodies with a piezoelectric immunosensor. Biosensors and Bioelectronics 13 (1998) 1279-1286. [ Links ]
30. Su X.; Li., S. F. Y.; Liu, W. and Kwang J. Piezoelectric quartz crystal based screening test for porcine reproductive and respiratory syndrome virus infection in pigs. Analyst, 125 (2000) 725-730. [ Links ]
31. Wu, Z.; Wu, J.; Wang, S.; Shen, G. and Yu, R. An amplified mass piezoelectric immunosensor for Schistosoma japonicum. Biosensors and Bioelectronics 22 (2006) 207-212. [ Links ]
32. Álvarez, M.; Calle, A.; Tamayo, J.; Lechuga, L. M.; Abad, A. and Montoya, A. Development of nano-me-chanical biosensors for the detection of the pesticide DDT. Biosensors and Bioelectronics, Vol. 18 (2003), 649-653. [ Links ]
33. Mauriz, E.; Calle, E.; Lechuga, L. M.; Quintana, J.; Montoya, A. and Manclús, J. J. Real-time detection of chlorpyrifos at part per trillion levels in ground, surface and drinking water samples by a portable surface plas-mon resonance immunosensor. Anal. Chim. Acta, Vol. 561 (2006), 40-47. [ Links ]
34. Mauriz, E.; Calle, A.; Montoya, A. and Lechuga, L. M. Determination of environmental organic pollutants with a portable optical immunosensor. Talanta (Oxford), Vol. 69 (2006) 359-364. [ Links ]
35. Yokoyama, K.; Ikebukuro, H.; Tamiya, E.; Karube, I.; Ichiki, N. and Arikawa, Y. Highly sensitive quartz im-munosesnors for multisample detection of herbicides. Anal. Chim. Acta, 304 (1995) 139-145. [ Links ]
36. Park, J. W.; Kurosawa, S.; Aizawa, H.; Hamano, H.; Harada, Y.; Asano, S.; Mizushima, Y. and Higaki, M. Dioxin immunosensor using anti-2,3,7,8-TCDD antibody which was produced with mono 6-(2,3,6,7-tetra-chloroxanthene-9-ylidene) hexyl succinate as a hapten. Biosensors and Bioelectronics 22 (2006) 409-414. [ Links ]
37. Kurosawa, S.; Aizawa, H. and Park, J. W. Quartz crystal microbalance immunosensor for highly sensitive 2,3,7,8-tetrachlorodibenzo-p-dioxin detection in fly ash from municipal solid waste incinerators. Analyst, 130 (2005) 1495-1501. [ Links ]
38. Steegborn, C. and Skládal, P. Construction and characterization of the direct piezoelectric immunosensor for atrazine operating in solution. Biosensors and Bioelectronics 12 (1997) 19-27. [ Links ]
39. Pribyl, J.; Hepel, M.; Halámek, J. and Skládal, P. Development of piezoelectric immunosensors for competitive and direct determination of atrazine. Sensors and Actuators B 91 (2003) 333-341. [ Links ]
40. Halámek, J.; Hepel, M. and Skládal, P. Investigation of highly sensitive piezoelectric immunosensors for 2,4-dichlorophenoxyacetic acid. Biosensors and Bio-electronics 16 (2001) 253-260. [ Links ]
41. Pribyl, J.; Hepel, M. and Skládal, P. P. Piezoelectric im-munosensors for polychlorinated biphenyls operating in aqueous and organic phases. Sensors and Actuators B 113 (2006) 900-910. [ Links ]
42. Sauerbrey, G. Verwendung von Schwingquarzen zur Wãgung dünner Schichten und zur Mikrowãgung. Zeitschrift für Physik, 155 (1959) 206-222. [ Links ]
43. Arnau A.; Jiménez Y. and Sogorb, T. Thickness-shear mode quartz crystal resonators in viscoelastic fluid media. J. Appl. Phys., 88(8), (2000) 4498-4506. [ Links ]
44. Buser, H. R. and Müller, M. D. Isomer-selective and enantiomer-selective determination of DDT and related compounds using chiral high-resolution gas chromatog-raphy/mass spectrometry and chiral high- performance liquid chromatography. Anal. Chem., Vol. 67 (1995), 2691-2698. [ Links ]
45. Hiemstra, M. and De Kok, A. Determination of N-methylcarbamate pesticides in environmental water samples using automated on-line trace enrichment with exchangeable cartridges and high-performance liquid chromatography. J. Chromatogr., Vol. 667 (1994), 155-166. [ Links ]
46. Thurman, E. M.; Meyer, M.; Pomes, M.; Perry, C. A. and Schwab, A. P. Enzyme-linked immunosorbent assay compared with gas chromatography mass spectrometry for the determination of triazine herbicides in water. Anal. Chem., 62 (1990) 2043-2048. [ Links ]
47. Singh K. V; Kaur, J.; Varshney, G. C.; Raje, M. and Raman Suri, C. Synthesis and characterization of hap-ten-protein conjugates for antibody production against small molecules. Bioconjugate Chem. 15 (2004) 168-173. [ Links ]
48. Goodrow, M. H.; Harrison, R. O. and Hammock, B. D. Hapten synthesis, antibody development, and competitive inhibition enzyme immunoassay for s-triazine herbicides. J. Agric. Food Chem. 38 (1990) 990-996. [ Links ]
49. Szurdoki, F.; Szekacs, A.; Le, H. M. and Hammock, B. D. Synthesis of haptens and protein conjugates for the development of immunoassays for the insect growth regulator fenoxycarb. J. Agric. Food Chem. 50 (2002) 29-40. [ Links ]
50. Hill, A. S.; McAdam, D. P.; Edward, S. L. and Skerritt, J. H. (1993). Quantitation of bioresmethrin, a synthetic pyrethroid grain protectant, by enzyme immunoassay. J. Agric. Food Chem. 41, 2011-2018. [ Links ]
51. Manclús, J. J.; Primo, J. and Montoya, A. Development of enzyme-linked immunosorbent assays for the insecticide Chlorpyrifos. 1. Monoclonal antibody production and immunoassay design. J. Agric. Food Chem. 44 (1996) 4052-4062. [ Links ]
52. Hammock, B. D.; Gee, S. J.; Harrison, R. O.; Jung, F.; Goodrow, M. H.; Li, Q. X.; Lucas, A. D.; Székács, A. and Sundaram, K. M. Immunological technology in environmental analysis: addressing critical problems. In: Immunological methods for environmental analysis, Van Emon, J. M., Mumma, R. O. (eds.). ACS Symposium Series 442, American Chemical Society: Washington, DC, 1990, pp 112-139. [ Links ]
53. Harrison, R. O.; Goodrow, M. H.; Gee, S. J. and Hammock, B. D. Hapten synthesis for pesticide immunoas-say development. In: Immunoassays for trace chemical analysis, Vanderlaan, M., Stanker, L., Watkins, B., Roberts, D. (eds.). ACS Symposium Series 451, American Chemical Society: Washington, DC, 1990, pp 14-27. [ Links ]
54. Goodrow, M. H.; Sanborn, J. R.; Stoutamire, D. W.; Gee, S. J. and Hammock, B. D. Strategies for immuno-assay hapten design. In: Immunoanalysis of agrochemi-cals, Nelson, J. O., Karu, A. E., Wong, R. B., Eds., ACS Symposium Series 586, American Chemical Society: Washington, DC, 1995, pp 119-139. [ Links ]
55. Marco, M. P.; Gee, S. and Hammock, B. D. Immuno-chemical techniques for environmental analysis II. Antibody production and immunoassay development. Trends Anal. Chem., 14 (1995) 415-425. [ Links ]
56. Johnson, J. C.; Van Emon, J. M.; Pullman, D. R. and Keeper, K. R. Development and evaluation of antisera for detection of the O,O-diethyl phosphorothionate and phosphorothionothiolate organophosphorus pesticides by immunoassay. J. Agric. Food Chem., 46 (1998) 3116-3123. [ Links ]
57. Haasnoot, W.; Du Pre, J.; Cazemier, G.; Kemmers-Voncken, A., Verheijen, R. and Jansen, B. J. M. Monoclonal antibodies against a sulfathiazole derivative for the immunochemical detection of sulphonamides. Food Agric. lmmunol., 12 (2000) 127-138. [ Links ]
58. Abad, A.; Manclús, J. J.; Mojarra, F.; Mercader, J. V; Miranda, M. A.; Primo, J.; Guardiola, V. and Montoya, A. Hapten synthesis and production of monoclonal antibodies to DDT and related compounds. J. Agric. Food Chem., 45 (1997) 3694-3702. [ Links ]
59. Manclús, J. J.; Abad, A.; Lebedev, M. Y.; Mojarrad, F.; Micková, B.; Mercader, J. V.; Primo, J.; Miranda, M. A. and Montoya A. Development of a monoclonal immunoassay selective for chlorinated cyclodiene insecticides. J. Agric. Food Chem. 52 (2004) 2776-2784. [ Links ]
60. Abad, A.; Moreno, M. J., and Montoya, A. Hapten synthesis and production of monoclonal antibodies to the N-methylcarbamate pesticide methiocarb. J. Agric. Food Chem., 46 (1998) 2417-2426. [ Links ]
61. Abad, A. and Montoya, A. Production of monoclonal antibodies for carbaryl from a hapten preserving the carbamate group, J. Agric. Food Chem., 42 (1994) 1818-1823. [ Links ]
62. Franek, M. and Hruska, K. Antibody based methods for environmental and food analysis: a review, Vet. Med. - Czech, 50 (1), (2005) 1-10. [ Links ]
63. Hock, B. Immunochemical analysis of water pollutants. Acta Hydrochimica and Hydrobiologica, 29 (2002) 375-390. [ Links ]
64. Kramer, K. and Hock, B. Recombinant antibodies for environmental analysis. Analytical and Bioanalytical Chemistry, 377 (2003) 417-426. [ Links ]
65. Goodrow, M. H.; Sanbom, J. R.; Stoutamire, D. W.; Gee, S. J. and Hammock, B. D. Strategies for immunoassay hapten design. In: Immunoanalysis of agrochemicals, Nelson, J. O., Karu, A. E., Wong, R. B. (eds.). ACS Symposium Series 586, American Chemical Society: Washington, DC, 1995, pp 119-139. [ Links ]
66. Abad, A.; Primo J. and Montoya A. Development of an enzyme-linked immunosorbent assay to carbaryl. 1. Antibody production from several haptens and characterization in different immunoassay formats. J. Agr. Food Chem., Vol. 45 (1997), 1486-1494. [ Links ]
67. Stanker, L. H. and Beier, R. C. Introduction to immu-noassays for residue analysis. In: lmmunoassays for residue analysis, Beier, R. C., Stanker, L. H. (eds.), ACS Symposium Series 621, American Chemical Society: Washington, DC, 1996, pp 2-16. [ Links ]
68. Meulenberg, E. P. Immunochemical detection of environmental and food contaminants: Development, validation and application. Food Technol. Biotechnol., 35 (1997) 153-163. [ Links ]
69. Manclús J. J. and Montoya A. Development of an enzyme-linked immunosorbent assay for 3,5,6-trichloro-2-pyridinol (TCP). 1. Monoclonal anti-body production and immunoassay design. J. Agr. Food Chem., 44 (1996) 3703-3709. [ Links ]
70. Mauriz, E.; Calle, A.; Abad, A.; Montoya, A.; Hilde-brandt, A.; Barceló, D. and Lechuga, L. M. Determination of carbaryl in natural water samples by a surface plasmon resonance flow-through immunosensor. Biosensors and Bioelectronics, 21 (2006) 2129-2136. [ Links ]
71. Llanes D. S.; Hempel, U. and Ocampo, A. Interface layer to improve polystyrene attachment on a quartz crystal resonator. Revista EIA, 4 (2005) 9-19. [ Links ]
72. Sai, V V R.; Mahajan, S.; Contractor, A. Q. and Mukher-ji, S. Immobilization of antibodies on polyaniline films and its application in a piezoelectric immunosensor. Anal. Chem., 78 (2006) 8368-8373. [ Links ]
73. Gobi, K. V.; Matsumoto, K.; Toko, K.; Ikezaki, H. and Miura, N. Enhanced sensitivity of self-assembled-monolayer-based SPR immunosensor for detection of benzaldehyde using a single-step multi-sandwich immunoassay. Analytical and Bioanalytical Chemistry, 387 (2007) 2727-2735. [ Links ]
74. Ferretti, S.; Paynter, S.; Russell, D. A. and Sapsford, K. E. Self-assembled monolayers: a versatile tool for the formulation of bio-surfaces. Trends in Analytical Chemistry, 19 (9), (2000) 530-540. [ Links ]
75. Ohtani, M.; Sunagawa, T.; Kuwabata, S. and Yoneyama, H. Preparation of a microelectrode array by photo-induced elimination of a self-assembled monolayer of hexadecylthiolate on a gold electrode. Journal of Electroanalytical Chemistry, 396 (1-2), (1995) 97-102. [ Links ]
76. Vaughan, R. D.; O´Sullivan, C. K. and Guilbault, G. G. Sulfur based self-assembled monolayers (SAM´s) on piezoelectric crystals for immunosensor development. Fresenius J Anal Chem, 364 (1999) 54-57. [ Links ]
77. Akrama, M.; Stuart, M. C. and Wong, D. K. Y. Direct application strategy to immobilise a thioctic acid self-assembled monolayer on a gold electrode. Analytica Chimica Acta 504 (2004) 243-251. [ Links ]
78. Ferretti, S.; Paynter, S.; Russell, D. A.; Sapsford, K. E. and Richardson, D. J. Self-assembled monolayers: a versatile tool for the formulation of bio-surfaces. TRAC-Trend. Anal. Chem., Vol 19 (2000), 530-540. [ Links ]
79. Frederix, F.; Bonroy, K.; Laureyn, W; Reekmans, G.; Campitelli, A.; Dehaen, W. and Maes, G. Enhanced performance of an affinity biosensor interface based on mixed self-assembled monolayers of thiols on gold. Langmuir 19 (2003) 4351-4357. [ Links ]
80. Briand, E.; Salmain, M.; Compère, C. and Pradier, C. M. Anti-rabbit immunoglobulin G detection in complex medium by PM-RAIRS and QCM influence of the antibody immobilisation method. Biosensors and Bioelectronics 22 (2007) 2884-2890. [ Links ]
81. Briand, E.; Salmain, M.; Herry, J. M.; Perrot, H.; Compère, C. and Pradier, C. M. Building of an immunosen-sor: How can the composition and structure of the thiol attachment layer affect the immunosensor efficiency? Biosensors and Bioelectronics 22 (2006) 440-448. [ Links ]
82. Chen, S.; Li, L.; Boozer, C. L. and Jiang, S. Controlled chemical and structural properties of mixed self-assembled monolayers of alkanethiols on Au(111), Langmuir 16 (2000) 9287-9293. [ Links ]
83. March, C.; Manclús, J. J.; Arnau, A.; Jiménez, Y.; Sogorb, T. and Montoya, A. Development of piezoelectric immunosensors based on monoclonal antibodies for pesticide analysis, 5o Congreso Iberoamericano de Sensores, Iberosensors, Montevideo, 2006. [ Links ]














