Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista EIA
Print version ISSN 1794-1237On-line version ISSN 2463-0950
Rev.EIA.Esc.Ing.Antioq no.7 Envigado Jan./June 2007
PRODUCCIÓN DE BIOMASA Y EXOPOLISACÁRIDOS DE Grifóla frondosa BAJO CULTIVO SUMERGIDO UTILIZANDO FUENTES DE CARBONO NO CONVENCIONALES
Paula Zapata1, Diego Rojas1, Carlos Fernández2, David Ramírez3, Gloria Restrepo4, Viviana Orjuela4, Marcela Arroyave4, Tatiana Gómez4, Lucía Atehortüa5
1 Laboratorio de Biotecnología y Biotecnología Vegetal, Universidad de Antioquia. Medellín.
1 Químico Farmacéutico, Universidad de Antioquia. MSc en Biología. Grupo de Biotecnología, Universidad de Antioquia. paozapata@gmail.com, diferova@gmail.com.
2 Licenciado en Educación, MSc. Departamento de Ciencias Básicas, Escuela de Ingeniería de Antioquia. pfcafer@eia.edu.co
3 Estudiante de Bioingeniería, Laboratorio de Biotecnología, Universidad de Antioquia. darax83@gmail.com
4 Estudiantes de Química Farmacéutica, Universidad de Antioquia. Grupo de Biotecnología, Universidad de Antioquia. glorico85@gmail.com, viviorjuelav84@yahoo.es, marcearroyave@hotmail.com, tatigomez22@hotmail.com
5 Bióloga, MSc. PhD, Coordinadora Grupo de Biotecnología, Universidad de Antioquia. latehor@yahoo.es.
Artículo recibido 20-IX-2006. Aprobado 16-VI-2007
Discusión abierta hasta diciembre de 2007
RESUMEN
Grifóla frondosa es un hongo Basidiomycete comestible y medicinal que produce polisacáridos tipo glucanos (β-1,6 y β-1,3) con actividad antitumoral e inmunomoduladora. Para el presente trabajo, el objetivo fue evaluar la incidencia de diferentes fuentes de carbono (FC) en la producción de biomasa y exopolisacári-dos (EPS), bajo condiciones de cultivo sumergido, utilizando un diseño estadístico factorial con dos factores: fuente de carbono (FC(1-7)) y medio (MB y MS). La máxima producción de biomasa micelial (21,10 ± 0,82) g/l y la máxima producción de EPS (6,53 ± 0,14) g/l se logró utilizando el medio MB suplementado con FC4.
Además de lo anterior, se logró desarrollar un medio de cultivo que cumple con el objetivo de disminuir costos, de Col $18.455 a $656 por litro de medio, produciendo (14,14 ± 0,82) g/l de biomasa y (5,16 ± 0,14) g/l de EPS, utilizando el medio MS suplementando con FC4. Estos resultados abren nuevas alternativas y posibilidades en nuestro país para el desarrollo de productos a partir de esta especie con costos que estén al alcance de la población.
PALABRAS CLAVE: hongo medicinal; bioprocesos; biomasa micelial; bioactivos.
ABSTRACT
Grifóla frondosa is a Basidiomycete fungus edible and medicinal, it produces polysaccharides such a glucans (β-1,6 and β-1,3) with anti-tumor and inmuno-stimulating activity. For this work, the aim was evaluate the incidence of different carbon sources (FC) in biomass and exo-polymer (EPS) production, under submerged culture conditions, by using a factorial statistical design with two factors: carbon source (FC(1-7)) and medium (MB and MS). The maximal yield of mycelial biomass (21,10 ± 0,82) g/l and the maximal yield in EPS (6,53 ± 0,14) g/l was achieved by using the MB medium supplemented with FC4. Besides, it was possible to develop a medium that fulfills the objective of reducing costs from $18.455 to $656 Colombian pesos for each liter of medium used, which produces (14,14 ± 0,82) g/l of biomass and (5,16 ± 0,14) g/l of EPS, using the MS medium supplemented with FC4. This result opens new alternatives and possibilities in our country for developing products of this species with cost that can be reached by population.
KEYWORDS: medicinal mushroom; bioprocess; mycelial biomass; bioactives.
INTRODUCCIÓN
Grifóla frondosa es un hongo Basidiomyicete, del orden Aphyllopherales de la familia Polyporaceae (Lee et al., 2003); crece en las montañas del noroeste de Japón, en Norteamérica y Europa, donde tradicionalmente se le atribuyen un gran número de propiedades y efectos benéficos para la salud (Hsieh et al., 2006).
Este hongo es mundialmente reconocido y valorado, debido a que su cuerpo fructífero y bio-masa micelial poseen alto valor, tanto nutricional como medicinal. Se caracteriza por su alto contenido de polisacáridos tipo glucanos β-1,6 y β-1,3, que poseen actividad antitumoral e inmunomodu-ladora (Matsui et al., 2001) y por contener péptidos con actividad inhibitoria de la enzima convertidora de angiotensina I (Choi et al., 2001). Además otras actividades biológicas reportadas son: antioxidante, hipoglicemiante, hipocolesterolemiante y antiinflamatorio (Smith et al., 2002). Actualmente a partir de la biomasa micelial o del cuerpo fructífero se producen polvos, infusiones, jarabes y cápsulas (Hsieh et al., 2006) como suplemento dietario para la prevención y tratamiento de algunas enfermedades como infecciones comunes, VIH, diabetes mellitus, hipertensión, hipercolesterolemia e infecciones del tracto urinario (Smith et al., 2002).
Por lo anterior, está en aumento la demanda de cuerpos fructíferos y productos de G. frondosa, que los sistemas convencionales de cultivo no tienen la capacidad de cubrir, porque estos sistemas tienen grandes desventajas: el largo tiempo de obtención de productos de interés (4-6 meses), la dificultad para garantizar la esterilidad de los procesos, la heterogeneidad de productos y la imposibilidad para controlar las variables y condiciones de cultivo (Cui et al., 2006).
Debido a esto, las investigaciones están encaminadas a la búsqueda de alternativas que permitan la producción de biomasa y bioactivos, de forma rápida, económica y confiable, y de esta manera brindar solución a los problemas que presenta la producción convencional. Una de esas alternativas es el cultivo sumergido, que posee notables ventajas frente a los sistemas convencionales, entre las cuales se distinguen el control y seguimiento de las condiciones de cultivo (temperatura, pH, agitación, concentración de nutrientes, esterilidad), disminución del tiempo para la obtención de biomasa y bioactivos (9-14 días), y la reducción de costos de obtención, separación y purificación de los metabolitos de interés (Lee et al., 2004); por estas razones el sistema ha tomado auge para la obtención de biomasa micelial y sus productos, permitiendo la producción en gran escala por medio de biorreactores, procesos de escalamiento y optimización de procesos.
Una preocupación constante para la utilización de cultivos sumergidos, principalmente en los países del Tercer Mundo, es el alto costo de los procesos en gran escala. Un punto clave para comenzar a subsanar este problema es formular y reformular nuevos medios de cultivo en vez de utilizar medios ya publicados por otros autores, los cuales se han convertido en la primera elección. Es el caso de la producción de biomasa a partir de hongos medicinales, en la cual las fuentes de carbono más utilizadas son glucosa, maltosa, galactosa y lactosa (Cui et al., 2006; Hsieh et al., 2006; Lee et al., 2004), que incrementan los costos de obtención de biomasa micelial y de bioactivos.
El objetivo en el presente trabajo fue evaluar la incidencia de diferentes fuentes de carbono (FC) no convencionales de bajo costo, en la producción de biomasa micelial y exopolisacáridos (EPS) de G. frondosa, bajo condiciones de cultivo sumergido. También se buscó la implementación de un protocolo de cultivo eficiente para la producción de biomasa a escala de laboratorio, con medios de cultivo económicos y de fácil adquisición.
MATERIALES Y MÉTODOS
Mantenimiento de la cepa y precultivos
La cepa de Grifola frondosa fue conservada en agar papa dextrosa (PDA) (Merck), incubada a 26 °C por 10 días y almacenada a 4° C. Luego se utilizaron inóculos de 1 cm de diámetro de micelio y agar para preparar los medios de precultivo (g/l): sacarosa, 60; KH2PO4, 2,97; peptona (Merck), 6,58; MgSO4.7H2O (Merck), 1; licor de maíz (Sigma), 15 (Cui et al., 2006); con un pH de 5,5 ± 0,1 e incubados a 100 r. p. m., 7 días a 26 °C.
Preparación del medio de cultivo y condiciones de cultivo
Se inocularon matraces de 250 ml (volumen de trabajo: 60 ml) con 2,0 ml de precultivo de G. frondosa. Los medios evaluados fueron (g/l): medio de sales (MS): KH2PO4 (Merck), 2,97; MgSO4.7H2O (Merck), 1; y medio básico (MB): MS más peptona, 6,48 y licor de maíz, 15 (Cui et al., 2006); ambos medios suplementados con 30 g/l de una de las fuentes de carbono FC1, FC2, FC3, FC4, FC5 o FC7.
Condiciones operativas de cultivo
Las condiciones de cultivo para todos los ensayos fueron: pH inicial del medio 5,5 ± 0,01, agitación constante a 100 r. p. m. (agitador orbital Alvel), temperatura de (26 ± 1) °C por 10 días de incubación a 1.700 luxes.
Determinación de biomasa
La determinación de biomasa micelial se llevó a cabo por el método del peso seco; la biomasa total obtenida de cada matraz fue filtrada y lavada con abundante agua desionizada y, finalmente, llevada a un horno de secado a 105 °C, hasta peso constante.
Cuantificación de exopolisacáridos
En la determinación de EPS, se removió el micelio por filtración y al líquido se le adicionó etanol al 95% (v/v) a 4 °C para precipitar los EPS (Tang y Zhong, 2002), con una posterior centrifugación a 2.400 r. p. m. durante 15 minutos. Los componentes insolubles fueron suspendidos en hidróxido de sodio (Merck), NaOH 1M a 60 °C durante 1 hora, y el sobrenadante fue cuantificado por el método fenol-ácido sulfúrico (FAS) (Dubois et al., 1956).
Análisis de resultados
Con base en la literatura consultada y experimentaciones previas realizadas en el laboratorio, el diseño propuesto fue un modelo factorial con dos factores: fuente de carbono (FC1, FC2, FC3, FC4, FC5 y FC7) y medio (MB y MS), con una hipótesis planteada: ambos factores tienen efecto sobre la producción de biomasa y exopolisacáridos de G. frondosa en condiciones de cultivo sumergido. Se realizaron las pruebas de ajuste al modelo (normalidad, homoce-dasticidad e independencia).
RESULTADOS Y DISCUSIÓN
- Producción de biomasa
El análisis de varianza (tabla 1) mostró que tanto el medio como la fuente de carbono influyen en la producción de biomasa micelial (p < 0,001). Además se muestra una interacción significativa entre los factores fuente de carbono y medio (p < 0,001).
En los resultados (figuras 1 y 2) se puede observar que el medio MB fue el mejor para la producción de biomasa, ya que en todos los casos se obtuvo una producción de biomasa igual o superior a 19,21 g/l, y el promedio general fue de 20,56 g/l. En el medio MS la producción, en todos los casos, fue inferior a 16,62 g/l y el promedio general fue de 12,74 g/l; de aquí se tiene que existen diferencias significativas entre ambos factores cuando se evalúa la producción de biomasa micelial. Ahora, cuando se observa la respuesta del hongo en los medios suplementados con diferentes fuentes de carbono, puede verse que en el medio MB la fuente de carbono resultó ser no significativa, con un valor máximo de (21,10 ± 0,82) g/l cuando fue suplementado con FC4; contrario a lo que sucede en el medio MS donde suplementar con diferentes FC produce diferencias bastante apreciables (figura 1). Es así como la mejor fuente de carbono para suplementar el medio MS es FC2, donde se produce (16,62 ± 0,82) g/l mientras que con la fuente de carbono FC7 sólo se produce (4,60 ± 0,82) g/l.
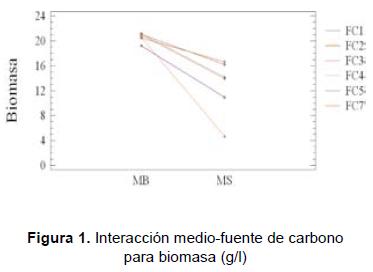
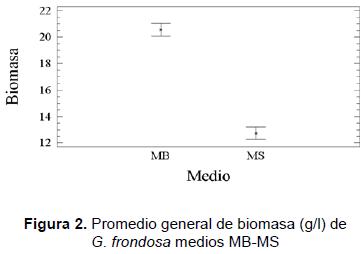
- Producción de exopolisacáridos
El análisis de varianza (tabla 2) mostró que tanto el medio de cultivo como la fuente de carbono influyen en la producción de EPS (p < 0,001). Además muestra una interacción significativa entre los factores fuente de carbono y medio (p < 0,001).
En los anteriores resultados (figuras 3 y 4) se puede observar que el mejor medio para la producción de EPS es MB, excepto cuando se suplementa con la fuente de carbono FC7. Ahora, cuando se observa la producción de EPS en ambos medios (MS y MB), el factor fuente de carbono resulta ser significativo, presentándose los mayores niveles con la fuente de carbono FC4; suplementado MB con esta fuente de carbono alcanza un valor de (6,53 ± 0,14) g/l; con un promedio general de 5,85 g/l.
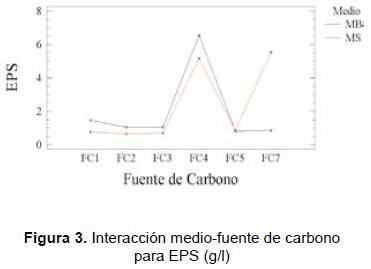
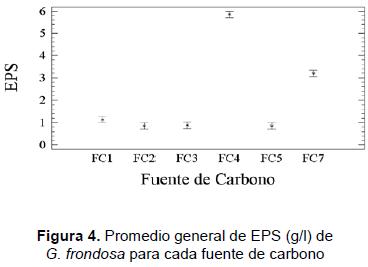
- Productividad y análisis económico
Cuando se trabaja con hongos, es necesario establecer un medio de cultivo adecuado que permita garantizar su mantenimiento y supervivencia. En general, los medios de cultivo utilizados son químicamente definidos, con cantidades conocidas de compuestos altamente purificados. Estos se diseñan con el fin de proporcionar la energía y los elementos necesarios para el crecimiento celular; por lo general, se requiere el uso de macronutrientes (fuentes de carbono, nitrógeno, fósforo, potasio, azufre y magnesio), micronutrientes (hierro, manganeso, cinc, cobre y molibdeno), factores de crecimiento (hormonas y vitaminas) y demás elementos específicos (sales con efecto tampón, antioxidantes y quelantes). Todo esto para lograr la mayor producción de biomasa o bioactivos (Lee et al., 2004; Xu et al., 2003; Cho et al., 2002; Bae et al., 2000). En la producción industrial es más útil y económico recurrir a medios complejos o de composición indefinida, donde las principales fuentes de nutrientes son cereales y subproductos derivados de la agroindustria, de animales y de microorganismos (Jaime, 2004).
Estudiar el efecto de la fuente de carbono en la producción de biomasa y bioactivos es un aspecto de relevante importancia, sin embargo, también se hace necesario desarrollar trabajos que busquen la disminución de costos en los medios de cultivo y el aumento en la producción de biomasa y metaboli-tos activos. Para el cultivo sumergido las fuentes de carbono que más se han estudiado son la glucosa, lactosa, sucrosa y maltosa (Carvajal y Rendón, 2004; Lee et al., 2003; Wagner et al., 2003); también se ha reportado el uso de celulosa, almidón; metanol, etanol; acido oléico, acido palmitoleico, aceite de oliva, aceite de soya y aceite de girasol (Yang et al., 2000; Schisler y Volkoff, 1977), siendo todos estos compuestos de alto costo y difícil adquisición para nuestro país.
En este estudio se utilizaron seis tipos de fuente de carbono para suplementar los medios MS y MB tomando como variables de respuesta la producción de biomasa y exopolisacáridos. Las fuentes de carbono utilizadas corresponden a mezclas complejas de cereales (trigo, avena, arroz), las cuales atienden los requerimientos básicos para el crecimiento del hongo, como es la fuente de carbono, vitaminas y elementos traza.
Cui et al. (2006), en su trabajo de optimización, utilizaron medio MB suplementado con glucosa y obtuvieron 22,50 g/l de biomasa y 1,32 g/l de EPS; aunque en nuestra investigación la producción de EPS fue superada sustancialmente (6,53 g/l), la producción de biomasa no fue superada (21,10 g/l); sin embargo, una comparación en términos económicos muestra que el medio MB suplementado con cualquiera de las fuentes de carbono (FC1-7) es más económico que el propuesto por Cui et al. (2006). Además, aunque los resultados obtenidos con el medio MS no son satisfactorios para la producción de biomasa (12,74 g/l), en términos de eficiencia se superan en forma notable los resultados publicados antes (tabla 3).
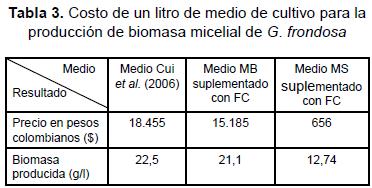
La productividad alcanzada con el medio MB suplementado con la fuente de carbono FC4 fue 0,70 g de biomasa/g de FC4, mientras que en MS es de 0,42 g de biomasa/g de FC; sin embargo, en términos de eficiencia, es evidente que MS es el medio para ser suplementado, ya que los costos de un litro de medio para la producción de biomasa y EPS son mucho menores que los reportados actualmente. Producir 1 g de biomasa en MS tiene un costo de Col $51,49; en medio MB, 1 g de biomasa tiene un costo de Col $738,57. El medio optimizado por Cui et al. (2006) tiene una productividad de 0,49 g de biomasa/ g de glucosa, sin embargo, producir cada gramo tiene un costo de Col $820. Además, el valor de EPS alcanzado en este trabajo en medio MS suplementado con FC4 fue de 5,16 g/l, superando lo obtenido con el medio optimizado de Cui et al. (2006) y acercándose a los valores reportados por Lee et al. (2003 y 2004).
La siguiente etapa de investigación estará encaminada a encontrar a qué concentraciones de las fuentes de carbono analizadas se verá favorecida la producción de biomasa, EPS y otros metabolitos de interés (intrapolisacáridos y triterpenos), los cuales también poseen actividad biológica.
CONCLUSIONES
El desarrollo del trabajo logró establecer un protocolo para la producción de biomasa y EPS del hongo medicinal Grifola frondosa en cultivo sumergido, el cual cumple con el propósito general del trabajo: disminuir costos de producción.
Luego de evaluar cada uno de los medios y de las fuentes de carbono, se tiene que usando el medio MB suplementado con la fuente de carbono FC4, con las condiciones operativas trabajadas, se obtienen producciones óptimas de biomasa y de EPS a partir del cultivo sumergido de Grifola frondosa, reduciendo el costo del medio en un 17,72%, valor que puede llegar a ser muy apreciable cuando se piensa en llevar el proceso a una escala piloto o industrial.
No obstante, es de anotar que, aunque el medio MS no presentó altos valores en la producción de biomasa micelial comparado con los reportes actuales o comparado con el medio MB, se puede concluir que cultivando el hongo en el medio MS suplementado con la fuente de carbono FC4 se consigue el objetivo de disminuir los costos de producción de biomasa y EPS de manera ostensible, ya que se reduce el precio del medio de Col $18.455 a Col $656, lo que representa una reducción del 96,45%.
Estos resultados abren una nueva puerta para el desarrollo de productos a partir de Grifola frondosa, ya que si el proceso es escalado en planta piloto o industrial, se podrían abastecer las necesidades de la industria nacional, generando alimentos, fitote-rapéuticos y cosméticos funcionales de bajo costo para el tratamiento o prevención de enfermedades de alto costo; y en un futuro se podrían alcanzar los mercados internacionales con productos de alto valor agregado con costos razonablemente competitivos.
AGRADECIMIENTOS
Esta investigación fue realizada gracias al apoyo científico, logístico y financiero de los grupos de Biotecnología y Biotecnología Vegetal, Sede de Investigación Universitaria (SIU), Universidad de Antioquia. Expresamos nuestros agradecimientos por el apoyo científico e instrumental que nos brindó el Grupo de Sustancias Bioactivas, Sede de Investigación Universitaria, Universidad de Antioquia.
BIBLIOGRAFÍA
Bae J. T.; Sinha J.; Park J. P.; Song C. H. and Yun J. W. 2000. Optimization of submerged culture conditions for exo-biopolymer production by Paecilomyces japónica. Journal of Microbiology and Biotechnology, 10, 482-487. [ Links ]
Carvajal D. y Rendón L. 2004. Evaluación de la producción de exopolisacáridos en fermentación sumergida a partir de Ganoderma lucidum. Trabajo de grado. (Ingeniería de Procesos). Universidad Eafit, Medellín. Colombia. [ Links ]
Cho Y. J.; Hwang H. J.; Kim S. W.; Song C. H. and Yun J. W. 2002. Effect of carbon source and aeration rate on broth rheology and fungal morphology during red pigment production by Paecilomyces sinclairii in a batch bioreactor. Journal of Biotechnology, 95, 13-23. [ Links ]
Choi H. S.; Cho H. Y.; Yang H. C.; Ra K. S. and Suh H. J. 2001. Angiotensin I-converting enzyme inhibitor from Grifóla frondosa. Food Research International, 34, 177-182. [ Links ]
Cui F. J.; Li Y.; Xu Z. H.; Xu H. Y.; Sun K. and Tao W. Y. 2006. Optimization of the medium composition for production of mycelial biomass and exo-polymer by Grifola frondosa GF9801 using response surface methodology. Bioresource Technology, 97, 1209-1216. [ Links ]
Dubois M.; Gilles K.; Hamilton J.; Rebers P. and Smith F. 1956. Colorimetric method for determination of sugar and related substances. Analytical Chemistry, 28, 350-356. [ Links ]
Hsieh C.; Liu C. J.; Tseng M. H.; Lo C. T. and Yang Y. C. 2006. Effect of olive oil on the production of mycelial biomass and polysaccharides of Grifola frondosa under high oxygen concentration aeration. Enzyme and Mi-crobial Technology, 39, 434-439. [ Links ]
Jaime L. 2004. Página de docencia Universidad Autónoma de México. Fermentaciones alimentarias. Sustratos y medios de cultivos utilizados en las fermentaciones alimentarias. En. http://www.uam.es/personal_pdi/ciencias/ljaime/tema4fa.pdf. Fecha de consulta: 5 de septiembre de 2006. [ Links ]
Lee B. C.; Bae J. T.; Pyo H. B.; Choe T. B.; Kim S. W.; Hwang H. J. and Yun J. W. 2003. Biological activities of the polysaccharides produced from submerged culture of the edible Basidiomycete Grifola frondosa. Enzyme and Microbial Technology, 32, 574-581. [ Links ]
Lee B. C.; Bae J. T.; Pyo H. B.; Choe T. B.; Kim S. W.; Hwang H. J. and Yun J. W. 2004. Submerged culture conditions for the production of mycelial biomass and exopolysac-charides by the edible Basidiomycete Grifola frondosa. Enzyme and Microbial Technology, 35, 369-376. [ Links ]
Matsui K.; Kodama N. and Nanba H. 2001. Effects of mai-take (Grifola frondosa) D-fraction on the carcinoma angiogenesis. Cancer Letters, 172, 193-198. [ Links ]
Schisler L. C. and Volkoff O. 1977. The effect of safflower oil on mycelial growth of Boletaceae in submerged liquid cultures. Mycologia, 69, 118-125. [ Links ]
Smith J.; Rowan N. and Sullivan R. 2002. Medicinal mushrooms: their therapeutic properties and current medical usage with special emphasis on cancer treatments. Cancer Research. University of Strathclyde. UK. [ Links ]
Tang Y. and Zhong J. 2002. Fed-batch fermentation of Ganoderma lucidum for hyperproduction of polysac-charide and ganoderic acid. Enzyme and Microbial Technology, 31, 20-28. [ Links ]
Wagner R.; Mitchell D. A.; Sassaki G. L.; Amazonas M. A. L. and Berovic M. 2003. Current techniques for the cultivation of Ganoderma lucidum for the production of biomass, ganoderic acid and polysaccharides. Food Technology and Biotechnology, 41, 371-382. [ Links ]
Xu C. P.; Kim S. W; Hwang H. J.; Choi J. W. and Yun J. W. 2003. Optimization of submerged culture conditions for mycelial growth and exo-biopolymer production by Paecilomyces tenuipes C240. Process Biochemistry, 38, 1025-1030. [ Links ]
Yang F. C.; Ke Y. F. and Kuo S. S. 2000. Effect of fatty acids on the mycelial growth and polysaccharide formation by Ganoderma lucidum in shake flask cultures. Enzyme and Microbial Technology, 27, 295-301. [ Links ]














