Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista EIA
Print version ISSN 1794-1237On-line version ISSN 2463-0950
Rev.EIA.Esc.Ing.Antioq no.7 Envigado Jan./June 2007
OBTENCIÓN DE DEXTRANO Y FRUCTOSA, UTILIZANDO RESIDUOS AGROINDUSTRIALES CON LA CEPA Leuconostoc mesenteroides NRRL B512-F
Olga Viviana Rodríguez*, Henry Hanssen**
* Departamento de Ingeniería Química, Facultad de Ingenierías, Universidad de América. vja-gua@gmail.com
** Magíster y Ph.D. en Biología Director Departamento de Investigación, Universidad Sergio Arboleda, Docente investigador Universidad Autónoma de Colombia. hhanssen22@yahoo.com.
El profesor Henry Hanssen falleció en enero de 2007, por lo cual, desde entonces, el artículo quedó a cargo de la ingeniera Olga Viviana Rodríguez.
Artículo recibido 6-XII-2006. Aprobado 21-VI-2007
Discusión abierta hasta diciembre de 2007
RESUMEN
Debido al gran potencial biotecnológico que presentan los residuos agroindustriales, se desarrolló el presente trabajo para la obtención de oligosacáridos, utilizando como materia prima residuos de cascaras de naranja, piña y cachaza de caña panelera, a escala de laboratorio. Por medio de un diseño experimental se evaluó la concentración y tipo de sustrato y la temperatura del proceso con tres niveles, para lograr la mayor producción. El desarrollo experimental se llevó a cabo con un volumen de 100 mL y 250 mL. En la etapa final se obtuvo como resultado una producción de 3,4 g/L de dextrano y 5,04 g/L de fructosa, utilizando como sustrato cascaras de naranja con estas condiciones: temperatura de 30 °C y concentración de sustrato de 20 g/L; durante el proceso se midieron el consumo de sustrato y la concentración de biomasa y productos. Se observó el desarrollo del microorganismo con los sustratos empleados en la experimentación, sin adición de nutrientes, con una adaptación favorable a éstos. Finalmente, se realizó una caracterización preliminar del polímero obtenido, con lo que se concluyó que puede obtenerse dextrano de grado técnico para su uso como espesante en la industria de alimentos y en el área de tratamiento de aguas residuales como floculante.
PALABRAS CLAVE: residuos agroindustriales; biopolímero; dextrano; fructosa; Leuconostoc mesenteroides.
ABSTRACT
Due to biotechnological potential that presents the agro-industrial remainders, the present work was developed about obtaining oligosaccharides using like raw material remainders of orange peels, pineapple peels, and panelera cane slowness, at level laboratory. An experimental design was used to evaluate type and concentration of substrate and process temperature at three levels, accordingly the greatest amount of dextran and fructose produced. All volumes worked were 100 mL and 250 mL. In the final phase, the result was a production of dextran 3.4 g/L and fructose 5.04 g/L, using orange peels as substrate, temperature at 30 °C and concentration of substrate of 20 g/L, determining for each sample: consumption of substrate, biomass, and amount of products. The growth of the microorganism was observed; correspondingly to a substrate without addition of nutrients with a favorable adaptation at medium supplied. Finally, an experimental characterization was developed, and it was concluded that technical grade dextran can be obtained used in food like thicker and waste water treatment.
KEY WORDS: agro-industrial remainders; biopolymers; dextran, fructose, Leuconostoc mesenteroides.
INTRODUCCIÓN
Los productos obtenidos a partir de fuentes reciclables, tales como los residuos agroindustriales, han merecido un interés creciente, debido a que permiten aminorar el impacto ambiental y los costos en el tratamiento y disposición de dichos residuos en las industrias [7]. Un ejemplo de estos productos son los polisacáridos o biopolímeros.
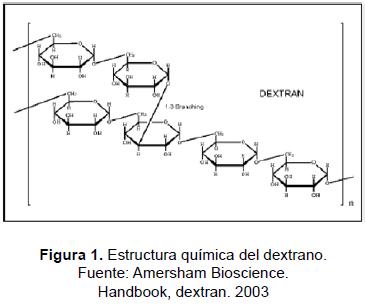
El dextrano es un polisacárido de alto peso molecular, compuesto de unidades de D-glucosa unidos mediante enlaces glucosídicos α-(1-6) (figura 1); son estructuralmente diversos y se caracterizan de acuerdo con el porcentaje, naturaleza y distribución de sus enlaces. El dextrano se produce generalmente en cultivos de bacterias lácticas como Streptococcus, Acetobacter o Leuconostoc, en medios que contienen sacarosa; las células en crecimiento secretan una enzima inducible llamada dextransucrasa que convierte el exceso de sacarosa hidrolizándola en dextrano y liberando fructosa al medio [21]. Fue aislado por primera vez en 1906 por Scheiber, y su principal aplicación radicó en el área farmacéutica como expansor del volumen del plasma sanguíneo y promotor del flujo de sangre [4]. El dextrano puede ser hidrolizado a azúcares simples como glucosa, isomaltosa, etc. por enzimas dextranasas producidas por microorganismos del género Penicillium y Verticillium.
Durante la generación de dextrano se obtiene a su vez fructosa; ésta representa una fuente de energía aprovechable. Como edulcorante la fructosa es un monosacárido de fácil absorción y rápida asimilación que proporciona una dosis balanceada de calorías en bebidas y alimentos. En la industria de la confitería posee propiedades humectantes y anti-cristalizantes, manteniendo la humedad y retardando el resecamiento del producto final [18]. La fructosa también tiene un gran potencial como material intermedio en la manufactura de 5-hidroximetil furfural (HMF) por inducción ácida; el HMF se ha usado en la producción de resinas fenólicas especiales y de una serie de polímeros furánicos [11].
La síntesis de dextrano se realiza por fermentación bacteriana o enzimática. El microorganismo empleado es Leuconostoc mesenteroides de las cepas NRRL B-512F, 512 y B1299; sólo con la cepa B-512F se produce dextrano a escala industrial, a partir de sacarosa comercial [19]. El sustrato más comúnmente empleado es la sacarosa en concentraciones aproximadas de 5%; y en fermentación enzimática puede ser hasta más o menos 20% y se obtiene una concentración de dextrano de 20 g/L. Han sido pocos los estudios referidos al uso de otros sustratos para la producción de polisacáridos; el centro de investigación biotecnológica de Irán realizó una investigación sobre la producción de dextrano a partir de fuentes económicas del país, como melazas de remolacha azucarera y extracto de salvado de trigo, y logró una concentración de 9,44 g/L de dextrano [3]. En 1996 Lopretti et al. realizaron un proyecto sobre la valorización de residuos para la generación de productos de alto valor agregado, entre ellos los polisacáridos, utilizando agua de coco, jugo de cáscaras de piña, naranja, mandarina, uvas, entre otros, con concentraciones entre 2,5 g/L y 8 g/L de dextrano [15].
El presente proyecto evalúa el uso de residuos de naranja, piña y cachaza de caña panelera que presentan un contenido entre 2% y 5% de sacarosa, para la producción simultánea de dextrano y fructosa mediante una bacteria láctica. Se realiza una evaluación fisicoquímica y un procedimiento para el pretratamiento de cada uno de los sustratos trabajados y una caracterización preliminar del polímero obtenido.
MATERIALES Y MÉTODOS
Selección y tratamiento de los residuos
La selección de los residuos se realizó de acuerdo con los siguientes criterios: baja utilización en otros procesos, alto volumen contaminante y facilidad en su adquisición para el desarrollo del trabajo.
De la caracterización fisicoquímica realizada previamente a cada residuo, se decidió trabajar con cáscaras de naranja, piña y cachaza de caña panelera, dado que presentaron un contenido de sacarosa en un valor alrededor del 2% al 5%, concentración adecuada para la fermentación.
Para cada sustrato se determinaron las siguientes propiedades: porcentaje de sacarosa y grados Brix (refractometría, AOAC 22.024/84.932/90), porcentaje de azúcares reductores (método colorimétrico DNS, [16]), pH ([5]), porcentaje de proteína (método Kjeldahl [5]), trazas minerales (absorción atómica, NTC 4808), cenizas (AOAC 7.009/84,942.05/90 [1]), acidez total (AOAC 31.231/84,942.15/90 [1]), humedad y materia seca (AOAC 7.003/84,930.15/90 [1, 5]) y carga microbiana (Guías Microb. Amb, FUAC). Para cada muestra evaluada se realizó un pretratamiento de decoloración (NTC 5146, AOAC 22.082/84.925.36/90) para evitar interferencia en las mediciones.
Se emplearon muestras representativas de residuos frescos. Cada uno de ellos por separado fue lavado, molido y filtrado para la extracción de los jugos de proceso; a continuación fueron pasteurizados, para garantizar una reducción sustancial de los microorganismos competidores para L. mesenteroides y la preservación del contenido de azúcares. Un diagrama del pretratamiento se presenta en la figura 2.
Microorganismo y condiciones de crecimiento
El microorganismo empleado para este estudio fue Leuconostoc mesenteroides NRRL B512-F, bacteria Gram positiva, quimiorganotrófica y aerobia facultativa. Su morfología es principalmente esférica y se encuentran en pares o cadenas cocos [13]. La especie mesenteroides produce glucosiltransferasas extracelulares, las cuales sintetizan dextrano y polímeros afines por división de la sacarosa y transferencia del grupo glucosídico a la cadena inicial de polímero, liberando fructosa como subproducto de la síntesis [8]. La cepa fue suministrada por el Instituto de Biotecnología de la Universidad Nacional Autónoma de México (IBT, Morelos). Fue liofilizada y posteriormente resuspendida y conservada en una solución de glicerol al 20% a -20 °C. Luego de la activación, se realizaron subcultivos en tubos Eppendorf (1,5 mL), que dieron origen a los preinóculos. El crecimiento fue monitoreado mediante el método de peso seco [12].
El medio estándar para su activación y mantenimiento presentó la siguiente composición (medio LM): glucosa (2%), extracto de levadura (20 g/L), K2HPO4 (20 g/L), MgSO4.7H2O (0,2 g/L), CaCl2.2H2O (0,05 g/L), FeSO4 (0,01 g/L), MnSO47H2O (0,01 g/L), NaCl (0,01 g/L) (Munguía Canales, IBT, envío electrónico, 2005). El pH del medio fue ajustado a 6,7 con H3PO4 y NaOH (0,1 N). Los cultivos fueron incubados en matraces a 27 °C en condiciones aerobias en un agitador orbital a una velocidad de 150 r. p. m.
Preinóculo e inoculo
Para el desarrollo del inoculo, se preparó previamente un preinóculo en caldo LM, el cual se esterilizó a 15 psig durante 15 minutos; esta preparación consistió en tomar "dos asadas" de una suspensión de células incubadas a 27 °C por 24 horas y añadirlas al preinóculo consistente en 10 mL de caldo LM estéril incubando a 30 °C de 18-20 horas.
A partir del preinóculo se preparó el inóculo con el jugo previamente tratado y pasteurizado correspondiente a cada montaje. La inoculación se realizó a partir de 5 mL de preinóculo y se incubó a una temperatura de 30 °C, agitación de 150 r. p. m. y un tiempo de 12-18 horas, verificando el crecimiento celular.
De acuerdo con lo arrojado en la fase preex-perimental, el período de incubación del inóculo fue de 12 horas, tiempo en el cual el cultivo se encuentra en la parte final de la fase exponencial de crecimiento correspondiente a una concentración de células de 105 unidades formadoras de colonia (UFC)/mL. Este valor se fijó para facilitar la reproducibilidad de los ensayos.
Pruebas preliminares
Para estudiar el comportamiento del microorganismo, el efecto de la concentración de sacarosa, la temperatura y otras variables durante el transcurso de la fermentación, se requiere evaluar dichos factores interactuando simultáneamente para observar si pueden afectar o no la conversión de sacarosa a dextrano y fructosa.
Para ello se realizó una selección preliminar de las variables más significativas, con el fin de determinar no sólo la producción de dextrano, sino el crecimiento del microorganismo en sustratos no convencionales. Se realizaron fermentaciones en condiciones aerobias, empleando distintas condiciones, en donde se observa la cantidad de polímero producido y el crecimiento celular. Las variables evaluadas en la fase preliminar fueron: concentración de sustrato, para establecer los niveles del diseño; pH, que es importante, ya que el crecimiento del microorganismo es satisfactorio con valores de pH entre 5 y 7 por tratarse de una bacteria láctica; adicionalmente, la producción intrínseca de polímero está dada por la cantidad de enzima que se secrete al medio y ésta es estable a valores entre 5 y 6,7, se realizaron pruebas con valores entre 5,5 y 6.7, ajustando el pH con H3PO4 concentrado y NaOH 0,1 N; la temperatura, debido a que la estabilidad de la enzima se presenta a valores de 32 °C y el microorganismo es una bacteria mesófila; para realizar las pruebas se seleccionó un intervalo de 20-35 °C, valor último de confirmación del rango.
Diseño experimental
Se evaluaron tres variables (concentración de sustrato, tipo de sustrato y temperatura), cada uno con tres niveles (bajo, medio y alto), para la producción de dextrano y fructosa por L. mesenteroides. Se eligió un diseño de tipo factorial con dos factores independientes y sus variables de respuesta. Debido a que se trabajaron tres sustratos diferentes, se realizó un diseño de dos factores para cada uno; en esta fase se efectuaron 27 fermentaciones por sustrato, las cuales se llevaron a cabo por triplicado para un total de 243 ensayos. Cada unidad experimental fue repartida en grupos de 9, que diferían en su nivel de temperatura; se trabajó en operación discontinua (por lotes) en un agitador orbital con control de temperatura, un volumen útil de 100 mL de medio y con estas condiciones estándar: 150 r. p. m., pH inicial 6,7, condiciones aerobias y tiempo de fermentación de 18 horas. Se tomó muestra inicial y final evaluando biomasa, cantidad de polímero, fructosa y consumo de sustrato residual.
Producción de dextrano y fructosa por fermentación por lotes
El medio de cultivo empleado fue jugo de cáscaras de naranja; se pasteurizó dentro de matraces de 250 mL que contenían 100 mL de medio, a 70 °C durante 10 minutos, de conformidad con los resultados obtenidos en la fase preliminar.
Para el sistema de fermentación, una vez alcanzada la temperatura de incubación (30 °C), se inoculó con 10 mL del inóculo, preparado con L. mesenteroides [105 UFC/mL]. El pH inicial de las fermentaciones fue de 6,7 (resultado de fase preex-perimental) ajustado con H3PO4 y NaOH 0,1 N, y la velocidad de agitación fue de 150 r. p. m. [12, 15, 23]. Se tomaron muestras cada dos horas con un volumen de 10 mL. A cada muestra se le realizó análisis de biomasa, dextrano, fructosa y sacarosa residual.
Análisis estadístico
Los resultados de las variables de respuesta fueron sometidos a análisis de varianza para el diseño factorial. Adicionalmente se realizaron pruebas de medias para observar las diferencias entre los tratamientos establecidos usando la prueba LSD.
En los casos en los cuales los análisis de varian-za permitieran identificar efectos significativos en las variables evaluadas en los tratamientos, se realizaron análisis de regresión lineal para obtener ecuaciones que describieran los datos experimentales. Para los análisis se emplearon los paquetes estadísticos Statgraphics, Minitab y Statistix. Todos los análisis se realizaron con un nivel de confianza del 95%.
Determinación de biomasa
L a concentración de biomasa se expresó como peso seco (g/L) de células totales (muertas y vivas) por unidad de volumen. Para su determinación se utilizó la técnica turbidimétrica con mediciones de absorbancia en un espectrofotómetro (Genesys 20D) a 600 nm (Monsan, 1997, [8]) y se convirtió con una curva estándar que relaciona la masa celular (peso seco) con la absorbancia de la muestra.
Determinación de sacarosa residual
El consumo de sacarosa se llevó a cabo usando refractometría (método AOAC 22.024/84.932/90), con las muestras clarificadas para evitar interferencia en el valor obtenido. Se empleó este método con una curva estándar que relaciona la concentración de sacarosa con el índice de refracción (medido a 20 °C).
Determinación de fructosa
Se utilizó el método colorimétrico resorcinol-tiourea (Epstein y Goldstein, 1962, [20]), aprovechando la reacción que ocurre entre la hexosa y el resorcinol, que genera un compuesto de color púrpura que absorbe luz a una longitud de onda de 510 nm.
Determinación de dextrano
La determinación de dextrano se realizó por el método gravimétrico. Consiste, primero, en la separación del polímero del medio de cultivo por centrifugación; el sobrenadante se precipita con una relación 1:1 de etanol (96%) y se decanta de 12-24 horas. Se centrifuga la solución (15.000 x 5 min) [18] y el pellet obtenido se seca dentro del tubo (tarado previamente) a una temperatura de 55 °C en presencia de vacío hasta peso constante. La cuantificación del polímero se realiza por diferencia de pesos con el peso inicial del tubo tarado [13, 21].
Caracterización del polímero
Caracerización química. El polímero se somete a un proceso de hidrólisis ácida con ácido clorhídrico (2 N) a 80 °C. Para efectuar la hidrólisis se tomaron 0,5 mL de muestra a partir de una solución al 1% del polímero y se agregó ácido clorhídrico. Finalmente, se determina la concentración del componente principal por el método de glucosa oxidasa [6].
Determinación de grupos funcionales por espectroscopia de infrarrojo (FTIR). Estas pruebas se realizan con el fin de determinar los grupos funcionales presentes en la muestra y así identificar el tipo de compuesto obtenido. Los ensayos se realizaron en un equipo de espectroscopia de infrarrojo (FTIR) Paragon 500, serie 1000 de Perkin Elmer, colocando las muestras en pastillas de KBr. Las muestras que se utilizaron para la realización del ensayo corresponden al polímero obtenido a partir de los sustratos jugo de piña y naranja. El material fue previamente desecado.
Evaluación del peso molecular por viscosimetría de capilar. Cuando el polímero es poco polidisperso, Mv (peso molecular promedio viscosimétrico), corresponde aproximadamente a Mw (peso molecular promedio en peso). Para el cálculo del peso, se utiliza la ecuación de Mark-Houwink [η] = KMa, que correlaciona la viscosidad intrínseca del polímero con el peso molecular promedio en masa de dicho polímero: K y a son las constantes de Mark-Houwink y dependen del polímero, del disolvente y de la temperatura a la cual se realiza el ensayo, y η es la viscosidad intrínseca del polímero [9].
DISCUSIÓN DE RESULTADOS
De acuerdo con los resultados obtenidos en la caracterización fisicoquímica, resumida en la tabla 1, se pudo determinar que los residuos presentaban proporciones de sacarosa (2-5%), proteína y trazas minerales, que justificaban su aprovechamiento sin necesidad de adición de nutrientes, como fuente para la producción de los oligosacáridos.
Fase preliminar
Se realizaron 6 fermentaciones en operación discontinua evaluando las variables establecidas en el diseño experimental, haciendo seguimiento a la concentración de sustrato, pH inicial y temperatura de proceso; se observó una adaptación del microorganismo a los diferentes sustratos evaluados, por medio de la curva de crecimiento. Dado que la fructosa es un producto formado a partir de la polimerización del dextrano en el medio de cultivo [8], sólo se tomó la concentración de dextrano como parámetro respuesta en los estudios preliminares; los datos obtenidos durante esta etapa preliminar se muestran en el figura 4.
Estos ensayos preliminares permitieron seleccionar las siguientes condiciones y rangos de operación del diseño en la fase experimental. El valor de pH inicial del medio arrojó buenos resultados cerca de la neutralidad (6,5-7,0), similar a lo reportado con los medios a base de sacarosa comercial, donde el valor óptimo de crecimiento celular se encuentra en 6,9 [21, 24]; la mayor producción de polímero sobre cada sustrato fue en promedio de 0,575 g/L ajustando el medio en un valor de 6,7, el cual fue seleccionado para la siguiente fase. La temperatura también fue un factor clave; los resultados mostraron que a una temperatura de 25 °C se lograba una concentración promedio de polímero de 0,666 g/L y una concentración celular de 3,2 g/L. Se decidió trabajar dentro de la zona óptima de crecimiento de L. mesenteroides (20-30 °C).
En cuanto a la concentración de sustrato en el medio, se obtuvo con cada sustrato un valor promedio de 0,402 g/L de polímero a una concentración de 30 g/L. Se seleccionaron niveles entre la concentración mínima requerida por el microorganismo de acuerdo con la fase preliminar, ya que, aunque existió producción de dextrano en baja concentración, el crecimiento celular observado fue muy pobre, lo que se corroboró en la revisión bibliográfica [3, 21, 24]. La concentración máxima fue la de cada sustrato, para aprovechar sus propiedades. Los niveles y variables seleccionadas según los resultados obtenidos en esta etapa se describen en la tabla 2.
Análisis estadístico
De acuerdo con el análisis estadístico realizado a los tratamientos, la temperatura tuvo un efecto significativo (p > 0,05) sobre la producción de dextrano y fructosa. Caso similar sucedió con la concentración de sacarosa inicial (p>0,05), que presentaba en ciertos tratamientos un efecto positivo para la producción mientras que las combinaciones de 22 °C y concentraciones altas (>30 g/L) presentaban una disminución sustancial. Este fenómeno del efecto de la concentración de sacarosa fue notorio en los ensayos realizados con cachaza de caña en su nivel superior (108 g/L); los valores por encima del 5-10% son elevados para llevar a cabo la fermentación con el microorganismo, debido a que éste no se desarrolla de manera efectiva en medios que contienen concentraciones mayores a 10-25% de sacarosa (figura 5).
Los análisis mostraron que los experimentos que presentaban un aumento en la temperatura del proceso, como los sustratos piña y naranja, aumentaban de igual forma el crecimiento celular y disminuían levemente la producción de dextrano, siguiendo una tendencia lineal significativa; esto indica que la concentración de los productos aumentó con el incremento en la temperatura en el rango establecido de trabajo para los tres sustratos en general; caso contrario ocurrió con la cachaza, cuyo comportamiento no presentó un ajuste satisfactorio, probablemente debido a su difícil manejo por ser un residuo con alto contenido de partículas en suspensión y un color oscuro.
Para establecer una comparación con los resultados obtenidos usando como sustrato la cachaza, no se encontraron criterios, ya que en la revisión bibliográfica no se hallaron artículos relacionados con su uso como sustrato de fermentación para la obtención de polisacáridos; sin embargo, se pudo observar un crecimiento celular y una producción de dextrano y fructosa en cachaza; aunque inferior a los otros dos sustratos, fue significativo, y eso lo posiciona como un sustrato interesante de estudio y establece la necesidad de buscar técnicas más sensibles para su medición.
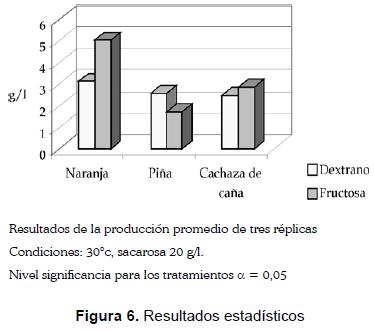
Los resultados descritos permitieron seleccionar el ensayo en el cual se trabaja con una concentración de 20 g/L y una temperatura de 30 °C. Como se observa en la figura 6, el sustrato que mayor concentración de productos generó fue el jugo de cáscaras de naranja, con un valor de 3,4 g/L de dextrano y 5,04 g/L de fructosa.
Cinética de fermentación
Con respecto a la cinética del proceso, en la figura 7 se muestra el comportamiento de la biomasa; se observó una fase de adaptación con un tiempo de duración de unas 6 horas. Este resultado es comparable con los descritos en los trabajos de Tsuchiya et al. [24] y Lopretti [15], quienes encontraron un crecimiento similar utilizando un tiempo de residencia de 24 horas, donde la fase de adaptación fue de 6-8 horas en sustratos como piña y naranja. En la etapa preliminar, se logró disminuir este tiempo, realizando los inóculos en los sustratos correspondientes.
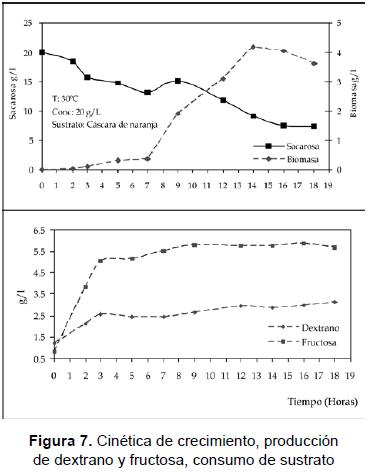
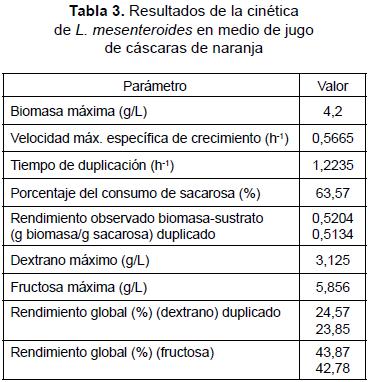
La fase logarítmica se prolongó durante 7 horas, exhibiendo un rápido crecimiento y agotando parte de la sacarosa antes de entrar a la fase estacionaria desde la hora 14 hasta la 18, cuando se observó la zona de máximo consumo mientras los metabolitos continuaban aumentando levemente en el medio. Este comportamiento puede describirse como un proceso con generación de metabolitos primarios que están parcialmente asociados al crecimiento celular y se dan luego de que las células han alcanzado su madurez [22]. La biomasa máxima fue de 4,2 g/L correspondiente a 1,15 x 109 UFCmL después de 15 horas de fermentación, y el dextrano y fructosa alcanzan su máxima concentración a las 17 horas con 3,125 y 5,678 g/L respectivamente. En comparación con los ensayos de la fase experimental, la biomasa fue de 3,6 gL en la hora 19 con una cantidad de dextrano máxima de 3,4 g/L y fructosa 5,04 en la hora 20.
Al igual que la cinética de crecimiento, la cinética de consumo de sacarosa presenta dos zonas bien definidas desde la hora 0 hasta la hora 10, que muestra un descenso en la concentración, y se observa un pico y una segunda fase desde la hora 10 hasta la hora 18, cuando el consumo de la sacarosa se hace más pronunciado debido al consumo doble entre el microorganismo y la enzima libre que polimeriza en el medio. El comportamiento del pH indicó una producción de metabolitos generados por el microorganismo, podría ser en una proporción de ácido láctico y otros compuestos que acidificaron el medio, como se describe en la literatura, tratándose de una bacteria láctica cuya ruta metabólica es he-terofermentativa; el valor de pH de 4,7 fue el final de la fermentación; este valor no es muy adecuado para la producción del polímero, ya que la enzima se inhibe a valores de pH bajos entre 5 y 4,5 [10]. La producción de dextrano con respecto al tiempo presentó un comportamiento lineal al igual que la fructosa; el rendimiento global fue de 24,57% para dextrano y 43,87% para fructosa. El rendimiento de biomasa en sustrato fue de 0.5204 g biomasa/g sacarosa. Los resultados obtenidos durante la evaluación de la cinética del proceso, usando como condiciones las seleccionadas en el diseño experimental se resumen en la tabla 3.
Caracterización preliminar del polímero
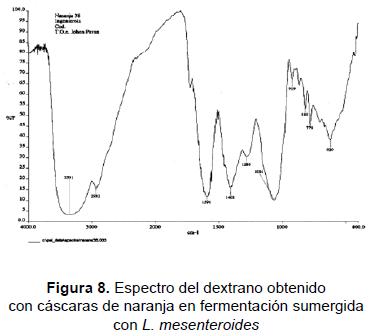
La caracterización preliminar del polímero se realizó con el objeto de conocer cuáles podrían ser sus aplicaciones potenciales. Se comprobó al realizar las pruebas con glucosa oxidasa que el producto obtenido presentaba concentraciones significativas de glucosa luego de la hidrólisis, marcando positivo para este compuesto. Posterior a la identificación química, se llevó a cabo un análisis de los grupos funcionales presentes en el compuesto por espectroscopia de infrarrojo (FTIR), esperando que arrojara algún resultado que permitiera analizar su estructura. Según el procedimiento, como la muestra no fue purificada completamente, se presentó un aumento en la longitud de los grupos OH debido a la presencia de otras sustancias orgánicas que contribuyen con dichos enlaces. En las bandas de absorción obtenidas se observó la similitud en los picos 3300, 2900 y 1020 nm-1 para los materiales poliméricos dándonos una aproximación a su estructura (figura 8).
Se realizaron cálculos para la aproximación de su peso molecular, característica esencial para determinar su uso. Se utilizó la ecuación de Mark-Houwink [9], que correlaciona la viscosidad intrínseca del polímero con su peso molecular promedio en masa. Se pudo llegar a un peso de 1 ´336.954,567 Da (mol/g), resultado muy similar al reportado en la literatura dentro de un rango que oscila entre 150.000 y 2´000.000 [2]. El dextrano obtenido con este peso molecular es apto para la industria de alimentos como aditivo y viscosante, y es factible de hidrolizar para obtener dextrano de peso molecular menor para uso en biología molecular y productos farmacéuticos [15].
CONCLUSIONES
En términos generales, se demostró que es posible obtener dextrano y fructosa en todos los sustratos evaluados. En el análisis fisicoquímico, los resultados mostraron para cada sustrato concentraciones por encima de 20 g/L de sacarosa, característica adecuada para llevar a cabo el proceso de fermentación sin necesidad de adición de nutrientes como sacarosa u otra fuente de carbono. Lo anterior convierte los residuos en una fuente potencial para el surgimiento de investigaciones encaminadas a su aprovechamiento.
Un factor importante en la producción y el crecimiento bacteriano fue la temperatura de proceso. Se observó que la temperatura cercana al rango mesófilo incrementó tanto la producción de dextrano y fructosa como el crecimiento celular; este factor se constituye en una limitante del proceso, debido a que un exceso o disminución de temperatura condiciona la óptima producción y subsiguiente liberación de enzima al medio para la polimerización de dextrano. Según los resultados encontrados en los ensayos preliminares y en la fase final, se observó que el mejor sustrato acorde con las condiciones nutricionales y con el cual se presentó un comportamiento satisfactorio del microorganismo es el jugo de las cáscaras de naranja, el cual logró el mejor rendimiento.
La cinética de generación de producto presentó un comportamiento similar al de la biomasa. El tiempo en el que se logra una concentración máxima de dextrano en el medio coincide con el máximo valor de biomasa obtenido, lo que indica que es un producto asociado parcialmente al crecimiento celular. La literatura reporta que la obtención de dextrano es enzimática y su generación es notoria en una etapa madura de las células; durante la experimentación se observó presencia de dextrano en el inóculo, lo cual sugiere una concentración de enzima temprana en el medio. Por ello en la etapa primera del proceso, que coincide con la fase de adaptación del microorganismo, existe una concentración de dextrano inicial; esto es consecuente con lo reportado por Tsuchiya et al. [24], los cuales mostraron que el proceso se basa en la producción de una enzima excretada al medio.
Considerando la complejidad de los sustratos utilizados, adicional al pretratamiento mecánico, sería un buen objeto de estudio realizar un procedimiento de degradación biológica para eliminar los compuestos que puedan interferir en el proceso, inhibiendo o disminuyendo la actividad de la enzima dextransucrasa para la producción de polímero, como las proteasas presentes en los residuos de piña, o interfiriendo en las mediciones de caracterización del producto como la pectina, compuesto presente en los residuos de naranja.
En resumen, son pocos los esfuerzos encaminados al aprovechamiento de residuos y material biodegradable para la producción de insumos químicos útiles para la industria nacional. Sin embargo, los resultados de esta investigación ratificaron la viabilidad de la obtención de polisacáridos de interés industrial a partir de residuos poco utilizados y poco tenidos en cuenta para su explotación, observándose una producción satisfactoria, en escala de laboratorio, que podría representar una disminución en los costos de consecución de materias primas para los bioprocesos.
AGRADECIMIENTOS
Agradecemos al Instituto de Genética de Poblaciones de la Universidad de los Andes (doctores Mauricio Linares y Natalia Giraldo), y al Laboratorio de Microbiología Ambiental de la Universidad Autónoma de Colombia por permitirnos el desarrollo experimental de esta investigación. Al ingeniero Álvaro Bermúdez por sus asesorías en análisis estadístico y sus oportunos aportes, al ingeniero David Rodríguez por su motivación y confianza y a la bacterióloga Estela Aguirre por su incondicional apoyo y aportes en el área microbiológica. Esta investigación va dedicada a la memoria del tutor y maestro doctor Henry Hanssen Villamizar (q. e. p. d.), cuyo empeño y constancia lograron impulsar este trabajo.
REFERENCIAS
1. Association of Official Analytical Chemist. Official methods of analysis of AOAC Inc. 14 ed., Arlington: AOAC., 1984. [ Links ]
2. Alsop, R. Industrial production of dextrans. Progress in industrial microbiology, 18, 1-44, 1983. [ Links ]
3. Behravan, Javad; Sedigheh, B. and Zohreh, Salimi. Optimization production by Leuconostoc mesenteroides NRRL B-512 using cheap and local sources of carbohydrate and nitrogen. Biotecnhol Appl. Biochem. 38:267-269, 2003. [ Links ]
4. Belder, A. N. Dextran, Handbook. Amersham Biosciences, 2003. [ Links ]
5. Bernal de Ramírez, Inés. Análisis de alimentos. Academia Colombiana de Ciencias Exactas, Físicas y Naturales. Guadalupe, Bogotá, 1994. [ Links ]
6. Burin, J. M. and Price, C. P. Measurement of blood glucose. Ann. Clin. Biochem, 22:327, 1995. [ Links ]
7. Corporación de Abastos de Bogotá, S.A. Corabastos. Ayer, hoy y mañana de los desechos en Corabastos, 2004. [ Links ]
8. Dols, Marguerite; Remaud-Simeon, M.; Monsan, P. and Lindley, N. Growth and energetic of Leuconostoc mesenteroides NRRL B-1299 during metabolism of various sugars and their consequences for dextransucrase production. Appl. Environmental Microbiology, 63, n°. 6: 2159-2165, 1997. [ Links ]
9. Eteshola, Edward; Gottlieb, Moshet and Shoshanna, (Malis) Arad. Dilute solution viscosity of red micro alga exopolysaccharide. Chemical Engineering Science, vol. 51, no. 9, pp. 1487-1494, 1996. [ Links ]
10. Plou, Francisco J.; Martín, Teresa; Gómez de Segura, Aranzazu; Alcalde, Miguel y Ballesteros, Antonio. Glucosyltransferases acting on starch or sucrose for the synthesis of oligosaccharides. Can. J. Chem. 80: 743-752, 2002. [ Links ]
11. Lichtenthaler, Frieder W. and Peters, Siegfried. Carbohydrates as green raw materials for the chemical industry. Clemens-Schõpf Institut für Organische Che-mie und Biochemie, Technische Universitãt Darmstadt, Darmstadt, Germany, 2001. [ Links ]
12. García Rodríguez, María Melina. Estudio de la producción de la levana obtenida a partir de Lactococcus lactis (cepa 34.1). Universidad Nacional de Colombia, Facultad de Ciencias, Departamento de Farmacia, Bogotá, trabajo de grado de pregrado, 2000. [ Links ]
13. Garvie, E. I. Genus leuconostoc. Bergey´s manual of systematic bacteriology. P. H. A. Sneath, N. S. Mair, M. E. Sharpe and J. G. Holt (eds.). Baltimore: the Williams and Wilkins, 1986. [ Links ]
14. González Páez, Andrés José. Evaluación de las operaciones de bioseparación de levana obtenida por tecnología de enzimas. Universidad Nacional de Colombia, Facultad de Ingeniería, Departamento de Ingeniería Química, Bogotá. Tesis de pregrado (Ingeniería Química) 2003. [ Links ]
15. Lopretti, Mary. Producción simultánea de dextrano y fructosa a partir de desechos agroindustriales en Iberoamérica. Aspectos científicos, técnicos y económicos. Cyted, Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo: Buenos Aires, junio 2002. [ Links ]
16. Miller, G. L. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal. Chem. 31: 426-428, 1959. [ Links ]
17. Producción de ácido láctico a partir de cáscara de piña. Universidad Nacional de Colombia, Facultad de Ingeniería, Departamento de Postgrados, Medellín. Tesis de maestría, 2000. [ Links ]
18. Remaud-Simeon, M.; López Munguía, A.; Pelec, V and Monsan, P. Production and use of glucosyltransferases from Leuconostoc mesenteroides NRRL B-1299 for the synthesis of oligosaccharides containing a(1-2) linkages. Appl. Biochem. and Biotechnol. 44:1014-117, 1994. [ Links ]
19. Rodríguez Charry, Jacqueline. Estudio del comportamiento de la enzima glucosa isomerasa inmovilizada en un reactor enzimático. Universidad de América, Facultad de Ingeniería, Departamento de Ingeniería Química, Bogotá, 2004. [ Links ]
20. Roe, J. H.; Epstein, J. H. and Goldstein, N. P. J. Biol. Chem. p. 178-839. 1962. [ Links ]
21. Salou, P.; Loubiere, P. and Pareilleux, A. Growth and energetic of Leuconostoc oenos during cometabolism of glucose with citrate or fructose. Applied and Environmental Microbiology. Vol. 60, n° 5, 1459-1466, May 1994. [ Links ]
22. Smith, M. R. and Zahnley, J. C. 1998. Production of glucosyltransferases by wild-type Leuconostoc mesen-teroides in media containing sugars other than sucrose. Journal of Industrial Microbiology and Biotechnology. 22: 139-148. [ Links ]
23. Holt, Scott M. and Cote, Gregory L. Differentiation of dextran-producing Leuconostoc strains by a modified randomly amplified polymorphic DNA protocol. Appl. Enviromental Microb. Vol. 64 n° 8, 3096-3098, Aug 1998. [ Links ]
24. Tsuchiya, H. M.; Koepsell, H. J.; Corman, J.; Bryant, G.; Bogard, M. O.; Feger, V H. and Jackson, R. W. 1952. The effect of certain cultural factors on the production of dextransucrases by Leuconostoc mesenteroides. J. Bacteriol. 64:521-527. [ Links ]
25. Gagné, I.; Matsuura, T. and Duvnjak Z. Enhanced high fructose syrup production by a hybrid fermentation/ pervaporation system using a silicone rubber hollow fiber membrane module. Department of Chemical Engineering, University of Ottawa, Canada. Separation Science and Technology, 37(9), 2055-2075, 2002. [ Links ]














